side – σ
реклама

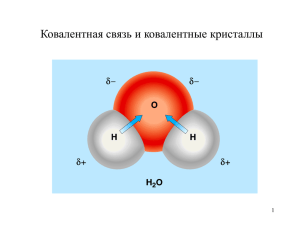
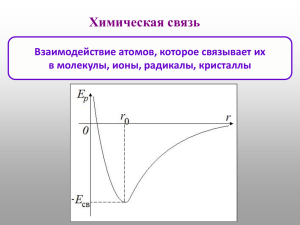
Гибридизация Органическая химия 11 класс И. Жикина Valents - валентность Valentsolek – валентная возможность Tetraeedriline süsinik – тетраэдрический углерод σ -side – σ-связь -side – -связь sp3 süsinik - sp3-углерод Углерод 1s22s22p2 – основное состояние 1s22s12p3 – возбужденное состояние Гибридизация атомных орбиталей Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии. Форма молекулярных орбиталей. Форма молекулярных орбиталей определяется геометрией перекрывания атомных орбиталей. s-, -связи -связь образуется между атомами, уже соединенными s-связью, за счет бокового перекрывания p -АО s-связь Образуется при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра атомов. Характерные особенности s- и -связей. s-Связь прочнее -связи. 1. По s-связям возможно внутримолекулярное вращение атомов. Вращение по -связи невозможно без ее разрыва! 2. Поляризуемость -связи значительно выше, чем s-связи 3 sp -гибридизация 2s + 2px + 2py + 2pz = 4 (2sp3) CH4 метан C2H6 -этан Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. sp2-гибридизация 2s + 2px + 2py = 3 (2sp2) sp-гибридизация 2s + 2px= 2 (2sp) Атомно-орбитальные модели Тип гибридизации Валентный угол Атомная орбиталь