лек1
реклама

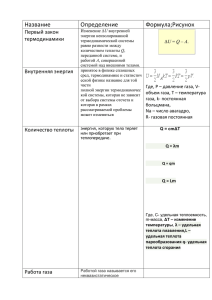
ВВЕДЕНИЕ В НАУЧНЫЕ ОСНОВЫ КРИОЛОГИИ ЛЕКЦИЯ №1 Диаграммы состояния и законы термодинамики Основная литература 1. Архаров А.М., Марфенина И.В., Микулин Е.И. Криогенные системы. Т.1. М.: Машиностроение, 1996. 576с. (3-е изд.) 2. Архаров А.М., Архаров И.А., Беляков В.П. и др. Криогенные системы. Т.2. М.: Машиностроение, 1999. 720с. (3-е изд.) 3. Техника низких температур. /под ред. Микулина Е.И., Марфениной И.В., Архарова А.М. М.: Энергия, 1975. – 512с. Основные задачи техники низких температур: 1. 2. 3. 4. ОХЛА ЖДЕНИЕ ТЕРМОСТАТИРОВАНИЕ ОЖИЖЕНИЕ И ЗАТВЕРДЕВАНИЕ РАЗДЕЛЕНИЕ ГАЗОВЫХ СМЕСЕЙ ПАРАМЕТРЫ СОСТОЯНИЯ T - температура (абсолютная), К р – давление (абсолютное), Па V – объём, м3 (или v - удельный объём, м3/кг) Диаграмма состояния в P-T координатах Диаграмма состояния в P-V координатах ФУНКЦИИ СОСТОЯНИЯ U - внутренняя энергия, Дж u – удельная внутренняя энергия, Дж/кг I – энтальпия, Дж i – удельная энтальпия, Дж/кг S – энтропия, Дж/кг s – удельная энтропия, Дж/кг Диаграмма состояния в T-S координатах ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ (закон сохранения энергии) 1. Закрытая система (нет входящих и выходящих потоков вещества) ΔU = L + Q или Δu = l + q 2. Открытая система (с входящими и выходящими потоками вещества) ΔI = L + Q или Δi = l + q Правило знаков: +L – работа совершается над системой -L – работа совершается системой +Q – теплота подводится к системе -Q – теплота отводится от системы ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Теплота с более низкого температурного уровня может быть перенесена на более высокий температурный уровень только при затрате работы Схема для иллюстрации L Qх Тх ХМ Qт Qт=L+Qх Тт Энтропия – функция состояния, определяющая меру «неупорядоченности». dQ dS T S - энтропия, Дж/кг; dq ds T s – удельная энтропия, Дж/кг·К