Лекция №22.
реклама

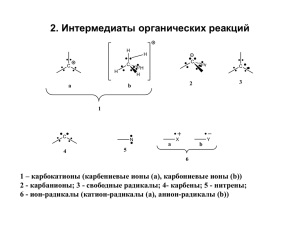
Теоретические основы органической химии Основные типы карбокатионов. Строение и cвойства. Лекция 22 (электронно-лекционный курс) Проф. Бородкин Г.И. Карбокатионы, строение и свойства Изучение начато с ~1900 г. Ph3CCl в C6H6 и CHCl3 – бесцветные растворы, не проводит электрический ток. Растворы в SO2, MeNO2 – ярко желтые, проводят ток. Ph3CCl + Ph3C ClO4 SO2 желтая кристаллическая соль + Ph3C желтый + Cl - Интенсивное изучение свойств карбокатионов начато с 1960 г. с применением ЯМР и сверхкислот Н HF (100% H2SO4) H2SO4 – SO3 HSO3F HSO3F-SbF5(1:1) HF-SbF5 (9:1) HF-SbF5 (1:1) -10.1 о -12 -13.6 -13.9 -17.5 -20 <-20 сверхкислоты Ho = - lg aH+ BH+ Ka = fB fBH+ B + H+ aH+ aB aBH+ pKa = -lg(aH+ aB)/aBH+ cB PKa = Ho - lg cBH+ aH+fB cB = -lg fBH+ cBH+ Основание ионизировано на 50% при Ho = PKa PKa MeNH2 10.62 NH2 4.58 NH2 O2N NO2 NO2 -10.1 В HF основание «запротоноровано» на 50 % Способы генерирования карбокатионов в растворах R1 1. R2 1 + R3 R H+ R4 2. OH + H+ 3. X + MXn X = F, Cl, Br, J, CN et al. R3 OH2+ C+ H R2 R4 C+ + H2O + MXn+1- Основные типы карбокатионов 1. Алкилкарбониевые ионы (G.A. Olah, 1963 г.) Me3C-F + SbF5 SO2FCl ЯМР Н1 -70oC Me3C+ + JH-C-C-F 20 гц м.д. м.д. SbF6- Me2CH-F + SbF5 SO2FCl -70oC Me2CH+ + 1 ЯМР Н CH м.д. SbF6- Me м.д. 13 ЯМР C CH Me 319 61 м.д. JCH = 169 гц sp2 гибридизация Первичные алкилкарбокатионы в растворе не генерированы MeCH2F + SbF5 MeCH2F SbF5 MeBr + SbF5 + Me-Br-Me + SbF5Br- РСА (T. Laube et al. JACS 1993, 7240) Me 121.2o планарен + 0.007 А 1.44(1) + 120.9o C Me 1.442(8) Me 1.445(9) A 117.9o Енильные карбокатионы Me Me Me 96% H2SO4 CH2 25oC Ha Me + Me Me Hb b Ha 9.02 H 7.20 Me Hb Me вращение затруднено 2.64 2.61 м.д. Аренониевые ионы C. MacLean. E.L. Mackor (1958 г.) + R Ar ArR + HF + BF3 H ПМР H + ЯМР 13С o-Me Me Me Me 127.6 21.5 137.3 CH2 p-Me Hap. 8 H + BF4- 7 6 H H 54.5 + 5 4 3 C 187м.д. 194.2 135.4 194.2 2 H H + 0.31 0.04 0.31 Аналоги электрофильного ароматического замещения X + X+ HSO3F + -70o X = H, Me, PhCH2, Cl, Br, NO2, SO3H E + + E+ X E E H + H+ + X X X E.L. Mackor et al. (1958 г.) ArH + KB = 2HF 1 KA ArH2+ + pKa = lgKB = -pKB pKB бензол толуол мезитилен пентаметилбензол гексаметилбензол HF2- 9.2 6.3 0.4 -0.1 -1.4 pKB = 9.2 – 2.9Zo,p -0.6 Zm Расчет pKB = 9.2 – 2x2.9 – 2x0.6 = 2.2 Эксперимент 1.9 pKB (ñ ó÷åòî ì ñòàòô àêòî ðà) 10 8 Ph-Ph 6 4 2 7 -2 -4 -6 7.5 8 8.5 9 Ip, ev Бензильные катионы ArCR2X + SbF5 X = Cl, F, OH è äð. SO2ClF -75o ArCR2+ + SbF5X- ì .ä. CH2+ Me 8.66 Me 2.62 Me Me 2.30 Me 2.62 Ñì .ä. H Me C+ q+ 230.4 (0.54) 141.5 155.1 133.8 161.6 (0.02) (0.14) (0.03) (0.19) Затрудненное вращение группы СН2 Ha CH2+ Hb C+ Me Me Me Ha Hb Me OMe PhCH2+ не генерирован Me Ea ~8ккал/ì î ëü Ароматические карбокатионы Ранее мы уже рассматривали свойства ряда карбокатионов: R R 2+ + + R R R R R Me R CH3 R R C+ C++ Me Me 2+ R R R Me Me Me Br Br + 70 ev + I Br циклононатетраенильный катион + топологтя Хюккеля топология Мёбиуса B3LYP/6-311G* A ароматичен (Angew. Chem. Int. 2004, 4396) Винильные катионы СR2=CR+ часто постулировали CO+ Me Me-C HSO3F-SbF5 C-Me C=C +CO Me H Возможные структуры: Me Me C=C H + C=C Me транс- Me sp2 H цис- H C + C Me sp Me Me Me Me Me Me C CH Me + CF3COOH C -15oC Fe Ar м.д. 6.75 6.16 J=12гц T.S. Abram, W.E. Watts 1974 г. Ar Ñ C H Fe + Ñ H Ar Aрильные карбокатионы + + + + + X S X X X X X T T Изодесмический процесс (ab initio): X-C6H4+ + C6H6 S +I o>m>p +M p>o>m C6H5+ + X-C6H5 T +M > +I p~o>m Матричная изоляция Bu Bu N Bu Bu N h -70oC Et N ЭПР + N2+ T Et MeO MeO + + T T OMe MP2/aug-CC-pVTZ 1.39 A 122o o 150 103o + 1.44 A 1.32 A + Ar По ИКС есть взаимодействие с Ar Ang. Chem Int. 2010, 10145 + По ИКС: основное состояние - триплетное H. A. Galu and J. Omens (Голландия) Ang. Chem. Int., 2011, 7004