Бензол. Ароматичность органических соединений
реклама
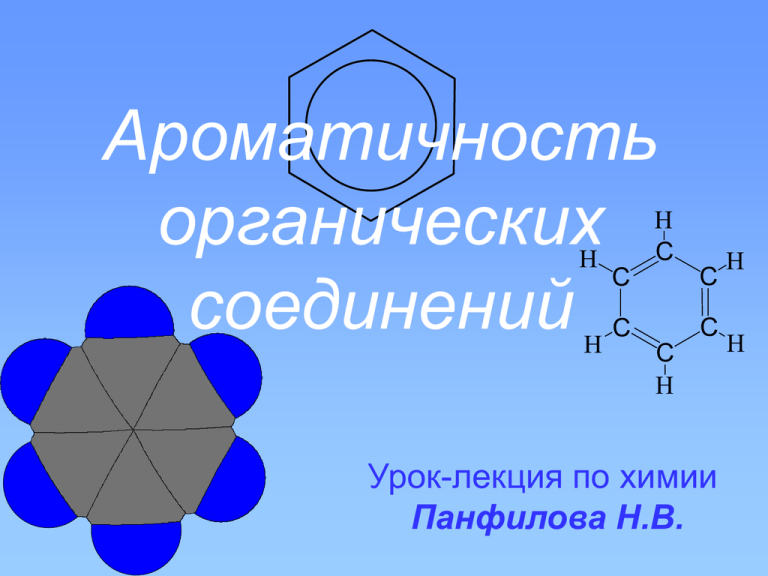
Ароматичность органических соединений H H H C C C C C C H Урок-лекция по химии Панфилова Н.В. H H Содержание • • • • • Введение Бензол (строение молекулы) Критерии ароматичности Правило Хюккеля Небензоидные ароматические соединения • Заключение В начале XIX в. на улицах Лондона, Петербурга, Берлина – появилось газовое освещение. В специальных фонарях горел светильный газ, получаемый из китового и трескового жира. Газ хранился в баллонах под давлением 30 атм. Зимой в баллонах образовывался конденсат. В 1825 г. из такого конденсата М.Фарадей выделил 3 г. угдеводорода, имеющего состав С6Н6. Бензол от араб. ben – аромат + zoa – сок + лат. ol[eum] – масло H H H C C C C C C H H H «Родоначальником» ароматических углеводородов (аренов) является бензол, строение которого часто выражают формулой, предложенной немецким химиком Ф.А. Кекуле (1865) При квантово-химическом расчете молекулы бензола по методу электронных пар учитываются пять резонансных структур молекулы бензола с различной долей участия в резонансе: Из этих структур наибольшее значение имеют первые две граничные структуры. Образование сигма-связей в молекуле бензола Все шесть атомов углерода находятся в состоянии sp2-гибридизации; длина связи С—С 0,140 нм валентные углы равны 120; Образование пи-связей У каждого углеродного атома цикла остается по одной негибридизованной рорбитали. Оси этих орбиталей параллельны, и каждое такое облако одинаково перекрывается с облаками соседних атомов углерода. ??? В каких соединениях наблюдается такое же явление? Как оно называется? Образование ароматического секстета Кратность связей выравнивается, они носят не двойной или одинарный, а полуторный или ароматический характер Поэтому в настоящее время для обозначения выравненности π-электронной плотности в молекуле бензола используют резонансный гибрид этих двух структур ( по гипотезе Л. Полинга ): 1. Циклическая структура Однако, кроме бензола и егосистемы многочисленных гомологов существуют 2.небензоидные Плоское строение системы соединения. ароматические 3. Наличие замкнутой системы π-электронов 4. Количество π-электронов должно быть равно 4n + 2 ( Правило Хюккеля ) Правило Хюккеля говорит о том, что плоские моноциклические молекулы, в которых каждый из образующих цикл атомов участвует в сопряжении, обладают ароматической устойчивостью при числе π-электронов 4n + 2 Пример: катион циклопропенилия 4∙0 + 2 = 2 C3 H 3 C5 H C7 H 5 7 C10 H 8 Циклопентадиенильный анион 4∙1 + 2 = 6 Катион циклогептатриенилия ( тропилий ) 4∙1 + 2 = 6 Азулен 4∙2 + 2 = 10 C4 H 4O Фуран 4∙1 + 2 = 6 O N C4 H 4 N2 Пиримидин 4∙1 + 2 = 6 N H N N C5 H 4 N 4 N N Пурин 4∙2 + 2 = 10 Понятие ароматичности, как и многие другие понятия органической химии, пока является качественным, поэтому границы его применимости очерчены не слишком четко. К понятию ароматичности прекрасно можно отнести слова А.М. Бутлерова, которыми он охарактеризовал значение качественных химических теорий: «Руководствуясь ими неосторожно, можно попасть на ложный путь, но без них приходится ощупью отыскивать дорогу».