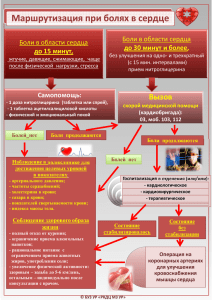
Инвазивные интратекальные методы
реклама

Московский научно - исследовательский онкологический институт им. П.А.Герцена – Филиал федерального государственного бюджетного учреждения «Национальный медицинский исследовательский радиологический центр Министерства Здравоохранения Российской Федерации ” директор - член-корреспондент РАМН, д.м.н., профессор Каприн А.Д. Инвазивные интратекальные методы пролонгированного обезболивания при хроническом болевом синдроме у онкологических пациентов. Собственный опыт Москва 2015 Зайцев А.М., Абузарова Г.Р., Сарманаева Р.Р., Кирсанова О.Н. Актуальность проблемы ХБС в онкологии • на начальных стадиях роста опухоли боль встречается у 30—40% [1] • при прогрессировании — 60—70% • при генерализации опухолевого процесса — у 90% Распространённость ХБС [2] % встречамости среди заболевших Опухоли головы и шеи 67–91% Опухоли предстательной железы 56–94% Рак шейки матки 30–90% Опухоли мочеполовых органов 58–90% Рак молочной железы 40–89% Рак поджелудочной железы 72–85% 1 - Паллиативная помощь онкологическим больным: [под. ред. проф. Г.А. Новикова, акад. РАМН В.И. Чиссова]. - М.: ООД «Медицина за качество жизни». - 2006. - 192с. 2 - Van den Beuken-van Everdingen MH, de Rijke JM, Kessels AG, et al.: Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Ann Oncol. 2007; 18(9): 1437–49 Актуальность проблемы При существующей потребности обезболивания у 228 691 умирающих от рака или ВИЧ, свыше 183 тыс. человек или 80,3% нуждающихся в обезболивания уходят из жизни с нелеченой болью Место в регионе (Европа) Страна Фентанил Морфин Прочие Итого 1 Германия 12 772 619 5 928 19 319 2 Австрия 10 252 4593 1 315 16 160 14 Франция 5 055 1024 685 6 764 17 Греция 4 217 14 39 4 270 118 14 24 156 75 12 20 107 - 37 Беларусь 38 РОССИЯ (82 место в мире) 39 Албания 28 20 21 69 40 Молдова 30 27 9 66 41 Украина 11 6 15 32 42 Македония 25 1 - 26 (доклад международного комитета по контролю над наркотиками «Наличие психоактивных средств , находящихся под международным контролем: обеспечение надлежащего доступа для медицинских целей и научных целей». Организация Объединенных Наций. 2010г.) Ступенчатое обезболивание (ВОЗ, 1986 г) ~20% Резистентный хронический болевой синдром ? World Health Organization, 1986; Vancouver Hospice Program, 1989 Хронический резистентный болевой синдром? «Используя те медицинские знания, которые мы имеем на сегодняшний день, можно полностью избавить пациента от боли» Паллиативная помощь: убедительные факты Стратегические документы ВОЗ, 2005 г. Чем мы можем им помочь? или функциональная нейрохирургия в лечении «трудной боли» Деструктивные методики Нейрохирургия Функциональная нейрохирургия Нейростимуляция Нейромодуляция Длительная интратекальная терапия Задачи современной нейрохирургической службы в онкологическом стационаре Хирургическое лечение первичных опухолей ЦНС Инвазивное обезболивание Хирургическое лечение экстраинтракраниальных опухолей Хирургическое лечение метастазов в головной мозг Модификации хронической инвазивной опиоидной терапии Ожидаемая продолжительность жизни < 3 месяцев Ожидаемая продолжительность жизни > 3 месяцев • эпидуральный катетер • спинальный катетер • носимая помпа • порт •имплантируемая программируемая морфиновая помпа Эпидуральный катетер Показания: • хроническая боль при низкой ожидаемой продолжительности жизни • боль на фоне проведения лучевой терапии Особенности: • тунелирование катетера и бактериальный фильтр увеличивают срок стояния (5 дней →1 месяц) • можно присоединять к внешней помпе или вводить болюсно • уровень установки – до Th3 Эпидуральный морфин: Nota bene! после однократного введения срок действия 6-24 часа сегментарный характер анальгезии (+ 2 дерматома выше и ниже) морфин липофобен, поэтому в эпидуральной жировой клетчатке распределяется медленно. Риск отсроченной (1 сутки) депрессии дыхания при краниальном распространении препарата <0,2%. В первые сутки больной должен наблюдаться • Приготовление “коктейля”: • 4 амп. морфина = 4 ml • 116 ml хлорида натрия • Общий объем = 120 ml • PCA режим: • Начальный уровень: 0,5 ml/hr • Болюсная доза: 0,25 или 0,5 ml • Lock out : 1 час Схема терапии Бупивакаин Опиоиды Коктейли: Бупивакаин 0,125% + морфин 0,05-0,1 мг/мл Порты (эпидуральные, спинальные) Программируемые помпы для пролонгированной анальгезии Organizer 100/500 Носимые программируемые помпы Rythmic Plus PCA – patient controlled analgesia • Приготовление “коктейля”: 4 амп. морфина = 6ml 114 ml хлорида натрия Общий объем = 120 (до 160) ml PCA режим: Начальный уровень: 1ml/hr Болюсная доза: 1 или 2 ml Lock out : 10 -15 мин Преимущества имплантируемых программируемых помп Контролируемая пациентом анальгезия Индивидуальный «интелектуальный» режим дозирования Полностью имплантированная система Не требует инвазивных процедур во время использования Механизм действия интратекальных опиоидов Эквианальгетические дозы Системное применение – разовая доза 10 мг Интратекальное введение разовая доза 0,01 мг (100 мкг) Мировой опыт Лекарственный препарат? Для введения в помпу применяются: Группы препаратов АТХ Опиоиды Морфин сульфат, Морфин гидрохлорид, Гидроморфон, Фентанил Местные анестетики (недостаток – моторный блок) Бупивакаин, Ропивокаин, Тетракаин α-2 адренэргические препараты Клонидин Антагонисты NMDA-рецепторов Метадон Другие группы Баклофен, Зиконотид, Мидазолам, Габапентин, Аспирин, Дроперидол В России и FDA для введения в помпу разрешены: 1. Морфин гидрохлорид 2. Баклофен 3. Зиконотид (не зарегистрирован в РФ) 4. Метотрексат (при нейролейкемии) Актуальность использования методов нейромодуляции у онкологических больных • Рак предстательной железы с метастазами в кости • Высокодифференцированные саркомы мягких тканей • Рецидив рака прямой кишки • • Рак почки с метастазами в кости Рак лёгких с изолированными метастазами в кости и контролируемым первичным очагом • Рак молочной железы с метастазами в кости • Первичные злокачественные опухоли костей Исследование Год, вид Количество пациентов с помпой Результаты Thomas J. Smith and colleagues 2002 г, мультицентровое, рандомизированное 71 У 84,5% - клинически значимое уменьшение болевого синдрома, токсичность 17% Rauck and colleagues 2003, мультицентровое, проспективное 119 Оценка боли по ВАШ в среднем, снизилась с 61% до 42% (на 31%) Deer and colleagues 2002 г, мультицентровое, проспективное 25 Снижение выраженности болевого синдрома на 57%, по сравнению с контрольной группой Becker and colleagues 2000 г, проспективное 43 Редукция невропатического компонента боли на 61.1%, ноцицептивного на 77.8% Onofrio and Yaksh 1990, проспективное 53 У 65% больных – 0-10% по ВАШ, у 53% пациентов – расширение физ. активности Penn and Paice 1987, проспективное 35 У 80% пациентов – полный регресс болевых ощущений Компоненты системы для интратекальной опиодной терапии Программатор Насос (помпа) Интратекальный катетер Индивидуальный менеджер терапии («пульт») Общий вид системы Спинальный сегмент катетера Помповый сегмент катетера Насос помпы в подкожной клетчатки передней брюшной стенки Th 6–9 уровень спинального конца катетера Клинические критерии отбора пациентов для имплантации помпы Критерии включения 1. 2. наличие тяжелого болевого синдрома более 60% по НОШ, вызванного опухолевой или неопухолевой патологией, требующего терапии сильными опиоидными анальгетиками неэффективность предшествующей обезболивающей терапии III ступени обезболивания (по ВОЗ) опиоидными анальгетиками в суточной дозе эквивалентной 30 мг морфина в/м Критерии ИСКЛЮЧЕНИЯ 1. отрицательный морфиновый тест на 300 мкг морфина (менее 30% редукции боли по ВАШ) 2. спинальный объемный процесс или сращения, которые препятствуют свободному пассажу ликвора; 3. значительное преобладание невропатического и психогенного компонентов боли над ноцицептивным. 4. тяжёлые побочные явления при морфиновом тесте с минимальной дозой морфина 5. гипертермия 3. общее физическое состояние от 40 до 100% по шкале Карнофского 6. декомпенсированная дыхательная, почечная, печеночная, сердечная недостаточность, энцефалопатия любой этиологии; 4. локализация болевого синдрома ниже Th1 позвонка 7. первичные заболевания головного мозга, травмы головы, повышенное внутричерепное давление; 5. положительный морфиновый тест 8. алкоголизм; 6. предполагаемый срок жизни не менее 3-х 9. тяжелые формы диабета месяцев 10. беременность, лактация; 7. Способность пациента выполнять процедуры исследования и предоставить письменное информированное согласие больного, соответствующее принципам GCP и законодательству РФ 11. кахексия (масса тела менее 50 кг), 8. возраст больных от 18 лет 14. одновременное применение ингибиторов моноаминооксидазы 9. отсутствие критериев исключения 15. наличие пролежней, эрозий и гнойных заболеваний кожи в области установки помпы или катетера 12. невозможность выполнения люмбальной пункции (тромбоцитопения, неконтролируемая коагулопатия, деформации позвоночника и др.) 13. гипопротеинемия (общий белок менее 60 г/л) 16. Аллергия на морфин Морфиновый тест 1. отменяется вся обезболивающая терапия 2. при мониторировании АД, ЧСС, ЧД, сатурации выполняется люмбальная пункция на уровне LIII-LIV. 3. Производится спинальное введение 100-300 мкг морфина гидрохлорида *. 4. Наблюдение в течение 12 часов в ОРИТ, оценка боли по DN4, НОШ, шкале физической активности, длительность анальгетического эффекта, побочные реакции * остатки морфина вводятся при возобновлении болевого синдрома (9900 – 9700 мкг). 0,90 0,10 0,50 0,56 0,96 0,84 0,86 0,05 18,86 Доля правильных диагнозов доля неправильных диагнозов Доля больных Доля положительных диагнозов Чувствительность Специфичность Вероятность эффективности помпы при положительном скрининг-тесте Вероятность неэффективности помпы при положительном скрининг-тесте Относительный риск n=40 тестов Этапы имплантации Визуализация помпы Поясничная область Передняя брюшная стенка Насос помпы на рентгенограмме Спинальный сегмент на рентгенограмме Спинальный катетер в субарахноидальном пространстве (МРТ) Программирование помпы Обычная схема терапии: базовая доза терапии 250-800 мкг/сутки болюсная доза 200 мкг до 8 раз в сутки с минимальными интервалами 3 часа Первый опыт в России: Материалы и методы n=32 • Неонкологическая группа – 7 • Онкологическая группа - 25 Количество Причины онкологической боли 6 Рак предстательной железы, метастазы в кости 5 Опухоли костей скелета 4 Рак лёгкого, метастазы в кости 3 Рак шейки матки, регионарный рецидив 2 Рак мочевого пузыря, регионарный рецидив 13 Метастазы в кости 1 Рак прямой кишки, метастазы в кости 13 Опухоль в мягких тканях 1 Рак молочной железы, метастазы в кости 1 Лимфоплазмоцитарная лимфома (Вальденстрема), с паравертебральным ростом 1 Рак поджелудочной железы 1 Рак почки, метастазы в кости Количество n=25 Первичная онкологическая патология Причины онкологической боли Первый опыт в России: Материалы и методы Возраст пациентов 23-81 год (57,5 ± 11,4 лет) Длительность болевого анамнеза 3-135 мес. (28,8 ± 31,2 месяцев) Интенсивность боли по НОШ без анальгезии 60-100% (90,5± 10,9%) Интенсивность боли по НОШ на фоне стандартной III ступени обезболивания 60-90% (67,6± 14,1%) Интенсивность боли по DN4 без анальгезии 2-4 балла (3,53 ± 0,4 балла) Интенсивность боли по DN4 на фоне стандартной III ступени обезболивания (с включением антиконвульсантов по показаниям) 0-4 балла (2,9 ± 0,8 баллов) Средняя доза опиоидных анальгетиков (суточная доза, эквивалентная морфину гидрохлориду в/м) 0-160 мг (82 ± 29,0 мг) Мужчины Женщины 21 (61%) 13 (38,2%) Средняя продолжительность ХБС: 6,6 месяцев Методы оценки: • НОШ (ВАШ) • DN4 • Шкала физической активности • SF-36 • Дневник боли Результаты: динамика болевого синдрома по НОШ 100 100100100 90 100100100100100 90 90 90 100100 90 90 90 100 90 90 100 90 100 90 90 90 80 80 80 80 80 70 70 70 70 70 70 70 70 70 70 60 60 60 60 60 60 60 50 50 50 50 50 40 30 30 30 30 20 20 20 20 20 10 10 10 10 10 10 1010 10 10 10 0 0 0 0 0 0 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 И нт енсив ност ь боли по НОШ без анальгет иков 20 21 22 23 24 И нт енсив ност ь боли по НОШ на фоне подобранной т ерапии III ст упени И нт енсив ност ь боли по НОШ после имплант ации помпы на 7-е сут ки p-value= 0,000301 Результаты: динамика ноцицептивного и невропатического компонентов болевого синдрома Динамика ноцицептивного компонента боли (по НОШ, %) 100 Динамика невропатического компонента боли (по DN4, баллы) 90,5 80 -78,0% 60 -60,0% 40 19,26 20 0 До имплантации Через 7 дней после имплантации Побочные явления и осложнения имплантации Побочные явления интратекального морфина Побочное явление Процент встречаемости Синдром отмены ранее использованных опиатов 15 (48,3%) больных в течение 3-10 дней после имплантации Кожный зуд 10 (32,2%) больных в начальной фазе терапии (1 сутки после имплантации/ теста) Головные боли 8 (25,8%) больных, носили характер постпункционных, длились 1-3 дня Задержка мочи 4 (12,9%) больных, после теста или в первые 2-6 сутки после имплантации Снижение либидо 2 (6,3%) больных мужчин через 1 месяц после имплантации Хирургические осложнения Количество Серома Обрыв катетера Патология 1 (3,2%) больного (выполнена ревизия) 1 (3,2%) больного, выполнена замена катетера Послеоперационные ограничения: Не выполнять УЗИ зоны помпы Не проходить через рамки металлоискателей Не выполнять МРТ с напряжённостью магнитного поля более 1,5 Тл Повторная госпитализация для заправки программируемой морфиновой помпы при израсходовании морфина замена помпы через 7 лет использования Недостатки методики инвазивный характер лечения, операционная травма, анестезиологический риск синдром отмены при длительной системной опиоидной терапии необходимость регулярной (однократно в 2-3 месяца) явки к врачу для заправки помпы высокая стоимость хронической интратекальной опиоидной терапии толерантность к интратекальному морфину имплантированная помпа не ограничивает лечение основного заболевания никаким из методов противоопухолевой терапии Клинический пример: больной К., 48 лет Клинический диагноз: хордома крестца, состояние после комплексного лечения в 2002-2013 г. Осложнение основного заболевания: хронический болевой синдром. При поступлении: положение вынужденное на животе. Минимальная физическая активность приводила к усилению болевого синдрома. Интенсивность болевого синдрома: • 60% по НОШ в покое • 90% по НОШ при активизации в пределах постели • 70% на фоне анальгетиков (трамадол 300-500 мг/сутки, налбуфин 1-3 р/сут при минимальной активизации, анальгетический эффект кратковременный и неполный). 20.08.2013 г. выполнена операция: «Имплантация программируемой морфиновой помпы в субарахноидальное пространство на уровне L3L4». После имплантации суточная доза 300 мкг/сут + болюсные введения по 50 мкг до 1 р/сут. Болевой синдром отсутствует. При МРТ поясничного отдела позвоночника и таза (янв. 14) – отрицательная динамика в виде появления отсева в параректальной клетчатке. Получает метротрексат + эндоксан Пациент вернулся на работу... Выводы резистентный хронический болевой синдром у онкологических больных хорошо купируется эпидуральной и спинальной опиоидной терапией использование программируемых устройств позволяет достичь контролируемой пациентом анальгезии гибкое программирование позволяет успешно устранять как суточный фон боли, так и прорывы боли количество терапевтических и хирургических осложнений минимально пациент должен быть комплексно обследован, консультирован профильным специалистом онкологом, химиотерапевтом, радиологом, на основании чего альголог и нейрохирург принимают решение о варианте инвазивного обезболивания ноцицептивный компонент боли устраняется на 78%, невропатический – на 60% хроническая интратекальная опиоидная терапия с применением имплантированных программируемых устройств – высокоэффективный метод у тщательно отобранной группы больных