Сероводород
реклама

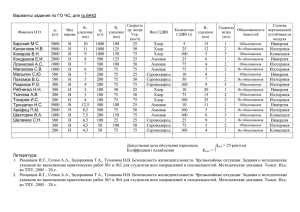
ГОУ ВПО Воронежская Государственная Технологическая Академия Школа Юного Химика «...Тогда услышал я ( о, диво) запах скверный, Как будто тухлое разбилося яйцо, Иль карантинный страж курил жаровней серой. Я нос себе зажав, отворотил лицо...» (А.С.Пушкин) 1832г. Выполнил :ученик 9 «А» класса МОУСОШ №12 Ильин Вячеслав Руководитель: доцент, к.х.н. Перегудов Юрий Семенович Воронеж 2010 Французский химик Жозеф-Луи Пруст (1754-1826) изучал действие кислот на природные минералы. В некоторых опытах неизменно выделялся отвратительно пахучий газ сероводород Н2S . В один из дней, действуя на минерал сфалерит ( сульфид цинка ZnS) хлороводородной кислотой HCl : ZnS + 2HCl = H2S ↑ + ZnCl2 Пруст заметил, что голубой водный раствор сульфата меди CuSO4 в стоявшем рядом стакане покрылся коричневой пленкой. он подвинул стакан с голубым раствором ближе к стакану , из которого выделялся Н2S , и, не обращая внимания на запах , стал перемешивать голубой раствор. Вскоре голубой цвет исчез, а на дне стакана появился черный осадок. Анализ осадка показал, что он является сульфидом меди: CuSO4 + H2S = CuS ↓+ H2SO4 Так, видимо, впервые было обнаружено образование сульфидов некоторых металлов при действии сероводорода на их соли. •В природе сероводород содержится в вулканических газах, •в воде минеральных источников, в Черном море, начиная с глубины 200 и более метр •образуется при распаде белковых веществ. Сероводород постоянно образуется на дне Черного моря при взаимодействии растворенных в морской воде сульфатов с органическими веществами : CaSO4 +CH4=CaS +CO2↑ +2H2O CaS+ H2O+ CO2=CaCO3↓+H2S↑ В этих реакциях сульфат кальция CaSO4 превращается в сульфид CaS с выделением диоксида углерода CO2 , а уже затем CaS , взаимодействуя с CO2 и водой , переходит в оседающий на дно моря карбонат кальция CaCO3 с одновременным выделением сероводорода H2S. Этот процесс связан с жизнедеятельностью сульфатвосстанавливающих микроорганизмов. До верхних слоев воды сероводород не доходит, так как на глубине около 150м он встречался с проникающим сверху кислородом. На этой же глубине обитают серобактерии, которые способствуют окислению сероводорода до серы S: 2H2S + O2 = 2H2O + 2S↓. В последние годы в связи с катастрофическим загрязнением Черного моря верхняя граница пребывания сероводорода постепенно поднимается, убивая на своем пути все живое. Смертельная граница уже достигла глубины 40 м. Однажды на лекции демонстрировался опыт: плавление серы в пробирке. Вдруг все почувствовали отвратительный запах. Лекция была сорвана. «В чем дело...» - недоумевал профессор. Все оказалось просто : в пробирку с серой попали кусочки парафина с пробковой крышки склянки, в которой хранился порошок серы. Смесь парафина – предельного углеводорода с примерной формулой С20Н42 – и серы при нагревании выделяет сероводород Н2S: С20Н42 + 21S = 21Н2S↑ + 20C Чем сильнее нагревается смесь, тем в больших количествах происходит выделение газа. Если прекратить нагревание, то реакция останавливается, и сероводород не выделяется. Поэтому реакция очень удобна для получения сероводорода в лабораториях. Сероводород взаимодействует с основаниями: H2S + 2NaOH = Na2S + 2H2O H2S проявляет очень сильные восстановительные свойства: H2S-2 + Br2 = S0 + 2HBr H2S-2 + 2FeCl3 = 2FeCl2 + S0 + 2HCl H2S-2 + 4Cl2 + 4H2O = H2S+6O4 + 8HCl 3H2S-2 + 8HNO3(конц) = 3H2S+6O4 + 8NO + 4H2O H2S-2 + H2S+6O4(конц) = S0 + S+4O2 + 2H2O (при нагревании реакция идет по - иному: H2S-2 + 3H2S+6O4(конц) =-t°= 4S+4O2 + 4H2O) Серебро при контакте с сероводородом чернеет: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O Качественная реакция на сероводород и растворимые сульфиды – образование темно-коричневого (почти черного) осадка PbS: H2S + Pb(NO3)2 = PbS(осадок) + 2HNO3 Na2S + Pb(NO3)2 = PbS(осадок) + 2NaNO3 Pb2+ + S2- = PbS(осадок) Один объём воды растворяет в обычных условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М раствора (сероводородной воды)). При нагревании растворимость понижается. Подожженный на воздухе сероводород сгорает по одному из следующих уравнений: 2 Н2S + 3O2 = 2 H2O + 2 SO2 + 1125 кДж (при избытке кислорода) 2 Н2S + O2 = 2 H2O + 2 S + 531 кДж (при недостатке кислорода). В водном растворе Н2S ведёт себя как весьма слабая кислота. Средние соли (с анионом S2-) называются сульфидами, кислые (с анионом HS-) - гидросульфидами. Несмотря на бесцветность самих ионов S2- и HS-, многие соли сероводорода окрашены в характерные цвета. Подавляющее большинство сульфидов практически нерастворимо в воде. А большая часть гидросульфидов хорошо растворима (но известна лишь в растворе). . Молекула Н2S имеет структуру равнобедренного треугольника с атомом серы в центре [d(HS) = 133 пм, угол HSH = 92°]. Сероводород представляет собой бесцветный и весьма ядовитый газ, уже 1 часть которого на 100 000 частей воздуха обнаруживается по его характерному запаху (тухлых яиц). Жидкий, сероводород имеет низкую диэлектрическую проницаемость (e = 6 при 0 °С) и как растворитель похож скорее на органические жидкости, чем на воду. Твердый Н2S имеет строение плотной упаковки с 12 ближайшими соседями у каждой молекулы (т. е. совершенно иное, чем лед). •Теплота плавления сероводорода равна 2,5 кДж/моль, • Теплота испарения 18,8 кДж/моль. •t пл. -85,54 °С, •t кип. -60,35 °С; • При 0 °С сжижается под давлением 1 МПа. •Восстановитель. Сероводород — ядовитый газ, придающий тухлым яйцам их характерный запах, — выполняет важную физиологическую функцию в организме млекопитающих, участвуя в регуляции кровяного давления. Фермент цистатионин-гамма-лиаза производит сероводород в стенках кровеносных сосудов. Мыши, лишенные этого фермента, с возрастом начинают страдать гипертонией. Ярко-красные червивестиментиферы живут в своих длинных трубках вблизи подводных горячих источников, выносящих из земных недр большие количества сероводорода. Кровь вестиментифер переносит не только кислород, но и сероводород, служащий пищей симбиотическим серным бактериям, которые заменяют червям пищеварительную систему. У млекопитающих сероводород в кровеносной системе тоже выполняет важную физиологическую функцию. На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны его смеси с воздухом, содержащие от 4 до 45 объемн. % Н2S. 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление. При вдыхании сероводорода в значительных концентрациях может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания. Противоядием служит прежде всего чистый воздух. Тяжело отравленным сероводородом дают вдыхать кислород. Иногда приходится применять искусственное дыхание. Сероводород из-за своей токсичности находит ограниченное применение. •В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы •В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод •Сероводород применяют для получения серной кислоты, элементной серы, сульфидов •Используют в органическом синтезе для получения тиофена и меркаптанов •В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.