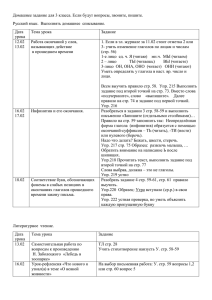
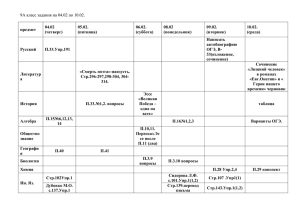
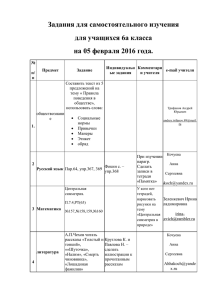
рабочая программа по химии 8 класс.
реклама

1 1. 2. 3. 4. 5. Структурные элементы рабочей программы Пояснительная записка. Содержание тем учебного курса. Учебно-тематический план. Требования к уровню подготовки учащихся, обучающихся по данной программе. Перечень учебно-методического обеспечения. Пояснительная записка Рабочая программа составлена с учётом Федерального Государственного стандарта, Программы по химии для общеобразовательных учреждений / О.С. Габриелян -7-е изд..стереотип.-М.: Дрофа. 2010,-78, 2с, учебника по химии для 8-го класса, автора О.С. Габриелян // М.: Дрофа, 2010. Химия как учебный предмет – неотъемлемая составная часть естественнонаучного образования на всех ступенях обучения. Как один из важных компонентов образовательной области «Естествознание» химия вносит значительный вклад в достижение целей общего образования, обеспечивая освоение учащимися основ учебных дисциплин, развитие интеллектуальных и творческих способностей, формирование научного мировоззрения и ценностных ориентаций. Согласно действующему Базисному учебному плану рабочая программа для 8-го класса предусматривает обучение химии в объеме 2 часа в неделю, 1 час выделен из школьного компонента в связи с усилением эколого-химического просвещения учащихся, по учебному плану МОБУ ООШ с. Новоиликово – (всего 102 часа). Весь теоретический материал курса химии для основной школы рассматривается на первом году обучения, что позволяет учащимся более осознанно и глубоко изучить фактический материал – химию элементов и их соединений. Наряду с этим такое построение программы дает возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов. В результате выигрывают обе составляющие курса: и теория, и факты. Программа построена с учетом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6-9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ. Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования – атомах, изотопах, ионах, простых веществах и важнейших соединениях элемента (оксидах и других бинарных соединениях, кислотах, основаниях и солях), о строении вещества (типологии химических связей и видах кристаллических решеток), некоторых закономерностях протекания реакции и их классификации. Основные цели учебного курса: формирование представления о химическом элементе и формах его существования – атомах, изотопах, ионах, простых веществах и их важнейших соединениях (оксидах и других бинарных соединениях, кислотах, основаниях и солях), о строении вещества (типологии химических связей и видах кристаллических решёток), закономерностях протекания реакций и их классификации. Основные задачи учебного курса: 2 Формирование у учащихся знаний основ науки – важнейших фактов, понятий, законов и теорий, химического языка, доступных обобщений и понятий о принципах химического производства; Развитие умений работать с веществами, выполнять несложные химические опыты, соблюдать правила техники безопасности, грамотно применять химические знания в общении с природой; Раскрытие роли химии в решении глобальных проблем человечества; Развитие личности обучающихся, формирование у них гуманистических отношений и экологически целесообразного поведения в быту и в трудовой деятельности. Изучение химии на ступени основного общего образования направлено на достижение следующих целей: освоение важнейших знаний об основных понятиях и законах химии, химической символике; овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций; развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями; воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры; применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде. Методические особенности изучения предмета: Значительное место в содержании курса отводится химическому эксперименту. Он открывает возможность формировать у учащихся специальные предметные умения: работать с веществами; выполнять простые химические опыты; учит школьников безопасному и экологически грамотному обращению с веществами в быту и на производстве Программа направлена на формирование учебно-управленческих умений и навыков, учебно-коммуникативных, учебноинформационных умений и навыков, развитие логического мышления на основе формирования умений сравнивать, классифицировать, обобщать, делать выводы, анализировать, сопоставлять. Организация обучения Формы организации обучения: индивидуальная, парная, групповая, интерактивная. Методы обучения: По источнику знаний: словесные, наглядные, практические; По уровню познавательной активности: проблемный, частично-поисковый, объяснительно-иллюстративный; По принципу расчленения или соединения знаний: аналитический, синтетический, сравнительный, обобщающий, классификационный. Технологии обучения: индивидуально-ориентированная, разноуровневая, ИКТ. Результаты обучения 3 Формы проверки и оценки результатов обучения: (формы промежуточного, итогового контроля, том числе презентации, защита творческих, проектных, исследовательских работ) Способы проверки и оценки результатов обучения: устные зачёты, проверочные работы, интерактивные задания, тестовый контроль, практические и лабораторные работы. Средства проверки и оценки результатов обучения: Ключ к тестам, зачётные вопросы, разноуровневые задания, практические работы. Содержание тем учебного курса. Введение. (8 ч.) Предмет химии. Вещества. Вводный инструктаж по т/б. Превращения веществ. Роль химии в нашей жизни. Краткие сведения по истории развития химии. Основоположники отечественной химии. Правила безопасной работы в химическом кабинете. Знакомство с лабораторным оборудованием. Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов. Тема 1. Атомы химических элементов. (13ч.) Основные сведения о строении атомов. Состав атомных ядер: протоны и нейтроны. Изменение числа протонов, нейтронов в ядре атома. Понятия химический элемент, изотопы. Электроны. Строение электронных оболочек атомов элементов № 1—20 ПСХЭ Д.И.Менделеева. ПСХЭ Д.И.Менделеева и строение атомов: физический смысл порядкового номера, номера элемента, группы, периода. Изменение числа электронов на внешнем уровне. Ионы. Ионная связь. Взаимодействие атомов элементов неметаллов – образование молекул простых веществ. Ковалентная неполярная хим. связь. Электроотрицательность. Ковалентная полярная химическая связь. Образование металлических кристаллов: взаимодействие атомов металлов между собой. Обобщение и систематизация знаний об атоме, металлических и неметаллических элементах, видах химической связи. Тема 2. Простые вещества. (10 ч) Простые вещества металлы (Fe, Al, Ca, Mg, Na, K): положение в ПСХЭ Д.И.Менделеева, общие физические свойства. Простые вещества неметаллы (O2, O3, H2, N2, S, P,C): положение в ПСХЭ, общие физ. свойства. Аллотропия. Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Молярный объём газообразных веществ. Тема 3. Соединения химических элементов. (18 ч) Степень окисления. Бинарные соединения, составление формул и номенклатура. Важнейшие оксиды и летучие водородные соединения. Основания, их состав, названия, растворимость, важнейшие представители. Кислоты, их состав, классификация, названия, важнейшие представители. Соли, их состав, названия, растворимость, важнейшие представители. Урок-упражнение в составлении формул и названий веществ. Расчёты по формулам. Типы кристаллических решёток. Закон постоянства состава. Вещества аморфные, кристаллические, 4 молекулярные. Чистые вещества и смеси, их состав и свойства. Массовая и объёмная доли компонента смеси. Очистка загрязненной поваренной соли. Лабораторные работы «Знакомство с образцами веществ разных классов», «Разделение смесей» Тема 4. Изменения, происходящие с веществами. (14 ч) Понятие явлений как изменений, происходящих с веществами. Физические явления в химии: дистилляция, кристаллизация и др. Химические явления, их признаки и условия протекания. Экзо- и эндотермические реакции. Реакции горения. Закон сохранения массы вещества. Химические уравнения. Расчёты по химическим уравнениям. Расчёты по химическим уравнениям, с использованием понятия «доля». Реакции разложения и соединения. Понятие о скорости хим. реакции и катализаторах. Получение, собирание и распознавание кислорода. Реакции замещения и электрохимический ряд напряжения металлов. Реакции обмена обратимые и необратимые. Получение, собирание и распознавание водорода. Обобщение знаний о типах химических реакций на примере свойств воды. Лабораторные работы: «Сравнение скорости испарения капель воды и спирта с фильтровальной бумаги», «Взаимодействие металлов железа, алюминия, цинка с р-рами солей (CuSO4, AgNO3)» , «Взаимодействие H2SO4 + BaCl2, HCl + AgNO3, NaOH + FeCl3» Тема 5. Практикум №1. Простейшие операции с веществом 3 часа В результате изучения темы учащийся должен - проводить самостоятельный поиск явлений сопровождающих химические реакции. Практические работы: 1.правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами. наблюдения за изменениями, происходящие с горящей свечой, и их описание. 2.анализ почвы и воды. 3.признаки химических реакций, 4.приготовление раствора сахара и определение массовой доли его в растворе. Тема 6. Растворение. Растворы. Реакции ионного обмена и окислительно – восстановительные реакции. (27 ч) Растворение как физико-химический процесс. Понятие о гидратах и кристаллогидратах. Растворимость. Кривые растворимости. Типы растворов. Понятие об электролитической диссоциации. Электролиты и неэлектролиты. Механизм диссоциации электролитов с разным типом связи. Степень электролитической диссоциации. Сильные и слабые электролиты. Основные положения ТЭД. Ионные уравнения реакций, условия их протекания. Классификация ионов и их свойства. Кислоты, их классификация, диссоциация и свойства в свете ТЭД. Молекулярные и ионные уравнения реакций нейтрализации. Таблица растворимости. Основания, их классификация, диссоциация, свойства в свете ТЭД. Соли, их классификация, диссоциация различных типов солей. Свойства солей в свете ТЭД. Обобщение сведений об оксидах, 5 их классификации и химических свойствах. Генетические ряды металлов и неметаллов. Генетическая связь между классами неорганических веществ. Генетическая связь между основными классами неорганических соединений. Окислительно-восстановительные реакции. Окислитель и восстановитель. Метод электронного баланса. Окисление и восстановление в реакциях ионного обмена. Свойства простых веществ, кислот и солей в свете представлений об ОВР. Лабораторные работы: «Химические свойства HCl, H2SO4», «Химические свойства NaOH, Cu(OH)2», «Химические свойства CaO, CO2», «Химические свойства». Тема 7.Практикум №2. Свойства растворов электролитов 4 часа. В результате изучения темы учащийся должен - проводить самостоятельный химический эксперимент по изучению свойств веществ. Практические работы: 1.ионные реакции, 2.условия протекания химических реакций между растворами электролитов до конца, 3.свойства кислот, оснований, оксидов и солей, 4.решение экспериментальных задач. Тема 8.Портретная галерея великих химиков 4 часа В результате изучения темы учащийся должен знать/понимать: основные понятия и законы, теории химии и ученых их открывших. называть авторов различных законов химии, даты их жизни и основные события жизнедеятельности . 6 Календарно-тематическое планирование № Тема урока Дата Цели раздела Тип урока Методы ТСО Виды деятельности учащихся Дополнительная литература Домашнее задание Введение. 8 часов 1. Химия – наука о веществах, их свойствах и превращениях. 2. Превращения веществ. Роль химии в жизни человека. 3. Краткий очерк истории развития химии Периодическая система химических элементов. Знаки химических элементов. Химические формулы. Относительная атомная и молекулярная масса. Массовая доля элемента в соединении. 4. 5. - формировать понятия «химический элемент», «вещество», «атомы», «молекулы», «химическая реакция»; дать определение химической формулы вещества, формулировку закона постоянства состава. - развивать умение различать понятия «вещество» и «тело», «простое вещество» и «химический элемент»; умение отличать химические реакции от физических явлений; определять положение химического элемента в ПС, называть химические элементы, вычислять массовую долю химического элемента в соединении, определять состав веществ по химической формуле, принадлежность к простым и сложным веществам. - воспитывать наблюдательность. Внимательность. Вводный Словесный наглядный практич. Комбинир. Словесный наглядный практич. Комбинир. Словесный наглядный практич. Урок изучения нового материала Словесный наглядный Изделия из стекла и алюминия, модели молекул. Растворы соляной кислоты и известковой воды, кусочек мрамора. Таблица Д.И.Мендел еева. Усвоение новых знаний, беседа М.Ю. Горковенко стр.13 Читать §1, упр.3,6,10. РТ упр. 1-10, стр. 4-7. Усвоение новых знаний, наблюдение М.Ю. Горковенко стр.74 Читать §2, упр.1.2. РТ, стр.7-9,упр.1-4. Усвоение новых знаний, беседа М.Ю. Горковенко стр.16 Читать §4, упр. 5. РТ, стр.913,стр.9-13. ПСХЭ, карточки – задания. Усвоение новых знаний, беседа М.Ю. Горковенко стр.336 §5, упр.1,2,8. РТ,стр.1316,упр.1-10. 7 6. Расчетные задачи: 1) Нахождение относительной молекулярной массы вещества 2) Вычисление массовой доли химического элемента. 7. Правила ТБ при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием. Наблюдения за изменениями, происходящими с горящей свечой, и их описание. 8. Урок применения знаний и умений Словесный наглядный ПСХЭ, карточки – задания Изучить правила работы на уроках химии, лабораторную посуду и оборудование, правила ТБ. Практическая работа №1. практич. Стр. 74 учебника Учебная работа под рук-вом учителя М.Ю. Горковенко стр.36 Оформить практическую работу. Изучить физические явления при горении свечи, обнаружить продукты горения в пламени. Изучить влияние воздуха на горение свечи. Практическая практич. работа №2. Стр.180 учебника Учебная работа под рук-вом учителя М.Ю. Горковенко стр.35 Оформить практическую работу. Тема 1. Атомы химических элементов. 13 часов 9. Основные сведения о строении атомов. 10. Изменения в составе ядер атомов химических элементов. 11. Изотопы как разновидности атомов химического элемента. - формировать понятия «химический элемент», «ионы», «химическая связь». - развивать умение объяснять физический смысл атомного номера, номеров группы и периодов, определять тип химической связи в соединениях, объяснять закономерности Урок изучения нового материала Словесный наглядный практич. Модели атомов. Усвоение новых знаний, беседа М.Ю. Горковенко стр.336 §6,упр.3-5. Урок изучения нового материала Комбинир. Словесный наглядный практич. Модели атомов. Усвоение новых знаний, беседа М.Ю. Горковенко стр.336 §7,упр.3-5. Словесный наглядный практич. ПСХЭ Усвоение новых знаний, беседа М.Ю. Горковенко стр.219 §7,упр.3. РТ,стр.21,упр.1 -6. 8 12. Строение электронных оболочек атомов 1 и 2 периода. 13. Строение электронных оболочек атомов 3 и 4 периода. 14. Изменение числа электронов на внешнем энергетическом уровне атомов 1и 2 периода. 15. 16. 17. 18. Комбинир. Словесный наглядный практич. ПСХЭ, таблица. Усвоение новых знаний, беседа М.Ю. Горковенко стр.178 §8,упр.1-2. РТ, стр.23,упр.1-6. Урок применения знаний и умений Словесный наглядный практич. ПСХЭ Воспроизведени е знаний М.Ю. Горковенко стр.179 Читать §8,9, упр.3,4.5. РТ, стр.26,упр.1-7. Изменение числа электронов на внешнем энергетическом уровне атомов 3 периода. Ионная связь. Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь. Комбинир. Словесный наглядный практич. Таблица Усвоение новых знаний М.Ю. Горковенко стр.31 Читать § 9, упр.2. РТ,стр.29,упр.1 -3. Комбинир. Словесный наглядный практич. Таблица Усвоение новых знаний М.Ю. Горковенко стр.21 Читать §10, упр.1-5. РТ,стр.33,упр.1 -5. Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь (3 периода). Непарные электроны элементов 1,2,3 пери. Электротрицательность зависимость э.о. элемента от положения Комбинир. Словесный наглядный практич. Таблица Усвоение новых знаний М.Ю. Горковенко стр.21 Читать §10, упр.1-5. РТ,стр.33,упр.1 -5. Комбинир. Словесный наглядный практич. Таблица Усвоение новых знаний М.Ю. Горковенко стр.76 Читать §11, упр.1-4. РТ, стр.34,упр.1-7. изменения свойств элементов в пределах малых периодов и малых подгрупп. - воспитывать внимательность, наблюдательность, формировать навыки самостоятельной работы, ответственность. 9 в таблице ПСХЭ. 19. Ковалентная полярная химическая связь. 20. Металлическая связь. Комбинир. Словесный наглядный практич. Таблица Усвоение новых знаний М.Ю. Горковенко стр.344 21. Контрольная работа по теме: №1. «Атомы химических элементов». Урок контроля знаний Практич. ДМ, карточки задания Воспроизведени е и оценка знаний М.Ю. Горковенко стр.83 Читать § 12, упр. 1-3. РТ,стр.36,упр. 1-4. РТ, стр.38-40. Тема 2. Простые вещества. 10 часов 22. Простые вещества – металлы. 23. Простые вещества – неметаллы. Аллотропные модификации простых веществ. Количество вещества. Моль. Молярная масса. 24. 25. 26. Расчетные задачи: Расчеты с использованием понятий «Количество вещества». «Молярная масса». - формировать понятия «моль», «молярная масса», «молярный объем», формул соединений. - развивать умение характеризовать химические элементы на основе положения в ПС и особенностей строения атомов; вычислять количество вещества, массу по количеству вещества -воспитывать внимательность, наблюдательность, формировать навыки самостоятельной работы, Комбинир. Словесный наглядный практич. Коллекция металлов Усвоение новых знаний, беседа М.Ю. Горковенко стр.83 Комбинир. Словесный наглядный практич. Образцы неметаллов Усвоение новых знаний, беседа М.Ю. Горковенко стр.46 Урок изучения нового материала Урок применения знаний и умений Словесный наглядный практич. Химические Усвоение соединения новых знаний, количество беседа М.Ю. Горковенко стр.348 м вещества 1 моль. Читать §13, упр. 1,3. РТ, стр. 42,упр.46. Читать §14, упр.3. РТ,стр.43,упр .1-8. §15,упр.2(а,б) , 3(а,б). РТ,стр.45,упр .1-5. 10 ответственность. 27. Молярный объем газообразных веществ. Урок изучения нового материала Словесный наглядный практич. Модель молярного объема газов Усвоение новых знаний, беседа М.Ю. Горковенко стр.349 §16,упр.1(а), 2(а,в),4,5. РТ,стр.51,упр .1-8. 28. Решение задач по теме: «Молярный объем газов». Словесный наглядный практич. Таблицы с формулами Воспроизведен ие знаний М.Ю. Горковенко стр.210 Читать §18,19, упр. 1-3 29. Решение задач по теме «Простые вещества». Словесный наглядный практич. Дидактичес кий материал Воспроизведен ие знаний М.Ю. Горковенко стр.212 30. Подготовка к контрольной работе Словесный наглядный практич Дидактичес кий материал Воспроизведен ие знаний Читать §15,16. РТ,стр.52,упр .9-12. Читать §15,16. РТ,стр.52,упр .9-12. 31. Контрольная работа №2 по теме: «Простые вещества». Урок применения знаний и умений Урок применения знаний и умений Урок комплексного применения знаний Урок контроля М.Ю. Горковенко стр.215 Читать §17, упр.2,5,6. РТ,стр.54,упр .1-5. Тема 3. Соединения химических элементов. 18 часов 32. Степень окисления Бинарные соединения. 33. Составление формул бинарных соединений, общий способ их названия - формировать знания формул кислот, оснований, солей, оксидов; знания по классификации веществ, способам разделения смесей. - развивать умение определять степень окисления элемента в Урок изучения нового материала Словесный наглядный практич. ПСХЭ Комбинир. Словесный наглядный практич. ПСХЭ Усвоение новых знаний, беседа Читать §17, упр.2,5,6. РТ,стр.54,упр .1-5. 11 34. 35. 36. 37. 38. 39. 40. Важнейшие классы бинарных соединений оксиды. Лабораторная работа №1 «Знакомство с образцами веществ разных классов» Важнейшие классы бинарных соединений водородные соединения. Основания их состав и названия.. Понятие о качественных реакциях. Кислоты их состав и названия. Представители кислот:Н2SO4; HCl; HNO3;H2CO3; Н2SO3 Лабораторная работа №1(в) Соли их состав, названия. соединении, называть классы неорганических соединений, определять состав вещества по их формулам, определять принадлежность вещества к определенному классу соединений, вычислять массовую долю вещества в растворе. - воспитывать умение использовать знания для критической оценки информации о веществах, применяемых в быту. Комбинир. Словесный наглядный практич. Образцы оксидов Усвоение новых знаний, беседа Комбинир. Словесный наглядный практич Образцы оксидов комбинированн ый Комбинир. Словесный наглядный практич. Образцы оснований Усвоение новых знаний, беседа М.Ю. Горковенко стр.61 Урок изучения нового материала Словесный наглядный практич. Образцы кислот Усвоение новых знаний, беседа М.Ю. Горковенко стр.227 Комбинир. Словесный наглядный практич Урок изучения нового материала Словесный наглядный практич. М.Ю. Горковенко стр.217 Читать §18, упр.1,4,5. Усвоение новых знаний, беседа Образцы солей Усвоение новых знаний, беседа Читать §18, упр.1,4,5. РТ,стр.58.упр .1-5. М.Ю. Горковенко стр.227 Читать §19, упр. 2-6. РТ,стр.61.упр .1-5. Читать §20, упр.1,3.5,табл ица 5. РТ,стр.66,упр .1-5. Читать §20, упр.1,3.5,табл ица 5. РТ,стр.66,упр .1-5. Читать §21, упр.1-3. РТ,стр.70,упр .1-5. 12 41. Представители солей: хлорид натрия, карбонат и фосфат Са. Комбинир. Словесный наглядный практич. Образцы веществ разных классов Усвоение новых знаний, беседа, наблюдение М.Ю. Горковенко стр.229 Читать §1821. РТ,стр.73,упр .1-2. 42. кристаллические решетки. Урок изучения нового материала Словесный наглядный практич. М.Ю. Горковенко стр.234 §22. РТ,стр.75,упр .1-5. 43. Чистые вещества и смеси. Лабораторная работа№2 «Разделение смесей» Изучение нового материала Словесный наглядный практич. Таблица Усвоение «Кристалли новых знаний, ческие беседа решетки», модели кристалличе ских решеток. Примеры Усвоение чистых новых знаний, веществ и беседа, смесей. Сера наблюдение .железные М.Ю. Горковенко стр.112 Читать §23. РТ,стр.78,упр .1-4., упр.1-6. Групповая работа, решение задач Групповая работа, решение задач М.Ю. Горковенко стр.353 М.Ю. Горковенко стр.354 §24,упр.2,5-7. Групповая работа, решение задач М.Ю. Горковенко стр.355 РТ,стр.79,упр .1-8. 44. 45. 46. Массовая и объемная доли компонентов смеси. Решение расчетных задач по теме: «Массовой и объемной долей компонентов смеси веществ». Решение расчетных задач по теме: «Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе - формировать знания формул кислот, оснований, солей, оксидов; знания по классификации веществ, способам разделения смесей. - развивать умение определять степень окисления элемента в соединении, называть классы неорганических соединений, определять состав вещества по их формулам, определять принадлежность вещества к определенному классу соединений, вычислять массовую долю вещества в растворе. - воспитывать умение использовать знания для критической стружки. вода. магнит. Комбинир. Урок применения знаний и умений. Урок применения знаний и умений Словесный наглядный практич. Словесный наглядный практич. Таблица Словесный наглядный практич. Таблица Таблица §25,упр.1-6. 13 растворителя». 47. 48. 49. оценки информации о веществах, применяемых в быту. Решение расчетных задач по теме: «Вычисление массы растворяемого вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества. Решение комбинированных задач по теме «Массовая и объемная доля компонентов смеси (раствора)». Контрольная работа №3 по теме: «Соединения химических элементов». Урок применения знаний и умений Словесный наглядный практич. Урок применения знаний и умений. Словесный наглядный практич Таблица Групповая работа, решение задач М.Ю. Горковенко стр.59 РТ,стр.83,упр .9-14. Групповая работа, решение задач Урок контроля Тема 4. Изменения, происходящие с веществами. 14 часов. 50. Физические явления в химии Лабораторная работа№3 «Сравнение скорости - формировать понятия «Химическая реакция», «классификация химических реакций», знание закона сохранения массы веществ. - развивать умение Комбинир. Словесный наглядный практич. Примеры химических реакций Усвоение М.Ю. новых знаний, Горковенко беседа стр.63 Читать §26,упр.1-3. РТ,стр.8990,упр.1-5. 14 испарения воды и спирта по их исчезновению на фильтровальной бумаге» 51. 52. 53. 54. 55. 56. Химические реакции. Химические уравнения. Закон сохранения массы веществ. Составление уравнений химических реакций. Расчеты по химическим уравнениям. Решение расчетных задач по теме: «Вычисление по химическим уравнениям массы или количества вещества одного из вступающих реакцию в-в или продуктов реакции. Решение расчетных задач по теме: «Вычисление массы, количества вещества, объем продукта реакции, составлять уравнения химических реакций, определять тип химической реакции, характеризовать химические свойства металлов, воды, возможность протекания реакций ионного обмена, решать расчетные задачи на установление простейшей формулы вещества по массовым долям элементов. - воспитывать умение использовать знания для критической оценки информации о веществах, применяемых в быту. Комбинир. Словесный наглядный практич. Дидактически й материал Усвоение М.Ю. новых знаний, Горковенко беседа стр.65 Читать §27. РТ,стр.91,упр .1-5. Урок применения знаний и умений Урок изучения нового материала Урок применения знаний и умений Словесный наглядный практич Примеры химических реакций Читать §27. РТ,стр.91,упр .1-5. Словесный наглядный практич. Задачники рабочие тетради Словесный наглядный практич Задачники рабочие тетради Групповая работа, решение задач Групповая работа, решение задач Групповая работа, решение задач Урок применения знаний и умени Словесный наглядный практич Задачники рабочие тетради Групповая работа, решение задач М.Ю. Горковенко стр.68 Читать §28,упр.3-4. РТ,стр.93.упр .1-5. Читать §28,упр.5-6. РТ,стр.93.упр .1-5. Читать §28,упр.5-6. РТ,стр.93.упр .1-5. 15 57. если известна масса исходного вещества, coдержащего определенную долю примесей». Реакции разложения. Комбинир. Словесный наглядный практич. Разложение перманганата калия Усвоение М.Ю. новых знаний, Горковенко беседа стр.70 Читать §29, упр.1.4.5. РТ,стр.100,уп р.1-6. Читать §30,упр.1-3,8. РТ,стр.102.уп р.1-5. Читать §31,упр.1-3. РТ,стр.105.уп р.1-4. 58. Реакции соединения. Комбинир. Словесный наглядный практич. Горение магния Усвоение М.Ю. новых знаний, Горковенко беседа стр.333 59. Реакции замещения. Лабораторная работа№4 «Взаимодействие железа с сульфатом меди (II)» Комбинир. Словесный наглядный практич. Взаимодейств ие железа с сульфатом меди (II) Усвоение М.Ю. новых знаний, Горковенко беседа стр.287 60. Реакции обмена. Лабораторная работа№5«Взаимо действие H2SO4 + BaCl2, HCl + AgNO3, NaOH + FeCl3» Типы химических реакций на примере свойств воды. Гидролиз солей Комбинир. Словесный наглядный практич. Нейтрализация щелочи кислотой в присутствии индикатора Усвоение М.Ю. новых знаний, Горковенко беседа стр.292 Читать §32, упр.2-5. РТ,стр.107,ур о.1-5. Комбинир. Словесный наглядный практич. Дидактически й материал Усвоение М.Ю. новых знаний, Горковенко беседа стр.24 Комбинир. Словесный Дидактически Усвоение Читать §33, упр.1. РТ,стр.109,уп р.1-7. Читать §33, 61. 62. 16 63. Урок контроля знаний Контрольная работа №4 «Изменения, происходящие с веществами». наглядный практич й материал новых знаний, беседа Словесный наглядный практич. ДМ, карточки - задания Воспроизведе ние и оценка знаний М.Ю. Горковенко стр.356 упр.1. РТ,стр.109,уп р.1-7. Читать §2733. Тема 5. Практикум №1. Простейшие операции с веществом. 3 часа. 64. ПР №1 Анализ почвы и воды. 65. ПР№ 2 Признаки химических реакций. 66. ПР№ 3 Приготовление раствора сахара и определение массовой доли его в растворе. Произвести механический анализ почвы и воды, получить почвенный раствор и произвести опыты с ним, определить прозрачность воды, определить интенсивность запаха воды. Произвести 4 опыта: прокаливание медной проволоки, взаимодействие мрамора с кислотой, взаимодействие хлорида железа ( III) с роданидом калия, взаимодействие карбоната натрия с хлоридом кальция. Приготовить раствор сахара и рассчитать его массовую долю в растворе. Практическая практич. работа №3. Стр. 181 учебника Учебная работа под рук-вом учителя М.Ю. Горковенко стр.71 Оформить практическую работу. Практическая работа №4. практич. Стр.183 учебника Учебная работа под рук-вом учителя М.Ю. Горковенко стр.57 Оформить практическую работу. Практическая практич. работа №5. Стр.185 учебника Учебная работа под рук-вом учителя М.Ю. Горковенко стр.357 Оформить практическую работу. Тема 6. Растворение. Растворы. Свойства растворов электролитов. 27 часов. 17 67. Растворение. Растворимость веществ в воде. 68. Электролитическая диссоциация. Электролиты и неэлектролиты. 69. Основные положения теории электролитической диссоциации. Диссоциация сильных и слабых кислот. 70. 71. Ионные уравнения реакций. 72. Условия протекания реакции обмена между электролитами до конца в свете ионных представлений. Классификация ионов и их свойства.. 73. - формировать понятия «электролиты», «неэлектролиты», «ион», «электролитическая диссоциация», «окислитель», «восстановитель», «окисление», «восстановление». - развивать умение составлять уравнения реакций, называть кислоты, основания, соли, оксиды; характеризовать химические свойства кислот, оснований, солей, оксидов; определять степень окисления элемента в соединении. Урок изучения нового материала Словесный наглядный практич. ПСХЭ, таблица растворимо сти Усвоение новых знаний, беседа М.Ю. Горковенко стр.358 Читать §34,упр.2. РТ,стр.115119, упр.1-10. Комбинир. Словесный наглядный практич. ПСХЭ, таблица растворимо сти Усвоение новых знаний, беседа М.Ю. Горковенко стр.46 Читать §35,упр.1,4.5. РТ,стр.120.уп р.206. Комбинир. Словесный наглядный практич. Портреты Аррениуса и Менделеева Усвоение новых знаний, беседа М.Ю. Горковенко стр.50 Читать §36,упр.2-5. рТ,стр.121.уп р.7-15. Урок изучения нового материала Урок комплексног о применения знаний. Словесный наглядный практич. Таблица Усвоение новых знаний, беседа М.Ю. Горковенко стр.74 Словесный наглядный практич Таблица Усвоение новых знаний, беседа Читать §37, упр.1-3. РТ,стр.127,уп р.3-5. Читать §37, упр.1-3. Комбинир. Словесный наглядный практич Таблица Усвоение новых знаний, беседа Читать §37, упр.1-3. 18 74. Кислоты, их классификация и свойства. Урок изучения нового материала Словесный наглядный практич. Взаимодейс твие с кислотами 75. Химические свойства кислот. Лабораторная работа№6«Химичес кие свойства HCl, H2SO4», набор кислот Основания, их классификация и свойства. Комбинир. Словесный наглядный практич Взаимодейс твие с кислотами Урок изучения нового материала Словесный наглядный практич. Взаимодейств ие углекислого газа с известковой водой. Получение осадков нерастворимы х гидроксидов Комбинир. Словесный наглядный практич. Урок изучения нового материала. Словесный наглядный практич. 76. 77. 78. Химические свойства оснований. Лабораторная работа№7«Химичес кие свойства NaOH, Cu(OH)2» , набор оснований Оксиды, их классификация и свойства. - формировать понятия «электролиты», «неэлектролиты», «ион», «электролитическая диссоциация», «окислитель», «восстановитель», «окисление», «восстановление». - развивать умение составлять уравнения реакций, называть кислоты, основания, соли, оксиды; характеризовать химические свойства кислот, оснований, солей, оксидов; определять степень окисления элемента в соединении. - воспитывать умение использовать знания для критической оценки информации о Усвоение новых знаний, беседа, наблюдение М.Ю. Горковенко стр.300 Читать §38,упр.1-6. РТ,стр.134,уп р.1-7. Усвоение новых знаний, беседа, наблюдение М.Ю. Горковенко стр.300 Читать §39, упр.3,5. РТ,стр.141.уп р.1-7. Усвоение новых знаний, беседа, наблюдение Образцы оксидов Усвоение новых знаний, беседа, наблюдение Читать §39, упр.3,5. РТ,стр.141.уп р.1-7. М.Ю. Горковенко стр.300 Читать §40, упр.1-3. РТ,стр.129,уп р.1-7. 19 79. 80. 81. 82. 83. 84. 85. 86 Химические свойства оксидов. Лабораторная работа№8«Химичес кие свойства CaO, CO2», набор оксидов Соли, их классификация и свойства. . Химические свойства солей. Лабораторная работа№9 «Химические свойства», набор солей Генетические ряды металлов и неметаллов. Генетическая связь между классами неорганических веществ. Выполнение упражнений по теме «Генетический ряд веществ». Окислительно – восстановительные реакции. веществах, применяемых в быту. Комбинир. Словесный наглядный практич Урок изучения нового материала. Словесный наглядный практич Образцы оксидов Усвоение новых знаний, беседа, наблюдение Читать §40, упр.1-3. РТ,стр.129,уп р.1-7. Таблица Усвоение новых знаний, беседа М.Ю. Горковенко стр.360 Читать §42,упр.1-4. РТ,стр.154,уп р.1-9. Таблица Усвоение новых знаний, беседа М.Ю. Горковенко стр.361 §43,упр.1-3. РТ,стр.157,уп р.1-8. Комбинир. Урок применения знаний и умений Урок изучения нового материала Урок применения знаний и умений Урок изучения нового материала Словесный наглядный практик. Словесный наглядный практик Словесный наглядный практик. Реакции ионного обмена и окислительно – 20 восстановительные реакции. 87. 88. 89. 90. 91. Составление уравнений окислительно – восстановительных реакций методом электронного баланса. Упражнения в составлении ОВР методом электронного баланса. Свойства простых веществ – металлов и неметаллов, кислот, солей в свете представлений об окислительно – восстановительных процессах . Решение задач по теме: «Составление уравнений окислительно – восстановительных реакций». Обобщающий урок по теме: «Растворение.Раств оры. Свойства растворов». Урок применения знаний и умений - формировать понятия «электролиты», «неэлектролиты», «ион», «электролитическая диссоциация», «окислитель», «восстановитель», «окисление», «восстановление». - развивать умение составлять уравнения реакций, называть кислоты, основания, соли, оксиды; Словесный наглядный практик. ДМ Групповая работа, решение задач М.Ю. Горковенко стр.362 РТ,стр.164.уп р.1-4. Повторение и Словесный закрепление.. наглядный практик. ДМ Воспроизведен ие знаний М.Ю. Горковенко стр.143 РТ , нерешенные задания. Урок применения знаний и умений Словесный наглядный практик. ДМ Групповая работа, решение задач Рабочая тетрадь. РТ,стр.166169. Повторение и Словесный закрепление.. наглядный практик. ДМ Воспроизведен ие знаний Рабочая тетрадь. РТ, нерешенные задания. 21 92. 93. Решение задач по теме: «Составление уравнений окислительно – восстановительных реакций». Контрольная работа №5 по теме: «Свойства растворов электролитов». характеризовать химические свойства кислот, оснований, солей, оксидов; определять степень окисления элемента в соединении. - воспитывать умение использовать знания для критической оценки информации о веществах, применяемых в быту. Урок применения знаний и умений Словесный наглядный практик. ДМ Групповая работа, решение задач Рабочая тетрадь. Урок контроля знаний Словесный наглядный практик. ДМ Воспроизведен ие и оценка знаний Рабочая тетрадь. РТ, нерешенные задания. Тема 7. Практикум №2. Свойства растворов электролитов. 4 часа 94. Практическая работа № 6 Ионные реакции. Изучить практическим путем свойства растворов кислот, оснований, оксидов и солей. Практическая Словесный работа наглядный практик. Стр.237 учебника Учебная работа под рук-вом учителя Оформить практическую работу. 95. Практическая работа № 7 Условия протекания химических реакций между растворами электролитов до конца. Практическая работа № 8 Свойства кислот, оснований, оксидов и солей. Изучить практическим путем свойства растворов кислот, оснований, оксидов и солей. Практическая Словесный работа наглядный практик. Стр.240 учебника Учебная работа под рук-вом учителя Оформить практическую работу. . Изучить практическим путем свойства растворов кислот, оснований, оксидов и солей. Практическая Словесный работа наглядный практик. Стр.241 учебника Учебная работа под рук-вом учителя Оформить практическую работу. 96. 22 97. Практическая работа № 9 Решение эксперементальных задач. Решить различные экспериментальные задачи. Практическая Словесный работа наглядный практик. Стр.242 учебника Учебная работа под рук-вом учителя Оформить практическую работу. Тема: Портретная галерея великих химиков.6часов 98. Жизнь и деятельность Д.И.Менделеева. Периодическая система химических элементов и строение атома. 99.. Роберт Бойль (1627-1691) Резерв: 3 часов. 23 Требования к уровню подготовки выпускников В результате изучения химии ученик должен: знать/понимать химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций; важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление; основные законы химии: сохранения массы веществ, постоянства состава, периодический закон; уметь называть: химические элементы, соединения изученных классов; объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена; характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ; определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена; составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций; обращаться с химической посудой и лабораторным оборудованием; распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонатионы; вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции; использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: безопасного обращения с веществами и материалами; экологически грамотного поведения в окружающей среде; оценки влияния химического загрязнения окружающей среды на организм человека; 24 критической оценки информации о веществах, используемых в быту; приготовления растворов заданной концентрации. Учебно-методический комплекс: для учителя: 1. Габриелян О.С., Остроумов И.Г. Химия. 8 класс: Настольная книга учителя. - М.: Дрофа, 2008. 2. Горковенко М.Ю. Поурочные разработки по химии: 8 класс. – М.: ВАКО, 2007. – 368с. 3. Габриелян О. С., Воскобойникова Н.П. Настольная книга учителя. Химия 8 класс.- М.: Дрофа, 2010 г. 4. Габриелян О. С. Химия в тестах, задачах, упражнениях. 8-9 класс.: учеб. пособие для общеобразоват. учреждений/ Габриелян О. С., Воскобойникова Н.П. - М.: Дрофа, 2005. – 350с. г. для учащихся: 1. Химия. 8 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян. - М.: Дрофа, 2007. – 267с. 2. Химия в формулах. 8-11 кл.: Справочное пособие/ В.В. Еремин. – М.: Дрофа, 1997. -64с. 3. Габриелян О.С., Яшукова А.В. Химия. 8 класс: рабочая тетрадь к учебнику Габриеляна О.С. – М.: Дрофа, 2009. – 176с. Оснащение учебного процесса Натуральные объекты: Коллекции минералов и горных пород; Металлов и сплавов; Минеральных удобрений; Пластмасс, каучуков, волокон. Химические реактивы и материалы: Наиболее часто используемые: простые вещества: медь, натрий ,кальций, магний, железо, цинк; меди(||),кальция, железа(|||),магния; кислоты: серная, соляная, азотная; основания - гидроксиды: натрия,кальция,25%-ный водный раствор аммиака; соли: хлориды натрия, меди(||),алюминия, железа(|||);нитраты калия, натрия, серебра; сульфаты меди(||),железа(||),железа(|||),аммония; иодид калия, бромид натрия; органические соединения: этанол, уксусная кислота, метиловый оранжевый, фенолфталеин, лакмус. Химическая лабораторная посуда, аппараты и приборы: приборы для работы с газами; аппараты и приборы для опытов с твердыми, жидкими веществами; измерительные приборы и приспособления для выполнения опытов; стеклянная и пластмассовая посуда и приспособления для проведения опытов. 25 Модели: Наборы моделей атомов для составления шаростержневых моделей молекул; Кристаллические решетки солей. Учебные пособия на печатной основе: Периодическая система химических элементов Д.И.Менделеева; Таблица растворимости кислот, оснований солей; Электрохимический ряд напряжений металлов; Алгоритмы по характеристике химических элементов, химических реакций, решению задач; Дидактические материалы: рабочие тетради на печатной основе, инструкции, карточки с заданиями, таблицы. Экранно-звуковые средства обучения: 1. Электронная библиотека «Просвещение». «Химия. 8 класс». Мультимедийное учебное пособие нового образца. 2. Учебное электронное издание «Химия (8-11 класс). Виртуальная лаборатория» 3. 1С: Репетитор. Химия. 4. компьютерные презентации в формате Ppt. ТСО: Компьютер; Мультимедиапроектор; Экран; Кодоскоп; 26