Урок 43
реклама

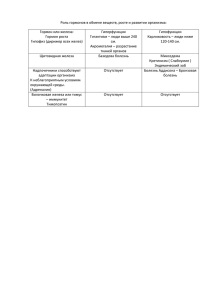
Урок 43 Оксиды, гидроксиды и соли железа (II) и железа (III) Цели урока: 1. Охарактеризовать способы получения и особенности физических и химических свойств соединений железа (II) и (III) (предметный результат). 2. Продолжить развивать умение генерировать идеи, выявлять причинноследственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат). 3. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат). Ход урока I. Подготовка к восприятию нового материала (10 мин) Опрос по домашнему заданию. II. Изучение нового материала (20 мин) Оксиды: FeO, Fe2O3, Fe3O4. При сгорании железа в кислороде и на воздухе в основном образуется смешанный оксид Fe3O4. Оксид Fe2O3 является амфотерным. Гидроксиды: Fe(OH)2. Чистый гидроксид железа (II) — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде. При нагревании разлагается. Fe(OH)3 амфотерный гидроксид. Красно-коричневого цвета, нерастворим в воде. Соли железа (II) получают при взаимодействии железа с растворами к-т HCl и разб. H2SO4. Соли железа (III) получают при сжигании железа в хлоре и при вз-и с конц. азотной и серной к-тами. Лабораторный опыт «Получение гидроксидов железа (II) и (III) взаимодействие их с кислотами и щелочами». III. Закрепление нового материала (10 мин) Решение задач по Боровских Рабочая тетрадь, С. 133. IV. Подведение итогов учебного занятия, рефлексия (5 мин) Домашнее задание: §44, с.136 задача 3, 4.