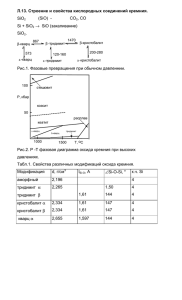
SiO 2 + Mg = __ +
реклама
Еремеева Наталья Александровна АКТИВНЫЙ РАЗДАТОЧНЫЙ МАТЕРИАЛ ПО ТЕМЕ « КРЕМНИЙ И ЕГО СОЕДИНЕНИЯ» 1.Положение в ПС и строение атома. Кремний(Si)- элемент ____ подгруппы ____ группы ____ периода периодической системы химических элементов Д. И. Менделеева, с атомным номером ____. Его электронная формула: Si 1s2... Возможные степени окисления: Si0 – 4e → Si+4, следовательно Si -Восстановитель Si0 + 4e → Si-4, следовательно Si-____ 2. Нахождение в природе Кремний(Si) - второй по распространенности элемент на Земле. Многие минералы образованы оксидом кремния (IV) SiO2. К ним относятся горный хрусталь, кварц, кремнезем. SiO2 – кремнезем – составная часть песка Al2O3 ∙2 SiO2 ∙2 H2 O – каолинит – составная часть глины K2O ∙ Al2O3 ∙6 SiO2 – ортоклаз ( полевой шпат) 3. Получение. Заполните таблицу: Получение кремния В лаборатории В промышленности SiO2+ C = __ + __ SiO2 + Mg = __ + __ 4.Физические свойства. Кристаллический Кремний Аморфный Заполните самостоятельно: 1. Кристаллический кремний-___. 2. Аморфный кремний-___. Кремний используется в качестве полупроводника. Из него изготавливают солнечные батареи. Кремний очень хрупок и относится к тугоплавким веществам. 5. Химические свойства. По химическим свойствам кремний, как и углерод, является ___. Но его неметалличность выражена слабее, так как он имеет меньшую величину ___ ___. 1.Кремний при обычных условиях химически довольно инертен. Взаимодействует только с фтором: Si +2F2 = ___; 2.С кислотами не взаимодействует ( кроме плавиковой HF и азотной HNO3). Si+ HF = Si + HNO3= 3.Растворяется в гидрооксидах щелочных металлов: Еремеева Наталья Александровна Si +2NaOH(конц) + H2 O = Na2SiO3 +2H2; 4.Измельченный кремний при нагревании с кислородом сгорает с образованием оксида кремния(IV): Si +O2 = ___ 5.При высокой температуре в электрической печи из смеси песка и кокса получается карбид кремния SiC- карбокорунд: Si + C =___ 6. Соединения кремния 1.Внимательно прочтите: Оксид кремния (IV). Оксид кремния (IV) называют также кремнеземом. Это твердое тугоплавкое вещество (t пл. 1700°С), широко распространенное в природе в двух видах: 1) кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности; 2) аморфный кремнезем — в виде минерала опала состава SiO2× п H2O; землистыми формами аморфного кремнезема являются диатомит, трепел. 2. Оксид кремния является кислотным оксидом. Какие химические свойства вы можете назвать общие с другими кислотами? SiO2 + MeO → MeSiO3 SiO2 + MeOH → MeSiO3 + H2 O Приведите примеры и запишите уравнения реакций. Специфическими химическими свойствами оксида кремния является то, что: Не реагирует с водой! При повышенной температуре вытесняет другие, более летучие оксиды из солей! Приведите примеры и запишите уравнения реакций Получение: Si + O2 = ___ Кремниевая кислота. 1.Прочитав текс учебника, ответьте на вопросы: Как получают кремниевую кислоту? Какими свойствами обладает кремниевая кислота? Почему плавиковую кислоту нельзя хранить в стеклянной посуде? Напишите уравнение реакции. Напишите степени диссоциации кремниевой кислоты. 2.Заполните таблицу: Название кислоты метакремниевая ? диметакремниевая Х=? Х=1 ? ? У=? ? У=2 ? Формула кислоты ? ? ? Соли кремниевой кислоты. Задание 1.Заполните пропущенные слова, пользуясь литературой. Еремеева Наталья Александровна 1.Соли кремниевой кислоты называются _________. 2.Если в состав природных силикатов входит оксид алюминия, то они называются _______. 3.Только силикаты ____ и ____ растворимы в воде. Задание 2. Силикаты натрия и калия называют растворимым стеклом, а раствор - жидким стеклом. Как известно силикаты широко применяют в технике. Жидким стеклом пропитывают ткани и древесину. Для чего?