Урок химии 9 классе. Урок новых знаний
реклама

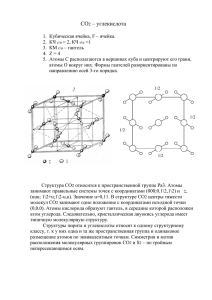
Урок химии 9 классе. Учитель - Низамутдинова Альфия Галиулловна Тема: Оксиды углерода. Тип урока: Урок новых знаний Цель урока: Изучить оксиды углерода: углекислый и угарный газ. Задачи урока: 1. Изучить строение, свойства, получение, области применения оксидов углерода, их взаимосвязь, воздействие угарного газа на организм человека, оказание первой медицинской помощи при отравлении угарным газом 2.Уметь описывать физические и химические свойства оксидов углерода, физиологическое воздействие их на организм, применять знания в жизни, в быту, проводить химический эксперимент с соблюдением техники безопасности, составлять уравнения реакций с их участием. 3.Воспитаниие потребности в безопасном обращении Веществами в быту. . Оборудование: компьютер, презентация, карбонат кальция, известковая вода, соляная кислота, прибор для собирания газа, пробирки, спички, модель огнетушителя, огнетушитель, минералы, газировка, видеозапись. План урока. 1. Организационный момент. Создание проблемной ситуации. Постановка целей и задач урока. 2.Изучение оксидов углерода. * Строение молекул СО и СО2. * Физические свойства. * Действие на организм человека. * Получение СО и СО2. * Химические свойства. * Инструктаж по технике безопасности при работе с кислотами *Закрепление Лабораторная работа «Получение и изучение свойств СО2» * Применение. 3.Заключение. Оценки. 4.Домашнее задание. Рефлексия. Ход урока 1.Организационный момент 2.Создание проблемной ситуации Вчера в газете в разделе чрезвычайных происшествий прочитала о том, как угорел заснувший при работающем двигателе в гараже водитель. Вам, я думаю, известны случаи, когда человек отравлялся угарным газом, при печном отоплении дома или бани. ПОЧЕМУ ПРОИСХОДИТ ОТРАВЛЕНИЕ УГАРНЫМ ГАЗОМ, А ЧЕЛОВЕК НЕ ЧУВСТВУЕТ ЕГО, А УГЛЕКИСЛЫМ ГАЗОМ НЕ ПРОИСХОДИТ ОТРАВЛЕНИЯ? Мы с вами знаем, что свойства веществ определяются строением. Цель наше урока изучить, сравнить строение молекул, свойства, области применения, получения углекислого и угарного газа. Узнаем, почему после побелки воздух становится влажным и свежим, почему в парилку бани нельзя складывать белые камни, как работает углекислотный огнетушитель? 2.Ответы на поставленные вопросы мы оформим в виде таблицы * Строение молекул СО и СО2. Признаки Строение молекул Угарный газ Углекислый газ Учитель: В молекуле СО между атомами ковалентных связей 3, а оттянутых от углерода к кислороду электронов- 2. В молекуле СО2 на образование ковалентных связей углерод отдает все 4 электрона. Учащиеся: Пишут в таблицу электронные и структурные формулы СО и СО2. *Физические свойства Учитель: Строение молекул веществ всегда определяет их свойства. Давайте запишем в таблицу, какие физическими свойствами они обладают и относительную плотность их по воздуху. Учащиеся: СО - газ, без цвета, без запаха ,малорастворимый в воде, Относительная плотность по воздуху примерно равняется 1. СО2- газ, без цвета, без запаха, растворяется в воде 1:1, относительная Плотность по воздуху равняется 1,5, при Р = 60 атм. превращается в жидкость при испарении , которой образуется «сухой лед». * Действие на организм человека. Учитель: Нам нужно подумать, почему происходит отравление угарным газом, а человек не чувствует происходящее, можно ли отравиться углекислым газом, почему нельзя входить в погреб без проветривания? Учащиеся: Ответ находят исходя из строения и физических свойств, если затрудняются, обращаются к учебнику. Заполняют таблицу. Угарный газ ядовитый, за счет не поделённой электронной пары в крови соединяется с гемоглобином в прочное соединение корбоксигемоглобин, лишая его возможности переносить кислород, человек не чувствует отравления, потому что СО не имеет цвета, не имеет запаха. СО2не ядовит, но не поддерживает дыхания и тяжелее воздуха в 1,5 раза, поэтому нельзя заходить в погреб без проветривания, нужно проветривать классные помещения во время перемен. *Первая помощь при отравлении СО. Учитель: Вы, из курса биологии, ОБЖ знаете какую помощь нужно оказать? Учащиеся: Доступ свежего воздуха .дать понюхать аммиак, горячий чай. *Получение СО и СО2. Учитель: Нам предстоит подумать о том, из каких веществ можно получить эти газы, так как они находят широкое применение. Вспомним специфические свойства карбонатов, взаимодействие углерода с кислородом. Демонстрирует получения СО2,видео запись. Почему мрамор нельзя класть в парилку? Учащиеся: Записывают у доски и в тетради уравнения. 1.С+ СО2 =СО. 1. С +О2 = СО2. 2.СаСО3 +2 НСL=СаСL2+СО2+Н2О 3.СО+О2 = СО2. 4.CаСО3 = СаО + СО2. Мрамор при нагревании разлагается на СО2,поэтому его нельзя класть в парилку. *Химические свойства. Учитель: Сейчас нам с вами нужно вспомнить классификацию оксидов и их свойства, найти в учебнике химические свойства СО, объяснить его восстановительные свойства, записать в таблицу их уравнения Самостоятельная работа. Учащиеся: Оксид СО несолеобразующий, не реагирует со щелочами и основными оксидами. В молекуле СО углерод имеет не поделенную пару электронов, поэтому он хороший восстановитель. горит в О2. 1.СиО +СО= Си + СО2 2.О2 +СО =СО2 Учитель: А теперь попробуем ответить на следующие вопросы: 1.Из каких веществ готовят газировку? 2.Что произойдет, если оставить открытым СаО? 3. ПОЧЕМУ ПОСЛЕ ПОБЕЛКИ СТАНОВИТСЯ СВЕЖО И СЫРО? Демонстрация СаО и газировки. Учащиеся: 1. Н2О +СО2 = Н2СО3 2.СаО + СО2 =СаСО3 3.Са(ОН)2 +СО2 =СаСО3 +Н2О Вывод: СО2 –кислотный оксид, взаимодействует с основным оксидом СаО, При побелке СО2из воздуха поглощается Са(ОН)2 и выделяется Н2О, не горит и не поддерживает горение. *Закрепление Учитель: Инструктаж по технике безопасности при работе с кислотами и щелочами. Нам на практике нужно закрепить знания, проведем лабораторную работу «Получение и изучение свойств СО2». Ответим на вопросы: как из СаСО3 получить СО2,какие опыты нужно провести чтобы доказать наличие СО2? Учащиеся: СО2 из СаСО3 получают действием кислот, определяют по помутнению Са(ОН)2,горящей лучиной, которая гаснет в СО2.Ребята, работая по парам, проводят лабораторную работу. *Применение СО и СО2 Учитель: На основе знаний строения молекул, физических и химических свойств СО2 и СО, расскажите областях применения этих веществ. Учащиеся: СО является восстановителем, используется как топливо, применяется в металлургии для получения металлов из их оксидов. Учитель: У нас в Челябинской области « МЕЧЕЛ», ММК, получают чугун и сталь, в Карабаше, в Кыштыме выплавляют медь. О каких областях Применения СО2 мы говорили, где применяется СО2,как вещество, которое не поддерживает горение? Учащиеся: СО2 применяют для приготовления шипучих напитков, «сухой лед» для хранения продуктов, в огнетушителях. Учитель: Демонстрирует углекислотный огнетушитель. Почему для тушения пожара, огнетушитель нужно перевернуть и сильно стукнуть, из каких веществ образуется пена? Рассмотрим модель огнетушителя. В колбу налили крепкий раствор соды. В неё вставили пробирку с концентрированной серной кислотой, закрыли газоотводной трубкой, переворачиваем и огнетушитель работает. *Заключение Мы с вами изучили строение молекул СО2 и СО, физические и химические свойства, соответствующие им области применения. На следующем уроке изучим угольную кислоту и её соли. Оценки с комментариями в дневники. *Домашнее задание: П. 29 до угольной кислоты, упр. 1-3, для сильных еще 4,в рабочей тетради Стр.124. *Рефлексия.