КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ Наименование разделов и тем Планируемые Скорректированн
реклама
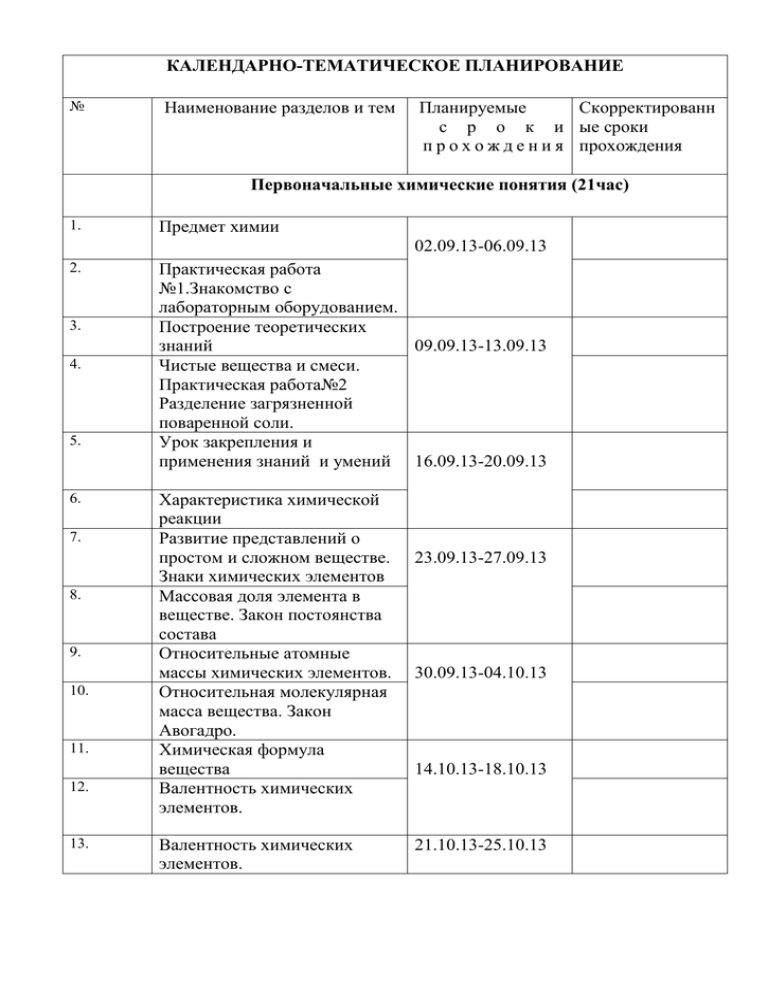
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ № Наименование разделов и тем Планируемые Скорректированн с р о к и ые сроки п р о х о ж д е н и я прохождения Первоначальные химические понятия (21час) 1. Предмет химии 02.09.13-06.09.13 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Практическая работа №1.Знакомство с лабораторным оборудованием. Построение теоретических знаний 09.09.13-13.09.13 Чистые вещества и смеси. Практическая работа№2 Разделение загрязненной поваренной соли. Урок закрепления и применения знаний и умений 16.09.13-20.09.13 Характеристика химической реакции Развитие представлений о простом и сложном веществе. Знаки химических элементов Массовая доля элемента в веществе. Закон постоянства состава Относительные атомные массы химических элементов. Относительная молекулярная масса вещества. Закон Авогадро. Химическая формула вещества Валентность химических элементов. Валентность химических элементов. 23.09.13-27.09.13 30.09.13-04.10.13 14.10.13-18.10.13 21.10.13-25.10.13 Названия бинарных веществ 14. 15. 16 17 18 19 Молярная масса вещества. 28.10.13-01.11.13 Молярный объём газообразного вещества. Урок закрепления и применения знаний и умений Уравнение химической 04.11.13-08.11.13 реакции Урок закрепления и применения знаний и умений Расчёт количества вещества по 11.11.13-15.11.13 уравнению реакции 20 Обобщение учебного материала 21 Контрольная работа №1 18.11.13-22.11.13 первоначальные химические понятия. Вещества и их превращения 16 часов 22 Становление в науке 23 24 25 26 27 28 29 представлений о простых веществах – металлах и неметаллах Металлы в природе. Первоначальные представления о химических свойствах металлов. История открытия кислорода. Состав воздуха Аллотропные модификации кислорода. Получение кислорода и озона Химические свойства кислорода. Применение кислорода Практическая работа№3 Получение кислорода и изучение его свойств. Урок закрепления и применения знаний и умений Расчеты по уравнению 02.12.13-01.12.13 09.12.13-13.12.13 16.12.13-20.12.13 23.12.13-27.12.13 13.01.14-17.01.14 химической реакции. 30 Урок закрепления и 31 32 33 35 применения знаний и умений История открытия водорода. Получение и физические свойства водорода. Химические свойства водорода. Применение водорода. Практическая работа №4 Получение водорода и изучение его свойств Углекислый газ. 36 Оксид и гидроксид кальция. 20.01.14-24.01.14 27.01.13-31.01.14 03.02.14-07.02.14 Свойства и применение. 37 Повторение и обобщение темы. 38 Контрольная работа 10.02.14-14.02.14 №2.вещества и их превращения Классы неорганических веществ 14часов 39 Кислотные оксиды 10.02.14-14.02.14 40 Кислоты 17.02.14-21.02.14 41 Классификация кислот. Особые свойства некоторых кислот. 42 Основные оксиды 24.02.14-26.02.14 43 Основания 44 Реакция нейтрализации. Соли 03.03.14-07.03.14 45 Химические свойства солей 46 Растворы. Массовая доля 10.03.14-14.03.14 вещества в растворе 47 Классификация неорганических веществ 48 Генетическая связь между классами неорганических веществ 49 Урок закрепления и применения знаний и умений 17.03.14-2.03.14 50 Практическая работа №5 24.03.14-28.03.14 Решение экспериментальных задач по теме «Свойства основных классов веществ» 51 Повторение и обобщение темы. 52 Контрольная работа № 3 31.03.14-05.04.14 оксиды, кислоты ,соли основания. Периодический закон Д.И. Менделеева. Строение Атома. 16 часов 53 Необходимость 54 55 56 57 58 59 60 классификации химических элементов. Практическая работа №6 Амфотерные оксиды и гидроксиды Открытие периодического закона. Структура периодической системы химических элементов Становление в науке представлений о строении атома. Состав атомных ядер. Изотопы Электронные оболочки атома. Атомные модели Бора. Описание элемента по положению в периодической системе элементов Д.И. Менделеева Урок закрепления и применения знаний и умений Обобщение темы. 31.03.14-05.04.14 07.04.14-11.04.14 21.04.14-25.04.14 28.04.14-03.05.14 05.05.14-10.05.14 61 Контрольная работа №4 Периодический закон. 62 Повторение темы Вещества и 12.05.14-16.05.14 их свойства 63 Повторение темы классы неорганических веществ 64 Повторение темы Периодический закон 19.05.14-24.05.14 65 Итоговое тестирование за 8 класс. 66 Анализ итогового тестирования. 67 Резервное время 68 Резервное время 26.05.14-29.05.14. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа составлена на основе авторской программы курса химии 8-9 класса П.А Оржековский, Л.М. Мещерякова, М.М. Шалашова, образовательной программы МБОУСОШ№4 им. П.И.Климука ЩМРМО (основное общее образование) на 2013-2014 учебный год, в соответствии с федеральным компонентом государственного образовательного стандарта Данная рабочая программа реализуется в рамках апробации учебника Оржековский П.А., Мещерякова Л.М., Шалашова М.М. Химия 8 класс . М.: «Астрель», 2013. на основании приказа № 62/2-о/д от 30.05.2013г.МБОУ СОШ№4 им. П.И. Климука ЩМРМО Изучение химии в школе на базовом уровне направлено: на освоение знаний о химической составляющей естественнонаучной картины мира, на освоение важнейших химических понятиях, законах и теориях на овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, для оценки роли химии в развитии современных технологий и получении новых материалов; на развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных; на воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде; на применение сформированных компетенций (полученных знаний и умений) для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде. Цели и задачи изучения предмета Освоение важнейших знаний об основных понятиях и законах химии, химической символике; Овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчёты на основе химических формул веществ и уравнений химических реакций; Развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями; Воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры; Применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, предупреждения явлений, наносящих вред здоровью человека и окружающей среде. Основная форма организации учебной деятельности: Урок Для достижения планируемых результатов обучения используются следующие Методы: Объяснительно-иллюстративный. Репродуктивный. Частично-поисковый. Проблемное изложение. Исследовательский Деятельностный Педагогические технологии Личностно-ориентированное обучение Технология интегрированного обучения ИКТ обучение Формы и методы контроля: Устный ответ Контрольная работа. Практическая работа Формы организации учебной деятельности: Индивидуальная, групповая, дидактические игры. Учебник по химии для 8 класса под редакцией П.А Оржековский, Л.М. Мещерякова, М.М. Шалашова рекомендован Министерством образования и науки Российской Федерации, соответствует обязательному минимуму содержания основного общего образования по химии, включен в Федеральный перечень учебников. Учебник содержит необходимый теоретический материал, соответствующий базовому уровню. Современное оформление, разнообразные вопросы и задания, возможность параллельной работы с другими пособиями, способствует эффективному усвоению учебного материала, а также развивающему подходу в обучении. Учебник содержит большое количество заданий, которые могут быть использованы для отработки умений и навыков, закрепления основных понятий, в учебнике много упражнений и задач разного уровня сложности. Программа включает все темы, предусмотренные федеральным компонентом государственного образовательного стандарта общего образования по химии и авторской программы учебного курса. Последовательность прохождения тем, и количество часов соответствует авторской программе. Авторская программа предлагает 5 практических работ, 4 контрольных в рабочей программе предусмотрено выполнение 5 практических 4 контрольных работ. Программа реализуется в учебнике: Оржековский П.А., Мещерякова Л.М., Шалашова М.М. Химия 8 класс . М.: «Астрель», 2013. Основное содержание учебной дисциплины. Тема 1. Первоначальные химические представления (21) Предмет химии. Значение химии. Вещества и физические тела (окружающие предметы). Химические явления. Исходные вещества и продукты реакции. Моделирование, как способ познания. Развитие в науке теоретических представлений о веществе и химической реакции: модель Аристотеля, атомная модель Демокрита. Роль Р. Бойля в становлении химии как науки. Основные положения атомно-молекулярной теории. Чистые вещества и смеси. Методы разделения смесей. Условия и признаки течения химических реакций. Реакция разложения и реакция соединения. Сущность химической реакции с позиции атомномолекулярной теории. Закон сохранения массы веществ в процессе химической реакции. Развитие в науке представлений о простом и сложном веществе. Химические элементы. Знаки химических элементов (H, O, C, Si, N, Р, S, Cl, Na, К, Ag, Au, Cu, Ca, Mg, Sn, Pb, Fe, Al, Zn). Аллотропия. Массовая доля химического элемента в веществе. Постоянство состава вещества. Относительная атомная масса химических элементов. Масса атома. Роль Дж. Дальтона в становлении атомно-молекулярной теории. Закон Авогадро. Относительная молекулярная масса вещества. Молярная масса вещества. Молярный объем вещества. Химическая формула вещества. Валентность химических элементов. Названия бинарных химических веществ. Уравнение химической реакции. Демонстрации: 1. Образцы веществ и физических тел, состоящих из этих веществ. 2. Горение магния. 3. Иллюстрация закона сохранения массы веществ. 4. Разложение воды под действием электрического тока. 5. Ознакомление с образцами простых и сложных веществ. 6. Шаростержневые модели молекул. 7. Примеры простых и сложных веществ, взятых количеством вещества 1 моль. 8. Химические реакции (по выбору учителя). Лабораторные опыты: 1. Знакомство с лабораторным штативом. 2.Знакомство с лабораторной посудой. 3. Изучение строения пламени. 4. Нагревание водных растворов. 5. Моделирование состава молекул некоторых веществ. 6. Изучение загрязненной поваренной соли. 7. Изучение свойств чистой поваренной соли и соли загрязненной сахаром и мелом. 8. Разделение смеси речного пека и воды фильтрованием. 9. Разделение подсолнечного масла и воды отстаиванием. 10. Выделение поваренной соли из водного раствора выпариванием. 11. Разделение смеси железа и серы с помощью магнита. 12.Обецвечивание водного раствора чернил адорбцией. 13. Горение лучины. 14. Нагревание сахара. 15. Взаимодействие соды и столового уксуса. 16. Взаимодействие мыльного раствора и укуса в присутствии индикатора. 17. взаимодействие известковой воды и углекислого газа. 18. Разложение сахара. Практические занятия: 1. Правила безопасной работы в химической лаборатории. Расчетные задачи: 1. Вычисление массовой доли элемента в веществе. 2. Вычисление относительной молекулярной массы веществ. 3. Вычисление количества вещества по массе вещества. 4. Вычисление количества вещества по объему газа. 5. Вычисление мольного соотношения участников реакции. Дополнительный учебный материал Расчетные задачи: 1. Расчеты массовой доли вещества в смеси. 2. Расчеты массовой доли веществ в многокомпонентных смесях (растворах) при смешении смесей (растворов). 3. Объемная и мольная доля вещества в смеси. 4. Расчеты на взаимосвязь объемной, массовой и мольной долей вещества в смеси. 5. Вывод химической формулы бинарного вещества по известному значению массовой доли одного из элементов. Тема 2. Вещества и их превращения (16 часов) Становление в науке представлений о простых веществах – металлах и неметаллах. Металлы в природе. Первоначальные представления о химических свойствах металлов (реакции с серой, кислородом и хлором). Роль металлов в истории человечества. Применение металлов и сплавов. Представление о неметаллах. История открытия кислорода. Развитие в науке представлений о воздухе. Состав воздуха. Загрязнители воздуха. Кислородная теория горения А. Лавуазье. Вещества, образованные химическим элементом кислородом. Получение кислорода разложением перманганата калия и пероксида водорода. Катализатор. Химические свойства кислорода: взаимодействие с фосфором, углем, серой, железом, медью, метаном. Представление о реакции окисления, как о взаимодействии вещества с кислородом. Применение кислорода. История открытия водорода. Получение водорода. Первоначальное представление о кислотах. Реакция замещения. Физические свойства водорода. Химические свойства водорода: взаимодействие с кислородом, оксидами металлов. Взаимодействие оксидов металлов с водородом как пример реакции восстановления. История открытия и получение углекислого газа. Физические и химические свойства углекислого газа. Проблема парникового эффекта. Оксид и гидроксид кальция (гашеная и негашеная извести). Получение оксида и гидроксида кальция. Взаимодействие гидроксида кальция с диоксидом углерода. История применения оксида и гидроксида кальция. Демонстрации: 9. Образцы руд (сульфидов, оксидов, хлоридов). 10. Горение железа в атмосфере кислорода. 11.Окисление меди. 12. Горение магния. 13. Взаимодействие железа с серой. 14. Взаимодействие меди с хлором. 15. Горение натрия в хлоре. 16. Собирание воздуха или кислорода методом вытеснения воды. 17. Определение объемной доли кислорода воздухе по изменению объёма воздуха при сжигании фосфора. 18. Получение кислорода разложением перманганата калия. 19. Каталитическое разложение пероксида водорода. 20. Собирание кислорода методами вытеснения воздуха и воды. 21. Горение веществ в кислороде (сера, фосфор, железо, уголь, спирт). 22. Получение водорода взаимодействием металлов с кислотами. 23. Получение водорода в аппарате Киппа. 24. Способы собирания водорода. 25. Проверка водорода на чистоту. 26. Горение водорода. 27. Взрыв гремучего газа. 28. Наполнение мыльных пузырей водородом. 29. Восстановление водородом меди из оксида меди(II). 30. Получение углекислого газа. 31. Приготовление известкового раствора. 32. Гашение негашеной извести. Лабораторные опыты: 19. Сравнение физических свойств серы, угля, железа, алюминия, меди. 20. Получение кислорода из перманганата калия и собирание его методом вытеснения воздуха. 21. Получение кислорода из перманганата калия и собирание его методом вытеснения воды. 22. Горение угля в кислороде. 23. Получение водорода из цинка и соляной кислоты. 24. Проверка водорода на чистоту. 25. Горение водорода. 26. Восстановление меди из оксида меди при помощи водорода. 27. Определение оксида углерода(IV) с помощью известковой воды. Практические занятия: 2. Получение кислорода и изучение его свойств. 3. Получение водорода и изучение его свойств (горение, восстановление оксида меди(II)). Расчетные задачи: 6. Расчеты массы вещества и объема газа по уравнению реакции. Дополнительный материал Расчетные задачи: 1. Выход реакции и способы его вычисления. 2. Расчеты с использованием значения выхода реакции. 3. Расчеты на избыток одного из участников реакции. Тема 3. Классы неорганических веществ (14 ч) Кислотные оксиды. Кислоты. Состав и название кислот. Общие химические свойства кислот: реакция с металлами, основными оксидами, изменение цвета индикаторов. Некоторые особенности свойств соляной, серной, азотной и ортофосфорной кислот. Основные оксиды. Основания и их названия. Химические свойства щелочей: реакции с кислотными оксидами, изменение цвета индикаторов. Реакция нейтрализации, как частный случай реакции обмена. Разложение нерастворимых в воде оснований и их взаимодействие с кислотами. Соли и их название. Химические свойства солей: реакция с металлами, реакция обмена. Растворы и растворение. Массовая доля вещества в растворе. Классификация неорганических веществ. Генетическая связь между классами неорганических веществ. Возможности использования атомномолекулярной теории для объяснения различных химических явлений. Демонстрации: 33. Изменение цвета пигментов, например, краснокочанной капусты или других пигментов растительного происхождения в кислотной среде. 34. Взаимодействие фосфорного ангидрида и, заранее полученных углекислого и сернистого газа с водой и индикаторами. 35. Взаимодействие оксида меди(II) с серной кислотой. 36. Обугливание серной кислотой бумаги, древесины и сахара. 37. Взаимодействие основных оксидов с водой. 38. Взаимодействие оксида кальция с оксидом углерода(IV). 39. Растворимость оснований в воде. 40. Взаимодействие твердого гидроксида калия (или гидроксида натрия) с оксидом углерода(IV). 41. Разложение гидроксида меди(II). 42. Взаимодействие растворимых и нерастворимых оснований с кислотами. 43. Замещение серебра медью из раствора соли. 44. Растворение сахара в воде. 45.Растворение в воде ацетона и отношение к воде растительного масла. 46. Получение насыщенного раствора хлорида калия. Лабораторные опыты: 28. Взаимодействие металлов с кислотами. 29. Изменение цвета индикаторов в щелочной среде. 30. Реакция нейтрализации. 31. Замещение меди железом из раствора соли. 32. Реакции обмена с участием солей (по усмотрению учителя). Практическое занятие: 4. Реакция между оксидом меди(II) и серной кислотой. Практическое занятие: 5. Решение экспериментальных задач по теме «Свойства основных классов веществ». Расчетные задачи: 6. Вычисление массовой доли растворенного вещества в растворе. Дополнительный материал Практикум. Решение экспериментальных творческих задач. Расчетные задачи: 1. Расчеты по уравнениям реакций с участием растворов или смесей веществ. 2. Вывод формулы вещества по результатам химической реакции. 3. Расчеты на взаимосвязь различных способов выражения концентрации растворов. 4. Расчеты на взаимосвязь величин, характеризующих растворимость вещества и концентрацию насыщенного раствора. :Тема 4. Периодический закон Д.И.Менделеева. Строение атома (14 ) Генетическая связь классов неорганических соединений. Необходимость классификации химических элементов. Попытки классификации химических элементов. Естественные семейства химических элементов. Открытие Периодического закона Д.И.Менделеевым. Объяснительная и Предсказательная роль периодического закона. Структура Периодической системы химических элементов. Факты, которые нельзя объяснить с помощью атомно-молекулярной теории. Становление в науке представлений о строении атома. Состав атомных ядер. Изотопы. Электронные оболочки атома. Атомные модели Бора. Описание химического элемента по положению в периодической системе химических элементов. Демонстрации: 47. Взаимодействие алюминия с растворами гидроксида калия и серной кислот. 48. Амфотерные свойства оксида и гидроксида алюминия или цинка. 49. Окраска пламени солями щелочных и щелочноземельных металлов. 50. Горение неоновой лампы. Лабораторные опыты: 32. Получение амфотерного гидроксида. 33. Взаимодействие амфотерного гидроксида с кислотой и щёлочью. Практическое занятие: 6. Амфотерные гидроксиды. Дополнительный материал Атомные орбитали. Электронная конфигурация атомов в зависимости от положения элемента в периодической системе Д.И. Менделеева. ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ В результате обучения химии в 8 классе учащиеся должны знать: химическую символику: знаки химических элементов, формулы химических веществ; важнейшие химические понятия: химический элемент, атом, молекула, относительная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций; основные законы химии: сохранение массы веществ, постоянство состава, периодический закон. уметь: Составлять Модели строения атомов элементов формулы веществ изученных классов по валентности атомов химических элементов; уравнения изученных химических реакций,. формулы изученных веществ по валентности атомов химических элементов; формулы веществ изученных классов по валентности атомов химических элементов и валентности кислотных остатков; уравнения химических реакций с участием простых веществ, оксидов, оснований и солей; уравнения химических реакций, соответствующие генетическим рядам металлов и неметаллов. Давать характеристику простым веществам металлам и неметаллам (кислорода, водорода); кислотным и основным оксидам, кислотам, щелочам и нерастворимым в воде основаниям, солям; генетическим рядам металлов и неметаллов. Химическм реакциям Химическим элементам (от водорода до кальция) в зависимости от их положения в периодической системе Д. И. Менделеева и особенностям строения их атомов. Определять: условия и признаки протекания изученных реакций; качественный и количественный составы изученных веществ по их формулам; валентность атомов химических элементов по формулам изученных веществ; кислоты как сложные вещества, в молекулах которых атомы водорода могут замещаться металлами; реакцию замещения. принадлежность изученных веществ к различным классам по их свойствам и по их формулам; валентность атомов химических элементов по формулам изученных классов химических веществ. признаки, характерные для растворов; необходимость использования индикаторов для определения кислой, нейтральной и щелочной среды; генетические ряды металлов и неметаллов; явления, сущность которых не может быть объяснена с позиции атомномолекулярной теории. причины и этапы систематизации химических элементов; в периодической таблице химических элементов период, группу; положение химического элемента в Периодической таблице; состав атомных ядер, различие состава атомных ядер у изотопов химических элементов; закономерности изменения свойств элементов в зависимости от их положения в периодической системе. Объяснять: различие между явлением и моделью, описывающей это явление; сущность изученных методов разделения и очистки веществ; отличие химических явлений от - физических; сущность относительной атомной и молекулярной масс; валентность как свойство атомов, определяющее постоянство состава веществ; что означает химическая формула вещества; сущность химической реакции на основе атомно-молекулярных представлений; сущность закона сохранения массы веществ; что химическое уравнение на микро-уровне показывает соотношение молекул исходных веществ и продуктов реакции, а на макро-уровне – мольное соотношение исходных веществ и продуктов реакции; невозможность понять сущность некоторых явлений (например, различий у химических элементов атомных масс, валентности, способности одних элементов образовывать металлы, а других неметаллы) несовершенством атомно-молекулярной теории. различие между фактом и умозаключением. истинность изученных химических законов и теоретических представлений на основании знаний о результатах экспериментов. сущность проведенных химических реакций; сущность окисления и восстановления на уровне атомно-молекулярной теории; роль катализатора в химической реакции; взаимосвязь свойств веществ и возможности их применения. условия горения и способы его прекращения; сущность рассмотренных экологических проблем причины периодичности изменения свойств химических элементов; причины построения модели строения атома; физический смысл атомного (порядкового) номера химических элементов, номеров группы и периода, к которым они принадлежат в Периодической системе химических элементов Д. И. Менделеева; закономерности изменения свойств химических элементов в пределах малых периодов и А-групп периодической системы; причины существования больших периодов; причины большего числа металлов, чем неметаллов. Проводить: распознавание растворов кислот и щелочей с помощью индикаторов; химические реакции, характеризующие свойства представителей изученных классов неорганических веществ; изученные химические реакции, иллюстрирующие генетическую связь классов неорганических веществ; классификацию веществ по различным признакам; типологию химических реакций по составу исходных веществ и продуктов. получение, собирание и идентификацию кислорода, водорода и углекислого газа; восстановление меди из оксида водородом Проводить расчеты: относительной молекулярной массы, молярной массы вещества по его химической формуле. массы или объема газа (исходного вещества или продукта реакции) по уравнению реакции; массы раствора и массы растворенного вещества с использованием данных о массовой доли растворенного вещества в растворе. количества вещества, зная массу или объем (газа) и наоборот; количества реагирующего вещества или продукта реакции уравнению реакции. Соблюдать правила: по техники безопасности при работе с веществами, лабораторной посудой и оборудованием; оказания помощи пострадавшим от неумелого обращения с изученными веществами. Проводить экспериментально: нагревание, отстаивание, фильтрование и выпаривание; очистку растворимого в воде вещества от содержащихся в нем нерастворимых в воде примесей; растворение веществ. Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: безопасного обращения с веществами и материалами; экологически грамотного поведения в окружающей среде; оценки влияния химического загрязнения окружающей среды на организм человека; критической оценки информации о веществах, используемых в быту; приготовления растворов заданной концентрации ПЕРЕЧЕНЬ УЧЕБНО-МЕТОДИЧЕСКОГО ОБЕСПЕЧЕНИЯ 1. Оржековский П.А. Мещерякова Л.М. Шалашова М.М. . Химия 8 Учебник для общеобразовательных учреждений. Гриф Рекомендовано Министерством образования науки РФ. М.: АСТ Астрель – 2013. – 272 2. Гендина Н.И., Колкова Н.И., Скипор И.Л., Стародубова Г.А. Формирование информационной культуры личности в библиотеках и образовательных учреждениях: Учебно-метод. пособие. – 2-е изд., перераб. - М.: Школьная б-ка, 2003. - 296 с. 3. Каракозов С.Д. Составляющие информационной культуры специалиста в контексте информатизации образования // Вестник Самарского государственного экономического университета. 2007, №9(35) . 4. Поташник М. М. Требования к современному уроку. Методическое пособие. — М.: Центр педагогического образования, 2011. 5. Фундаментальное ядро содержания общего образования/ под ред. В.В. Козлова, А.М. Кондакова. – 2-е изд.- М.: Просвещение, 2010.- 59с. – (Стандарты второго поколения). 6. Шамова Т. И., Давыденко Т. М., Шибанова Г. Н. Управление образовательными системами. — М.: Издательский центр «Академия», 2006. 7. И.Г. Хомченко « Сборник задач и упражнений по химии для средней школы» М.; « Новая Волна», 2001 – 2005. http://school-collection.edu.ru http://www.chemnet.ru. http://www.periodictable.ru



