Тема урока Планируемые результаты обучения эксперимент
реклама
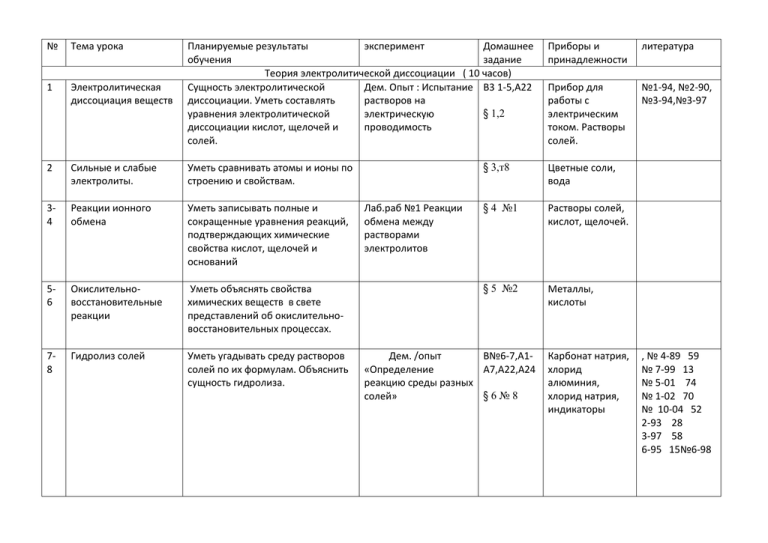
№ Тема урока 1 Электролитическая диссоциация веществ Планируемые результаты эксперимент Домашнее обучения задание Теория электролитической диссоциации ( 10 часов) Сущность электролитической Дем. Опыт : Испытание В3 1-5,А22 диссоциации. Уметь составлять растворов на § 1,2 уравнения электролитической электрическую диссоциации кислот, щелочей и проводимость солей. 2 Сильные и слабые электролиты. Уметь сравнивать атомы и ионы по строению и свойствам. 34 Реакции ионного обмена Уметь записывать полные и сокращенные уравнения реакций, подтверждающих химические свойства кислот, щелочей и оснований 56 Окислительновосстановительные реакции Уметь объяснять свойства химических веществ в свете представлений об окислительновосстановительных процессах. 78 Гидролиз солей Уметь угадывать среду растворов солей по их формулам. Объяснить сущность гидролиза. Лаб.раб №1 Реакции обмена между растворами электролитов Приборы и принадлежности литература Прибор для работы с электрическим током. Растворы солей. №1-94, №2-90, №3-94,№3-97 § 3,т8 Цветные соли, вода § 4 №1 Растворы солей, кислот, щелочей. § 5 №2 Металлы, кислоты Дем. /опыт В№6-7,А1«Определение А7,А22,А24 реакцию среды разных §6№8 солей» Карбонат натрия, хлорид алюминия, хлорид натрия, индикаторы , № 4-89 59 № 7-99 13 № 5-01 74 № 1-02 70 № 10-04 52 2-93 28 3-97 58 6-95 15№6-98 9 Решение экспериментальных задач. Уметь брать пробы веществ, описывать результаты наблюдений, делать выводы, составлять уравнения реакций. 10 Контрольная работа №1 Строение атома, степень окисления, электролитическая диссоциация 11 Строение атомов кислорода и серы. Строение простых веществ 12 13 Практическая работа №1 В8-10 А1-А7 А22-А24 Кислород и сера (9 часов) Уметь применять знания периодической системы и строения атома при характеристике элементов и простых веществ Сера. Аллотропия. Физические свойства. Уметь разъяснять зависимость качественных изменений от количественных на примере явления аллотропии Химические свойства серы .Применение Уметь составлять уравнения реакций взаимодействия серы с кислородом, водородом, и металлами. §7,8 Сера, компьютер §9 коллекция «Минералы и горные породы» §10, №6 Колба, ложка, сера, лакмус, вода Дем.Ознакомление с образцами серы и ее природных соединений. №5-95(35 стр) №5-96 (67 стр) №5-98 (65 стр) №1-00 (75,49) №3-97 (30) №3-94 (22) №2-89 14 Сероводород. Сульфиды. Оксид серы(IV).Сернистая кислота. Уметь распознавать сульфид- и сульфит ионы 15 Оксид серы (VI)Серная Знать химизм производства серной кислота. кислоты. Уметь записывать уравнения реакций, характеризующих свойства серной кислоты. 16 Решение задач Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной массе, количеству вещества или объему одного из вступающих или получающихся в реакции веществ. Уметь решать задачи на определение выхода продукта реакции в % ах от теоретического Дем/опыты «Получение SO2», «Взаимодействие SO2 с водой» Лаб.раб. №2 Распознавание сульфид- и сульфитионов в растворе §11,12 Дем/опыт «Взаимодействие конц. серной кислоты с медью» Лаб.работа № 3 «Качественная реакция на сульфат – ион» §13, №2 Тесты №12-14 по выбору Схема «Производство серной кислоты» Серная кислота, медные стружки, хлорид бария, разные соли серной кислоты №3-89(114) №4-89 №4-90 №5-91 (66) №7-98 №6-91 стр32 №4-96 (66) №2-93 (28) №7-00 (56) №2-02 (66 )экол №4-02 (41) §14, № 4 17 Химическое равновесие. Скорость химических реакций Знать условия смещения химического равновесия Знать зависимость скорости реакции от природы веществ, температуры, концентрации, катализатора, поверхности контакта 18 Экспериментальные задачи по теме «Кислород и сера» Уметь экспериментально доказывать качественный состав серной кислоты , распознавать сульфаты, предполагать признаки химических реакций 19 Контрольная работа №2 Соляная кислота, мел, серная кислота, оксид меди, алюминий, сера, вода, спиртовка № 8-02 (67) № 9-01 (18) № 1-91 (18) №6-90 (57) №5-97 (55) №2-93 (28) Практическая работа №2 Азот и фосфор (10 часов) 20 21 Подгруппа азота. Азот. Знать строение молекулы азота. Физические и Уметь составлять уравнения химические свойства. реакций, характеризующих химические свойства азота в свете представлений об окислительновосстановительных процессах Аммиак .Соли аммония. Знать лабораторный и промышленный способы получения аммиака, свойства аммиака и его водного раствора. § 15,16 Лаб.раб.№4 Взаимодействие солей аммония со щелочами § 17,18 Тест 7 №1-02 экол №1-03 №6-94 №4-96 №5-96 №2-00 №3-97 Модель установки синтеза аммиака, соли аммония, раствор щелочи, 72,77 41 46 60,61 24 84 37,38 №3-94 35 №5-95 21 №3-4-92 28 №4-94 42 э №1-96 60 индикаторы, спиртовка, аммиак, соляная кислота, палочка стеклянная №6-98 81,84 №7-99 68 №9-01 39 № 5-96 25 №5-02 №1-03 №1-91 №6-91 №4-92 №6-93 23 41 8 61 30 54 №2-03 №1-03 №1-09 №6-98 №2-03 №1-98 56 66 41,66 52 56 88 22 Азотная кислота Химизм лабораторного и промышленного способов получения азотной кислоты, ее свойства и применение Дем/опыт «Взаимодействие азотной кислоты с медью» §19 Конц. серная кислота, медь, спиртовка, нитраты 23 Соли азотной кислоты Знать свойства солей азотной кислоты Дем.опыт: «Качественная реакция на нитратион» § 20 , №1 Соли азотной кислоты, спиртовка 24 Фосфор и его соединения Природные соединения фосфора, аллотропные модификации. Основные химические свойства, некоторые области применения фосфора и его соединений Дем/опыт «Получение оксида фосфора ( )», §21,22 №5,6 Фосфор, спиртовка, вода,индикатор, колба, ложка с пробкой, нитрат серебра «Качественная реакция на фосфат ион» №5-95 №3-94 №9-01 №2-97 18 21 29,76 мэг 25 Минеральные удобрения Знать свойства азотных, калийных, фосфорных удобрений. Правила техники безопасности при работе с удобрениями Лаб.работа №5 «Ознакомление с минеральными удобрениями» § 23, №7-11 Коллекция «Набор удобрений» №6-94 №3-97 №3-97 №3-99 №1-98 №6-95 №2-05 48 30 31 79 26 55 19 26 Получение аммиака и изучение его свойств. кислотой» Практические работы №3 Соли аммония, щелочь, спиртовка, лакмус Минеральные удобрения 65 55 67 41 Определение минеральных удобрений. Дописать отчет о проделан ной работе. №5-98 №5-97 №5-96 №4-94 27 28 Знать химические свойства изученных соединений. Уметь определить неизвестные вещества , используя качественные реакции Уметь распознавать предложенные удобрения и подтверждать их состав. 29 Контрольная работа №3 § 24,25 , вопр. 4-9 Стр90 Кристаллические решетки алмаза и графита,схема №10-01 37 №2-02 71 №1-03 6 Практическая работа №4 Углерод и кремний ( 7 часов) 30 Углерод и кремний. Особенности строения атома углерода и кремния Аллотропные модификации углерода – алмаз, графит. Их строение и свойства, применение 31 Оксиды углерода Уметь составлять уравнения горения и восстановления металлов СО; взаимодействия с водой диоксида углерода 32 Угольная кислота и ее соли Знать формулы и названия различных солей угольной кислоты. Уметь объяснить результаты превращений солей 33 Кремний и его соединения Кремний и его соединения в природе, применение и свойства кремния и его соединений. 34 Силикатная промышленность Знать свойства цемента, стекла и получение их в промышленности газогенератора §26,27 Лаб. работа №6 «Распознавание карбонатов», «Превращения карбонатов» Дем. Ознакомление с образцами природных карбонатов Лаб.опыт № 7 Качественная реакция на силикат-ион Дем. «Знакомство с природными соединениями кремния», «Знакомство с видами стекла, топлива» №3-02 №4-02 №2-03 №1-03 64 17 11 42,6 Т-ца «Устройство газогенератора §28 ,29 Тесты, 1516 Стр 90 Соли угольной кислоты, пробирка с газоотводной трубкой, спиртовка, §30,31 Коллекция «Стекло и изделия из стекла», «Минералы и горные породы» §33, т4,7,8 Коллекция «Стекло», фарфоровые изделия № 1-03 42 № 3-03 57 № 3-03 56 № 9-01 24 № 9-01 29 № 10-01 39 № 4-04 71 35 Получение оксида углерода (IV) и изучение его свойств. 36 Контрольная работа №4 37 Строение атомов металлов. Физические свойства. Сплавы. 38 Металлы в природе и их получение 39 Химические свойства металлов. Ряд активности . Уметь распознавать карбонат-ион, наличие данного газа. Практическая работа №5 отчет Карбонаты, кислоты № 1-00 49 № 2-96 34 № 6-89 76 Общие свойства металлов (3 часов) §34,36,38 Уметь характеризовать строение Дем. атомов металлов, применять «Ознакомление с знания о металлической связи и металлами» кристаллической решетки для разъяснения физических свойств, способы защиты от коррозии §35, упр №57 Знать способы промышленного получения металлов. Разъяснять суть химических реакций. Уметь применять электрохимический ряд напряжений при объяснении реакций между металлами и растворами солей Кристаллически е решетки металлов Дем. «Изучение взаимодействия металлов с растворами солей» Тесты 3,7 Стр112, §37 № 1-96 29 № 5-98 67 № 3-02 30 № 1-96 29 № 5-98 67 № 3-02 30 Электрохимический ряд напряжений металлов № 2-02 37 40 Металлы IA - IIIA групп периодической таблицы химических элементов Д.И.Менделеева ( 5 часов ) §39, т2 Характеристика Уметь дать характеристику Дем.Ознакомление с Натрий, вода, щелочных металлов подгруппе щелочных металлов образцами солей фенолфталеин щелочных металлов. 41 Положение магния и кальция в периодической системе Уметь разъяснять общие и особые свойства кальция.. 42 Кальций и его соединения Знать , чем обусловлена жесткость воды. Знать химические свойства кальция. 43 Алюминий и его соединения Уметь составлять уравнения химических реакций, характеризующих общие свойства алюминия, его оксида и гидроксида. Уметь разъяснять явление амфотерности 44 Решение экспериментальных задач Уметь распознавать соединения щелочных металлов, кальция по анионам, практически получать их из предложенных веществ. §40, т5 Природные соединения кальция §41 Карбонаты, спиртовка, известь Лаб.опыт №8 Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами. §42 7-8 тесты Коллекция «Алюминий» Практическая работа №6 отчет Дем. «Ознакомление с природными соединениями кальция» №5-97 62 №1-98 65 №6-98 54 Железо (3часа) 45 Строение и свойства железа Уметь разъяснять свойства железа, оксидов, гидроксидов, солей железа в свете учения об ионных реакциях и окислительновосстановительных процессах 46 Железо и его соединения Уметь подтверждать практически знания о свойствах соединений железа. 47 Решение экспериментальных задач Уметь составлять план анализа веществ. Уметь распознавать, получать вещества. Делать выводы. §43,отв на все воросы Коллекция «Металлы и сплавы» № 2-02 15 2-2000 84 6-93 55 Лаб.раб. №9 «Получение гидроксидов железа и взаимодействие их с кислотами и щелочами Изучить таблицу Стр221§44 Соли железа, щелочи, спиртовка, кислоты 3-99 27 1-2000 75 Практическая работа №7 «Металлы и их соединения» Дописать отчет о проделан ной работе № 5-96 68 5-94 45 6-90 49 Металлургия (5 часов) 48 Производство чугуна Записывать уравнения реакций , лежащих в основе получения чугуна. Уметь объяснить сущность доменного производства чугуна §45-46 Рассказать по схеме Коллекция «Чугун и сталь» № 10-02 34 3-95 34 49 Производство стали 50 Проблема безотходной технологии в металлургии, охрана окружающей среды. 51 52 Решение задач 53 54 Пробное ЕГЭ 55 Органическая химия. Основные положения теории строения органических веществ. Классификация органических веществ. 56 Знать способы получения стали. Уметь сравнивать различные способы получения по экономическим и экологическим показателям Знать сущность безотходной технологии, методы охраны окружающей среды от загрязнения отходами металлургической промышленности. §47 Рассказать по схеме Написать об экологиче ских проблемах своей деревни Знать элементарную классификацию органических веществ № 8-02 28 №5-99 7 №1-94 №4-98 №7-99 №5-99 №6-90 №2-99 Вычисления по химическим уравнениям массы, объема или количества вещества одного из продуктов реакции по массе исходного вещества, объему или количеству вещества, содержащего определенную долю примесей. Органические соединения (12 часов) Объяснить причины многообразия органических веществ. Виды изомерии. Модель кислородного конвертора §48-49 §50 6 9 46 78 57 Предельные углеводороды. Знать предельных углеводородов по их формулам, уметь определить гомологов, свойства (горение, замещение) Знать непредельных углеводородов по их формулам, уметь определить гомологов, свойства (горение, присоединение), практическое значение. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения. 58 Непредельные углеводороды 59 Природные источники углеводородов. 60 Решение задач Установление простейшей формулы вещества по массовым долям элементов 61 Спирты 62 Карбоновые кислоты. Эфиры. Жиры. Метанол и этанол. Физические свойства, применение и физиологическое действие спиртов. Глицерин, этиленгликоль и применение Муравьиная и уксусная кислоты физические свойства. Роль жиров в организме Дем. Модели молекул органических соединений §51зад№1 Лаб.раб.№10,11 «Получение этилена и его свойства.», «Получение ацетилена и его свойства. §52,53 Дем. Образцы нефти и продуктов их переработки.. §54 Образцы нефти, каменного угля и продукты их переработки. Дем. Качественная реакция на многоатомные спирты §55 Спиртовка Дем. Исследование свойств жиров: растворимость в воде и органических растворителях §56, зад №2 Образцы жиров Этанол, карбид кальция, вода, серная кислота, пробка с газоотводной трубкой 63 Углеводы. Нахождение в природе, применение и биологическая роль глюкозы, сахарозы, крахмала и целлюлозы Понятие об аминокислотах. Белкивысокомолекулярные природные соединения, их биологическая роль, применение. Дем. Качественные реакции на глюкозу и крахмал §57, зад.№5 64 Аминокислоты. Белки. Дем. Качественные реакции на белок §58, т 2-3 65 Полимеры Иметь представление о полимерах Дем. Ознакомление с образцами изделий из полиэтилена, полипропилена, поливинилхлорида §59,№14 устно 66 Лекарства. Понятие о составе лекарств, правила их применения 67 68 Контрольная работа №6 Резервное время -2 часа §60 Образцы углеводов Согласовано, зам.директора по УР __________ Хабибуллина Г.А. Утверждаю, директор школы: ____________Д.Я.Курмашев Тематическое планирование по химии для 9-ого класса Всего: 68 часов Практические работы:7 Лабораторные работы: 17 Учебник Г.Е.Рудзитис, Ф.Г.Фельдман М.«Просвещение»,2008г.



