Факультативное занятие на тему «Уравнение состояния
реклама

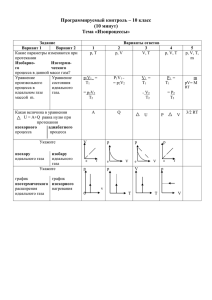
Факультативное занятие на тему «Уравнение состояния идеального газа» в X классе Цели: -образовательная – ознакомление с уравнением состояния идеального газа; -развивающая – формирование умения сравнивать, анализировать; -воспитывающая – выработка умения работать в группе (развитие коммуникабельности). Оборудование: поурочные карты, экспериментальные задания и необходимое к ним оборудование Ход факультативного занятия Ориентировочно – мотивационный этап Поисковый этап Контрольно – коррекционный этап и домашнее задание 1.Повторение ранее изученного материала с помощью задания 2 (см. поурочная карта). 2.Фронтальное обсуждение выполненного задания. 3.Ориентировка учащихся по содержанию последующей работы: поурочная карта (задание 3.1, 3.2, 3.3) 1.Работа учащихся в группах, сформированных в соответствии с индивидуальным выбором учащихся способов достижения задач. 1.Доклады 3 учащихся о результатах достижений работы в группе. 2.Коррекция знаний тех учащихся, которые допустили ошибки. 3.Рефлексия. 4.Самоопределение в отношении домашнего задания. 5 мин. 2 мин. 2 мин. 15 мин. 10 мин. 10 мин. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Поурочная карта Задачи: усвоить уравнение состояния идеального газа, уравнение Менделеева- Клапейрона. Задание I Прочитайте следующий текст: Для однозначного описания равновесного состояния газа достаточно определить его термодинамические параметры: давление, объем, температуру. Соотношение, связывающие эти параметры, называется уравнением состояния. В общем виде его можно записать так: p=p(V,Т). Задание II Повторите ранее изученный материал с помощью следующих заданий: 2.1. Составьте два текста (А1… и А2…) из фраз А,Б,В,Г,Д. А: 1. при неизменной температуре с увеличением давления… 2. при неизменном давлении и повышении температуры… Б: 1. увеличивается… 2. уменьшается… В: При этом… 1.произведение давления газа на его объем является постоянной величиной. 2.изменение объема газа прямо пропорционально изменению его температуры. Г: Зависимость между этими параметрами изображается… 1. графиками на рис. А 2. графиками на рис. Б V А P2 P1 0 t p Б t2 t1 0 V Д: Эти линии называются… 1. изобарами, а соответствующие им процессы – изобарными. 2. изотермами, а соответствующие им процессы – изотермическими. Найдите, какое из приведенных уравнений при v=const является уравнением… 1. изотермического процесса 2. изобарного процесса 3. изохорного процесса 4. произвольного процесса, протекающего с идеальным газом 5. состояния идеального газа А: V1T2 = V2T 1 Б: p1V1=p2V2 В: p1v1/T1=p2V2/T2 Г: p1T2=p2T1 Д: pV=vRT Задание III Выберите наиболее приемлемый для Вас вид деятельности по решению задач урока: 1. Выведите уравнение состояния, используя законы Бойля – Мариотта и Гей – Люссака (теоретики); 2. Получите уравнение состояния для произвольного количества газа (теоретики); 3. Экспериментально установите связь между давлением, объемом и температурой для фиксированного количества газа (практики). Задание IV Продумайте полученный результат и подготовьте к отчету по результатам своей деятельности. Задание V Прослушайте сообщение учителя. Задание VI Рефлексия. 1. Представьте, что перед Вами футбольное поле. Подумайте и расскажите, кем вы были в течение урока (зрителем на дальнем ряду, активным болельщиком, игроком команды, вратарем). Почему? Что мешало (или помогало) Вам принять активное участие на уроке? 2. Удовлетворены ли Вы достигнутым результатом? Задание VII Самоопределитесь в отношении домашнего задания: ∙ Сделать конспект параграфа 22 или ∙ Ответьте на вопросы после параграфа 22 и проверьте себя по тексту учебного пособия ∙ Выведите уравнение состояния, используя законы Шарля и Гей – Люссака ∙ Опишите применение газовых законов в технике Экспериментальное задание №1 Цель: Изучите экспериментально связь между объемом, давлением и температурой воздуха. Оборудование: 1) цилиндр переменного объема; 2) манометр демонстрационный; 3) кастрюля с горячей водой; 4) брусок – подставка; 5) резиновая трубка. Порядок выполнения работы 1.Соедините цилиндр с помощью резиновой трубки с манометром. Измерьте давление воздуха в цилиндре. 2.Измерьте объем воздуха в цилиндре в относительных единицах V1 ~ I1. 3. Измерьте температуру воздуха в цилиндре, считая её равной комнатной. 4. Налейте в банку (кастрюлю) горячей воды, опустите туда цилиндр, произвольно изменив объем воздуха в цилиндре с помощью винта. 5. Повторите опыт в холодной воде. 6. Результаты измерений запишите в таблицу: P V T PV/T Примечание Комнатная температура Теплая вода Холодная вода 7. Пользуясь полученными результатами, вычислите значения PV/T для каждого состояния. 8. Сравнив полученные результаты, сделайте выводы. Подсказка к заданиям: 3.1. Изучите §22, выводы запишите в тетрадь. 3.2. Смотри экспериментальные задания 1 и 2.