Соли - 1aya.ru
реклама
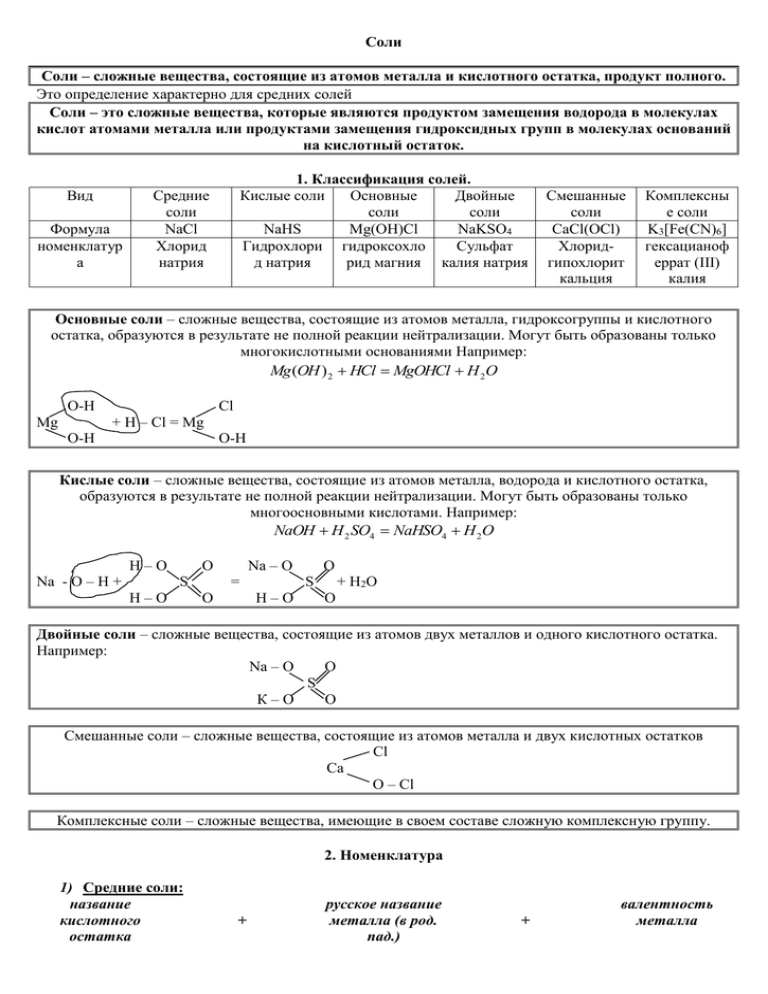
Соли Соли – сложные вещества, состоящие из атомов металла и кислотного остатка, продукт полного. Это определение характерно для средних солей Соли – это сложные вещества, которые являются продуктом замещения водорода в молекулах кислот атомами металла или продуктами замещения гидроксидных групп в молекулах оснований на кислотный остаток. Вид Формула номенклатур а 1. Классификация солей. Кислые соли Основные Двойные соли соли NaHS Mg(OH)Cl NaKSO4 Гидрохлори гидроксохло Сульфат д натрия рид магния калия натрия Средние соли NaCl Хлорид натрия Смешанные соли CaCl(OCl) Хлоридгипохлорит кальция Комплексны е соли K3[Fe(CN)6] гексацианоф еррат (III) калия Основные соли – сложные вещества, состоящие из атомов металла, гидроксогруппы и кислотного остатка, образуются в результате не полной реакции нейтрализации. Могут быть образованы только многокислотными основаниями Например: Mg (OH ) 2 HCl MgOHCl H 2O О-Н Cl + H – Cl = Mg Mg O-H O-H Кислые соли – сложные вещества, состоящие из атомов металла, водорода и кислотного остатка, образуются в результате не полной реакции нейтрализации. Могут быть образованы только многоосновными кислотами. Например: NaOH H 2 SO4 NaHSO4 H 2O H–O Na - O – H + Na – O O S H–O = S H–O O O + H2 O O Двойные соли – сложные вещества, состоящие из атомов двух металлов и одного кислотного остатка. Например: Na – O O S К–O O Смешанные соли – сложные вещества, состоящие из атомов металла и двух кислотных остатков Cl Сa O – Cl Комплексные соли – сложные вещества, имеющие в своем составе сложную комплексную группу. 2. Номенклатура 1) Средние соли: название кислотного остатка + русское название металла (в род. пад.) + валентность металла 2) Кислые соли: Число «Н» + гидро название кислотного остатка + 3) Основные соли: Число гидроксо «ОН» + 4) Двойные соли: название кислотного остатка 5) Смешанные соли: название кислотных остатков (по усложнению) + + название кислотного остатка русское название + металла (в род.пад.) валентность металла русское название металла (в род.пад.) валентность металла + + русские названия металлов (в род.пад.) + + русское название металла + + валентность металлов валентность металла Физические свойства солей. Большинство солей – твердые вещества белого цвета, некоторые соли имеют окраску. По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Химические свойства солей 1) Растворяются в воде (см. таблицу растворимости). 2) Соли взаимодействуют с металлами, если: а) соли растворимые; б) металл стоит левее соли; в) металл не щелочной и не щелочноземельный Металл соль Металл соль Fe CuSO4 FeSO4 Cu 3) Растворы солей взаимодействуют со щелочами, если образуется осадок раствор соли раствор щелочи новая соль новое основание 4) 5) 6) 7) FeCl3 NaOH Fe(OH ) 3 NaCl Растворы солей взаимодействуют с кислотами, если образуется газ или осадок СОЛЬ КИСЛОТА СОЛЬ КИСЛОТА BaCl 2 H 2 SO4 BaSO 4 HCl Растворы солей взаимодействуют между собой, если образуется осадок соль I соль II соль III соль IV CuSO4 Ba ( NO3 ) 2 Cu( NO3 ) 2 BaSO 4 Некоторые соли разлагаются при нагревании (нитраты, карбонаты) t CaCO3 CaO CO2 Основные соли взаимодействуют с кислотами, а кислые с основаниями. NaHSO4 NaOH Na2 SO4 H 2 O MgOHCl HCl MgCl 2 H 2 O Неметалл Получение солей Кислотный оксид Кислота Соль Металл Соль (1) - Соль + Н2 (4) Соль + металл (8) Основной оксид - Соль (2) Соль + вода (5) - Основание - Соль + вода (3) Соль + вода (6) Соль+основание (9) Соль - - Соль+кислота (7) 11) Разложение некоторых солей: NaNO3 → NaNO2 + O2↑ Соль+соль (10)



