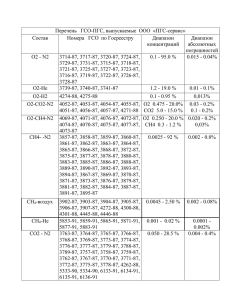
Пример расчета горения топлива
реклама

ПРИМЕР ВЫПОЛНЕНИЯ РАСЧЕТА ГОРЕНИЯ ГАЗООБРАЗНОГО ТОПЛИВА Состав топлива СН4 = 90,8 % С2Н6 = 5,4 % Определяем коэф. пересчета К с→ р = 100 / ( 100+0,124*W ) К с→ р = 100 / ( 100+0,124*100 ) = 0,89 С3Н8 = 1,2 % С4Н10 = 0,3% СО2 = 1,3 % N2 = 1,0 % W = 100 г/нм³ Для заданного состава топлива выполняем полный расчёт горения. СН4= 0,89*90,8 = 80,812% С2Н6 = 0,89*5,4 = 4,806 % С3Н8= 0,89*1,2 = 1,068 % С4Н10 = 0,89*0,3 = 0,267 % СО2= 0,89*1,3 = 1,157 % N2 = 0,89*1 = 0,89 % W= 100 % - ( 80,812 + 4,806 + 1,068 + 0,267 + 1,157 + 0,89 ) = 11 % Расчет выполняем на 100 м3 СН4 = 80,812 % = 80,812 м³ С2Н6 = 4,806 % = 4,806 м³ С3Н8 = 1,068 % = 1,068 м³ С4Н10 = 0,267 % = 0,267 м³ СО2 = 1,157 % = 1,157 м³ N2 = 0,89 % = 0,89 м³ W = 11 % = 11 м³ ∑ = 100 % = 100 м³ Реакции горения СН4+ 2 О2 → СО2 + 2 Н2О 80,812 161,62 80,812 161,62 С2Н6 + 3,5 О2 → 2 СО2 + 3 Н2О 4,806 16,82 9,612 14,418 С3Н8 + 5 О2 → 3 СО2 + 4 Н2О 1,068 5,34 3,204 4,272 С4Н10 + 6,5 О2 → 4 СО2 + 5 Н2О 0,267 1,74 1,068 1,335 Определяем суммарный расход кислорода ∑ О2 = 161,62 + 16,82 + 5,34 + 1,74 = 185,52 м³ Расход азота N2 = 3,76 * 185,52 = 697,55 м³ Теоретический объем воздуха Lт = О2 + N2 = 185,52 + 697,55 = 883,07 м³/100 м³ Практический объем воздуха Lп = α * Lт = 1,05 * 883,07 = 927,22 м³/100 м³ или 9,27 м³/м³ газа Определяем теоретический объем дымовых газов Vт = СО2+N2+Н2О = (1,157+80,812+9,612+3,204+1,068) + (697,55+0,89) + + (11+161,62+14,418+4,272+1,335) = 95,853+698,44+192,645 = 986,938 м³/100 м³ или 9,87 м³/м³ Vп = Vт + ∆L Определяем избыток воздуха ∆L= Lп – Lт = 927,22 – 883,07 = 44,15 м³, из них О2 = 44,15 * 0,21 = 9,2715 м³ N2 = 44,15 * 0,79 = 34,88 м³ Практический объем дымовых газов Vп = 986,938 + 44,15 = 1031,088 м³/100 м³ или 10,31 м³/м³ Таблица материального баланса горения топлива Приход М3 кг 1. Топливо СН4 = (80,812/22,4)*16 57,72 С2Н6 = (4,806/22,4)*30 6,44 С3Н8 = (1,068/22,4)*44 2,097 С4Н10 = (0,267/22,4)*58 0,69 N2 = (0,89/22,4)*28 1,11 W = (11/22,4)*18 8,84 2. Воздух О2 = 278,28 (185,52/22,4)*32*1,05 915,53 N2 = (697,55/22,4)*28*1,05 Итого: 1270,707 Расход М3 Дымовые газы СО2 = (95,853/22,4)*44 Н2О = (192,64/22,4)*18 N2 = (733,37/22,4)*28 О2 = (9,2715/22,4)*32 Итого: кг 188,28 154,8 915,53 13,24 1271,85 Определяем процентный состав дымовых газов: % СО2 = ( 95,853 / 1031,088 ) * 100 % = 9,29 % % N2 = ( ( 697,55 + 34,88 + 0,89 ) / 1031,088 ) * 100 % = 71,12 % % Н2О = ( 192,645 / 1031,088 ) * 100 % = 18,68 % % О2 = ( 9,2715 / 1031,088 ) * 100 % = 0,89 % Определяем плотность дымовых газов: ρд.г. = (%СО2*μСО2+%N2*μN2+%Н2О*μН2О+%О2*μО2) / (100*22,4) = = (9,29*44+71,12*28+0,89*32+18,68*18) / (100*22,4) = 1,23 кг/м³. µ -молярная масса Определяем низшую теплоту сгорания по формуле: Qр н=(qCН4*%СН4+qС2Н6*%С2Н6+qС3Н8*%С3Н8+qС4Н10*%С4Н10)/100 Q – низшая теплота сгорания компонента топлива( справочник) Qр н = (35811*80,812+63748*4,806+91255*1,068+118646*0,267) / 100 = = 33294,702 кДж. В 1 м³ дыма: СО2 = 0,0929 м³ Н2О = 0,1868 м³ N2 = 0,7112 м³ Определяем температуру горения топлива: Задаемся tк1 = 2100ºС Определяем энтальпиюiо iо = Qр н / Vт = 33294,702 / 9,87 = 3373,32 кДж/м³ Определяем теплосодержание дымовых газов iсо2 = Vсо2 * С со2 * tк = 0,0929 * 2,4699 * 2100 = 481,85 кДж/м³ iн2о = 0,1868 * 1,9633 * 2100 = 770,16 кДж/м³ iN2 = 0,7112 * 1,4914 * 2100 = 2227,44 кДж/м³ ∑ = 3479,45 кДж/м³ Задаемся tк2 = 2200°С iсо2 = 0,0929 * 2,4699 * 2200 = 504,79 кДж/м³ iн2о = 0,1868 * 1,9633 * 2200 = 806,84 кДж/м³ iN2 = 0,7112 * 1,4914 * 2200 = 2333,5 кДж/м³ ∑ = 3645,13 кДж/м³ Определяем калориметрическую температуру по формуле tк = tк1 + ( ( iо – i1 ) / ( i2 – i1 ) ) * ( tк2 – tк1 ) tк = 2100 + ( ( 3373,32 – 3479,45 ) / ( 3645,13 – 3479,45 ) ) * ( 2200 – 2100 ) = = 2163,98 ºС Определяем практическую температуру tn = 2163,98 * 0,7 = 1514,786 ºС tn = tк * ŋ