Открытый урок Обобщение по теме Алканы, алкены, алкины» : Громова Ольга Ильинична
реклама

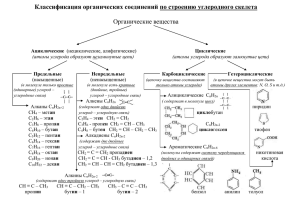
МОУ «Лямбирская средняя общеобразовательная школа №1» Открытый урок Обобщение по теме Алканы, алкены, алкины» Учитель: Громова Ольга Ильинична 2009 год Цели: 1. Организовать деятельность учащихся по восприятию, осмыслению, поаторению знаний о гомологическом ряде алканов, алкенов, их строении, особенности функциональной группы, природе двойной связи, физических и химических свойствах. 2. Обеспечить закрепление знаний о Sp3 Sp2 Sp гибридизации, взаимном влиянии атомов. 3. Создать содержательные и организационные условия для самостоятельного применения школьниками комплекса знаний и способов деятельности. 4. Организовать деятельность учащихся по обобщению знаний и способов деятельности. 5. Организовать проверку и оценку знаний и способов деятельности учащихся, организовать деятельность учащихся по коррекции своих знаний и способов деятельности Тип урока: комбинированный Метод урока: - словесный (беседа, рассказ) - наглядный (доска, шаростержневые модели) Задачи: - образовательная (формирование у учащихся основных понятий и законов органической химии, фактов, научного языка, раскрытие доступных обобщений мировоззренческого характера, т.е. овладение основами знаний химической науки) - развивающая (развитие умений наблюдать и объяснять явления и закономерности, проявляющиеся в природе, лаборатории, в повседневной жизни) - воспитательная (воспитание элементов эколого-химической культуры; повышение мотивации к учению через изучаемый предмет; формирование внутренней потребности к самосовершенствованию) Ход урока I. Орг момент. II Обобщение знаний 1) Фронтальный опрос. Общая формула алканов, алкенов, алкинов, спиртов, альдегидов, карбоновых кислот Гибридизация алканов, алкенов, алкинов О чём говорит Sp3, Sp2, Sp Угол между облаками при Sp3, Sp2, Sp Какую форму в пространстве имеет молекула при Sp3, Sp2, Sp Первое положение Бутлерова Второе положение Бутлерова Что такое изомер Что такое гомолог О чём говорит суффикс ан, ен, ин С какими классами существуют межклассовые изомеры у алканов, алкенов, алкинов, спиртов, альдегидов, карбоновых кислот. В каком случае возможна изомерия, геометрическая ,оптическая Что означает: гидрирование, гидратация, дегидрирование, дегидратация Какой вид гибридизации имеется в следующих веществах:СН4, СН2=СН2, СН≡СН Пока идёт фронтальный опрос 4 ученика выполняют письменные задания. Работа у доки строится следующим образом: один ученик, быстрее всех выполнивший задание объясняет его, садится, на его место встаёт другой и т. д. до конца урока (Работа идёт по карточкам) Карточка № 1. Составьте и запишите уравнения следующих химических реакций: а) гидрирование бутена-1; б) гидрохлорирование пропена; в) гидратация пропена; г) горение бутана Карточка № 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Карточка № 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения СаСО3 →СаО→СаС2 →СН≡СН→СН2=СН2→СН3—СН2ОН→ СН2=СН2→ СН3—СН2СI Карточка № 4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения СН4 → СН2=СН2→ СН≡СН→ СН2=СН2→ СН3 —СН3→ СН3—СН2СI→СН2=СН2→СО2 Карточка № 5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения С→СН4 →СН3СI→СН3 —СН3→СН2=СН2→СН2СI—СН2СI→СН2=СН2→n[— СН2 —СН2—] Карточка №6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Карточка № 7 Решить задачу При сгорании 3г. углеводорода было получено 8,8 г.углекислого газа,5,4 г. воды. Относительная плотность углеводорода по воздуху равна 1,03. Определите молекулярную формулу углеводорода. 3г. 8,8г. 5,4г. CxHу + О2 = СО2 + Н2О 44г 18г Т.к. -.это углеводород => кроме углерода и водорода в нём больше ничего не содержится. Весь углерод из углеводорода перешёл в 8,8г СО2, а водород в 5,4г Н2О. 1. Рассчитаем Мr (CxHу) Мr (CxHу) = 1,03 29 = 30 2.Рассчитаем массу углерода в 8,8г СО2 44 8,8 8,8 12 ; Х ; Х = 2,4г 12 Х 44 3. Рассчитаем массу водорода в 5,4г Н2О. 18 5,4 5,4 2 ; Х ; Х = 0,6 2 Х 18 4. Рассчитаем количество атомов углерода и водорода 2,4 0,6 : 0,2 : 0,6 2 : 6 ;=> С2Н6 γ = т/Аr; х : у = 12 1 5. Устанавливаем простейшая формула или истинная Мr (С2Н6) = 12 2 + 6 = 30; Это истинная формула Карточка № 8 Определите молекулярную формулу предельного углеводорода, если а) относительная плотность по водороду равна 43; Дано: D (CxHу) Н2 = 43 СnH2n+2 Решение: 1.Найдём молекулярную массу М(CxHу) = D(CxHу)Н2 Мr(Н2) X -: У- ? (n) 2. Найдём количество атомов, составив уравнение СnH2n+2 =86 (Вместо С и Н подставим числовые значения их относительных атомных масс и придём к математическому уравнению) 12n + 2n + 2 = 86; 14n = 86 – 2; 14n = 84; n = 6 => C6H14 Карточка № 9 Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углеводорода и 7,69% водорода. Найдите молекулярную формулу. : Дано W% (С) = 92, 31 W% (Н) = 7, 69 D (CxHу)Н2 = 39 Решение: 1.Найдём молекулярную массу Мr (CxHу) = 39 2 = 78 2. Найдём количество атомов, т.е. отношение х:у=? 92,31 7,69 : 7,69 : 7,69 1 : 1 ; => СН 12 1 3. Убедимся, истинная это формула или простейшая. Для этого найдём молекулярную массу (СН); Мr(СН) = 12 + 1 = 13, а у нас 78 => нашли простейшую формулу. Чтобы вывести истинную формулу вещества нужно узнать сколько раз 13 уложится в 78,. именно на столько нужно будет увеличить количество атомов в простейшей формуле. 78: 13 = 6 => С6Н6 Mr (С6Н6) = 12 6 + 6 = 78 γ = т/Аr; х : у = Карточка №10.Назовите вещества по систематической номенклатуре Карточка №11. Назовите следующие алкины: а) СН С–СН2–СН3; III Кроссворд «Предельные углеводороды». На каждую парту выдается по кроссворду, время решения которого 5 мин. После этого проверяют ответы. Ребята, которые ответили на все вопросы правильно и быстрее всех, получают оценку «отлично». Для заполнения сетки кроссворда по горизонтали необходимо ответить на следующие вопросы. По горизонтали: 1. Алкан, имеющий молекулярную формулу С3Н8. 2. Простейший представитель предельных углеводородов. 3. Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием. 4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана. 5. Трихлорметан. 6. Название радикала С2Н5–. 7. Наиболее характерный вид реакций для алканов. 8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях. Если ребята правильно ответили на вопросы, то в выделенном столбце по вертикали получат одно из названий предельных углеводородов. Ответ. Конкурс «Проведи линию». В двух столбцах приведены формулы алканов и их названия по номенклатуре ИЮПАК. Нужно соединить линией каждую формулу с соответствующим ей названием предельного углеводорода. Сколько изомеров в этой таблице? (Два изомера – 2-метилпропан и н-бутан) 2. Загадка. В названии какого кисломолочного продукта нужно убрать крайние буквы, чтобы получить название предельного углеводорода с массовой долей углерода 75%. (Сметана – метан.) 3. Названия каких алканов зашифрованы в ребусах? .) (Октава – октан (Бутон – бутан.) (Танк – этан.) IV. Подведение итогов Карточка № 1. Составьте и запишите уравнения следующих химических реакций: а) гидрирование бутена-1; б) гидрохлорирование пропена; в) гидратация пропена; г) горение бутана Карточка № 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Карточка № 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения СаСО3 →СаО→СаС2 →СН≡СН→СН2=СН2→СН3—СН2ОН→ СН2=СН2→ СН3— СН2СI Карточка № 4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения СН4 → СН2=СН2→ СН≡СН→ СН2=СН2→ СН3 —СН3→ СН3— СН2СI→СН2=СН2→СО2 Карточка № 5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения С→СН4 →СН3СI→СН3 —СН3→СН2=СН2→СН2СI—СН2СI→СН2=СН2→n[— СН2 —СН2—] Карточка №6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Карточка № 7 Решить задачччу При сгорании 3г. углеводорода было получено 8,8 г.углекислого газа,5,4 г. воды. Относительная плотность углеводорода по воздуху равна 1,03. Определите молекулярную формулу углеводорода. Карточка № 8 Определите молекулярную формулу предельного углеводорода, если а) относительная плотность по водороду равна 43; Карточка № 9 Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углеводорода и 7,69% водорода. Найдите молекулярную формулу. Карточка №10.Назовите вещества по систематической номенклатуре Карточка №11. Назовите следующие алкины: а) СН С–СН2–СН3; 2. Загадка. В названии какого кисломолочного продукта нужно убрать крайние буквы, чтобы получить название предельного углеводорода с массовой долей углерода 75%. (Сметана – метан.) Кроссворд «Предельные углеводороды». Для заполнения сетки кроссворда по горизонтали необходимо ответить на следующие вопросы. По горизонтали: 1. Алкан, имеющий молекулярную формулу С3Н8. 2. Простейший представитель предельных углеводородов. 3. Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием. 4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана. 5. Трихлорметан. 6. Название радикала С2Н5–. 7. Наиболее характерный вид реакций для алканов. 8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях. Если правильно ответили на вопросы, то в выделенном столбце по вертикали получится одно из названий предельных углеводородов. Конкурс «Проведи линию». В двух столбцах приведены формулы алканов и их названия по номенклатуре ИЮПАК. Нужно соединить линией каждую формулу с соответствующим ей названием предельного углеводорода. Сколько изомеров в этой таблице? (Два изомера – 2-метилпропан и н-бутан) 3. Названия каких алканов зашифрованы в ребусах .)