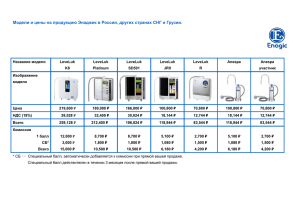
тесты с ответами
реклама

Мониторинг по химии 9 класс Фамилия и имя _________________________ класс____________ школа_________________ Город__________________________ район__________________________________________ I вариант Часть А А 1 . В атомах элементов II группы главной подгруппы на последнем слое: А) 1 электрон; Б) 2 электрона; В) 3 электрона; Г) 4 электрона. А 2 . Среди элементов есть металл, оксиды и гидроксиды которого проявляют амфотерный характер. Это элемент: А) Be Б) Mg В) Ca Г) Sr А 3 . В химических реакциях металлы II группы главной подгруппы II группы главной подгруппы: А) окислители, Б) восстановители, В) окислители и восстановители. А 4 . По сравнению со щелочными металлами металлы II группы главной подгруппы: А) более химически активные; Б) менее активные; В) равной активности. Часть С С1. Составьте уравнения химических реакций согласно схеме: Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2 Укажите тип каждой химической реакции; реакцию №1 разберите как окислительно-восстановительный процесс; для реакции №4 составьте полное и сокращенное ионные уравнения. С2. Решить задачу: Какой объём SO2 может быть получен при сжигании 1,6 г S, если выход продукта составляет 80% от теоретически возможного. Мониторинг по химии 9 класс Фамилия и имя _________________________ класс____________ школа_________________ Город__________________________ район__________________________________________ II вариант А 1 . В атомах элементов I группы главной подгруппы на последнем слое: А) 1 электрон; Б) 2 электрона; В) 3 электрона; Г) 4 электрона. А 2 . Среди элементов есть металл, оксиды и гидроксиды которого проявляют амфотерный характер. Это элемент: А) Al Б) In В) Tl Г) B А 3 . В химических реакциях металлы I группы главной подгруппы: А) окислители, Б) восстановители, В) окислители и восстановители. А 4 . По сравнению со щелочноземельными металлами металлы I группы главной подгруппы: А) более химически активные; Б) менее активные; В) равной активности. А 5. Какой из металлов при взаимодействии с кислородом образует пероксид: А) Li ; Б) Са ; В) Na С) Mg Часть С С1. Составьте уравнения химических реакций согласно схеме: Li ---- Li 2O ---- Li OH ----- Li 3PO 4 Укажите тип каждой химической реакции; реакцию №1 разберите как окислительно-восстановительный процесс; для реакции №4 составьте полное и сокращенное ионные уравнения. С2. Решить задачу: Какой объём Н 2 может быть получен при растворении в воде 11,5 г Na, если выход водорода составляет 95% от теоретически возможного. Ответы на мониторинговую работу в 9 классе (2 четверть) 1 вариант Часть А оценивается в 1 балл каждый правильно выполненный ответ ( всего 4 балла) 1 2 3 4 Б А Б Б Часть С С1. Содержание верного ответа и указание оценивания (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Балл Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2 1) 2Ca + O2 = 2CaO Ca0 - 2 e → Ca+2 /2 – (восстановить – окисляется) 2O0 +4 e→ O-2/1 – (окислитель – восстанавливается) 2) CaO + Н2О= Ca(OH)2 3) Ca(OH)2 + Н2СО3 = CaCO3 + 2 Н2О 4) CaCO3 + 2НСl= CaCl2 + СО2 + Н2О CaCO3 + 2H+ +2 Cl- = Ca2+ +2Cl- + Н2О CaCO3 + 2H+ = Ca2+ + Н2О Ответ включает все названные выше элементы, не содержит химических ошибок 6 Ответ включает 4 уравнения реакций, но выполнено одно из предложенных заданий. Ответ не содержит химических ошибок 5 Каждое уравнение без химических ошибок оценивается в 1 балл Всего 4 Каждое правильно выполненное из предложенных заданий оценивается в 1 б. Всего 2 Ответ неправильный 0 Максимальный балл 6 С2. Оценивается в 3 балла ( каждый из шагов в 1 балл) Дано: m (S)=1,6 г W (SO2) = 80% Найти: V (SO2) Решение: 1. S + O2 = SO2 2. Вычисляем по уравнению реакции объём SO2 - это объём теоретический Из 1 моль S получаем 1 моль SO2 - по уравнению реакции, значит, при окислении 32 г S получаем 22,4 л SO2, а при окислении 1,6 г S получаем х л SO2 х = 1,6*22,4/32 = 1,12 (л) 3. Найдём практический объём по формуле W = VT / VП , VП = VT * W VП (SO2) = 1,12 * 0,8 = 0,896 (л) Ответ: V(SO2)= 0,896 л Итого вся работа: 5 «отлично» - 13- 11 баллов; 4 «хорошо» - 10 -8 баллов; 3 «удовлетворительно» 7-5 баллов; 2 «неудовлетворительно» - менее 5 баллов. Ответы на мониторинговую работу в 9 классе (2 четверть) 2 вариант Часть А оценивается в 1 балл каждый правильно выполненный ответ ( всего 4 балла) 1 2 3 4 5 А А Б А В Часть С С1. Содержание верного ответа и указание оценивания (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Li ---- Li 2O ---- Li OH ----- Li 3PO 4 Балл 1) 4Li + O2 = 2 Li 2O a. Li0 - 1 e → Li+1 /4 – (восстановить – окисляется) b. 2O0 +4 e→ O-2/1 – (окислитель – восстанавливается) 2) Li 2O + Н2О= 2LiOH 3) 3 LiOH + Н3PO4= Li 3PO4+ 3 Н2О 3 Li+ + 3 OH- +3H+ + PO4 3- = Li 3PO 4 + 3 Н2О Ответ включает все названные выше элементы, не содержит химических ошибок 5 Ответ включает 3 уравнения реакций, но выполнено одно из предложенных заданий. Ответ не содержит химических ошибок 4 Каждое уравнение без химических ошибок оценивается в 1 балл Всего 3 Каждое правильно выполненное из предложенных заданий оценивается в 1 б. Всего 2 Ответ неправильный 0 Максимальный балл 5 С2. Оценивается в 3 балла ( каждый из шагов в 1 балл) Дано: m (Na)= 11,5 г W (Н 2) = 95% Найти: V (Н 2)- ? Решение: 1. 2Na + 2Н2О = 2Na ОН + Н 2 2. Вычисляем по уравнению реакции объём Н 2 - это объём теоретический Из 2 моль Na получаем 1 моль Н 2 - по уравнению реакции, значит, при гидрировании 46 г Na получаем 22,4 л Н 2 а при гидрировании 11,5 г Na получаем х л Н 2 х = 11,5*22,4/46 = 5,6 (л) 3. Найдём практический объём по формуле W = VT / VП , VП = VT * W VП (Н 2) = 5,6 * 0,95 = 5,32 (л) Ответ: V(Н 2)= 5,32 л Итого вся работа: 5 «отлично» - 13- 11 баллов; 4 «хорошо» - 10 -8 баллов; 3 «удовлетворительно» 7-5 баллов; 2 «неудовлетворительно» - менее 5 баллов.