25 октября (120 минут) Химия – 9 - 2011 1.
реклама
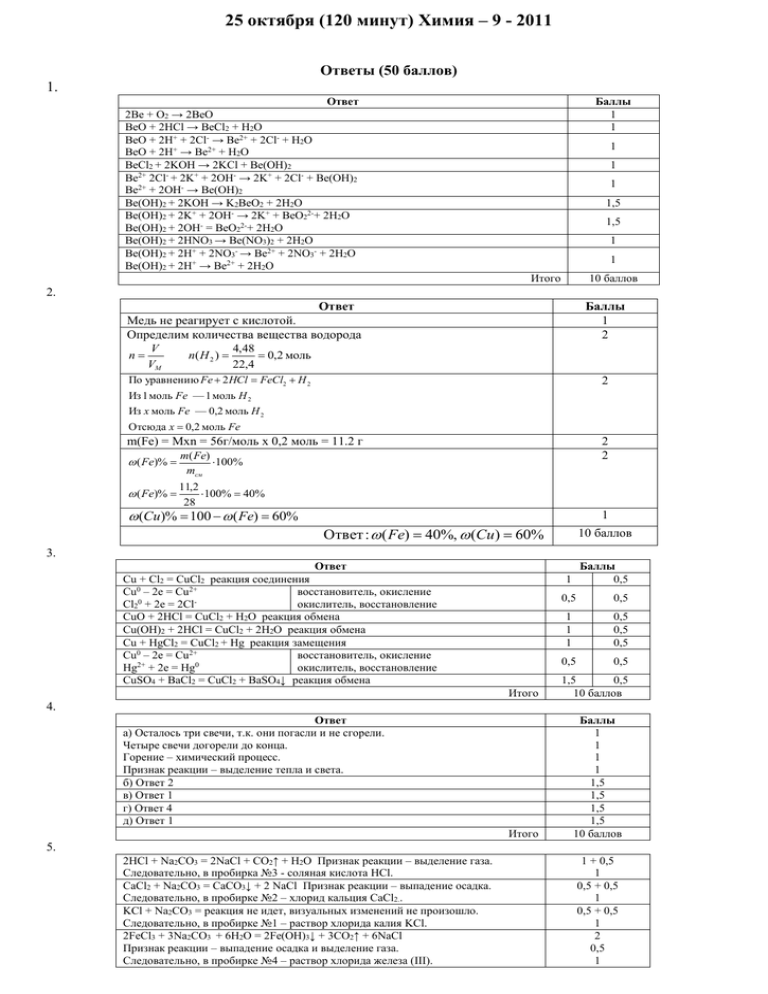
25 октября (120 минут) Химия – 9 - 2011 Ответы (50 баллов) 1. Ответ 2Ве + О2 → 2ВеО ВеО + 2HCl → BeCl2 + H2O ВеО + 2H+ + 2Cl- → Be2+ + 2Cl- + H2O ВеО + 2H+ → Be2+ + H2O BeCl2 + 2KOH → 2KCl + Be(OH)2 Be2+ 2Cl- + 2K+ + 2OH- → 2K+ + 2Cl- + Be(OH)2 Be2+ + 2OH- → Be(OH)2 Be(OH)2 + 2KOH → K2BeO2 + 2H2O Be(OH)2 + 2K+ + 2OH- → 2K+ + BeO22-+ 2H2O Be(OH)2 + 2OH- = BeO22-+ 2H2O Be(OH)2 + 2HNO3 → Be(NO3)2 + 2H2O Be(OH)2 + 2H+ + 2NO3- → Be2+ + 2NO3- + 2H2O Be(OH)2 + 2H+ → Be2+ + 2H2O Баллы 1 1 1 1 1 1,5 1,5 1 1 Итого 10 баллов 2. Ответ Медь не реагирует с кислотой. Определим количества вещества водорода V 4,48 n n( H 2 ) 0,2 моль VM 22,4 Баллы 1 2 По уравнению Fe 2 HCl FeCl2 H 2 2 Из 1 моль Fe — 1 моль H 2 Из x моль Fe — 0,2 моль H 2 Отсюда x 0,2 моль Fe m(Fe) = Mxn = 56г/моль х 0,2 моль = 11.2 г 2 2 m( Fe) ( Fe)% 100% mсм ( Fe)% 11,2 100% 40% 28 (Cu)% 100 ( Fe) 60% 1 Ответ : ( Fe) 40%, (Cu) 60% 10 баллов 3. Ответ Cu + Cl2 = CuCl2 реакция соединения Cu0 – 2e = Cu2+ восстановитель, окисление Cl20 + 2e = 2Clокислитель, восстановление CuO + 2HCl = CuCl2 + H2O реакция обмена Cu(OH)2 + 2HCl = CuCl2 + 2H2O реакция обмена Cu + HgCl2 = CuCl2 + Hg реакция замещения Cu0 – 2e = Cu2+ восстановитель, окисление Hg2+ + 2e = Hg0 окислитель, восстановление CuSO4 + BaCl2 = CuCl2 + BaSO4↓ реакция обмена Баллы 0,5 1 0,5 0,5 1 1 1 0,5 0,5 0,5 0,5 0,5 Итого 1,5 0,5 10 баллов Итого Баллы 1 1 1 1 1,5 1,5 1,5 1,5 10 баллов 4. Ответ а) Осталось три свечи, т.к. они погасли и не сгорели. Четыре свечи догорели до конца. Горение – химический процесс. Признак реакции – выделение тепла и света. б) Ответ 2 в) Ответ 1 г) Ответ 4 д) Ответ 1 5. 2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O Признак реакции – выделение газа. Следовательно, в пробирка №3 - соляная кислота HCl. CaCl2 + Na2CO3 = CaCO3↓ + 2 NaCl Признак реакции – выпадение осадка. Следовательно, в пробирке №2 – хлорид кальция CaCl2.. KCl + Na2CO3 = реакция не идет, визуальных изменений не произошло. Следовательно, в пробирке №1 – раствор хлорида калия KCl. 2FeCl3 + 3Na2CO3 + 6H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl Признак реакции – выпадение осадка и выделение газа. Следовательно, в пробирке №4 – раствор хлорида железа (III). 1 + 0,5 1 0,5 + 0,5 1 0,5 + 0,5 1 2 0,5 1 Итого 10 баллов



