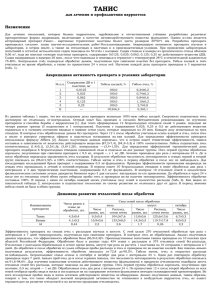
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное учреждение высшего
реклама

МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное учреждение высшего профессионального образования «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» ТЫНЬО ЯРОСЛАВ ЯРОСЛАВОВИЧ ВЛИЯНИЕ САНИТАРНО-ГИГИЕНИЧЕСКОГО РЕЖИМА ТЕПЛИЦ НА СОСТОЯНИЕ ПЧЕЛИНЫХ СЕМЕЙ И СПОСОБЫ СТАБИЛИЗАЦИИ ИХ РЕЗИСТЕНТНОСТИ В ЭКСТРЕМАЛЬНЫХ УСЛОВИЯХ Специальность 06.02.05 — Ветеринарная санитария, экология, зоогигиена и ветеринарно-санитарная экспертиза Диссертация на соискание ученой степени кандидата биологических наук Научный руководитель: член-корреспондент РАСХН, доктор сельскохозяйственных наук, профессор Кочиш И.И. Москва 2010 2 СОДЕРЖАНИЕ ВВЕДЕНИЕ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 1. ОБЗОР ЛИТЕРАТУРЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 1.1. Микроклимат теплиц при технологическом регламенте выращивания культуры огурца . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 1.1.1. Технологические системы формирования микроклимата в теплицах . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 1.1.2. Световой, температурный, влажностный регламенты выращивания культуры огурца в теплицах . . . . . . . . . . . . . . . . 15 1.1.3. Степень микробной обсемененности теплиц . . . . . . . . 17 1.1.4. Токсикологическая характеристика средств защиты растений для пчел . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 1.2. Влияние абиотических факторов на резистентность пчелиных семей . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 1.2.1. Температурный режим . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 1.2.2. Влажностный режим . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27 1.2.3. Газовый режим . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 1.3. Изменение резистентности пчелиных семей при их содержании в теплицах . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30 1.3.1. Влияние микроклимата теплиц на пчелиные семьи . . . 31 1.3.2. Условия кормления пчелиных семей в теплицах . . . . . . 32 1.3.3. Характеристика отдельных показателей физиологического состояния пчелиных семей в теплицах . . . . . . . . . . . . . . . 33 1.3.4. Влияние профилактических и лечебных обработок против вредителей и болезней культуры огурца на пчелиные семьи . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ . . . . . . . . . . . . . . . . . . . . . . . . 48 2.1. Материалы и методы исследований . . . . . . . . . . . . . . . . . . . . . . 48 2.2. Результаты экспериментальных исследований . . . . . . . . . . . . 54 3 2.2.1. Изучение особенностей микроклимата теплиц в течение зимне-весеннего культурооборота огурцов . . . . . . . . . . . . . . . 54 2.2.1.1. Динамика температурных, влажностных, газовых режимов в теплицах в период зимне-весеннего культурооборота . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56 2.2.1.2. Динамика микрофлоры в модулях теплицы в течение зимне-весеннего культурооборота . . . . . . . . . . . . 60 2.2.2. Степень воздействия патогенов культуры огурца на резистентность пчелиных семей . . . . . . . . . . . . . . . . . . . . . . . . . . 64 2.2.3. Разработка условий применения Монклавита-1 в качестве дезинфектанта против патогенной грибковой микрофлоры пчел . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71 2.2.3.1. Лабораторные опыты по изысканию дезинфицирующих свойств препарата Монклавит-1 . . . . . . . . . . 73 2.2.3.2. Продолжительность жизни пчел в садках после их обеззараживания препаратом Монклавит-1 . . . . . . . 76 2.2.3.3. Производственные испытания Монклавит-1 в качестве дезинфектанта при микозной инфекции пчел . . 79 2.2.4. Возможность применения препарата ТАНГ для стабилизации жизнедеятельности пчелиных семей в условиях защи- 83 щенного грунта . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.2.4.1. Разработка условий применения ТАНГА в условиях защищенного грунта . . . . . . . . . . . . . . . . . . . . . . . . 84 2.2.4.2. Производственные испытания препарата ТАНГ в качестве корректора жизнедеятельности пчелиных семей, опыляющих культуру огурца в условиях защищенного грунта . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87 2.2.4.2.1. Экономическая эффективность от применения препарата ТАНГ . . . . . . . . . . . . . . . . . …………………….. 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ . . . . . . . . . . . 91 94 4 4. ВЫВОДЫ И ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ . . . . . . . . . . . . . . . 105 БИБЛИОГРАФИЧЕСКИЙ СПИСОК . . . . . . . . . . . . . . . . . . . . . . . . . . 107 ПРИЛОЖЕНИЕ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 128 5 ВВЕДЕНИЕ Актуальность темы. Современные российские тепличные хозяйства представляют собой средние и крупные предприятия со сложной агропромышленной структурой. В условиях рыночных взаимоотношений приоритеты производственных программ диктуются спросом. Огурцы занимают большие площади в культурооборотах. В дореформенный период доля в первом обороте составляла 84-92 %, а во втором 16-25 %, сейчас 67-70 и 72-75 % соответственно [123, 137, 159, 168, 184]. При сбыте продукции немаловажным является поиск путей поднятия конкурентоспособности продукции защищенного грунта. Самым эффективным агрономическим приемом, повышающим урожай культуры огурца, является насыщенное опыление медоносными пчелами. Кроме того, именно перекрестное опыление растений пчелами дает хорошие вкусовые качества продукции, товарный вид, что поднимает конкурентоспособность продукции защищенного грунта на рынке спроса [46, 59, 122, 134, 167, 177 и др.]. В условиях рынка необходимым условием выживания отечественных агропромышленных компаний перед иностранными является повышение урожайности тепличных овощей с одновременным снижением их себестоимости. Достижения данных целей складываются из различных факторов, одним из которых является повышение эффективности эксплуатации пчелиных семей путем оптимизации санитарно-гигиенического режима их содержания. На основании вышеизложенного изучение влияния санитарно- гигиенического режима блочных теплиц на жизнедеятельность пчелиных семей и пути повышения их устойчивости к экстремальным условиям является актуальной задачей. Цель работы. Изучение влияния санитарно-гигиенического режима блочных теплиц в течение зимне-весеннего культурооборота огурца на жизнедеятельность пчелиных семей и выявление путей повышения их жизнестойкости в экстремальных условиях. 6 Задачи исследований: исследовать динамику температурных, влажностных, газовых режимов в теплицах в период зимне-весеннего культурооборота огурцов; изучить динамику микрофлоры в модулях теплицы и ульях пчелиных семей в течение зимне-весеннего культурооборота; выяснить характер изменений, возникающих в пчелиных семьях под влиянием изменений микроклимата теплиц в течение зимне-весеннего культурооборота; разработать режимы дезинфекции препаратом Монклавит-1 ульев, сотовых рамок, пчеловодного инвентаря при аскосферозе пчел; определить степень воздействия пчеловодного инвентаря на продолжительность жизни пчел, расплод, яйценоскость маток после их дезинфекции Монклавитом-1; выявить возможность применения препарата ТАНГ для стабилизации жизнедеятельности пчелиных семей в течение зимне-весеннего культурооборота. Научная новизна. Впервые изучена динамика микроклимата современных блочных теплиц, каждый модуль которых рассчитан на 1 га полезной площади, в течение зимне-весеннего культурооборота огурцов и его влияние на пчелиные семьи, опыляющие данную культуру. Установлено, что на компьютерные автоматические системы поддержания микроклимата в модулях теплиц может оказывать воздействие внешняя окружающая среда: сильные морозы, интенсивность солнечной активности, резкий перепад температур. Это приводит к сбою управляемости микроклиматом теплиц, в результате чего происходит сбой микроклимата в регламенте выращивания огурцов. Последнее создает экстремальные условия и для содержания пчелиных семей в теплице, которые приводят к снижению продолжительности жизни пчел и воспроизводительной функции маток, уменьшению численности семей. Впервые установлено, что патогены растений свободно попадают в ульи пчелиных семей и при наличии их в большом количестве в модуле теплицы мо- 7 гут нанести микробный стресс пчелиным семьям. Он проявляется в активизации патогенов пчел аналогичной природы, если те имеются в их гнезде. Показано, что микробный стресс является запуском к началу инфекционных болезней в пчелиных семьях. Выявлена величина экономического порога опасности: 34 % удельного веса патогена растений в комплексе микроорганизмов, находящихся в воздухе улья, от общего числа колониальных единиц равных 100. Изучена возможность применения препарата Монклавит-1 в качестве дезинфектанта против патогенной микозной микрофлоры пчел. Разработаны режимы дезинфекции Монклавитом-1 пчеловодного инвентаря, обеспечивающие 100 %-ную эффективность применения. Показана целесообразность применения пробиотика Танг в качестве корректора жизнедеятельности пчелиных семей, опыляющих огурцы в условиях защищенного грунта. Практическая ценность. Установлена высокая дезинфицирующая активность препарата Монклавит-1 против микозной микрофлоры пчел. Это позволило рекомендовать разработанную методику применения для практического пчеловодства. Выявлены условия стабильности и причины дестабилизации микроклимата теплиц в процессе зимне-весеннего культурооборота. Эти знания легли в основу определения сроков и кратности применения пробиотика ТАНГ в опережающем режиме для стабилизации физиологического состояния пчелиных семей и их работоспособности на опылении растений в течение зимне-весеннего культурооборота. Разработанная схема применения пробиотика ТАНГ в промышленных условиях теплиц способствует качественному опылению культуры огурца и повышает сохранность пчелиных семей на 27,8 % в сравнении с контролем. Результаты исследований по применению препаратов Монклавит-1 и ТАНГ вошли в проект «Рекомендации по комплексной системе санитарногигиенических, ветеринарных и зоотехнических мероприятий для обслужи- 8 вания пасек тепличных хозяйств, специализирующихся на опылении растений в защищенном грунте». Апробация работы. Материалы диссертационной работы доложены и обсуждены на: - Третьей Всероссийской конференции «Высокие технологии и апикультура» 10-14 декабря 2008 г., г.Ижевск; - Международной научно-практической конференции «Современное пчеловодство. Проблемы, опыт, новые технологии» 12-13 августа 2010 г., г.Ярославль. Публикации. По материалам диссертации опубликовано 5 научных статей, в т.ч. 4 в журналах, рекомендованных ВАК РФ. Основные положения, выносимые на защиту. Проведенные исследования и полученные результаты позволяют вынести на защиту следующие основные положения диссертационной работы: динамика температурных, влажностных, газовых режимов в теплицах в период зимне-весеннего культурооборота огурцов; динамика микрофлоры в модулях теплицы и ульях пчелиных семей в течение зимне-весеннего культурооборота; характер изменений, возникающих в пчелиных семьях под влиянием изменений микроклимата теплиц в течение зимне-весеннего культурооборота; дезинфицирующие свойства Монклавита-1 при аскосферозе пчел, согласно разработанной схеме применения; эффективность применения препарата ТАНГ для повышения резистентности пчелиных семей в условиях защищенного грунта. 9 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Микроклимат теплиц при технологическом регламенте выращивания культуры огурца Основным источником жизнедеятельности и экологии пчелиных семей является внешняя среда. Она может включать определенные приемы и способы кормления, содержания, микроклимата, искусственно созданного человеком. Микроклимат в теплицах определяется основными параметрами технологического регламента выращивания той или иной сельскохозяйственной культуры, а пчелам, осуществляющим опыление этих культур, приходится приспосабливаться к особенностям микроклимата. 1.1.1. Технологические системы формирования микроклимата в теплицах Современное тепличное хозяйство – сложный агропромышленный комплекс, включающий в себя теплицы для выращивания растений в условиях защищенного грунта, сервисный блок инженерно-технологического оборудования, блок бытовых и административных помещений, котельную, технологический коридор для связи отдельных помещений. Отдельная теплица состоит из одного или нескольких тепличных модулей. Модуль чаще всего рассчитан на 1-2 га полезной площади с высотой шпалер 2,1-2,8 м и комплектуется в полном объеме или частично всеми основными видами технологических систем жизнеобеспечения растений и поддержания микроклимата. Влияние внешней окружающей среды, гибкость использования теплиц и управляемость микроклиматом требуют уменьшения размеров отдельных тепличных модулей и увеличения количества используемых технологических систем. Вместе с этим увеличивается их стоимость. Поэтому, при проектировании тепличных комплексов специально решается задача по определению 10 оптимальных размеров тепличных модулей и включению в них необходимых технологических систем [127]. Сами теплицы классифицируются по множеству признаков: по назначению: овощные, цветочные, рассадные, зеленные, цитрусовые, грибные и т.д.; по продолжительности эксплуатации: круглогодичные, весенние или сезонные (весна, лето, осень); по технологии выращивания растений: грунтовые, малообъемные, гидропонные, стеллажные; по конструктивным характеристикам и признакам. Технологические системы. Теплицы комплектуются средствами автоматического контроля и управления, которые позволяют обеспечивать необходимые условия микроклимата в пределах агротехнических требований для выращивания различных сельскохозяйственных культур. Блок бытовых и вспомогательных помещений содержит системы тепловой подготовки и подачи воды на полив, узлы смешения и приготовления растворов минеральных удобрений для подпитки растений, подсистемы регулирования температуры и стабилизации давления теплоносителя для систем водяного обогрева теплиц. Технологический коридор имеет свою подсистему подлоткового обогрева для обеспечения снеготаяния, подсистемы верхнего или бокового воздушного обогрева и форточной вентиляции для стабилизации температурного режима. Кроме того, любое тепличное хозяйство для подготовки рассады к высадке в закрытом или открытом грунте имеет рассадное отделение, занимающее около 10% общей площади теплиц. Системы обогрева. Для поддержания требуемого температурного режима в теплицах в холодное время года применяют различные системы обогрева: водяные, паровые, калориферные, электрические, газовые, биоэнергетические, гелиоэнергетические и другие. Основное распространение получили системы водяного обогрева с получением тепла от центральных районных 11 теплоэнергетических станций или собственных котельных и отдельных специализированных тепловых узлов. В современных теплицах применяются системы с раздельным многоконтурным обогревом. Поскольку в больших теплицах невозможно обеспечить одинаковую температуру на всей площади, выполняется дополнительное разделение на отдельные контуры обогрева для отдельных секций теплицы. Системы вентиляции. Наибольшее распространение получили системы естественной вентиляции, представляющие собой форточки (фрамуги), расположенные в кровле или боковом ограждении теплиц и имеющие специальные исполнительные механизмы, снабженные электрическим приводом, для установки фрамуг в любое необходимое положение от полностью закрытого до полностью открытого (максимальный угол открытия определяется конструкцией теплицы). Количество и размеры форточек зависят от географического положения теплицы и составляют от 15-20% на севере до 50% поверхности кровли в южных климатических зонах. Управление температурой и влажностью в теплице с помощью форточной вентиляции должно сопровождаться постоянным контролем наружной температуры, скорости и направления ветра. Кроме систем форточной вентиляции в теплицах применяют системы рециркуляционной вентиляции, обеспечивающие с помощью электрических вентиляторов принудительную циркуляцию воздуха в теплице и способствующие при этом выравниванию температурного поля теплицы и лучшему воздухообмену растений. Система испарительного охлаждения и доувлажнения. Если в теплое время года добиться снижения температуры воздуха и растений в теплице не удается с помощью форточной вентиляции, то целесообразно использовать систему испарительного охлаждения, которая позволяет, практически не влияя на интенсивность светового потока, снижать температуру на несколько градусов. 12 Одновременно с охлаждением воздуха происходит его увлажнение, поэтому систему называют также системой испарительного охлаждения и доувлажнения (СИОД). Степень охлаждения и увлажнения зависит от размеров капель воды, создаваемых жиклерами, от размеров растений и от режима работы системы. Для исключения оседания водяной аэрозоли на поверхность растений и для достижения необходимой степени охлаждения и увлажнения воздуха и растений применяют циклическое повторение включения системы. При мелкодисперсном распылении воды температура воздуха может быть снижена на 4-6 °С, а температура растений - на 6-14 °С. Относительная влажность воздуха может быть увеличена на 20-25%. Система зашторивания. В теплицах применяют экраны типа жалюзи и штор. Наибольшее распространение получили шторные экраны, изготовленные из специальной ткани, задерживающей электромагнитное излучение преимущественно в инфракрасной области и пропускающей воздух. Сворачивание и разворачивание экранов осуществляется с помощью системы с электроприводом. В зависимости от использованного материала экран пропускает от 50 до 80 % солнечной радиации и благодаря этому позволяет снижать перегрев теплицы. Поэтому экран разворачивают в яркие солнечные дни, когда избыток солнечной энергии приносит больше вреда, чем пользы растениям. Система досвечивания. Системы искусственного досвечивания растений представляют собой сеть ламп электрического освещения, снабженных рефлекторами направленного светоотражения для равномерного освещения растений в теплице и устройствами запуска (электрического поджига) ламп. Выбор светотехнического оборудования зависит от типа теплицы, выращиваемой культуры, нормируемой интенсивности облучения, световой зоны, искусственной составляющей нормируемой облученности, удельной мощности при заданном коэффициенте полезного действия источника света в области ФАР, типа системы облучения и источника света. При размещении 13 светильников в теплице учитывается требование равномерного освещения растений, а также их взаимное влияние на другие технологические системы. Подпитка растений углекислым газом. Для повышения концентрации углекислого газа (СО2) в воздухе теплицы применяют установки трех типов: газовые генераторы, вырабатывающие углекислый газ на основе сжигания природного газа; системы распределения углекислого газа из баллонов (цистерн); системы подачи в теплицу углекислого газа, выделенного из продуктов сгорания природного газа в котельных, работающих для обогрева теплиц. Углекислый газ в холодном состоянии тяжелее воздуха и хорошо обеспечивает подкормку растений в любое время года. Если же углекислый газ имеет повышенную температуру, что бывает при его получении от простого сжигания природного газа прямо в теплице, то он легче воздуха и в теплое время года, когда фрамуги открыты, достичь желаемой концентрации СО2 в воздухе теплицы практически невозможно. Эффективность таких установок значительно снижается. Кроме того, работа газогенераторов сопровождается выделением значительного количества тепловой энергии. Наиболее просто, с минимальными побочными эффектами углекислый газ может подаваться в теплицы путем перевода в газообразное состояние сжиженного СО2. Однако такой способ подкормки растений углекислым газом считается наиболее дорогим. Работа системы подачи СО2 должна быть согласована с работой систем дождевания и СИО, так как при их одновременном включении углекислый газ будет сразу же выпадать на растения в виде кислоты. Таким образом, система подпитки воздуха углекислым газом может работать только в результате непрерывного контроля микроклимата в теплице, состояния технологических систем и анализа потребностей растений. Это достигается с помощью специализированных систем автоматического управления. 14 Системы полива. Системы полива представляют собой распределенную по всей теплице водопроводную сеть, выполненную из пластмассовых труб, с разбрызгивателями или капельницами, через которую осуществляется подача подогретой до 20-25 °С воды к растениям с помощью насосов. Водопроводная сеть дождевания располагается над растениями, сеть капельного полива - прямо на почве. Разбрызгиватели и капельницы изготовлены таким образом, чтобы обеспечить равномерное распределение воды по всей теплице при изменении давления в системе в широком диапазоне. Подача воды к растениям осуществляется циклически в соответствии с графиком полива для ее равномерного распределения в течение светового дня. Важной особенностью систем полива является возможность осуществления одновременно с подачей воды подпитки растений солями минеральных удобрений. Такая подпитка всегда сопровождает капельный полив при малообъемной технологии выращивания растений. В этом случае полив осуществляется раствором минеральных удобрений, приготовленным с помощью специального растворного узла. Представленная информация указывает на то, что температура, влажность, физические, химические свойства воздуха, содержание в нем микроорганизмов зависят от технологического регламента выращивания сельскохозяйственной культуры, метеорологических условий, смены времени суток, работы вентиляционно-отопительной, агрохимической и других технологических систем. Поэтому микроклимат теплицы, где непосредственно проводятся исследования, необходимо изучать, с тем чтобы узнать уровень его опасности или безопасности для пчелиных семей и в соответствии с этим разработать приемы, которые бы ограничили отрицательное воздействие микроклимата теплиц на пчелиные семьи и тем самым обеспечили полноценное опыление растений и сохранность пчелиных семей. 15 1.1.2. Световой, температурный, влажностный регламенты выращивания культуры огурца в теплицах Во всех тепличных хозяйствах, специализирующихся на выращивании овощей, под культуру огурца выделяется до 80-90 % площадей теплиц [73, 78, 134]. Предпочтение отдается различным пчелоопыляемым гибридам. Они отличаются габитусом, формой, опушением плодов и выраженностью пола, которая определяется, в основном, на главном стебле, а у гибрида опылителя ведется учет количества мужских узлов и на побегах следующего порядка ветвления. В мужском узле формируется до 12-14 мужских цветков, которые раскрываются поочередно. Таким образом, период цветения одного мужского узла растянут по времени на 20-30 дней. В сочетании с хорошим отрастанием боковых побегов это обеспечивает достаточным количеством мужских цветков на длительное время [10, 150, 155, 168]. Одним из многих условий, влияющих на рост и развитие культуры, является свет. Растение реагирует как на интенсивность света, так и длину светового дня. Интенсивность света в зимне-весеннем культурообороте меняется значительно: от минимального в январе до значительной солнечной радиации к июню. Свет высокой интенсивности ускоряет рост, ветвление, развитие, цветение огурца. Кроме того, интенсивность света значительно влияет на пол растений. Низкая освещенность увеличивает количество мужских, а высокая – количество женских цветков. Так, у гибрида F1 Атлет, в зависимости от освещенности, количество мужских узлов на главном стебле, закладывающихся до шпалеры на высоте 2,2 м, может колебаться от 4-5 до 8-9. Это оказывает значительное влияние как на работу пчел в теплицах, так и на получение раннего урожая [10, 87, 128]. Длина дня также сильно меняется при выращивании в зимне-весеннем культурообороте. Так, в Москве длина дня в начале января составляет 7 ч 20 мин. К середине апреля она составляет 14 ч, в конце июня – 17 ч 20 мин. Таким образом, растение огурца, рекомендуемое к выращиванию в зимне- 16 весеннем обороте, должно нейтрально относиться к фотопериоду, быть одновременно и теневыносливым и светолюбивым, а также переносить жару в июне-июле [49, 150]. Многочисленные исследования показывают, что оптимальной температурой в зоне корневой системы для роста и развития огуречного растения является 19-20 0С. Более высокая температура, получаемая при включении подсубстратного обогрева или при разложении органики, вносимой в грунты, не имеет преимуществ. Более того, повышение температуры почвы до 25-28 0С может стимулировать развитие фузариозных гнилей [3, 17, 49]. Температура воздуха при выращивании огурца меняется в более значительных пределах. С помощью ночной температуры регулируют вегетативный и генеративный рост огуречных растений. Так, выдерживание температуры ночью в теплицах в пределах 16-17 0С в январе-феврале способствует образованию большого количества женских завязей на главном стебле, тем самым усиливается проявление женского пола. При этом завязи получаются сильными, более жизнеспособными. Эта температура также активизирует рост боковых побегов и корневой системы. Ночная температура в пределах 20-22 0С значительно увеличивает проявление мужского пола. Причем увеличивается количество мужских узлов на главном стебле, интенсивно наливаются ранее завязавшиеся плоды, а закладывающиеся новые женские завязи получаются более тонкими и слабыми, чаще могут опадать, при этом в узле закладываются, как правило, не две женские завязи, а лишь одна. При повышенных ночных температурах новые боковые побеги почти не образуются, а в марте высокая ночная температура может стимулировать образование коротких (детерминантный тип) боковых побегов с 4-5 женскими завязями, но без листа или с очень мелким листом. Таким образом, высокая ночная температура усиливает отдачу раннего урожая, но ускоряет старение растений. В таких условиях из-за интенсивного налива женских завязей и высокой интенсивности дыхания растения быстрее расходуются накопленные ассимилянты, корневая система при этом сильно страдает [134, 150, 153]. 17 Для предупреждения процесса старения растений, после первых 3-4 недель плодоношения и сбора плодов с главного стебля до шпалеры, ночную температуру воздуха понижают до 16-17 0С, в течение 8-12 дней. Этот прием позволяет восстановить ослабленную корневую систему растений, стимулирует рост боковых побегов [87, 153, 155]. Для получения высокого раннего урожая в феврале-марте, а в пасмурную погоду и в апреле, чередуют периоды поддержания ночной температуры воздуха. Для усиления образования завязей ночную температуру воздуха поддерживают на уровне 16-17 0С в течение 10-12 дней. В последующие 1012 дней, с целью усиления налива сформировавшихся завязей, ночную температуру повышают до 20-21 0С, а затем на 10-12 дней вновь снижают до 1617 0С. Комбинированный температурный режим согласовывают с освещенностью конкретного года и с физическим состоянием растений. Он должен также сочетаться с опылительной деятельностью пчел. Температурный режим днем держат на уровне 20-24 0С, а в пасмурные дни – 19-21 0С. Оптимальная температура поливной воды 20-22 0С, относительную влажность воздуха в теплице поддерживают на уровне 75-80 % [65, 87, 88]. Подача СО2 для подкормки растений огурцов в теплицах проводится через 2 недели после посадки и заканчивается за неделю до ликвидации культуры. В зимне-весенний период до открытия фрамуг в светлое время суток в воздухе теплицы постоянно поддерживают уровень СО2 до 700-800 ppm. В весенне-летний период, когда фрамуги открыты, СО2 подается в теплицы в утренние часы, обеспечивая уровень его содержания в воздухе не менее 400 ppm [65, 185, 186]. 1.1.3. Степень микробной обсемененности теплиц Источниками микробного заражения растении, а затем и воздуха в теплицах служат почва, субстраты, семена растений, больные растения и поверхности технологического оборудования. 18 Из почвы и субстратов выделяют микроорганизмы родов Trichoderma, Pseudomonas, Fusarium, Rhizoctonia, Penicillium, Aspergilla, НСГ, Agrobacterium и др. Из них грибы Penicillium и Aspergilla не патогенны для культуры огурца, но являются токсинообразователями и могут способствовать активизации семенной инфекции [4, 11]. Инфекция, которая передается семенами, находится под кожицей семени, например, в виде мицелия у аскохитоза [153, 176, 187, 188]. Наиболее опасными для растения являются микроорганизмы родов Pseudomonas и Fusarium. Так, наличие в грунте фитопатогенного гриба Fusarium в количестве 15 % микрочастиц на 1 г почвы считается высоким. Поражение корневой системы растений проявляется спустя неделю после высадки рассады [4]. Тепличный огурец поражается комплексом вредных патогенов, вызывающих различные болезни: корневые гнили (фузариоз, питиоз, бактериоз, бактериальный токсикоз); прикорневые гнили (питиоз, бактериоз, бактериальный токсикоз); узловой аскохитоз; плодовая гниль, мучнистая роса, зеленая крапчатая мозаика и др. На растениях паразитируют и вредные членистоногие – западный цветочный трипс Frankliniella occidentalis, белокрылка Trialeurodesvaporariorum, обыкновенный паутинный клещ Tetranychus urticae, тли (Macrosiphum euphorbiae, Aphis gossypit), нематоды. Перечисленные членистоногие являются переносчиками патогенов и способствуют быстрому перезаражению всей площади теплиц. Кроме того, интенсивное размножение членистоногих вызывает у растений глубокие изменения обмена веществ, приводящие к сильному угнетению в развитии. В результате питания вредителей содержимым растительных клеток листья приобретают вначале мраморный оттенок, а затем буреют и засыхают. Уровень экономического порога вредоносности считается, когда численность вредителей на растении достигает: 20-30 имаго и 40-60 личинок трипсов в среднем на 1 м2; около 50 имаго, до 200 личинок, 500 яиц, 400 пу- 19 париев белокрылки на одно растение; до 300 подвижных особей паутинного клеща на 1 растение; до 30 особей тли на 1 растение [4]. Значительный перепад температур в зимний период, повышение влажности свыше 80 %, недостаток тепла на фоне присутствия инфекции в семенах и торфе приводит к появлению корневой, прикорневой, плодовой гнилей, узловому аскохитозу, мучнистой росе. В двух вариантах из трех гнили возникают при колонизации корневой системы растений патогенными грибами рода Fusarium. В результате болезни происходит закупорка сосудов, гниль плодов и корней, депрессия растений [11, 163, 187]. Раннее отмирание корней культуры огурца приводит к накоплению патогенов в субстрате около растений, созданию источника инфекции, способного реализовываться при стрессовых воздействиях на растения [11]. Мучнистая роса вызывается двумя видами патогенных грибов: Erysiphe cichoracearum (конидиальная стадия – Oidium erysiphoides) и Sphaerotheca suliginea cucurbitae. В условиях средней полосы России наибольшее распространение имеет вид E.cichoracearum. Развитие его воздушного мицелия на листовых пластинках приводит к уменьшению фотосинтетической поверхности листьев, а также к физиологическим нарушениям в жизнедеятельности растений и, соответственно, к снижению урожая. Мобильность конидий патогена по воздуху обеспечивает быстрое перемещение внутри теплиц и, как правило, после появления первичных очагов их количество в разных точках теплицы в течение нескольких дней резко возрастает [28, 111, 113]. Сведений об уровне экономического порога вредоносности микроорганизмов в воздухе теплиц для растений в доступной нам литературе не обнаружено. Это связано, вероятно, с особенностями технологии выращивания огурца, в которой предусмотрено ежедневное дождевание и, следовательно, количество выявленных микроорганизмов в воздухе при данном приеме не будет отражать уровень действительного количественного воздействия патогенов на растения. В этом плане показатели микробной обсемененности суб- 20 стратов, почвы, растений, внутренних поверхностей теплиц дают наиболее объективную оценку. Отражается ли накопление патогенов растений в теплицах в процессе технологического цикла выращивания культуры огурца на степень устойчивости пчелиных семей к собственным патогенам или запуском к началу перечисленных болезней являются отравления пчел в результате химических обработок растений, является неизвестным. Работ в этом направлении не проводили. 1.1.4. Токсикологическая характеристика средств защиты растений для пчел При работе в теплицах пчелы подвержены опасному воздействию ядохимикатов. Эта причина, по данным большинства публикаций, является одной из основных, приводящих к сильному ослаблению пчелиных семей [46, 78, 86, 89, 90, 91, 98, 112, 183]. Чтобы предотвратить негативное влияние средств защиты растений на пчелиные семьи и избежать потерь урожая тепличных растений от недостаточного опыления, необходимо точно знать степень опасности каждого ядохомиката для пчел. Известно, что ядохомикаты проходят токсикологическую оценку в отношении медоносных пчел. Все ядохомикаты делятся на 4 класса опасности для пчел: 1-й класс – препараты, несовместимые с использованием насекомыхопылителей. Часть из них нельзя применять в теплицах, где планируется использование пчел и шмелей. Другие можно применять, но выдержав достаточно долгий срок от завершения обработки до установки ульев снова в теплицу. Применение препаратов, когда ульи находятся в теплице, строго запрещено. 2-й класс – препараты средней опасности для пчел и шмелей. Перед проведением обработки следует вечером после лета пчел закрыть леток и вынести улей из теплицы. После обработки ульи можно вернуть на прежние места 21 не ранее, чем спустя указанный срок ожидания. Нужно иметь в виду, что в пасмурные дни для разложения действующих веществ пестицидов требуется больше времени. 3-й класс – препараты, малоопасные для пчел и шмелей. Перед проведением обработки необходимо накануне вечером закрыть леток и накрыть улей пленкой для защиты от попадания на его поверхность рабочего раствора препарата. Через три часа после окончания обработки пленку можно снять и открыть леток. 4-й класс – препараты, практические не опасные для пчел и шмелей. В таблице 1 приведены сведения о классе опасности для пчел некоторых химических препаратов, разрешенных к применению в теплицах (фунгициды, инсектициды, акарициды) [183]. Таблица 1. Класс опасности пестицидов для пчел и рекомендуемый период ожидания после применения препарата в теплицах Препарат 1 ФУНГИЦИДЫ Акробат МЦ, СП Квадрис КС Байлетон Виркон С, СП Колфуго-суиер, КС Браво, КС Превикур, КС Производитель Фитопатогены Класс опасности Срок ожидания после обработки, ч, сут. 2 3 4 5 «БАСФ» Фитофтороз, альтернариоз, пероноспороз Мучнистая роса, фитофтороз, пероноспороз, аскохитоз Мучнистая роса, серая гниль и др. заболевания Дезинсфектант Мучнистая роса, серая гниль, фузариоз и др. заболевания 3 3ч 3 3ч 3 3ч 3 3 3ч 3ч Фитофтороз, пероноспороз, бурая пятнистость Пефоноспороз, корневая гниль 3 3ч 3 3ч «Сингента» «Байер» «КРКА» «Агро Кеми» «Сингента» «Байер» 22 1 Ридомил Голд, СП 2 «Сингента» 3 Фитофтороз, макроспориоз, перенос пороз, альтернариоз Ровраль, СП «Байер» Белая и серая гнили Строби, ВДГ «Басф» Мучнистая роса, пероноспороз Тиовит Джет, ВДГ «Сингента» Мучнистая роса Топаз, КЭ «Сингента» Мучнистая роса и др. заболевания Фалькон «Байер» Мучнистая роса и др. заболевания Формайод «Фармбиомед» Дезинфекант, бактериоцид, вируоцид Фундазол, СП «Агро Кеми» Фузариоз, мучнистая роса, антракноз и др. заболевания Эупарен мульти, ВДГ «Байер» Серая гниль и др. заболевания Кумулус, ДФ «БАСФ» Мучнистая роса, пятнистость ФУНГИЦИДЫ, не разрешенные к применению Оксихом ..... — — Каратан, бовистин Нимрод, каптан, браво, куправит, курзат, рубиган, каптан, топаз 100 ЕС, тирам, ронилан, сапроль, сера коллоидная, фитолавин, бактофит, псевдобактерин Би-58 Новый, КЭ Вертимек, КЭ Данадим, КЭ Децис, КЭ Каратэ Зеон, СК Конфидор Экстра, ВДГ Конфидор, ВРК Моспилан, РП Матч, КЭ Талстар, КЭ Фитоверм, 0,2% КЭ 5 3ч 3 3 3ч 3ч 3 23 3ч 1,5 сут. 3ч 2 1,5 сут. 3 3 ч 3 3ч 2 1,5 сут 1 2 3 14 сут 1,5 сут 3ч Белокрылка, тля, трипсы и Белокрылка др. Белокрылка, тля, трипсы, минирующая муха, комарики др. 3 3 1 3ч 3ч 14 сут Белокрылка, тля, трипсы и др. Мухи, тля, трипсы Паутинный клещ, трипсы Комплекс вредителей Комплекс вредителей Комплекс вредителей 2 1,5 сут 2 2 1 2 1 Белокрылка, тля, трипсы и др. «Ниппон Сода» Тепличная белокрылка «Сингента» Колорадский жук, плодожорки «ФМС» Западный цветочный трипс «Фармбиомед» Паутинный клещ, тля, трипсы 1 3 4 1,5 сут 1,5 сут 14 сут 1,5 сут Полностью не совместимо Полностью не совместимо 3ч 3ч 1 7 сут 3 3ч ИНСЕКТИЦИДЫ И АКАРИЦИДЫ Актара, ВДГ «Сингента» Адмирал КЭ «Кромптон» Актеллик, КЭ «Сингента» Арриво, КЭ 4 3 «ФМС» «Басф» «Сингента» «Кеминова» «Авентис» «Сингента» «Байер» 23 1 Фитоверм М, 0,2% 4 3 5 3ч Белокрылка, тля, трипсы, клещи и др. ИНСЕКТИЦИДЫ И АКАРИЦИДЫ, не разрешенные к применению Торпедо, фастак, нек1 Полностью сион, дурсбан, рогор, не совместимые каскад, карате, хостатион 1 14 сут Диазинон, маршал, месорол Все препараты метамидофоса Малатин, цимбуш, тиодан, тионекс Хостаквик, афутан Аполло, пегас, каратан Неорон, апплауд, фури, тригард, кельтан, фенилан,бикол, битобациллин, боверин, вертициллин, спинКонтекст, цезарь, тор пиримор, апекс, омайт, тедион, микотал . Фуфанон, КЭ 2 3 «Фармбиомед» Табачный, западный цветочный трипсы, паутинный клещ «Кеминова» 1 30 сут. 1 21 сут. 1 14 сут. 2 2 1,5 сут. 0,5 сут. 3 3 ч. 4 3ч Независимо от токсичности применяемого препарата, после проведения химической обработки необходимо удалить из теплицы упаковку, опрыскиватели и другой инвентарь, а также материалы, использовавшиеся при обработке. Если планируется применение препаратов 2-го класса опасности, то заблаговременно пчелиные семьи готовят к перевозке: утеплительный материал убирают, проверяют, у всех ли сотов имеются разделители, если нет, то вставляют колышки, последнюю рамку фиксируют гвоздями, забивая их в плечики рамок, затем на корпус гнезда ставят магазинную надставку. Вынесенные из теплицы ульи ставят в отдельное, хорошо проветриваемое помещение при температуре воздуха 10-15 0С. В этот период следует один раз в день давать пчелиным семьям по 0,5 л воды в боковые кормушки [46, 90]. 24 При возвращении пчелиных семей в теплицу их надо расставить на те же места, которые они занимали перед выносом из теплицы. Открыть следует сначала 1-2 семьи. Если через 1,5-2 ч случаев отравления нет, то у всех пчелиных семей открыть летки, если отмечается гибель пчел – вынести пчелиные семьи из теплицы. 1.2. Влияние абиотических факторов на резистентность пчелиных семей Резистентность организма животных характеризуется устойчивостью к действию разнообразных природных факторов. Механизм резистентности играет ведущую роль в защите организма от вредных воздействий внешней среды. Неспецифические факторы защиты действуют практически всегда против всех чужеродных агентов микробной и немикробной природы. Они передаются по наследству, обусловлены врожденными биологическими особенностями, присущими данному виду живых организмов [52, 57, 66]. Пчелиная семья – это целостный социальный организм, состоящий из особей, которые обладают сложными взаимосвязями внутри и вне гнезда. Функциональный полиморфизм стаз пчел, составляющих пчелиную семью, со строгой специализацией выполняемых функций, сделал невозможным существование стаз отдельно друг от друга, но вместе с тем превратил сообщество «пчелиная семья медоносных пчел» в суперорганизм [37, 38, 156, 203205, 216, 230, 234]. Как и любой другой организм, пчелиная семья подвержена воздействию факторов внешней среды. В процессе эволюции медоносные пчелы приобрели способность регулировать микроклимат своего жилища и приобрели способности теплообразования, терморегуляции, управления режимами влажности, газового состава воздуха [2, 32, 34, 35, 40, 205, 220, 225]. Это позволило виду Apis mellifera освоить территорию от южных до самых северных широт планеты. 25 1.2.1. Температурный режим Медоносная пчела может существовать при температуре во внешней среде от -50 до +50 0С [231]. Температурный режим внутри гнезда определяется жизнедеятельностью и физиологическим состоянием пчелиной семьи. В активный период сезона в расплодном гнезде пчел самая стабильная температура держится в зоне отложенных яиц и молодых личинок. Оптимальная температура для их развития составляет 34,0-35,5 0С [35, 156, 189, 213]. Температура в области развивающихся пчел и трутней имеет небольшие различия (от 0,2 до 1 0С). Она зависит от зоны размещения расплода и внешней температуры. В центральной части гнезда средняя температура у развивающихся пчел и трутней не различается. В зоне размещения маточников пчелы поддерживают температуру на 0,2-2 0С ниже, чем в зоне пчелиного расплода. На сотах без расплода температура зависит от внешней температуры, но не опускается ниже 13-14 0С [37, 40, 232]. Указанные температурные режимы могут стабильно поддерживаться только в сильных семьях. Установлено, что в зоне расплода температура в слабых семьях ниже, чем в сильных. Так, в семьях численностью 2,3 и 20 тыс. пчел при колебаниях внешней температуры от +9 до +21 0С в первой семье температура в области пчелиного расплода равнялась 32,2 0С, во второй – 33,7 0С [32]. Е.К.Еськовым [32, 33, 37], Н.Г.Бабкиной [2] установлено, что при 29 0С гибель пчелиного запечатанного расплода составляет 34,8 %, при 28 0С – 62 %, при 27 0С погибают все развивающиеся пчелы в запечатанном расплоде. При 38 0С гибель расплода составляет 95 %. Степень снижения температурных режимов в запечатанном пчелином и трутневом расплодах в сравнении с открытым зависит от локализации расплода в гнезде, количества расплода, 26 находящегося в смежных ячейках, численности пчелиных семей, колебаний внешней температуры. Механизм терморегуляции представляет собой цепь сложных поведенческих актов. Важную роль при этом играют индивидуальные особенности пчел – чувствительность их терморецепторов, способность в сотни раз замедлять или усиливать обмен веществ. Типичных рецепторов теплоты у пчел пока не обнаружено. Считается, что их функцию выполняют рецепторы, определяющие концентрацию газов в воздухе. Порог чувствительности пчел на изменения температуры в гнезде составляет 0,2 0С [36, 38]. Одной из особенностей пчелиных семей является то, что пчелам значительно легче повысить температуру гнезда, чем понизить. Так, за один и тот же промежуток времени пчелы семьи способны повысить температуру гнезда на 30 0С, а понизить лишь на 4 0С. В зависимости от ситуации и интенсивности воздействия термофактора пчелы ведут себя по-разному. Так, при повышении температуры гнезда, и в первую очередь в зоне размещения расплода, пчелы активно понижают ее, уменьшая плотность скопления, рассредоточиваясь по сотам и тем самым увеличивая объем гнезда и его теплопотери. Если температура продолжает превышать оптимальную для взрослых и развивающихся членов семьи, то пчелы покидают гнездо и выкучиваются, собираясь под дном или прилетной доской улья [34, 38]. При понижении температуры в гнезде пчелы плотнее собираются на сотах, перемещаются в верхнюю часть гнезда и на соты с расплодом. Одновременно у пчел усиливается обмен веществ, а, следовательно, и образование теплоты. Если меры, принятые пчелами, не обеспечивают оптимальную температуру, то они постепенно собираются в середине гнезда в клуб, создавая защитную корку, что уменьшает теплопотери в 9 раз. Таким образом, несмотря на довольно совершенную систему терморегуляции в пчелиных семьях, температурный режим как в месте расположения расплода, так и на других участках может варьировать в зависимости oт ряда факторов. Это, в свою очередь, вызывает ответные реакции организма пчел. 27 Так, при снижении или увеличении температурных режимов в области расплода изменяется продолжительность цикла развития рабочих пчел. Если при оптимальной температуре выращивания расплода цикл развития рабочих пчел составляет 21 сутки, то при снижении до 32,5 0С – 22,3, при 32,0 0С – 23,0, при 38,0 0С – 19-20. При этом при пониженных температурах выращивания в теле увеличивается количество воды, снижается масса тела. Отмечают изменение морфометрических признаков [32, 36, 37, 40, 41, 58, 69]. Все это отражается на развитии пчелиных семей и их продуктивности. По данным В.И.Лебедева [79], слабые семьи имеют достоверно меньшую массу молодых пчел, показатели экстерьера, нагрузку медового зобика, интенсивность летной деятельности. Содержание воды в теле пчел к осени падает, по данным автора, у пчел из сильных семей на 6,3 %, а из слабых – на 4,4 %. Это приводит к тому, что пчелы из слабых семей менее устойчивы к неблагоприятным факторам зимовки. Данный факт объясняется тем, что в жизнедеятельности пчел большое значение имеет содержание воды в их теле. Потеря свободной воды в теле насекомых к осеннему периоду свидетельствует о повышении их холодоустойчивости [130, 164, 200, 226]. 1.2.2. Влажностный режим Температура и влажность воздуха взаимосвязаны. Показатели влажности разнообразны, но в пчеловодстве наибольшее значение имеет относительная влажность воздуха, т. е. процент насыщения его водяными парами. В летний период влажность воздуха в гнезде колеблется от 25 до 100 % в зависимости от состояния семьи, погодных условий и времени суток. Наиболее высокая относительная влажность воздуха (85-95 %) поддерживается в зоне размещения открытого расплода. При 45 %-ной относительной влажности воздуха яйца высыхают и из них не вылупляются личинки, а при 50-55 %-ной – погибает до 40 % эмбрионов. Оптимальная относительная влажность для эмбрионального развития в яйце - 70-85 % [37, 156]. 28 Относительная влажность в период роста и развития расплода сказывается на качестве выращенных пчел. Она изменяет содержание воды в тканях пчел, а в связи с этим оказывает влияние на массу тела, размер тергитов [129, 156]. Установлено, что излишняя влажность способствует появлению и усилению таких опасных болезней, как нозематоз, аскосфероз, акарапидоз, варрооз, европейский гнилец и др. При опасности перегрева пчелы используют воду, повышая влажность воздуха. Для этого они развешивают капельки воды в ячейках расплодных сотов, на планках рамок. Кроме того, потребность пчелиной семьи в воде зависит от численности открытого расплода в улье. Чем она выше, тем больше потребность в воде. При хорошем медосборе потребность в воде значительно уменьшается, так как семья имеет возможность восполнить дефицит влаги за счет приносимого нектара. Установлена связь между концентрацией содержимого медового зобика пчел и приносом ими воды. При повышенной концентрации сахара в медовом зобике многие пчелы начинают пить воду. Для массового сбора воды концентрация сахара в медовом зобике должна быть 40 %. Необходимой мерой, облегчающей доставку воды пчелами в улей, является установка на пасеке поилки. 1.2.3. Газовый режим Содержание кислорода и диоксида углерода в гнезде медоносных пчел непостоянно и зависит от физиологического состояния пчелиной семьи (наличие и величина расплода, численность пчел в семье, роевое состояние), периода сезона, места в гнезде, уровня аэрации гнезда. Как правило, в центральной части гнезда концентрация диоксида углерода выше, чем на периферии. 29 Наибольшее количество углекислого газа отмечают в зимнем клубе. В этот период пчелы выдерживают концентрацию СО2 до 4 %. При более высокой концентрации приступают к аэрации клуба [23, 39, 103]. Количество диоксида углерода в клубе пчел увеличивается с увеличением силы пчелиной семьи, что способствует более высокой температуре внутри клуба. Установлено, что у зимостойких пород пчел содержание диоксида углерода в клубе выше (до 6-8 %), чем у менее зимостойких [1]. Если концентрация диоксида углерода повышается и держится в улье на уровне 8-11 %, пчелы быстро изнашиваются и гибнут, семьи выходят из зимовки ослабленными. Это задерживает их весеннее развитие [31, 32]. В благоприятный летний период концентрация диоксида углерода в центральной части гнезда в среднем составляет 0,25 %, а кислорода – 19,9 %. осенью с понижением активности пчел содержание диоксида углерода возрастает, а кислорода – уменьшается. Так, уже в сентябре среднемесячное значение диоксида углерода в центре гнезда составляет 1,1 %, а на периферии – 0,6 % [71]. Как показали данные публикаций, пчелиные семьи обладают набором уникальных внешних рецепторов высокой чувствительности и механизмов регуляций температуры, влажности, газов, которые позволяют семьям создавать свой микроклимат гнезда. Это обеспечивает им резистентность в окружающей среде. Однако оптимальное регулирование микроклимата под силу сильным семьям при условии хорошей кормовой базы. Понятие «сильная семья» варьирует и зависит от времени сезона. В ранневесенний период, в условиях центрального, северного регионов и Сибири, сразу после выставки пчелиных семей из зимовника сильной считается семья массой 1,75-2,0 кг (7-8 улочек), средней – 1,25-1,5 кг (5-6 улочек), слабой – 1,0 кг и ниже. К главному медосбору: сильная семья – 5,0-6,0 кг (20-24 улочки), средняя – 3,5-4,5 кг (13-18 улочек), слабая – 3 кг (12 улочек) и ниже. В осенний период: сильная семья – 2,25-2,75 кг (9-11 улочек), средняя – 1,752,0 кг (7-8 улочек), слабая – 1,5 кг (6 улочек). Пчелиные семьи силой 1,25 кг 30 (5 улочек) и ниже семьями не считаются. Их называют «запасные матки», так как такие семьи не могут создать оптимальный микроклимат внутри гнезда на протяжении всей зимовки и при экстремальных условиях, как правило, погибают [37, 71, 156]. 1.3. Изменение резистентности пчелиных семей при их содержании в теплицах 1.3.1. Влияние микроклимата теплиц на пчелиные семьи Исследования по содержанию пчелиных семей в теплицах выполнены в подавляющем большинстве в пленочных, частично в остекленных теплицах на 500-1000 м2 [7, 19, 22, 30, 46, 68, 84, 89, 97, 98, 102, 132, 170, 179, 180]. Во всех работах по содержанию пчелиных семей в теплицах о климате говорится в общих чертах – он отрицательно действует на пчел. В теплицах отмечают постоянно повышенную температуру и влажность. При искусственном пополнении воздуха углекислым газом (технологический прием для повышения урожайности огурцов) его содержание может кратковременно достигать до 1 %, что безвредно для пчел [46, 83, 179]. Н.Д.Машинская [98] указывает на присутствие в теплицах повышенных концентраций углекислого газа и аммиака, но количественных данных нет. В работе приведены конкретные данные о том, что температура в остекленных теплицах повышается с 14 часов до 37-50 0С из-за плохой вентиляции. В какие сроки культурооборота это происходит, не уточняется. Далее автор указывает, что в остекленных теплицах круглосуточно и в течение всего сезона выращивания огурцов поддерживается высокая температура и высокая влажность воздуха. В пленочных теплицах проблемы сохранения пчел во второй половине зимне-весеннего культурооборота не существует, так как пчелиные семьи можно ставить между теплицами. 31 И.Н.Мадебейкин [83] установил, что понижение температуры воздуха в теплицах в ночное время до 10 0С отрицательно сказывается на опылительной деятельности пчел в течение дня. Кроме микроклимата, на сохранность пчелиных семей отрицательно действуют: ограниченность пространства теплиц и светопроницаемость кровли. Пчелы бьются о стекла, так как не видят их. В холодное время, стремясь вылететь, приклеиваются к стеклам. Часто пчелы вылетают из теплиц через мелкие щели и теряются. Большие потери пчел наблюдают при первом открытии фрамуг. Я.М.Самосадов [132] отмечает, что семьи в теплицах быстро слабеют, несмотря на регулярное подсиливание 1-2 рамками расплода, плохо опыляют огурцы. Отверстия, сделанные в местах скопления пчел, позволили пчелам вылетать на волю и семьи перестали сильно изнашиваться, стали активнее опылять огурцы. Для снижения потерь пчел предложены форточки, которые должны быть сделаны сразу, как только пчелиные семьи поставлены в теплицу. Чтобы пчелы не блуждали и не терялись, по периметру форточки рекомендовано окрашивать краской [46, 67, 68, 84, 132, 179]. Н.Д.Машинская [98, 100] установила, что микроклимат теплиц резко сокращает продолжительность жизни пчел. Осенние пчелы, выращенные в семьях, стоящих на пасеке, прожили в теплицах после их выставки в конце января 65-75 дней, а пчелы, выращенные в семье в условиях теплицы численностью 15000-17000 пчел, при обеспечении пергой – 22-24 дня, без перги – 19-20 дней. М.Ф.Шеметков [77] отмечает низкую выживаемость расплода в семьях, находящихся в теплицах. Из 1398 отмеченных личинок было запечатано 831. В другой исследуемой семье гибель личинок составила 49,6 %. Л.И.Боднарчук [7] исследовал яйценоскость маток разных рас. Он установил, что среднесуточная яйценоскость маток степной украинской расы составила 115 яиц, серой горной кавказской – 219, карпатской – 550. Количе- 32 ство выращенных пчел за 87 дней (с 06.02 по 03.05) составило в семье степной украинской расы 8875, серой горной кавказской – 16340, карпатской – 41240 штук. В ясные солнечные дни воздух в теплицах часто нагревается до 35 0С и выше. При такой температуре и высокой относительной влажности воздуха (80-90 %) пчелы не в состоянии удерживать нормальную температуру в гнезде, что отрицательно сказывается на состоянии расплода и жизнедеятельности взрослых пчел. В таких условиях погибает до 50 % личинок, на 12 % уменьшается масса только что вылупившихся молодых пчел и снижается их выживаемость при голодании на 44,2 % [83]. 1.3.2. Условия кормления пчелиных семей в теплицах Основным кормом пчел являются углеводы, которые пчелы получают из меда и нектара, а белки и жиры – из цветочной пыльцы. Энергетические вещества пчелы получают из углеводов меда, а пластические – из белков пыльцы. В тепличных хозяйствах с полезной площадью 1000 м2 среднесуточное поступление пыльцы в пчелиную семью составляет в среднем 3 г при норме 45-50 г [68,80]. По данным Н.Д.Машинской [98], микроклимат теплиц и отсутствие перги в гнездах пчел численностью 15000 не снижает яйценоскости маток, пока в семье есть пчелы-кормилицы, но вызывает каннибализм у рабочих пчел. В семьях, получающих пергу, рождается в среднем до 71,5 % пчел от числа отложенных маткой яиц, а без перги – не более 21,5 %, остальные яйца и молодые личинки поедаются пчелами. А.Н.Мельниченко и Н.В.Никифорова [102] в семьях пчел из теплиц Горьковской области установили, что до кормления пергой яйценоскость маток колебалась от 10 до 25 яиц в сутки, а после первого кормления – от 96 до 125 яиц, после второго – от 42 до 275 яиц. 33 Изучение экстерьерных признаков пчел, работающих в теплицах, показало, что у пчел, работающих в условиях теплиц, хоботки, крылья и тергиты уменьшаются на 10-11 % независимо от того, получают они пергу или нет. В семьях, не получающих пергу, рабочие пчелы выкармливают расплод за счет истощения своего тела, но сами живут 18-19 дней, а пчелы, получающие пергу, живут 22-24 дня [98, 100]. По данным И.Н.Губайдуллина [19], морфометрические показатели у пчел, рожденных в теплицах, не получающих пыльцу, снижаются в течение 5 поколений на 2,6-3,1 %. У пчел, рожденных в теплицах и получающих пергу, СГОЛ и пробиотик «Акпеник», показатель повышается к пятому поколению на 6,2 %. Н.Д.Машинской [98] экспериментально установлено, что при полной обеспеченности пергой пчелиные семьи численностью 15-17 тыс. способны проработать в теплицах активно в течение всего культурооборота. Семьи, не обеспеченные пергой, погибают через 87 дней после постановки в теплицы. При кормлении пчел заменителями перги (смесь соевой муки, пекарских дрожжей и сухого молока в соотношении 3:1:1 замешивалась на сахарном сиропе и в виде лепешек раздавалась в ульи, их клали поверх рамок под холстик) семьи сохраняются в рабочем состоянии в течение 2,5-3 месяцев. Число летных пчел в семьях, не обеспеченных пергой, составляет 5,3 % от общего количества, а в семьях, обеспеченных пергой – 18,2 %. В условиях климата Сибири пчел из теплиц выставляют в пространства между теплицами рядом с дверьми в начале мая. 1.3.3. Характеристика отдельных показателей физиологического состояния пчелиных семей в теплицах Основными показателями физиологического состояния пчел являются: продолжительность жизни, масса тела, воспроизводство потомства, внутренние органы и гемолимфа. 34 По данным А.Маурицио [95], Я.Л.Шагуна [175], М.В.Жеребкина [42, 43], Н.Г.Билаш [5], продолжительность жизни у полезных насекомых изменяется в зависимости от сезона, породы, кормления. Зимние пчелы живут 911 месяцев. Этот период характеризуется минимальным расходом энергии и питательных веществ в организме. Зимующие пчелы отличаются от летних не только продолжительностью жизни, но живой массой и обменом веществ [39]. По сообщению Г.Ф.Таранова и Т.Н.Азимова [159], осенью в семьях появляются более крупные особи, превышающие летних по массе на 12-14 %. Весенне-летние пчелы живут 30-35 дней. По мнению Г.Ф.Таранова, Т.Н.Азимова [159], А.М.Рямовой [129], это связано со значительной работой по сбору нектара, воды, пыльцы, их переработкой, выкармливанием расплода, чисткой ячеек, гнезд и т.д. Наименьшая продолжительность жизни наблюдается у пчел во время главного медосбора – 25-29 дней. Это объясняют усиленной работой по доставке и переработке нектара. Если вылеты пчелы осуществляют на далекие расстояния и в ветреные дни, то они изнашиваются еще быстрее. Периодические изменения условий внешней среды (режима питания, температуры, влажности, солнечной радиации и др.) могут повлечь за собой нарушения физиологических процессов. Поэтому без дополнительного поступления пыльцы в пчелиных семьях происходит нарушение воспроизводства молодых пчел и развития пчелиной семьи в целом. Делались попытки замены пыльцы пшеничной, гороховой, ржаной, овсяной, гречишной, кукурузной мукой [22, 157], но пчелы, получавшие вместо перги муку, переставали выкармливать расплод. Использование продуктов с полноценными белками (сухие дрожжи, цельное молоко, яичный желток, яичный белок, сухие сливки) также не могло заменить пергу [157]. В результате А.Ф.Губин с соавт. [21] рекомендовали пчеловодам подставлять в пчелиные семьи заранее припасенные соты с пергой. 35 С.А.Стройков [152] испытал молоко цельное, сухое, дрожжи пивные, медицинские дрожжи, белковую пасту Зубрилина, сояполл, смесь по Гайдуку, творог и пришел к выводу, что наибольшее количество расплода пчелы выкармливают, когда питаются свежей пергой. Позднее стали разрабатывать композиции белковых подкормок с обязательным добавлением пыльцы, чаще перги [13, 19, 46, 80, 86, 90 и др.]. Это повысило усвояемость чужеродного белка, но все исследователи вынуждены были отметить, что разработанные композиции не могут полностью заменить пергу. Н.Г.Еремия [30] на основании изучения динамики белка, аминокислот и трансаминирующих ферментов в теле развивающихся и взрослых пчел, находящихся в естественных условиях и в теплицах, пришел к заключению, что особую роль в процессе белкового обмена в организме пчел играет секреция молочка, необходимого для выкармливания молодых личинок и кормления маток. Молочко содержит 3,5 мг/г свободных и 799,9 мг/г связанных аминокислот, и его образование связано с потреблением пчелами белкового корма (пыльца, перга). В конце зимовки в теле пчел возрастает относительное содержание жира, свободных и связанных аминокислот, что связано, вероятно, с началом потребления пчелами запасов перги из-за необходимости выкармливания личинок. В теле пчел, работающих в теплицах, при отсутствии в гнезде перги, резко снижается содержание аминокислот. По сумме пятнадцати аминокислот потери составляют 25,7 %, что приводит к усиленному износу пчел и, естественно, снижению продолжительности их жизни в теплицах, когда пчелы начинают погибать. Недостаток перги, пыльцы в пчелиных семьях теплиц автор рекомендует компенсировать скармливанием сахарно-медового канди с подсолнечниковым шротом или шротом кукурузных зародышей с добавлением синтетических аминокислот, микроэлементов и витамина В12. Это приводит к улучшению их состояния, повышается опыляемость цветков огурцов. Урожайность культуры огурца при данной подкормке возрастает на 41 %. В результате 36 опытов было выявлено, что канди со шротом кукурузных зародышей пчелы лучше поедали, чем с подсолнечниковым шротом. Следует учесть тот факт, что пчелиные семьи заносятся в теплицы, когда еще находятся в состоянии зимнего покоя, и их ферментные системы «приторможены», поэтому перевариваемость корма слабая. Вероятно, подсолнечниковый шрот более инороден для пчел, чем шрот кукурузных зародышей. Применение предложенного рецепта замедляет процесс снижения аминокислот в теле пчел, но не восстанавливает их полностью. По данным автора, в условиях Молдавии свежий нектар и пыльца появляются в природе через 28-40 дней после постановки пчелиных семей в теплицы. За это время, при наличии подкормки, снижение аминокислот, в общей сложности, происходит на 11,8-13,0 %, а в контроле – на 25,82 %. В настоящее время появились многофункциональные по своему назначению препараты нового поколения отечественного производства. К таким препаратам можно отнести сыворотку (молочная) гидролизованную, обогащенную лактатами – СГОЛ [81]. Препарат содержит частично гидролизованный белок молочной сыворотки, олигопептиды и свободные аминокислоты, глюкозу, галактозу, лактаты, нуклеиновые кислоты, витамины С, Е, В1, В2, В6, РР, β-каротин, эргостерин, фолиевую кислоту, эндосомальные ферменты молочнокислых бактерий, микро- и макроэлементы, полисахариды, живую культуру лактококков и лактобацилл. Препарат разработан для подкормки животных [81]. А.Г.Маннапов с соавт. [86] на основе препарата СГОЛ разработали биологически активную белковую композицию для подкормки пчел: сахарная пудра : мед : цветочная пыльца : СГОЛ и успешно испытали ее в условиях Башкортостана в теплицах пленочного типа. Применение данной композиции В.П.Мамаевым [84] в пленочных теплицах в семьях массой 1 кг увеличило количество печатного расплода в семьях на 24 день опыта на 38,7 % в срав- нении с первоначальным значением, в то время как при подкормке - сахарная пудра : мед : цветочная пыльца – данный показатель увеличился на 26,1 % в 37 сравнении с первоначальным. В контроле (сахарно-медовая смесь) отмечено за этот период снижение количества печатного расплода на 57,5 % от первоначального значения. К сожалению, данных по динамике печатного расплода, силе семей на протяжении всего культурооборота В.П.Мамаев [84] не приводит, поэтому невозможно оценить действительную возможность использования семей кавказской расы массой 1 кг в теплицах в условиях Южного Урала при стимулировании их указанной активной композицией. И.Н.Губайдуллин [19] для восстановления нормальной ассоциации микрофлоры кишечника пчел на начало культурооборота огурца и лучшей усвояемости белковой подкормки ввел в разработанную А.Г.Маннаповым с соавт. [86] композицию отечественный пробиотик «Апиник». Проведены испытания нескольких разработанных композиций на семьях массой 1,8 кг среднерусской расы в теплицах пленочного типа. В результате экспериментальных исследований установлено, что скармливание пчелиным семьям перги в комплексе со СГОЛом и пробиотиком «Апиник» способствует увеличению печатного расплода к концу эксперимента (16.05) в 5,85 раза в сравнении с первоначальным показателем (33,8 кв.). Это на 31,8 % больше в сравнении с контролем (95,6 кв.), где семьям скармливали только мед. По данным автора, динамика массы однодневных рабочих пчел в контроле во всех шести поколениях, выращенных в теплицах, снижалась и к концу опыта стала на 8,5 % ниже первоначального показателя. В опытной группе отмечалось повышение данного показателя и к концу эксперимента масса однодневных пчел составляла 107,4 мг, что на 8,8 % больше исходного значения и на 17,6 % больше, чем в контроле. К сожалению, не представлены показатели продолжительности жизни пчел, нарождающихся в условиях теплиц. Показатели продолжительности жизни, сделанные в садках, не имеют ничего общего с действительным положением дел. На основании анализа литературных данных можно заключить, что технология кормления пчелиных семей в теплицах отработана. Подавляющее 38 большинство исследователей считают оптимальным применение в качестве белкового корма пыльцы или перги. При недостатке пыльцы можно применять белковые подкормки, но с обязательным введением в композицию пыльцы или перги. Анализы биохимических, физиологических показателей пчел, продолжительность их жизни, количество и качество выращиваемого расплода указывают на то, что имеет место проблема коррекции резистентности организма пчел к негативным факторам, которые отрицательно действуют на организм пчел в теплицах. Исследований по данному вопросу в условиях теплиц не проводили. 1.3.4. Влияние профилактических и лечебных обработок против вредителей и болезней культуры огурца на пчелиные семьи Одной из серьезных причин снижения резистентности и гибели пчелиных семей подавляющее число публикаций связывают с их отравлением пестицидами. Так, Н.Д.Машинская [98] установила, что препараты рогор, карбофос даже через 3 дня после применения не утрачивают токсичности для пчел, что вызывает их гибель в каждой семье в среднем по 1500 пчел. Оставшиеся в живых полевые пчелы проявляют признаки химического токсикоза, не работают на массиве и приступают к опылению цветков огурца только на 9-й день после последней обработки, после усиленных дрессировок. Матки возобновляют яйцекладку через 8 суток после обработки, что наносит большой дополнительный урон развитию пчелиных семей, часто невосполнимый. Кроме того, урожай огурцов также резко падает, а хозяйство терпит большие убытки. Исследования Ж.К.Маркосяна [90] показали, что от применения пестицидов снижается завязываемость плодов, ухудшается товарный вид продукции. Обработка карбофосом, рогором требует изоляции пчел на 3 и более дней. В результате завязываемость плодов вместо 97,1 % снижается до 18 %. 39 Н.Н.Зарецкий [46], обобщая материал многолетней практики работы с пчелиными семьями в теплицах, свидетельствует о том, что изоляция пчел и удаление их из теплиц на время токсического действия пестицидов не решает проблему отравления. Они оказываются в еще худшем положении в сравнении с оставшимися в теплицах. Закрыть летки в ульях для изоляции пчел можно только поздно вечером или рано утром до начала их лета. В том и другом случаях с раскрывшихся цветков не будет собран нектар и пыльца. При обработке растений химическими препаратами нектар и пыльца поражаются ими. Какое-то количество пестицидов успеет разложиться ко времени, когда пчелиные семьи снова занесут в теплицу, но оставшихся веществ будет значительно больше. В результате внесенные в теплицу пчелы в возбужденном состоянии из-за того, что их держали закрытыми, начинают активно летать в теплице и наряду с вновь распустившимися цветками будут посещать и ранее раскрывшиеся, особенно те, где имеется пыльца. Кроме того, вынос пчелиных семей из теплицы приводит к сбою ритма внутри гнезда, в том числе и в яйцекладке маток. Наконец, закрытие летков в улье приводит к возбуждению пчел и повышению температуры внутри гнезда. Все это способствует большой гибели пчел, часто невосполнимой. Более безопасно, считает автор, оставлять пчелиные семьи в теплицах и не закрывать летки. Обработку растений обычно проводят во второй половине дня. В этом случае надо начинать опрыскивание с противоположной стороны от улья. Этим летающих пчел постепенно оттесняют к улью. В последнюю очередь обрабатывают растения около улья. На это короткое время улей закрывают пленкой. После обработки сразу с улья снимают пленку. После обработки растений пчелы не летают в теплицах. Вероятно, их отпугивает запах пестицида. На следующий день пчелы посещают только вновь раскрывшиеся цветки. Их лепестки обращены к внутренним органам цветка, чисты от препарата и массовой гибели, как при изоляции, не происходит. Во втором варианте, вероятно, все зависит от степени токсичности и пролонгирующей способности ядохимиката. 40 К сожалению, мало публикаций, которые бы указывали о количественной степени потерь. Но отмечают, что обработки службы защиты растений против вредителей и болезней растений приводят к потере иногда всех летных пчел и являются причиной постановки в теплицы новой партии пчелиных семей. Н.Н.Зарецкий [46] констатирует, что после значительной гибели пчел в пчелиных семьях от разных причин, особенно после химических обработок, часто оставшийся расплод не обогревается полностью и гибнет из-за малого количества пчел в гнезде, которые не могут регулировать микроклимат гнезда и не могут обслужить весь расплод. В семье наблюдают незаразную болезнь – застуженный расплод. В случае, когда в теплице сильно повышается температура, до 40 0С и выше, то может случиться перегрев гнезда, и погибает при этом большое количество расплода. Перечисленные изменения в гнезде пчел являются предрасполагающими факторами для появления инфекционных болезней: аскосфероз, европейский или американский гнильцы, в зависимости от климата региона. Анализ публикаций по инфекционным болезням растений показывает, что из патогенов растений наибольший процент приходится в условиях теплиц на факультативные микроорганизмы грибной природы – Fusarium, Erysiphe, Sphaerotheca и др. [4. 11. 153]. Что касается пчелиных семей, то в условиях теплиц они чаще всего болеют такими инфекционными болезнями, как аскосфероз, нозематоз, реже европейский гнилец, из них первые две болезни вызывают патогенные грибы Ascosphaera apis и Nosema apis, то есть, как у растений, у пчел в условиях теплиц процент патогенов грибной природы также превалирует. В последнее время аскосфероз регистрируют практически во всех теплицах. При микозах значительно снижается продуктивность пчелиных семей, по разным оценкам от 20-40 % [146] до 50-60% [60. 62. 76], при этом острая форма болезни вызывает до 30-50 % гибели расплода. По мнению Й.Сокол и Й.Кубинец [145], проявление и распространение инфекционных болезней 41 расплода пчел оказывает неблагоприятное влияние на состояние окружающей среды и понижение урожайности энтомофильных культур. Аскосфероз (перицистоз, перицистисмикоз, известковый расплод, меловый расплод) - инфекционная болезнь открытого расплода медоносных пчел, пчел-листорезов и шмелей. Возбудитель - сумчатый гриб рода Ascosphaera. Различают два подвида этого гриба: Ascosphaera apis var. apis и Ascosphaera apis var. major, которые отличаются между собой разме- рами и конфигурацией спор и плодовых тел. Размер спор Ascosphaera apis var. apis 3-3,8 x 2,3 мкм, диаметр плодового тела 32-99 (65,8 мкм), Ascosphaera apis var. major - 3,3-4,2 x 2,5 и 88,4-168мкм (128,4мкм) соответственно. У варианта apis споровые шары зеленовато-коричневого, а у major - черного цвета. Они образуются у варианта apis при температуре 30 °С, а у major – 20 °С. Гриб растет на питательных средах (среда Сабуро, сусловый агар, картофельно-глюкозный агар), образуя тонкий ползучий мицелий, состоящий из многоклеточных, бесцветных гиф толщиной 4,2-12,0 мкм. Клетки гриба многоядерные, мицелий обладает половым диморфизмом. Женский мицелий белого, мужской - желтовато-зеленоватого цвета, который со временем темнеет. При встрече двух разнополых мицелиев на их гифах образуются короткие выросты, на которых формируются половые структуры - гаметангии. Это многоядерные, не дифференцированные на гаметы (половые клетки) образования, отделенные от гиф перегородками. Женский и мужской гаметангии отличаются друг от друга размерами. Женский гаметангий (овогоний) значительно больше мужского (антеридий). Он переливает свое содержимое (ядра, протоплазма) в женский. После этого сначала происходит кариогамия - слияние ядер, а затем их множественное деление. При спорообразовании формируется большое число спор, которые склеиваются в компактные споровые шары, называющиеся асками или сумками. Зрелый нутриоцит со споровыми шарами называется цистой или спороцистой. Он имеет вид капсулы сферической или грушевидной формы, в зависимости от подвида возбудителя [ 62, 149 ]. 42 Возбудители грибковых заболеваний пчел обладают исключительно высокой степенью устойчивости во внешней среде к физическим и химическим факторам / В пустых ульях, в сотах и инвентаре гриб Ascosphaera apis сохраняет жизнеспособность в условиях пасеки 4 года; при температуре - 27 °С - в течение года [45.62]. В текучем паре (100 0С) споры возбудителя устойчивы в течение 10 минут [106]. По сообщению A. Borchert [195], гриб удавалось выращивать через 15 лет хранения его в коллекции. В.И.Полтев с соавт. [119] считают, что споры гриба в гнездах пчелиных семей могут сохраняться десятками лет. Н.А.Спесивцева [149] относит гриб Ascosphaera apis к сапрофитам, которые в большинстве своем являются условно-патогенными, способными развиваться не только во внешней среде, но и в живом организме. Действие температуры на рост мицелия и споруляцию установили исследователи А.D.Betts [193]; A.Maurisio [223]; Н.Prokschl [228]; К.Furuya et. al. [206]; К.Rust et. al. [229]. По их данным, оптимальная температура для вегетативного роста - 25 – 35 °С, для споруляции - 30-35 °С. L.Bailey [192] установил идеальную температуру для роста гриба – 35 °С. Согласно данным Z.Glinski; et. al. [209, 210] прорастание спор гриба происходит при температуре 25-30 °С и относительной влажности 92,5 %. Р.Ендреяк [29] при культивировании гриба Ascosphaera apis определил, что наиболее активное развитие данного возбудителя происходит при температуре 30-32 °С и относительной влажности 57-70 %. Для борьбы с аскосферозом пчел в течение длительного времени изыскиваются средства различных групп химических соединений. К ним относятся нистатин, актидион, холиновая соль глюкозилполифунгина, тиабендазол, фунгизон, гризеофульвин, ундециловая кислота и др. [211]. По мнению А.Тошкова с соавт. [160] и Г.Н.Михальцевич с соавт. [104], лечение антибиотиками гнильцовых и парагнильцовых поражений расплода вызывает дисбактериозы, к которым присоединяются микозы пчел. Ряд ученых [27, 48, 63, 64, 99] рекомендуют использовать препараты на основе йода и его соединений для борьбы с аскосферозом и аспергиллезом пчел. 43 Одним из главных условий предупреждения и ликвидации микозов пчел, учитывая высокую устойчивость спор их возбудителей к физическим и химическим факторам, является своевременное и правильное выполнение ветеринарно-санитарных мер на пасеках, среди которых дезинфекция ульев, сотов, инвентаря имеет большое практическое значение. При аскосферозе, аспергиллезе дезинфекции подвергаются деревянные и металлические части, предметы пчеловодного инвентаря и оборудования. Существует несколько видов дезинфектантов. Так, с помощью 10 %-ного раствора перекиси водорода с 0,5 %-ной муравьиной кислотой из расчета 0,5 л/м2 проводят обработки ульев двукратно при экспозиции 6 часов. Пригодные для использования соты обильно орошают до полного заполнения каждой ячейки 3 %-ным раствором перекиси водорода с добавлением 0,5 % муравьиной кислоты. Через 4 часа их промывают и высушивают. Сильно пораженные мицелием грибов соты перетапливают на воск, вытопки и мерву сжигают. Топленый воск и пасечную мерву тщательно упаковывают в ящики или деревянные бочки, которые предварительно с внутренней стороны выстилают бумагой или полиэтиленовой пленкой разового пользования. После упаковки сырье маркируют как «зараженное», указывают в ветеринарном свидетельстве адрес хозяйства (пчеловода-любителя), вид неблагополучия пасеки по тому или иному заболеванию и отправляют на воскозавод для использования на технические цели или автоклавируют при температуре 127 °С в течение 2 часов в случае необходимости изготовления вощины. Мед, полученный от пчелиных семей неблагополучных пасек, хранят в плотно закрытой посуде и реализуют только для пищевых целей. Использование его для подкормки пчел запрещается [62, 99, 140]. Высокая устойчивость возбудителей микозов пчел отмечена к ряду химических соединений (щелочи, кислоты, альдегиды, перекиси и другие). Это подтверждается увеличением времени экспозиции при применении перечисленных препаратов. 44 Высокую обеззараживающую активность в ходе лабораторных и производственных испытаний проявили солянокислый раствор однохлористого йода (препарат 74-Б), гипохлор, перекись водорода с муравьиной кислотой, глутаровый альдегид, препарат глак, щелочной раствор формальдегида [18, 140, 142, 146]. A.Brizard et al. [196] отмечает, что предпочтительно использовать раствор гипохлорита натрия вместо раствора формалина, принимая во внимание выработанную резистентность спор Ascosphaera apis. По данным К.Кодама [55], им установлен фунгицидный эффект раствора катионового мыла (при разведении 1/1600) методом погружения в него патологического материала на 15 минут, раствора амфотерного мыла (1/1800) - погружением на 10 минут и раствора йода (1/3200) - 15 минут. Только одночасовые экспозиции формальдегида достаточны для ингибирования роста гриба Ascosphaera apis, а суточная экспозиция обеспечила 100 % фунгицидный эффект. Согласно результатам исследований Т.Накане с соавт. [108], наиболее эффективными дезинфектантами при лечении и профилактике известкового расплода пчел являются катионовое мыло (соединение с четвертичным аммиаком) и пропионовый вермикулит. С профилактической целью Т.Gochnauer et al. [211], J.D.Lahitte [219], М.М.Сычев [154], Е.Martinka [222] предлагают дезинфицировать пчеловодное оборудование водным раствором формалина, окисью этилена, аммиака, гипохлоритом натрия или метилбромидом. К.Гургулова [24, 25] для борьбы с аскосферозом рекомендует проводить гигиенические мероприятия, включающие уничтожение мумифицированных личинок и дезинфекцию инвентаря фезиам-формом. На неблагополучных по аскосферозу и аспергиллезу пчел пасеках особое внимание следует уделять дезинфекции почвы. A.M.Смирнов с соавт. [141], Е.Т.Попов [121] предлагают для дезинфекции почвы мест стоянок пасек 4 % раствор формальдегида, хлорную известь (38 % активного хлора), и дуст тиазона. 45 Отрицательное воздействие хлора и его соединений на рост и развитие Ascocphaera apis лежит в основе дезинфекционного препарата юколу [ ]. Дезинфекция ульев и сотов на неблагополучных по доброкачественному гнильцу и микозам пасеках достигается увлажнением 6 % раствором формальдегида при экспозиции 3 часа или 6 %-ным щелочным раствором формальдегида в течение 6 часов, а сотов – 4 %-ным раствором перекиси водорода [15, 27]. Положительный результат при лечении и профилактике грибковых заболеваний пчел показало использование в качестве дезинфектанта препаратов Ветсан и Ветсан-1 [15, 146]. Для дезинфекции зараженных сотов, считает Р.Ендреняк [29], необходимо использовать 4 % раствор формалина. А.А.Жуковым [45] для дезинфекции ульев и пчеловодного инвентаря при аскосферозе пчел предложен дезинфицирующий препарат перкарб на основе перкарбоната натрия, образующего в водном растворе перекись водорода. Однако наибольшую активность показали препараты перекиси водорода 10 % концентрации; формальдегида, хлорамина «Б» в концентрации от 0,5 % и выше, 10 %-ного раствора калия перманганата. О высокой эффективности препарата аскозол, активно действующим веществом, которого является дифенил-(2-хлорфенил)-1-имидазолиллитан, сообщают А.К.Лихотин с соавт. [82]. Для лечения и дезинфекции при микозах рекомендуются препараты йода, йодистого калия, раствор Люголя, 1 %-ный раствор однохлористого йода и 2 %-ный раствор формалина [62, 106]. Анализ представленных публикаций показал, что у возбудителей микозов и бактериозов быстро вырабатывается устойчивость к дезинфектантам. В результате одни и те же препараты показывают разную эффективность и авторам приходится рекомендовать более высокие концентрации или новые препараты. Поэтому требуется постоянный поиск новых средств. Анализ материалов, представленных в обзоре литературы, позволяет сделать вывод о том, что на протяжении всего технологического цикла вы- 46 ращивания культуры огурца на пчелиные семьи воздействуют различные по продолжительности и силе факторы. В условиях теплиц на 500-1000 м2 некоторые факторы были устранены или с помощью технологических приемов смягчены. Так, разработан технологический прием использования форточек для того, чтобы пчелы свободно могли вылететь из теплиц в любое время. Это снизило уровень гибели пчел и значительно повысило уровень опылительной деятельности. Изученным является также вопрос о кормлении пчелиных семей в теплицах. Разработанная технология предусматривает обязательное применение в качестве белкового корма пыльцы или перги. Доказано, что без включения белковых подкормок происходит резкое снижение продолжительности жизни пчел с последующей быстрой гибелью всей семьи. Современные теплицы с модулями на 10000-20000 м2 и более в сравнении с теплицами на 500-1000 м2 предусматривают новые технологии выращивания сельскохозяйственных культур. Они владеют большим набором технологических систем формирования микроклимата в теплицах и обслуживания растений, поэтому требуется изучать особенности микроклимата в теплицах и степень его воздействия на пчелиные семьи на протяжении всего культурооборота, так как в современных теплицах не предусмотрены дополнительные площади между модулями, куда можно было бы поставить пчелиные семьи, когда позволят метеорологические условия региона. Остаются неизученными вопросы об уровне воздействия микробных патогенов растений на резистентность пчелиных семей. В частности, не изучена степень воздействия микробной массы патогенов растений на степень устойчивости пчелиных семей к собственным патогенам. Открытым остается вопрос о том, что является запуском к началу инфекционных болезней пчелиных семей – отравление пчел в результате химических обработок растений или накопление патогенов растений до уровня, вызывающего снижение резистентности к собственным патогенам? 47 Не затронута проблема коррекции резистентности пчелиных семей к болезням в условиях защищенного грунта. Эти вопросы требуют изучения. Повышение резистентности в животноводстве направлено на устранение, а если это невозможно, то смягчение причин, отрицательно действующих на организм, и повышение его защитно-приспособительных механизмов. Для изучения данной проблемы в условиях теплиц необходимо точно знать особенности микроклимата, время и причины наибольшего отрицательного воздействия на пчелиные семьи, чтобы вовремя их смягчить. 48 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ 2.1. Материалы и методы исследований Работа выполнялась в 2006-2009 гг. в условиях тепличного комплекса СПК «Соревнование» Мытищинского района Московской области и на кафедре зоогигиены имени А.Л.Даниловой ФГОУ МГАВМиБ. Объектом исследований были: микроклимат теплиц блочного типа с полезной площадью одного модуля – 10 000 м2 и высотой шпалер – 2,1 м, культура пчелоопыляемого гибрида огурца «Эстафета», пчелиные семьи карпатской породы; пробиотик Биод-5 (рабочая версия в пчеловодстве ТАНГ), препарат Монклавит1. Динамику температурных, влажностных, газовых режимов в тепличных модулях в период зимне-весеннего культурооборота огурца изучали по данным компьютерного автоматического контроля. Бактериальную загрязненность почвы определяли на чашках Петри. Пробы почвы брали по общепринятой методике [75]. Затем от общей навески отбирали 30 г почвы и помещали в стерильную колбу вместимостью 500 мл, добавляли 270 мл стерильной водопроводной воды, взбалтывали в течение 10 мин и получали разведение 1:10. Далее 1 мл жидкости стерильной пипеткой переносили в пробирку, куда приливали 9 мл стерильной воды. Получали разведение 1:100. Таким же образом готовили последующие разведения 1:1000, 1:10 000, 1:1 000 000. Из каждого разведения для каждой группы микроорганизмов брали по 1 мл суспензии для посева на соответствующие питательные среды. Каждый вариант опыта закладывали в трех повторностях. Микробную обсемененность воздуха ульев пчелиных семей изучали с помощью метода свободного осаждения микроорганизмов на питательные среды [75]. 49 Для выращивания колоний микроорганизмов использовали следующие питательные среды: мясопептонный агар и среду Черепова – для бактериальных микроорганизмов, среды Сабуро, Чапека – для микроорганизмов грибковой природы. В среды Сабуро, Чапека добавляли стрептомицин (1 г/л) для подавления бактериальной микрофлоры. Инкубировали при 20, 25, 28, 30 и 35 0С. Подсчет отдельных групп микроорганизмов проводили в следующие сроки: бактериальные микроорганизмы – через 24-48 часов, микозные – через 5-12 суток. Для изучения динамики бактериальной и микозной обсемененности воздуха в ульях пчелиных семей отбор проб проводили сразу после постановки пчелиных семей в теплицы, а затем через каждые 10 суток. Учеты пораженности и интенсивности развития мучнистой росы на растениях проводили на естественно зараженном массиве в условиях теплицы по 5-балльной шкале учета болезней растений, утвержденных ВИЗР [122], согласно которой: 0 – растения здоровые; 1 балл – отдельные пятна мучнистой росы на листьях растений: 2 балла – мучнистым налетом охвачено до 10 % листовой поверхности растений; 3 балла – мучнистым налетом охвачено от 11 до 25 % листовой поверхности растений; 4 балла – мучнистым налетом охвачено от 26 до 50 % листовой поверхности растений; 5 баллов – мучнистым налетом охвачено свыше 50 % листовой поверхности растений. Количество учетных растений в теплице на 10 000 м2 составляло 500 (по 50 растений в 10 делянках, расположенных по диагонали модуля). Пораженность растений мучнистой росой в процентах определяли по формуле: n a 100 b 50 где а – количество пораженных растений; в – общее количество растений. Интенсивность развития болезни (%) вычисляли по формуле: R a b 100 nc где Σа·b – сумма произведений числа пораженных растений на соответствующий им балл поражения; n– общее число учетных растений; с– высший балл шкалы, на которой проводилась оценка степени поражения. Разработку условий применения Монклавит-1 в качестве дезинфектанта против грибковой микрофлоры проводили в соответствии с общепринятыми нормативными документами: Основные методические требования к постановке экспериментов в пчеловодстве. Современные методы исследования патологии пчел (утверждено РАСХН, 2000) Методические рекомендации по изучению и разработке способов профилактики и борьбы с аскосферозом пчел (утверждено ВАСХНИЛ, 1987) Инструкция по дезинфекции, дезакаризации, дезинсекции и дератизации на пасеках (утверждена Главным управлением ветеринарии 10.05.1990). В процессе выполнения работы были использованы: а) полевые штаммы грибов Ascosphaera apis var apis и Ascosphaera apis var major, выделенные нами из патологического материала производственной пасеки, обладающие характерными культуральными и морфологическими свойствами; б) питательные среды: сусло – агар, среда Сабуро; в) расплод и взрослые пчелы; г) препарат Монклавит-1. 51 Выделение культуры гриба рода Ascosphaera проводили из сотов с погибшими мумифицированными личинками, взятыми с пасеки СПК «Соревнование» Московской области. Для выделения культуры возбудителя соскобы с тел погибших личинок суспензировали и переносили в чашки Петри на сусло – агар или среду Сабуро. Для подавления сопутствующей микрофлоры перед посевом в питательную среду, расплавленную на водяной бане и охлажденную до 40-45 0С, добавляли стрептомицин – 100 тысяч ЕД на 1 л среды. Посевы культивировали в термостате при температуре 28-32 0С и наблюдали за ними в течение 10-12 суток. С целью получения чистой культуры производили дополнительный пересев с периферии колоний, характерных для каждого варианта вида гриба. Опыты по разработке режимов дезинфекции с использованием обеззараживающих агентов проводили на тестах (10х10) из дерева (имитация материала ульев); металла (имитация медогонок и другого металлического инвентаря) и сотов. Для инфицирования тест-объектов использовали свежеприготовленную взвесь гриба Ascosphaera apis в концентрации 200 тысяч спор в 1 мл. Для этого из 10-суточной культуры гриба, выращенного на среде Сабуро, в стадии спороношения делали смывы и центрифугировали при 2,5 тысячах об/мин в течение 30 минут. Надосадочную жидкость сливали, а осадок использовали для инфицирования Инфицирование тест-объектов, последующее взятие проб после истечения экспозиции и посевы на питательные среды для определения эффективности обеззараживания проводили согласно Инструкции по дезинфекции [120]. Опыты ставили не менее чем до получения трех совпадающих результатов с сопровождением контроля. Рабочую форму дезинфицирующего раствора готовили непосредственно перед опытами. Были испытаны 1, 3, 5, 7 и 10 %-ные растворы препарата. Для нанесения дезинфектанта использовали баллон типа «Росинка» емкостью 1,5 л, производительностью 1,5-2 мл раствора в секунду. Для осуществления визуального контроля качества нанесения аэрозоля на тест-объект и 52 установления дозы дезинфектанта для ульев и сотов в дезраствор добавляли основной фуксин в концентрации 0,02 %. Ульи и соты обрабатывали раздельно. Сначала дезинфицировали ульи, разъединяя их составные части, обрабатывая поочередно все детали. После обработки детали собирали, улей накрывали крышкой, закрывали летки и выдерживали от 2 до 24 часов. Соторамки с инфицированными ячейками в отмеченных квадратах обрабатывали поочередно сначала с одной, а затем с другой стороны факелом аэрозоля, расходуя на каждый магазинный (435х145 мм) и гнездовой (435х300 мм) сот по 125-250 мл дезраствора, соответственно. Затем соты помещали в обработанные ульи, заполняя весь объем, накрывали их крышками и выдерживали определенную экспозицию (от 2 до 24 часов). Каждому опыту были подобраны контрольные тест-объекты, которые были обработаны дистиллированной водой. По истечении срока экспозиции проводили нейтрализацию препарата 0,2 %-ным раствором тиосульфата натрия, с тест-объектов отбирали пробы для микологических исследований. Контроль качества дезинфекции проводили по наличию роста возбудителя микоза пчел A.apis в смывах с контрольных и опытных тест-объектов. По окончании установленной опытом экспозиции ульи, соты и весь другой пчеловодный инвентарь промывали водой, высушивали и использовали по назначению. В производственных опытах по проверке разработанных режимов дезинфекции использовали инфицированные грибом Ascosphaera apis ульи, соты и инвентарь, отобранные от семей, неблагополучных по аскосферозу. Разработку схемы применения пробиотика ТАНГ проводили в двух модулях теплицы, расположенных рядом, параллельно друг другу, под одним углом к солнцу. Семьи подбирали по принципу аналогов: приблизительно одной массы (1,38…1,43 кг), возраста маток (полетки), кормовых запасов. Было составлено 4 группы по 5 пчелиных семей в каждой. В первой группе пчелиные семьи получали инвертированный сироп в дозе 200 мл, обогащен- 53 ный 1х109 м.к. ТАНГА, во второй – 2х109 м.к., в третьей – 3х109 м.к., четвертая группа служила контролем – ей скармливали инвертированный сахарный сироп без препарата. Стимулирующие подкормки готовили в день применения. Сначала необходимое количество препарата ТАНГ разводили в 50 мл кипяченой воды, а затем переносили в инвертированный сахарный сироп, тщательно перемешивая. Один курс состоял из четырех подкормок, проводимых через 2-3 суток. Подкормки проводили ежемесячно, начиная с марта. За всеми пчелиными семьями осуществляли единый зоотехнический уход, который предусматривал наличие 1,0-1,5 кг меда на улочку пчел и 4050 г пыльцы в сутки. В процессе исследований вели визуальные наблюдения за состоянием пчел, поведением пчелиных семей. Критерием оценки состояния пчелиных семей служили: их масса, количество и качество печатного расплода, летноопылительная деятельность пчел. Перечисленные тесты определяли по общепринятым методикам до и через каждые 12 суток после начала опытов. Среднюю продолжительность жизни рабочих пчел определяли по методу Г.А.Шипилова [182], в основе которого предложен расчет по формуле: X 300 C1 , 25 (C1 C2 ) P1 где X - средняя продолжительность жизни пчел по результатам двух последовательных зоотехнических учетов, проводимых через каждые 12 суток; С1 и С2 – сила семьи в улочках при первом и втором осмотрах; Р1 – площадь печатного расплода при первом осмотре в квадратах; 300 и 25 – величины коэффициентов, полученные в результате предварительных математических операций. Расчеты экономической эффективности применения ТАНГА для стабилизации состояния пчелиных семей, осуществляющих опыление культуры огурца в условиях защищенного грунта, проведены согласно «Методике 54 определения экономической эффективности законченных НИР в сельском хозяйстве» (М., 1977). Цифровые данные экспериментального материала статистически обработаны по Н.Плохинскому [116]. 2.2. Результаты экспериментальных исследований 2.2.1. Изучение особенностей микроклимата теплиц в течение зимне-весеннего культурооборота огурцов Агрофитоклимат теплицы формируют растения и человек: масса растений в объеме сооружения диктуется уровнем освещенности, температурой, влажностью, концентрацией СО2 по ярусам внутрирастительного агрофитоценоза с учетом фазы роста и развития растений, их габитуса и возраста. Режим микроклимата принято дифференцировать от прорастания семян до экономического плодоношения. Тепличный комплекс СПК «Соревнование» Московской области представлен теплицей блочного типа, состоящей из 6 модулей, объединенных технологическим коридором. Полезная площадь одного модуля – 10 000 м2 с высотой шпалер – 2,1 м. Теплицы светопрозрачные с однослойным ограждением из стекла (рис.1). Для поддержания температурного режима в теплицах используют водяную систему обогрева от собственной котельной. Горячая вода подается в теплицы по трубопроводам и обеспечивает равномерность выделения тепла по всей поверхности теплицы. Снижение температуры воздуха в теплое время года, удаление избытка влаги из теплицы осуществляют с помощью системы естественной форточной вентиляции. Фрамуги (форточки) расположены в кровле и снабжены электрическим приводом для осуществления автоматической регуляции их открытия и закрытия. Кроме этого используют систему испарительного охлаждения – микродисперсное распыление воды на растения с помощью жиклеров (дождевание). 55 Рис.1. Общий вид теплицы 56 Подпитку растений углекислым газом осуществляют с помощью системы подачи в теплицу газа, выделенного из продуктов сгорания природного газа в котельных, работающих для обогрева теплиц. Полив растений осуществляют дождеванием и капельным поливом. Одновременно с поливом растения подпитывают солями минеральных удобрений. Технология выращивания растений: грунтовая и в одном модуле - малообъемная (рис.2 и 3). Теплица укомплектована компьютерным автоматическим контролем для обеспечения необходимых условий микроклимата в пределах агротехнических требований выращивания культуры огурца. 2.2.1.1. Динамика температурных, влажностных, газовых режимов в теплицах в период зимне-весеннего культурооборота Теплицы приравниваются к пищевым предприятиям, поэтому один раз в месяц санэпидемстанция г.Мытищи Московской области делала заборы воздуха и воды на установление соответствия их качества санитарногигиеническим нормам. Лабораторный анализ проб воздуха и воды, взятых в феврале, марте, апреле, мае и июне, не выявил нарушений. Воздух и вода соответствовали санитарно-гигиеническим нормам, предъявляемым к пищевым предприятиям. С февраля до начала марта температура в теплицах днем колебалась в пределах 21-25 0С, а ночью 17-18 0С при относительной влажности воздуха 68,3±4,35 до 76,6±2,56 %. Количество углекислого газа в воздухе находилось на уровне 0,04…0,8 % (Приложение 1). С середины февраля и за 2 недели до окончания первого культурооборота проводили искусственное насыщение воздуха теплиц углекислым газом для повышения урожайности овощных культур. Установлено, что при повышении концентрации СО2 до 0,6 % урожай огурцов возрастает на 72 %. 57 Рис.2. Открытый грунт 58 Рис.3 Микрообъемная технология 59 В конце первой декады марта температура вне теплиц резко понизилась ночью до -20…-25 0С, а днем держалась на уровне -8…-12 0С. Интенсивная активность солнца днем приводила к тому, что несмотря на регулирование температурных режимов, в середине дня она поднималась в теплицах до 2629 0С. Ночью отмечено кратковременное падение температуры до 8-10 0С. Для снижения температуры и перегрева растений в теплицах днем вентиляцию проводили путем автоматического открытия фрамуг и дождевания растений. Последнее привело к тому, что кроме резких перепадов температуры между днем и ночью, к концу марта в теплицах отмечено повышение относительной влажности в среднем на 16 % в сравнении с первой декадой месяца (Приложение 1). За данный период отмечено, что иногда и кратковременно количество углекислого газа в воздухе доходило до 1,5 %. В апреле морозы снизились. Резких перепадов температур в модулях между днем и ночью больше не регистрировали. Разница температур составляла в среднем 25,5 %. Днем, как правило, открывали фрамуги и обильно проводили дождевание растений. Относительная влажность в сравнении с мартом повысилась еще на 5,2 % (Приложение 2). В связи с увеличением зеленой массы растений процентное содержание углекислого газа в воздухе увеличилось в сравнении с мартом на 20,4 %. В мае температура в теплицах повысилась в сравнении с апрелем днем на 4,7 %, ночью на 4,2 %, а относительная влажность на 5,4 %. Процент углекислоты сократился на 33,7 % в сравнении с апрелем из-за снижения зеленой массы растений и продолжительного проветривания теплиц. Анализ результатов температурных, влажностных и газовых режимов показал, что в процессе зимне-весеннего культурооборота огурца имеющиеся технологические системы поддержания микроклимата в теплице в экстремальных условиях не могли поддерживать заданные регламенты. Влияние внешней окружающей среды приводило к сбою управляемости микроклиматом как в случае сильных морозов, так и при увеличении интенсивности солнечной активности. 60 2.2.1.2. Динамика микрофлоры в модулях теплицы в течение зимне-весеннего культурооборота За сутки до выставки пчелиных семей в теплицы (25.01.2006) в модулях теплицы были взяты образцы почвы и проведена оценка морфологокультурального разнообразия микрофлоры. Из выявленных микроорганизмов 75 % приходилось на долю микроорганизмов микозной этиологии (табл.2). Присутствие родов Penicillium, Trichoderma в почвогрунтах положительно влияет на почвенные биоценозы, так как они обладают высокой целлюлолитической активностью. Общеизвестно также, что эти грибы являются важнейшими антагонистами почвенных фитопатогенных микромицетов. Тем не менее, удельный вес указанных родов в грунте был невелик, что свидетельствует о недостаточной интенсивности в них микробиологических процессов. Следует отметить наличие и патогенных видов. Среди выделенных патогенов особое внимание уделено представителю рода Erysiphe, вызывающего у огурцов мучнистую росу. Его удельный вес в комплексе микроорганизмов был наибольшим (29,1 %). Таблица 2. Разнообразие микроорганизмов в почве теплицы СПК «Соревнование» Общее количе- Встречаемость % от общего количества ство, КОЕ, шт. микроорганизмов микроогранизмов 48 Pseudomonas 8,33 Agrobacterium 10,41 Pantoea 6,25 Penicillium 14,7 Aspergilla 6,25 Fusarium 4,17 Erysiphe 29,1 Trichoderma 20,83 61 Наличие в почве в данный период времени указанного патогена свидетельствовало о том, что недостаточно эффективно была произведена пропарка грунта в ликвидационный период после завершения второго культурооборота или произошел занос возбудителя извне. Мучнистая роса тыквенных вызывается двумя микроорганизмами - Erysiphe cichoracearum и Sphaerotheca fuliginea. Они относятся к классу Ascomycetes, подклассу Euascomycetidae, порядку Erysiphales, pp. Erysiphe и Sphaerotheca. Erysiphe cichoracearum DC et Salm. f.cucurbitacearum Pot. Грибница паутинистая, белая, голубоватая или сероватая на обеих сторонах листа. Конидии бочонкообразные или почти цилиндрические, 26-31 х 11-18 мкм, в цепочках. Клейстотеции коричневые, шаровидные, 65-150 мкм в диаметре. Придатки многочисленные, сплетающиеся, бесцветные, затем в массе коричневые, извилистые, длинные (до 200 мкм). Сумки числом по 7-22 в клейстотеции, эллипсоидальные или часто неравнобокие, на коротких ножках, у вершины часто с перехватом или почти усеченные, 55-85 х 22-23 мкм. Споры по 2 в сумке, эллипсоидальные, реже несколько неправильные, 15-25 х 12-16 мкм. Sphaerotheca fuliginea Poll. f.cucurbitacearum Pot. Налет грибницы и конидиальных плодоношений в виде отдельных округлых выпуклых пятен налета, желтовато-коричневого цвета с обеих сторон листа, часто на стеблях и даже на плодах. Клейстотеции 85-100 мкм в диаметре, шаровидные, темно-коричневые. Придатки в небольшом количестве, короткие, бесцветные, обычно слаборазвитые. Сумка 1 в клейстотеции широкояйцевидная, почти шаровидная, 55-70 мкм в диаметре. Аскоспор в сумке 8. Конидии 22,4-28,8 х 12,8-16,0 мкм, в цепочках. В условиях Центрального региона наибольшее распространение имеет вид E.cichoracearum [111]. На формирование фитопатосистемы оказывают влияние температура и влажность. Резкие перепады температур и влажности, начиная со второй декады марта, способствовали проявлению мучнистой росы на растениях в начале третьей декады марта (рис.4). 62 Рис.4. Мучнистая роса на огурцах. Первые единичные очаги мучнистой росы проявились на листьях растений, расположенных около дверей и фрамуг. Начиная с 25.03 до конца мая против мучнистой росы регулярно обрабатывали растения квадрисом. Препарат относится к третьему классу опасности и мало токсичен для пчел. Обработки проводили вечером после окончания лета пчел. Пчелиные семьи изолировали в теплицах согласно ветеринарно-санитарным требованиям. Через 3 часа после обработок пленки с ульев снимали и открывали летки. За указанный период было проведено 12 обработок. Динамика развития болезни приведена в виде графиков на рис.5 (без обработок) и рис.6 (обработка квадрисом). В качестве контроля использовали изолятор площадью 20 м2, отгороженный пленкой. 63 Как показали результаты исследований, болезнь быстро распространилась по изолятору. Всего лишь за месяц (рис.5) она поразила 76 % растений при интенсивности поражения 39 %. Рис.5. Динамика развития мучнистой росы в условиях теплицы. Рис.6. Динамика развития мучнистой росы при обработке квадрисом. 64 Обработки квадрисом замедлили процесс распространения мучнистой росы (рис.6) на 30,9 % и способствовали снижению интенсивности развития болезни в 2,1 раза в сравнении с контролем. Тем не менее, стало очевидным, что ликвидировать болезнь с помощью обработок квадрисом не удалось. Общее поражение растений превышало 50 %. Увеличился процент выпада растений. Поэтому в конце мая пчелиные семьи были вывезены из модулей. С 13 июня теплицу закрыли на карантин и приступили к ликвидационным работам. Представленные данные показали, что экологические условия среды (температура и влажность) влияют на формирование фитопатосистемы в теплице. Технологический уход за растениями определяет уровень распространения мучнистой росы. Распространение и перезаражение растений связано с дождеванием, а также попаданием возбудителя в сок растений, когда обрывают листья и плоды. 2.2.2. Степень воздействия патогенов культуры огурца на резистентность пчелиных семей Для изучения степени воздействия патогенов культуры огурца на резистентность пчелиных семей, работающих в теплицах, нами была проведена оценка морфолого-культурального разнообразия микрофлоры в ульях пчелиных семей в процессе зимне-весеннего культурооборота. В семьях только что поставленных в теплицы (26.01) обнаружены микроорганизмы, присущие пчелиным семьям, из которых два вида являлись патогенными, вызывающими гафниоз и аскосфероз пчел. Третий патоген, Paenibacillus alvei, являлся вторичной инфекцией при европейском гнильце (табл.3). Следовательно, пчелиные семьи поступают в теплицу с патогенами, которые при неблагоприятных воздействиях могут вызвать заболевание пчелиных семей. 65 Таблица 3. Соотношение основных родов микроорганизмов в ульях пчелиных семей в течение зимне-весеннего культурооборота огурца (n = 5) Дата Общее Встречаемость Клинические исследований число микроорганизмов, признаки КОЕ, шт. % от общего количества болезней пчел 1 2 3 4 26.01 26 07.02 38 Paenibacillus alvei 19,2 Hafnia alvei 11,5 Bacterium, прочие 46,2 Ascosphaera apis 23,1 P.alvei 13,2 H.alvei 7,9 Bacterium 36,8 A.apis 15,8 нет нет Erysiphe cichoracearum 18,4 20.02 103 Penicillium 7,9 P.alvei 5,8 H.alvei 2,9 Pseudomonas 5,8 Bacterium прочие 17,6 A.apis 8,7 E.cichoracearum 33,9 Penicillium 20,4 Aspergillus 4,8 нет 66 1 2 03.03 227 14.03 24.03 443 369 3 4 P.alvei 1,3 H.alvei 0,9 Pseudomonas 6,6 Bacterium прочие 18,9 A.apis 19,8 E.cichoracearum 38,0 Penicillium 14,5 P.alvei 1,6 H.alvei 1,4 Pseudomonas 6,7 Bacterium прочие 8,6 A.apis 23,0 E.cichoracearum 51,9 Penicillium 6,8 A.apis 46,6 Клинические при- E.cichoracearum 53,4 знаки аскосфероза Пестрый расплод без клинических признаков поражения Клинические признаки аскосфероза первая степень поражения первая степень поражения 04.04 412 A.apis 59,2 Клинические при- E.cichoracearum 40,8 знаки аскосфероза первая степень поражения 15.04 372 A.apis 69,6 Клинические при- E.cichoracearum 30,4 знаки аскосфероза первая степень поражения 26.04 318 A.apis 73,3 Клинические при- E.cichoracearum 26,7 знаки аскосфероза первая и вторая степени поражения 67 Анализ воздуха из ульев, взятый на 12 сутки опыта, показал, что в ульях стали присутствовать и микроорганизмы растений. К 20.02 видовой состав микроорганизмов возрос вдвое, а количество колониальных единиц – в 4 раза в сравнении с 26.01. Необходимо отметить, что наиболее высокий удельный вес в комплексе микроорганизмов в ульях имел патогенный гриб Erysiphe cichoracearum (33,9 %), который вызывает мучнистую росу у культуры огурца. В 1,5 раза возросло число колоний гриба A.apis и в 2,6 раза повысилось число колоний гриба рода Penicillium в сравнении с предыдущими данными (7.02). Последнее может быть связано с тем, что пчелы, вероятно, приносили их специально в гнездо, так как многие виды этого рода являются продуцентами антибиотически активных веществ, подавляющих развитие фитопатогенных грибов. Клинические обследования пчелиных семей, зоотехнические учеты и динамика продолжительности жизни пчел представлены в таблицах 5, 6 и 7. При облете после постановки пчелиных семей в теплицу в среднем на 8 % произошел отход пчел (08.02). Затем состояние пчелиных семей стабилизировалось. К 20.02 в семьях на 1,5 % увеличилась масса пчел и в 2,2 раза увеличилось количество печатного расплода. Вместе с тем средняя продолжительность жизни пчел за период 08.02-20.02 снизилась в 1,6 раза. Это связано с отходом старых пчел, с возобновлением воспитания расплода и продуцированием маточного молочка для его кормления, а также с преодолением отрицательного воздействия микроклимата теплиц. Несмотря на то, что общий уровень патогенов растений в ульях составил 39,7 % (Pseudomonas и E.cichoracerum, см. табл.3), а также в 1,5 раза возросло число колоний A.apis – патогена пчел, вызывающего аскосфероз, клинических признаков инфекционной болезни расплода пчел не отмечено. Тем не менее, на основании микробиологических исследований можно считать, что произошла активизация патогена пчел грибковой природы. Вывод сделан на основании увеличения в 1,5 раза числа колоний гриба A.apis в пчелиных семьях. 68 К 03.03 разнообразие микроорганизмов осталось почти прежним. Не был зарегистрирован только патоген грибковой природы Aspergillius. Однако общее число колоний возросло еще в 2,2 раза в сравнении с предыдущими данными. Для лучшего подсчета колоний перед разливом в чашки Петри в охлажденную до 40-45 0С среду стали добавлять медицинскую стерильную желчь (15,0 г/л) в качестве ограничения роста грибных колоний. Удельный вес патогенного гриба E.cichoraceаrum оставался самым высоким и вместе с другим опасным для растений патогеном Pseudomonas их процент в общем количестве микроорганизмов ульев составил 44,6 %. Таблица 4. Степень воздействия микроклимата теплиц на пчелиные семьи в течение зимне-весеннего культурооборота огурца (n = 5) Даты зоотехнических учетов 28.01 08.02 20.02 05.03 18.03 31.03 13.04 26.04 0,85± 0,046 0,53± 0,316 16,2± 1,36 8,84± 9,29 Масса пчелиных семей, кг, X±mx 1,5± 0,038 1,38± 0,046 1,45± 0,064 1,55± 0,062 1,20± 0,076 1,15± 0,065 Печатный расплод, кв., X±mx 12,0± 0,44 20,4± 2,08 26,2± 2,24 39,3± 1,84 30,8± 2,00 20,3± 1,96 Поведение патогенов пчел также изменилось. Если представительство P.alvei и H.alvei находилось приблизительно на одном уровне в процессе исследований, то число колоний A.apis продолжало возрастать. В процентном соотношении с другими представителями комплекса микроорганизмов данный показатель увеличился в 2,3 раза, а если считать по количеству выявленных колоний – в 7,5 раза в сравнении с исходными данными на 26.01. Представительство колоний грибов рода Penicillium возросло в 11 раз в сравнении с результатами на 07.02. 69 Появление пестрого расплода и увеличение количества колоний гриба A.apis свидетельствовало о том, что патоген аскосфероза стал активно размножаться. Создались условия для поражения ослабленных личинок грибом A.apis. Однако пчелиные семьи массой 1,55 кг (учет 05.03, табл.4) интенсивно освобождали расплод от больных личинок, не допуская сильного увеличения микозной массы в гнездах. В этих условиях в 1,5 раза возросло количество печатного расплода. Однако продолжительность жизни за период 20.0205.03 сократилась еще на 27,2 % в сравнении с предыдущим показателем (табл.5). Таблица 5. Продолжительность жизни пчел опытных семей пчел в течение зимне-весеннего культурооборота огурца Даты 28.01- 08.02- 20.02- 05.03- 18.03- 31.03- 13.04- учетов 08.02 20.02 05.03 18.03 31.03 13.04 26.04 Дни 106,5 66,1 48,1 31,0 32,3 27,1 21,0 Резкий перепад температуры и относительной влажности между днем и ночью в начале второй декады марта в теплицах потребовали от пчелиных семей дополнительной энергии для стабилизации микроклимата гнезда. Открытие фрамуг привело к потере части летной пчелы. В результате перечисленных отрицательных воздействий произошла дестабилизация пчелиных семей. В среднем сила семей к 18.03 сократилась на 22,6 %, воспроизводство молодых пчел – на 21,6 %, а продолжительность жизни за период 05.03-18.03 снизилась в 1,6 раза. Удельный вес патогенов огурца (14.03, табл.3) в комплексе микроорганизмов ульев повысился еще на 31,4 %, а общее число микроорганизмов в комплексе увеличилось в 2 раза в сравнении с предыдущими данными (03.03). Число колоний A.apis в чашках Петри возросло в 2,3 раза. Все это способствовало тому, что во всех пчелиных семьях были зарегистрированы клинические признаки аскосфероза. 70 Проявление мучнистой росы на культуре огурца было зарегистрировано 23.03. т.е. через неделю после того, как проявились клинические признаки аскосфероза в пчелиных семьях. К лечению болезни приступили 25.03 и проводили регулярные обработки до конца мая. Как отмечалось ранее, препарат квадрис принадлежит к 3-му классу опасности для пчел и является слаботоксичным. Тем не менее, постоянные обработки против мучнистой росы, выпад растений, наличие в большом количестве возбудителя мучнистой росы в теплице, проявление аскосфероза в семьях пчел крайне отрицательно сказалось на состоянии пчелиных семей. Зоотехнические учеты от 31.03; 13.04; 26.04 показали постоянное снижение численности семей, количества расплода и продолжительности жизни пчел. Фактически работоспособными остались две пчелиные семьи из пяти. Остальные погибли. В результате исследований микрофлоры в ульях пчелиных семей в процессе зимне-весеннего культурооборота установлено, что патогены растений свободно попадают в ульи пчелиных семей. При наличии большой массы патогенов растений в теплицах они могут нанести микробный стресс пчелиным семьям, который проявляется в активизации патогенов пчелиных семей аналогичной природы, если те имеются в их гнезде. Выявлена величина экономического порога опасности: 34 % удельного веса патогена растений в комплексе микроорганизмов, находящихся в воздухе улья, от общего числа колониальных единиц равных 100. На основании полученных результатов можно считать, что запуском к началу инфекционных болезней пчелиных семей является накопление патогенов растений в теплицах до уровня, вызывающего снижение резистентности у пчел к собственным патогенам. Отравление пчел в результате химических обработок растений лишь усугубляет эпизоотологический процесс конкретного заболевания. В результате исследований динамики микрофлоры в воздухе ульев пчелиных семей установлено следующее. Пчелиные семьи поступают в теплицы с нарушением зоогигиенических норм, и их микробиологический фон вклю- 71 чает различные патогены пчел. При наличии большой массы патогенов растений в воздухе ульев они наносят микробный стресс пчелиным семьям, который проявляется в активизации патогенов пчелиной семьи аналогичной природы. Выявлена величина экономического порога опасности: 34 % удельного веса патогена растений в комплексе микроорганизмов от числа колониальных единиц больше 100. Дестабилизация условий содержания пчелиных семей на фоне активизации патогена пчел приводит к снижению разистентности пчелиных семей и появлению клинических признаков болезни. Некоторое отравление пчел остатками препарата, который применяла служба защиты против болезни растений, усугубляет эпизоотологический процесс конкретной болезни. 2.2.3. Разработка условий применения Монклавита-1 в качестве дезинфектанта против патогенной грибковой микрофлоры пчел При оценке морфолого-культурального разнообразия микрофлоры растений выявлено, что в теплицах большинство патогенов растений составляли микроорганизмы микозной этиологии. В ульях пчелиных семей, поставленных в модули теплиц для опыления огурцов, также обнаружены микроорганизмы микозной природы, вызывающие аскосфероз пчел. Полученные результаты привели к необходимости поиска современного дезинфектанта широкого спектра действия для надежного обеззараживания ульев и сотов от патогенной микрофлоры с тем, чтобы свести к минимуму вероятность присутствия патогенов в пчелиных семьях при их постановке в теплицы. В последнее время все чаще встречаются публикации об успешном применении отечественного препарата Монклавит-1 в качестве лечебного средства при болезнях различной этиологии животных и птицы, а также в качестве дезинфектанта [125, 131, 173, 174]. 72 Монклавит-1 – йодополимерный ветеринарный препарат относится к новому поколению йодосодержащих антисептиков-дезинфектантов, содержащий йод в форме комплекса N-амида-цикло-сульфопроизводного. По внешнему виду представляет собой полупрозрачную стерильную жидкость темно-желтого или красноватого цвета со слабым специфическим запахом и рН 4,1, пенящуюся при взбалтывании (ТУ 9337-007-462707004-04). Препарат производится ООО «Оргполимерсинтез СПб», Санкт-Петербург. На основании большого количества исследований выявлено, что Монклавит-1 обладает бактерицидной и фунгицидной активностью в отношении грамотрицательных микроорганизмов, патогенных грибов и дрожжей: Escherichia coli, Candida albicans, Malassezia pachydermatis, Aspergillus fumigates, Aspergillus niger, Penicillium granulatum, Trichophyton mentagrophytes, Microsporum canis, Pseudomonas aerusinosa, Proteus vulgaris. Проявляет бактериостатические свойства к грамположительным микроорганизмам родов Staphylococcus и Streptococcus, также Microplazma и другие. Кроме того, оказывает пролонгированное антисептическое, дезинфицирующее, десенсибилизирующее, противоотечное и регенерирующее действие. Препарат не обладает местно-раздражающим действием, токсичностью, аллергенностью, мутагенностью, иммунодепрессивностью, тератогенностью, канцерогенностью [101]. В связи с изложенным цель работы заключалась в изучении возможности применения препарата Монклавит-1 в качестве дезинфектанта против патогенной микозной микрофлоры пчел. Для выполнения поставленной задачи необходимо было решить следующие вопросы: - изучить фунгицидную активность Монклавита-1 в отношении гриба Ascosphaera apis на различных тест-объектах; - разработать режимы дезинфекции Монклавитом-1 пчеловодного инвентаря; 73 - изучить влияние продезинфицированных Монклавитом-1 предметов на пчел. 2.2.3.1. Лабораторные опыты по изучению дезинфицирующих свойств препарата Монклавит-1 Для контаминации тест-объектов использовали свежеприготовленную взвесь гриба Ascosphaera apis, содержащую 200 тыс. спор в 1 мл. Взвесь наносили на тест-объекты из дерева, оцинкованного железа и воска (кусочки сота). Инфицированные тест-объекты подсушивали в течение 30 минут, после чего наносили 1, 3, 5, 7 и 10 %-ные растворы Монклавита-1. Тест-объекты контрольной группы подвергали обработке стерильной водой в тех же условиях. Экспозиции в опытах составляли 2, 4, 6, 12, 24 ч. После окончания экспозиции с тест-объектов путем смыва и соскоба брали пробы и центрифугировали при 3 тыс. об/мин в течение 20 минут. Надосадочную жидкость сливали, а осадок высевали на среду Сабуро и культивировали в термостате при температуре 30-32 0С в течение 12 суток. Оценку качества дезинфекции проводили по наличию или отсутствию роста гриба. Достоверность эксперимента учитывали при получении трех совпадающих результатов. Представленные результаты (табл.6) показали, что препарат Монклавит1 обеззараживает деревянные, металлические и восковые тест-объекты от Ascosphaera apis при концентрации 5 %. Причем деревянные и восковые тестобъекты обеззараживались при экспозиции 12 ч, а металлические – 24 ч. Перед испытанием дезинфектанта мы изучали характер распределения аэрозоля при помощи баллона «Росинка» объемом 1,5 л на стенках, дне улья, в ячейках сотов, металлическом инвентаре. Длина факела аэрозоля достигала 25,0+3 см, что позволяло обрабатывать и внутреннюю поверхность безразборных ульев (лежаки, Дадан). 74 Таблица 6. Степень обеззараживания тест-объектов препаратом Монклавит-1 (n = 20) Тест-объект Концентрация, Количество Экспозиция (ч) % тестов 2 4 6 12 24 1 20 0 0 0 0 3 3 20 0 2 4 4 12 5 20 1 5 12 20 20 7 20 4 10 15 20 20 10 20 5 10 19 20 20 контроль 5 0 0 0 0 0 Оцинкованное 1 20 0 0 0 0 0 железо 3 20 0 1 5 6 6 5 20 0 4 7 15 20 7 20 3 5 12 18 20 10 20 7 10 17 20 20 контроль 5 0 0 0 0 0 1 20 0 0 0 0 4 3 20 0 5 8 10 12 5 20 0 7 16 20 20 7 20 0 9 18 20 20 10 20 0 17 20 20 20 контроль 5 0 0 0 0 0 Дерево Соты В ходе опытов установлено, что для оптимального равномерного покрытия окрашенным аэрозолем требуется 500+10 мл на 12-рамочный улей, 1200+15 мл – на многокорпусный (4 корпуса). Полученные результаты позволили рассчитать необходимое количество дезраствора в зависимости от 75 типа ульев, их площади и объема внутреннего пространства (табл.7).При разработке режимов дезинфекции сотов использовали традиционный способ дезинфекции, когда заполняют раствором дезинфектанта каждую ячейку. В этом случае на 1 сотовую рамку требуется 1 л дезраствора. Кроме того, применяли метод опрыскивания, когда с помощью окрашенного раствора, чтобы правильно рассчитать объем дезинфектанта, опрыскивали внутренние стенки ячеек до равномерного нанесения дезраствора. Установлено, что обеззараживание происходит при аэрозольной обработке с обеих сторон с расстояния 25-30 см с расходом на гнездовую рамку (435х300 мм) по 200-250 мл, на магазинную – 100-125 мл. Таблица 7. Площадь и объем опытных ульев Тип улья Площадь внутреннего Объем внутреннего пространства (м2) пространства (м3) 1,8 0,17 Лежак (24 рамки) 1,4 0,13 Дадан 12-рамочный 0,8 0,07 Магазинная надставка с 1,0 0,09 Многокорпусный (4 корпуса) 12-рамочным ульем После обработки сотовые рамки помещали в продезинфицированные ульи, заполняя весь объем, накрывали крышками, закрывали летки и выдерживали заданную экспозицию. Разницы в эффективности полностью заполненных раствором Монклавита-1 сотов и сотов, подвергшихся только опрыскиванию, не установлено. Это позволило рекомендовать метод опрыскивания из мелкодисперсного распылителя для дезинфекции сотов с помощью дезинфектанта Монклавит-1. Оптимальные режимы обобщены и представлены в таблице 8. 76 Таблица 8. Эффективные режимы дезинфекции ульев и сотов Монклавитом-1 при аскосферозе пчел Расход дезраствора, мл Улей Соты (на 1 шт.) 12-рамоч- 12-рамоч- лежак многокор- ный ный с (24 рамки) пусный 1000 1200 гнездовые магазинные 250 125 надставкой 500 750 Согласно полученным данным, оптимальная концентрация дезинфектанта составила 5 %, а экспозиция как для ульев, так и сотовых рамок – 12 ч, для металлических изделий – 24 ч. Анализ полученных результатов по изучению дезинфицирующей активности Монклавита-1 показал, что данный препарат надежно обеззараживает пчеловодный инвентарь от возбудителя аскосфероза пчел и может быть применен в качестве дезинфектанта. 2.2.3.2. Продолжительность жизни пчел в садках после их обеззараживания препаратом Монклавит-1 Полученные положительные результаты применения Монклавита-1 в качестве дезинфектанта пчеловодного инвентаря против возбудителя аскосфероза пчел привели к необходимости выяснить степень его влияния на пчел. С этой целью были поставлены опыты по изучению продолжительности жизни пчел в садках после их дезинфекции Монклавитом-1. 77 Для постановки опытов было подготовлено 6 энтомологических садков, которые поместили внутри улья и обработали Монклавитом-1 по разработанному режиму. По истечении экспозиции дезинфекции садки извлекли, высушили на открытом воздухе, три садка просто проветрили и высушили, а три других сначала промыли водой, а затем просушили. После этого в каждый садок поместили по 50 одновозрастных (1-2 суток) пчел. Параллельно в 3 садках, не подвергшихся дезинфекции, содержали контрольных пчел, отобранных из тех же семей. На протяжении всего эксперимента пчелам давали сахарный сироп, приготовленный 1:1. Садки с опытными и контрольной группами были помещены в термостат при температуре 30 0С и относительной влажности 70-75 %. Состояние и поведение пчел, их активность, количество погибших особей учитывали в течение периода, когда в садке оставалась половина пчел, первоначально отобранных для опыта, и сравнивали с показателями контрольной группы. Среднюю продолжительность жизни вычисляли по формуле: Пж = (а1+ а2 + а3 + ……… аn) / Н, где Пж – продолжительность жизни пчел; а1+ а2 + а3 + ……… аn – количество живых пчел, после 1, 2, 3, 4 и т.д. суток; Н – количество первоначально взятых пчел. Результаты исследований, представленные в таблице 11, показали, что обработка садков препаратом Монклавит-1 с последующим проветриванием и промыванием не оказывала отрицательного влияния на поведение и продолжительность жизни пчел. Обработка садков даже без последующего промывания не привела к снижению уровня продолжительности жизни опытных пчел, которая оставалась во всех опытах 32+1,3 суток (табл.9). 78 Таблица 9. Влияние продезинфицированных препаратом Монклавит-1 энтомологических садков на продолжительность жизни пчел Препарат Количество пчел, Продолжительность жизни пчел шт. (суток) без промывания с промыванием Монклавит-1 300 32,0±1,30 32,0±1,30 Контроль 150 32,0±1,11 32,0±1,1 На основании результатов лабораторных и пасечных исследований можно сделать следующие выводы. Монклавит-1 обладает фунгицидной и фунгистатической активно- стью в отношении грибов рода Ascosphaera. 5 %-ный раствор Монклавита-1 применяется методом опрыскивания из мелкодисперсного распылителя в дозе 0,5 л на улей типа Дадана-Блатта, 1 л на улей-лежак, 1,2 л на многокорпусный улей (4-корпусный), 0,25 л на стандартную (435х300 мм) корпусную и 0,125 л на магазинную (435х145 мм) сотовые рамки при экспозиции 12 часов. Металлический инвентарь обеззараживается 5 %-ным раствором Монклавита-1 с экспозицией 24 часа. Монклавит-1 при разработанной схеме применения не оказывает отрицательного воздействия на взрослых пчел. 79 2.2.3.3. Производственные испытания Монклавита-1 в качестве дезинфектанта при микозной инфекции пчел Положительные результаты лабораторных и пасечных опытов позволили провести испытания разработанного режима дезинфекции в производственных условиях. Необходимо было: установить степень эффективности обеззараживания контаминированного грибом Ascosphaera apis пчеловодного инвентаря препаратом Монклавитом-1 при аскосферозе пчел; изучить влияние продезинфицированных объектов на пчел, маток и выращивание расплода. Испытания проведены на производственной пасеке СПК «Соревнование» Мытищинского района Московской области. На пасеке от больных и подозреваемых в заражении аскосферозом пчелиных семей взяты смывы с внутренних поверхностей ульев и сотовых рамок. В 56 пчелиных семьях была выделена и идентифицирована культура гриба Ascosphaera apis. Семьи были пересажены в чистые ульи. Соты с пораженным расплодом были сожжены. Из кормовых рамок был откачен мед. Эти соты и освободившиеся ульи от больных семей подлежали дезинфекции Монклавитом-1. Перед дезинфекцией ульи и планки рамок сотов подвергали тщательной механической очистке, а затем обрабатывали 5 %-ным раствором Монклавита-1 методом опрыскивания из садового распылителя АО-1 при давлении 4 атм из расчета 500 мл на улей типа Дадана и 250 мл на магазинную надставку с предварительным разбором комплектующих деталей ульев, если они были разборными. Дезраствор наносили на стенки, донья, подкрышники и внутренние стенки крышки ульев с расстояния 30-35 см от распылительной го- 80 ловки. Затем, если ульи были разборными, их собирали и закрывали летки задвижками. На сотовые рамки, установленные на металлических поддонах, препарат наносили с расстояния 25-30 см сначала с одной, затем с другой стороны, расходуя на каждую сотовую рамку по 250 мл дезинфектанта. Затем сотовые рамки ставили в обработанные ульи, закрывали крышками и выдерживали 12 ч. Контрольные ульи и соты были обработаны стерильной дистиллированной водой. Через 12 ч ульи и соты проветривали и делали смывы с их поверхностей. При лабораторных исследованиях смывов возбудителей аскосфероза пчел в опытных ульях и сотах не выявлено. В смывах с контрольных ульев и сотов отмечен рост возбудителя. После взятия смывов одну часть обеззараженных ульев и сотов промывали водой из расчета 1 л на один улей и 1 л на одну сотовую рамку. Другую часть использовали без промывания. Воду из ячеек удаляли путем центрифугирования в медогонках. После чего их просушивали в течение 24-48 ч. В продезинфицированные и просушенные ульи и сотовые рамки перегоняли пчелиные семьи, подобранные по принципу аналогов по массе пчел, возрасту маток, числу сотов, типу улья, с одинаковыми условиями медосбора. Опыты сопровождались контрольными группами. Одна группа – здоровые семьи. Их помещали в чистые, продезинфицированные ульи и соты, другая группа – семьи, пораженные аскосферозом, заселяли в непродезинфицированные ульи. В общей сложности в опыте было занято 5 групп по 14 пчелиных семей в каждой. 1 и 2-я группы – больные семьи, которые перегнали в чистые, продезинфицированные, промытые водой ульи и соты; 3-я группа – больные семьи перегнали в чистые, продезинфицированные ульи и соты без промывания; 4-я группа – больные семьи перегнали в чистые, без дезинфекции ульи и соты; 5-я группа - здоровые семьи перегнали в чистые, продезинфицированные ульи и соты. 81 Семьи 1 и 2-й групп отличались друг от друга тем, что семьи 1-й группы далее лечили нистатином, а семьи 2-й группы не лечили. 3-ю и 4-ю также группы лечили нистатином. Препарат нистатин вводили в гнездо методом скармливания. Лечебный сироп готовили в день применения из расчета 1 млн. ЕД нистатина на 1 л сахарного сиропа. Скармливали из расчета 100-150 мл лечебного сиропа на одну улочку пчел четырехкратно через каждые 5 суток. В опыте были семьи массой 1,25-1,5 кг. Учет количества расплода при помощи рамки-сетки стали проводить через 12 суток после начала опыта. Всего проведено четыре учета через каждые 12 суток. Кроме того, исследовали качество засева и время, когда матки приступили к яйцекладке. Результаты исследований показали, что после перегона семей в другие ульи матки сразу приступили к яйцекладке во всех опытных группах. Пчелы не проявляли беспокойства. Мертвых пчел, выброшенного расплода не установлено. Таблица 10. Влияние продезинфицированных ульев и сотов на выращивание расплода (n = 14) № Количество печатного расплода, кв. группы Даты учета 14.05 26.05 07.06 19.06 1 14,4±5,28 52,6±4,88 106,2±22,76 128,8±20,42 2 11,4±3,12 36,4±5,16 74,5±17,22 71,4±12,06 3 12,6±3,12 58,6±12,14 99,4±16,26 130,2±26,84 4 13,0±2,32 68,4±10,66 81,2±12,08 96,2±10,24 5 22,4±5,16* 82,8±12,33* 158,5±22,62** 242,9±26,88** */Достоверно выше по сравнению с контролем при Р>0,95 **/ при Р>0,99 ***/ при Р>0,999 Результаты исследований, представленные в таблице 10, показали, что количество расплода в 1-й и 3-й группах было приблизительно одинаковым. Выброшенных мертвых пчел, расплода, выкучивания пчел из ульев указан- 82 ных групп не отмечено. Следовательно, последующее промывание водой после дезинфекции ульев и сотов Монклавитом-1 влияния не имеет и оно излишне. Установлено, что перегон пчелиных семей на чистые, продезинфицированные ульи и соты недостаточен для выздоровления семей, пораженных аскосферозом. Уже через месяц после перегона (07.06) в пчелиных семьях 2-й группы появились клинические признаки поражения расплода грибом Ascosphaera apis. В семьях отмечены клинические признаки первой степени поражения расплода и только в одной семье зарегистрирована вторая степень поражения. В семьях 4-й группы также через месяц появились единичные мумифицированные личинки. Это свидетельствует о том, что лечение пчелиных семей без дезинфекции ульев и сотов не освобождает полностью пчелиные семьи от аскосфероза. Количество печатного расплода за все время опыта в 4-й группе было выращено в среднем на 14,1 % меньше, чем в семьях, пересаженных в продезинфицированные ульи и соты (1-я и 3-я группы). Микологические исследования смывов с внутренних стенок ульев и сотов 1-й и 3-й групп показали отсутствие роста возбудителя аскосфероза. Лучше всего в течение опыта развивались контрольные здоровые семьи. Количество выращенного расплода было в 1,6 раза больше в сравнении с 1-й и 3-й группами, успешно освободившимися от аскосфероза в первой декаде июня. Посевы со смывов с внутренних стенок ульев и сотов (01.06) у данных групп дали отрицательные результаты. На основании результатов лабораторных, пасечных и производственных испытаний Монклавита-1 в качестве дезинфектанта при микозной инфекции пчел можно сделать следующие выводы. Разработан метод дезинфекции ульев и сотов 5 %-ным раствором Монклавита-1 методом опрыскивания из мелколдисперсного распылителя при расходе 500 мл раствора на один 12-рамочный улей (0,8 м2), 250 мл на одну стандартную гнездовую (435х300 мм) и 125 мл на одну магазинную 83 (435х145 мм) сотовые рамки с экспозицией 12 часов. После окончания экспозиции сотовые рамки, ульи высушивают и используют по назначению без промывания. Условия применения Монклавита-1 100 % обеззараживают контаминированные возбудителем аскосфероза ульи, соты и пчеловодный инвентарь. Использование продезинфицированных ульев и сотов без последующего промывания водой не оказывает отрицательного влияния на поведение пчел, яйцекладущую способность маток, выращивание расплода и продолжительность жизни пчел. 2.2.4. Возможность применения препарата ТАНГ для стабилизации жизнедеятельности пчелиных семей в условиях защищенного грунта В животноводстве повышение защитно-приспособительных механизмов организма осуществляют с помощью иммунокорректоров. Они представляют собой большую группу веществ гетерогенных по природе, свойствам, конкретно получаемому эффекту и механизму действия [52, 66, 74, 115, 126, 161]. Анализ литературных данных по уровню эффективности и характеру воздействия остановил наше внимание на пробиотическом препарате БИОД5 (рабочая версия для пчел – ТАНГ) на основе бактерий рода Bacillus. У пробиотиков на основе бактерий рода Bacillus выявлены иммуномодулирующие, антиаллергические, антитоксические, антирадиационные свойства. Препарат обладает антибактериальной, антимикозной и антивирусной активностью. Установлена высокая ферментативная активность, что положительно воздействует на регулирование и стимулирование пищеварения. Способствует лучшему усвоению кормов и увеличивает приросты животных [110, 115, 136, 144, 148, 161]. В пчеловодстве препарат ТАНГ впервые применен против энтеробактериальных инфекций и европейского гнильца [92-94]. 84 Действующим веществом препарата является смесь бактерий Bacilla subtilis ТПИ 13 и Bacilla licheniformis ТПИ 11 в соотношении 3:1. Разработаны препаративные формы БИОД-5 в виде порошка, таблеток, растворов. Для пчеловодства более эффективен препарат в форме порошка и таблеток. Хорошие результаты, полученные при лечении бактериальных болезней расплода и взрослых пчел, а также резкое улучшение состояния пчелиных семей после скармливания им пробиотика позволили нам испытать ТАНГ для стабилизации жизнедеятельности пчелиных семей в условиях защищенного грунта. 2.2.4.1. Разработка условий применения ТАНГА в условиях защищенного грунта Для поставленных целей сформировано 4 опытных группы по 5 пчелиных семей-аналогов в каждой. В своих исследованиях мы пользовались порошком, который состоит из смеси бактерий с наполнителем. В 1 г порошка 2,5х1010 микробных клеток (м.к.). В первой группе пчелиные семьи получали инвертированный сахарный сироп в дозе 200 мл, который был обогащен 1х109 м.к. бактерий, во второй – 2х109 м.к., третьей – 3х109 м.к., четвертая группа служила контролем. Ей скармливали только инвертированный сахарный сироп. Результаты исследований показали, что уже на следующий день после подкормки отмечено повышение активности пчел во всех группах, получающих препарат ТАНГ. Матки работали, как и прежде, не прекращая яйцекладку. Через 1,5 месяца после начала опыта (18.04) масса пчелиных семей в контрольной группе снизилась на 42 % (табл.11). В первой группе снижение произошло на 21,7 %, то есть в 1,9 раза меньше в сравнении с контролем. Во второй группе масса пчелиных семей в сравнении с исходной сократилась лишь на 6,5, в третьей – на 5,6 %. Это стало возможным за счет стабильного выращивания расплода в семьях, получающих подкормки с препаратом 85 ТАНГ (табл.11). В первой группе для получения указанного эффекта пчелы затрачивали больше усилий в сравнении со второй и третьей группами. Таблица 11. Влияние препарата ТАНГ различной концентрации на состояние пчелиных семей в условиях защищенного грунта (n = 5) № Доза, груп м.к. Даты учетов 01.03 12.03 24.03 06.04 18.04 30.04 12.05 пы Масса пчелиных семей, кг 1 1х109 2 2х109 3 3х109 контр - 1 1х109 2 2х109 3 3х109 контр - 1,38±0,06 1,25±0,08 1,25±0,10 1,20±0,14 1,08±0,26 0,80±0,27 1,40± 0,07 1,43± 0,05 1,38± 0,06 33,3± 1,94 42,1± 2,06 39,2± 2,16 39,1± 1,88 1,43± 1,38± 1,40± 1,31± 0,10 0,12 0,09** 0,01** 1,38± 1,38± 1,50± 1,35± 0,07 0,09 0,12** 0,10** 1,33± 1,20± 1,05± 0,80± 0,09 0,02 0,03 0,14 Количество печатного расплода, кв. 40,2± 38,4± 39,4± 23,2± 2,14* 4,28* 3,88** 4,12 37,4± 34,5± 42,7± 36,5± 3,14 3,92 4,28** 4,64 41,2± 34,1± 36,2± 32,0± 2,76* 3,24 2,98* 3,23 30,9± 27,3± 20,2± 22,0± 2,14 2,36 3,67 4,12 0,63±0,26 1,13± 0,13 1,20± 0,30 0,60± 0,10 0,9± 0,30 1,03± 0,06** 0,45± 0,12 22,8± 3,44 28,5± 1,85* 33,2± 4,32* 18,0± 2,88 17,8± 5,36 19,0± 2,88 29,5± 4,33** 12,4± 2,36 */Достоверно выше по сравнению с контролем при Р>0,95 **/ при Р>0,99 ***/ при Р>0,999 Вывод сделан на основании результатов продолжительности жизни пчел (табл.12). Данный показатель в период 06.04-18.04 у семей первой группы сократился на 22,5, во второй – на 15,2, в третьей – на 9,1 % от первоначального уровня. В контрольной группе снижение было наибольшим и составило 27,3 %. Снижение продолжительности жизни пчел у всех пчелиных семей, занятых в опыте, связано с несколькими причинами. Гибели пчел способствовали 86 лечебные обработки культуры огурца против прикорневой гнили. Кроме того, с конца марта пчелы стали вылетать из теплиц на волю. Для их лучшей сохранности предварительно были сделаны форточки, чтобы пчелы привыкли заранее к местам вылета, а не зависели от фрамуг, которые автоматически открывались и закрывались, ориентируясь на создание оптимальных температур для выращивания огурцов. Тем не менее, при вылетах часть пчел терялась, особенно если источник медосбора находился за сильно эксплуатирующимся Ярославским шоссе, находящимся рядом с теплицами. Имели место блуждания пчел и их гибель от переохлаждения. Таблица 12. Влияние препарата ТАНГ различной концентрации на продолжительность жизни пчел (n = 5) № Доза, группы м.к. Продолжительность жизни, дни 01.03- 12.03- 24.03- 06.04- 18.04- 30.04- 12.03 24.03 06.04 18.04 30.04 12.05 1 1х109 36,0 37,3 34,6 27,9 27,5 24,0 2 2х109 37,6 40,0 44,5 31,9 28,8 26,4 3 3х109 38,6 40,0 54,4 35,1 31,4 28,4 контр. - 37,4 36,6 34,0 27,2 22,8 21,1 20 апреля была изучена летно-опылительная деятельность всех опытных групп пчелиных семей. Было выявлено, что в первой группе в опылении культуры огурца участвовало 3, во второй и третьей – по 4, в четвертой – 2 пчелиных семьи. Остальные по состоянию своей силы и продолжительности жизни пчел в опылении культуры огурца участия не принимали. К концу опыта (через 2,5 месяца) масса пчелиных семей в контроле снизилась на 67,4 % (табл.11). Это на 19,3 % больше в сравнении с первой и в 1,8 и 2,4 раза больше в сравнении со второй и третьей группами, соответственно. 87 Количество выращенного расплода за этот же срок в контроле составило 17000 ячеек. В первой группе их было на 26,5, во второй – на 41,6, в третьей – на 44,4 % больше в сравнении с контролем (табл.6). Самая низкая продолжительность жизни пчел к концу опыта отмечена в контроле (4 группа). Она составила 21,1 дня. Это на 13,7 % меньше, чем в первой, на 25,1 и 34,5 % меньше, соответственно, чем во второй и третьей группах (табл.12). К концу опыта в первой группе в живых осталось 60, во второй и третьей – по 80, в четвертой – 20 % семей от первоначального количества. Результаты опытов свидетельствуют о целесообразности применения пробиотика ТАНГ в качестве корректора жизнедеятельности пчелиных семей в диапазоне концентраций 2-3х109 микробных клеток для пчелиных семей, опыляющих огурцы в условиях защищенного грунта. 2.2.4.2. Производственные испытания препарата ТАНГ в качестве корректора жизнедеятельности пчелиных семей, опыляющих культуру огурца в условиях защищенного грунта Положительные экспериментальные опыты позволили нам испытать разработанную схему применения препарата ТАНГ в производственных условиях тепличного хозяйства СПК «Соревнование». Схема алиментарного применения препарата ТАНГ апробирована в зимне-весеннем культурообороте огурца «Эстафета» на фоне стандартного ухода за пчелиными семьями. Было сформировано 2 группы: опытная состояла из 18. контрольная – 6 пчелиных семей, подобранных по принципу аналогов: приблизительно одной массы, кормовой обеспеченности, матками-полетками. Семьям опытной группы с марта скармливали ТАНГ четырехкратно через каждые 2-3 суток в дозе 3х109 м.к. на одну пчелиную семью, разведенных в 200 мл инвертированного сахарного сиропа. Курс подкормок повторяли через каждый месяц 88 до конца культурооборота. Семьям контрольной группы в эти же сроки скармливали по 200 мл инвертированного сиропа на семью без препарата (табл.13). Таблица 13. Схема производственных испытаний Группа Количество Масса пчелиных Обработка пчелиных семей семей, кг пчелиных семей 1,43±0,053 Инвертированный в группе, шт. Контрольная 6 сахарный сироп по 200 мл на одну пчелиную семью по схеме опыта Опытная 18 1,42±0,072 ТАНГ в дозе 3х109 м.к. в 200 мл инвертированного сиропа на одну пчелиную семью четырехкратно с экспозицией 2-3 суток. Повтор через каждый месяц В результате испытаний отмечена стабилизация в снижении гибели пчел в опытных семьях. Сила семей к завершению культурооборота снизилась на 22,5 % (табл.14). Это в 2,8 раза меньше в сравнении с контролем. Причиной служили подкормки ТАНГом, в результате чего стало возможным с начала апреля вылетать большему числу пчел из теплиц и приносить свежие нектар и пыльцу, поскольку в опытных семьях полевых пчел было значительно 89 больше, чем в контрольных. Это наглядно прослеживается по результатам показателя продолжительности жизни (табл.15). Таблица 14. Степень стабилизационной эффективности применения препарата ТАНГ на пчелиные семьи в производственных условиях Группа Даты учетов 03.03 16.03 29.03 11.04 24.04 07.05 20.05 02.06 Масса пчелиных семей, кг Опыт Контроль 1,42± 1,25± 1,43± 1,42± 1,35± 1,25± 1,05± 1,1± 0,072 0,082 0,124 0,152 0,014 0,112 0,210 0,260 1,43± 1,25± 1,20± 1,10± 0,75± 0,70± 0,65± 0,50± 0,053 0,080 0,036 0,167 0,100 0,061 0,10 0,167 Количество печатного расплода, кв. Опыт Контроль 40,14± 32,0± 52,0± 48,5± 42,5± 30,8± 41,3± 28,8± 2,16 3,23 4,64 2,06 4,28 3,42 4,33 5,36 36,2 42,8± 38,4± 36,0± 30,0± 30,0± 26,0± 6,3± 4,26 2,36 3,44 4,12 2,10 0,43 1,57 4,57 В начале опыта продолжительность жизни пчел в опытной группе была на 6,3 % ниже в сравнении с контролем. К апрелю данный показатель в опытных семьях уже на 10,1 % превосходил контрольные, в начале мая – на 17,1 %, а к концу опыта – на 32,5 %. Практические полевых пчел в контрольных семьях, начиная с середины апреля, почти не было. Таблица 15. Продолжительность жизни пчел (дни) в производственных испытаниях препарата ТАНГ во время зимне-весеннего культурооборота Группа Даты учетов 03.03- 16.03- 29.03- 11.04- 24.04- 07.05- 20.05- 16.03 29.03 11.04 24.04 07.05 20.05 02.06 90 Опыт 30,0 30,0 32,7 32,1 31,0 29,5 27,4 Контроль 32,0 31,3 29,7 21,6 25,7 24,0 18,5 Тем не менее, во второй половине мая сила семей в опытной группе в некоторых семьях сократилась. Клинические обследования пчелиных семей в процессе зимне-весеннего культурооборота показали, что в третьей декаде апреля в опытных семьях появился аскосфероз. В 22,2 % пчелиных семей была зарегистрирована I степень поражения расплода. В третьей декаде мая пораженных аскосферозом семей стало 38,9 % от общего количества семей опытной группы. Данное количество пораженных семей регистрировали до конца культурооборота (Приложение 3). В контрольной группе аскосфероз зарегистрировали с третьей декады марта в 66,7 % пчелиных семей с I степенью поражения. С третьей декады апреля пораженных семей стало в общей сложности 83,3 % с первой, второй и третьей степенью поражения. В первой декаде мая все семьи контрольной группы были поражены аскосферозом. Болезнь в семьях прогрессировала и с третьей декады мая более половины пчелиных семей в группе имели третью степень поражения. Сравнивая результаты двух групп, можно с уверенностью констатировать, что применение препарата ТАНГ сдерживало развитие аскосфероза и способствовало тому, что в опытной группе пчелиные семьи болели в легкой форме. 91 20 мая была изучена летно-опылительная деятельность пчел, в результате которой установлено, что из общего количества опытных семей на опылении работало 61,1 %. У остальных пчелы выполняли только внутриульевые работы. В контроле в опылении принимало участие к этому времени 33,3 % семей. (Приложение 4) За время производственного испытания пчелами было выращено в контрольных семьях в среднем 22770 ячеек расплода, а в опытных – 31600, то есть на 38,8 % больше, чем в контроле (табл.14). Представленные данные свидетельствуют о том, что стабилизационная эффективность препарата оказала свое положительное воздействие на воспроизводительную функцию маток и физиологическое состояние пчел, позволившее им вырастить такое количество потомства. 2.2.4.2.1. Экономическая эффективность от применения препарата ТАНГ Затраты: 1. На одну пчелиную семью за одну декаду (3 мес) требуется 145 мг ТАНГА (доза 0,012 г на 1 п/с х 4 = 0,048 г – на 1 курс в месяц, а за 3 месяца – 0,048 г х 3 = 0,144 г). Затраты ТАНГА для опытной группы: 18 п/с х 0,144 г = 2,6 г Стоимость 1 г ТАНГА составляет 35 руб. Стоимость затраченного препарата: 2,6 г х 35 руб. = 91 руб. 2. Препарат ТАНГ вводили в гнездо с помощью инвертированного сахарного сиропа; дозу препарата растворяли в 200 мл и наливали в кормушку каждой семье. Одной семье за одну декаду требуется 2,5 л сахарного сиропа, а следовательно, 1,25 кг сахара. Стоимость 1 кг сахара составляет 25 руб. Затраты на сахарный сироп для опытной группы составили: 18 п/с х 1,25 кг = 22,5 кг сахара 92 Стоимость сахара для опытной группы составила: 22,5 кг х 25 руб. = 562,5 руб. Для инвертирования сахарного сиропа требуется пчелит. 1 г пчелита стоит 10 руб. 1 г пчелита инвертирует 5 л сахарного сиропа. На инвертирование 45 л сахарного сиропа требуется 9 г пчелита. Стоимость затраченного пчелита: 9 г х 10 руб. = 90 руб. 3. На обслуживание пчелиных семей пчеловодом (подготовка препаратов, сахарного сиропа, его инвертирование, раздача активированной подкормки пчелиным семьям) за одну декаду затрачено 51 ч. Один час работы пчеловода стоит: 8000 руб. : 22 дня = 363,6 руб./день; 44,6 руб./час 44,6 руб. х 51 ч = 2274,6 руб. Итого затрат: 91 руб. + 562,5 руб. + 90 руб. + 2274,6 руб. = 3018,1 руб. Чистый доход складывается из прибыли от сохранности работоспособных пчелиных семей за вычетом затрат на препараты и обслуживание. Семья массой 1,4-1,5 кг стоит 4300 руб. Стоимость 18 пчелиных семей опытной группы составила: 4300 руб. х 18 п/с = 77400 руб. Прибыль от применения препарата ТАНГ в сравнении с контролем составила 27,8 % (Приложение 3). В денежном выражении это равно: 77400 руб. 27,8%. 21517,2 руб. 100% Чистый доход от опытной группы из 18 пчелиных семей составил: 21517,2 руб. – 3018,1 руб. = 18499,1 руб. Чистый доход от применения препарата ТАНГ из расчета на каждые 10 пчелиных семей составляет 10290,2 руб.: 11954 руб. – (52,5 руб. + 312,5 руб. + 50 руб. + 1248,8 руб.) = 10290,2 руб. 93 Таким образом, результаты производственных испытаний позволяют утверждать, что применение пробиотика ТАНГ в экстремальных условиях теплиц стабилизирует ситуацию по массе пчелиных семей, сдерживает гибель пчел, способствует воспроизведению потомства, продлевает жизнь и работоспособность пчелиным семьям на опылении растений и экономически оправдано. (Приложение 5) 94 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ Одной из основных культур, выращиваемых в условиях защищенного грунта, являются огурцы. Самым эффективным агрохимическим приемом, повышающим урожай этой культуры, является насыщенное опыление медоносными пчелами. Именно перекрестное опыление растений пчелами дает хорошие вкусовые качества продукции и товарный вид, что поднимает конкурентоспособность продукции защищенного грунта на рынке спроса. В настоящее время в нашей стране на человека в год приходится 4,6 кг огурцов при норме 13 кг, то есть существует совершенно очевидная возможность увеличения производства тепличных овощей. В условиях рынка необходимым условием выживания отечественных агропромышленных компаний является повышение урожайности тепличных овощей с одновременным снижением их себестоимости. Достижение данных целей складывается из различных факторов, одним из которых является повышение эффективности эксплуатации пчелиных семей путем оптимизации санитарно-гигиенического режима их содержания. Из-за отсутствия автоматического контроля за показателями микроклимата в теплицах площадью 500-1000 м2, где в подавляющем большинстве случаев выполнялись работы по разработке технологии кормления и содержания пчелиных семей, опыляющих сельскохозяйственные культуры, пользовались приблизительными и фрагментарными данными. Только в единичных публикациях приведены конкретные цифровые показатели. Так, И.Н.Мадебейкин [83] сообщает о случаях понижения температуры воздуха в ночное время до 10 0С, Н.Д.Машинская [98] указывает, что в остекленных теплицах Сибири на 1000 м2 в весенне-летний период с 14 часов температура поднимается до 37-40 0С, а если закрыть двери – до 50 0С. М.Ф.Шеметков, Пученя [179], Н.Н.Зарецкий [46] отмечают, что при искусственном пополнении воздуха углекислым газом его содержание кратковременно может достичь 1 %. Однако все приведенные данные не дают полного представления о микроклимате в течение всего культурооборота. 95 Современные теплицы на 10000-20000 м2 полезной площади, с комплексом автоматического регулирования основных параметров жизнеобеспечения растений и микроклимата модулей теплиц радикально отличаются от теплиц на 500 и 1000 м2. В этих условиях создание оптимальных технологий содержания пчелиных семей в теплице должно основываться на количественных данных экологических факторов внутри и вне теплиц, взаимно согласованных с агроклиматическим и мелиоративным потенциалом угодий для того или иного растения. Следует подчеркнуть, что факторы внешней среды играют определяющую роль в жизнедеятельности организма, поскольку из нее он получает кислород и питательные вещества. Несоблюдение параметров микроклимата, предусмотренных в зоогигиене, оказывает негативное влияние на естественную резистентность организма, в частности, пчелиных семей. Для достижения оптимизации санитарно-гигиенического режима пчелиных семей в условиях теплиц необходимо знать особенности микроклимата в течение всего культурооборота. Изучение динамики температурных, влажностных, газовых режимов в теплицах в период зимне-весеннего культурооборота выявило слабое звено в технологической системе поддержания микроклимата теплиц. Если содержание углекислого газа в процессе всего культурооборота соответствовало в среднем уровню, необходимому для высокой урожайности культуры огурца, то динамика температурных и влажностных режимов была далека от агротехнических требований. Как показали результаты исследований, внешние климатические условия при резком снижении или повышении температуры приводили к сбою управляемости перечисленными показателями внутри теплиц. В результате перепад температур между днем и ночью со второй декады марта стал составлять 14,8 0С. В апреле он сократился, однако средние дневные температуры в апреле на 16, а в начале мая на 21 % были выше оптимальных и не соответствовали технологическим условиям выращивания огурцов. 96 Экстремальные температурные режимы пытались стабилизировать вентиляцией модулей теплиц путем открытия фрамуг и дождевания растений. В результате относительная влажность повысилась со второй декады марта в сравнении с технологическим регламентом выращивания огурцов сначала на 5,3, а к концу месяца на 22,2 %. В апреле данный показатель снизился за счет выровнявшихся внешних климатических условий, а затем вновь стал повышаться и к концу мая увеличился на 30 % в сравнении с рекомендуемыми нормами (Приложение 1,2). Перепад температур между днем и ночью в 14,5 0С и повышенная относительная влажность считаются экстремальными для растений, вызывая их ослабление и активизацию патогенной грибковой микрофлоры, если она присутствует в теплицах [49, 88, 111, 113]. Это, собственно, мы и наблюдали при изучении динамики патогенов культуры огурца в течение зимневесеннего культурооборота. Растения с клиническими признаками мучнистой росы появились через 12 суток после сбоя микроклимата в теплицах. Болезнь быстро распространилась по модулям, несмотря на то, что служба защиты растений сразу же стала обрабатывать растения квадрисом против возбудителя данной болезни. Для пчелиных семей указанные изменения в микроклимате теплицы также весьма отрицательны и требуют дополнительных усилий, чтобы оптимизировать микроклимат гнезда. По данным Е.К.Еськова [32, 35], в слабых семьях пчелы не в состоянии поддерживать температуру 34-35,5 0С в области расплода и часто регистрируют снижение показателя до 32,5-33 0С. Это замедляет развитие развивающегося потомства, увеличивает процент гибели преимагинальных форм и снижает в конечном итоге выход молодых пчел из расплода. В наших исследованиях сложившаяся ситуация привела к снижению яйцекладки маток. Интенсивные усилия для восстановления микроклимата в гнезде способствовали снижению продолжительности жизни пчел. При таких обстоятельствах опылительная деятельность пчелиных семей 97 снижена за счет того, что в семьях остается мало пчел возраста полевой пчелы. На основании полученных результатов мы делаем вывод о том, что в указанных условиях могут находиться только семьи, которые в состоянии регулировать микроклимат гнезда. Следовательно, в современных модулях теплиц необходимы семьи массой не менее 1,5-1,75 кг с кормовой обеспеченностью согласно их кондиции. Наши результаты согласуются с данными А.В.Королева, И.М.Калмыкова [67], рекомендующих в условиях современных теплиц использовать семьи массой не ниже 1,5-1,75 кг с обязательным боковым утеплением в первой половине культурооборота и с эксплуатацией только нижних летков в этот период для того, чтобы обеспечить в расплодном гнезде необходимые температуру и влажность.. В комплексе наших дальнейших исследований большое внимание было уделено изучению микробного фона в модулях теплиц в процессе всего культурооборота и степени его воздействия на пчелиные семьи, поскольку этот вопрос до настоящего времени не изучался. Для получения объективной информации сначала была проведена оценка морфолого-культурального разнообразия микрофлоры в почве перед постановкой пчелиных семей в модули теплиц. Несмотря на то, что после завершения культурооборотов были проведены ликвидационные работы по уничтожению патогенов растений методом пропарки грунта, в комплексе микроорганизмов было установлено наличие патогенов растений. Изучением путей проникновения возбудителей болезней в теплицы занималось большое число ученых . Было выявлено несколько способов проникновения: семенная инфекция, почвенная, воздушная, водная [28, 53, 109, 113, 187, 188]. Кроме того, установлено, что возбудители родов Rhisctonia и Fusarium могут сохраняться в почве после ее пропарки с остатками растений и без них на глубине более чем 10 см [53]. К.М.Степанов [151] пришел к выводу, что освобождение спор различных видов Fusarium осуществляется каплями дождя с последующим перено- 98 сом их воздушными потоками. Отчленение спор осуществляется с помощью воды. Брызги от больных растений попадают на здоровые, заражая их. Опыты Л.И.Демидовой [28], проведенные в теплицах, подтвердили высказанную точку зрения. Изучение путей передачи возбудителей инфекционных болезней внутри теплиц показало следующее. Установлено, что пчелы при опылении растений набирают на брюшко и лапки некоторое количество спор грибов. Но из-за ее стремления садиться не на листья, а преимущественно на здоровый цветок, споровая нагрузка на насекомое очень мала. Огуречный комарик, паутинный клещ откладывают яйца на нижней части стебля растения или его корень, способствуя нарушению целостности растения, и это является благоприятным моментом для внедрения и развития в растении многих патогенных микроорганизмов, например, спор грибов Ascochyta cucumis, Fusarium, Oxysporum и др., мицелии Sclerotinia scherotiorum, Rhizoctonia adernoldii и др. [28, 113, 151]. Проникновение с воздухом патогенов, по данным Л.И.Демидовой [28], может произойти осенью через форточки с последующим переносом в землю с помощью почвообрабатывающих орудий и тепличных рабочих. При изучении морфолого-культурального разнообразия микрофлоры в воздухе ульев пчелиных семей сразу после их постановки в модули теплицы обнаружены патогенные микроорганизмы пчел как бактериальной, так и грибковой природы. Дальнейшие исследования микрофлоры в течение всего культурооборота показали, что патогены растений свободно попадают в ульи пчелиных семей, а при наличии большой массы в теплицах они наносят микробный стресс пчелиным семьям. Стресс проявляется в активизации патогенов пчел, имеющихся в гнезде. При этом в гнезде пчел активизируются патогены аналогичной природы, то есть той, которая вызвала болезнь растений. Экспериментально установлена высокая сопротивляемость пчелиных семей патогенам гнезда. Они интенсивно освобождали расплод от больных личинок, не допуская большого увеличения микозной массы в гнездах. В ре- 99 зультате при клиническом обследовании семей отмечали пестрый расплод без клинических признаков болезни. Это проявлялось также в том, что пчелы приносили в гнезда грибы рода Penicillium. С момента их первой регистрации в гнезде (07.02) и до 14.03 число колоний гриба возросло в 11 раз (табл.3). Известно, что данный род является продуцентом веществ, подавляющих развитие фитопатогенных грибов. Аналогичная ситуация приводится В.И.Масленниковой и Н.З.Зенухиной [99], которые установили факт приноса в гнезда сильными семьями производственной пасеки грибов рода Penicillium в ранневесенний период. Поскольку грибы были обнаружены на стенках улья и сотах, а в теле пчел их не было выявлено, то авторами было высказано предположение о том, что пчелы приносят эти грибы для дезинфекции гнезда. Данные результаты еще раз подтвердили правильность выдвинутого предположения о том, что в модули теплиц необходимо ставить семьи, которые могут регулировать микроклимат гнезда, а это значит, что в теплицах должны работать пчелиные семьи массой не ниже 1,5 кг. На основании изложенного экспериментального материала нами установлено, что технология содержания пчелиных семей определяется основными параметрами микроклимата теплиц, которые, в свою очередь, диктуются технологией содержания культуры огурца, и напрямую зависят от стабильности систем контроля компьютерных агротехнологий. По сути, основные параметры технологии содержания культуры огурца – именно параметры температуры, влажности, газового состава, освещенности, микрофлоры оптимальны и для пчелиных семей средней численности, опыляющих эти растения. Однако сбои в системе контроля микроклимата приводят в конечном итоге к снижению резистентности пчелиных семей и проявлению болезни, возбудитель которой находился в гнезде при постановке семей в теплицу. Успех борьбы с инфекционными болезнями пчел зависит от своевременного и правильного выполнения всех оздоровительных мероприятий, учитывая, что лечебные и дезинфекционные мероприятия необходимо про- 100 водить одновременно [138]. Исходя из того, что в теплицах 75 % патогенов растений составляли микроорганизмы микозной этиологии, а в ульях пчелиных семей также обнаружены патогены грибковой природы, то необходимым условием содержания пчелиных семей в защищенном грунте является строгий санитарно-гигиенический контроль в пчелиных семьях. Это сведет к минимуму присутствие патогенов пчел в их гнездах при постановке в теплицы и будет способствовать тому, чтобы пчелиные семьи справились с экстремальными условиями теплиц. В последние годы отмечается значительное ухудшение эпизоотической ситуации по микозам пчел [61, 72, 76, 82, 96, 146, 147]. Вопросу изучения аскосфероза пчел, а именно условиям выживания возбудителя, разработкам средств и методов борьбы, особенностям дезинфекции посвящено большое число публикаций отечественных и зарубежных исследователей [6, 18, 24, 26, 27, 29, 50, 55, 104, 105, 106, 140, 141, 142, 146, 147, 224, 233]. Споры возбудителя чрезвычайно устойчивы к воздействию факторов окружающей среды, к действию различных классов химических соединений и быстро вырабатывают резистентность как к лечебным средствам, так и дезинфектантам. Поэтому проблема поиска экологически безопасных и биологически активных дезинфицирующих средств для использования в ветеринарной практике пчеловодства остается актуальной. В этой связи наше внимание привлек отечественный препарат Монклавит-1, действующим веществом которого является йод в виде сложного полимерного комплекса в водном растворе. Подбор компонентов в данном препарате позволил снизить раздражающее действие йода при наружном и его токсичность при энтеральном применениях с одновременным повышением антибактериальной активности [124, 125, 174]. Общепризнанным является факт, что йод – лидер в лечении грибковых, бактериальных, протозойных и вирусных инфекций [54, 63, 64, 106]. В сочетании с компонентами, присутствующим в составе Монклавита-1 препарат превзошел формальдегид в качестве дезинфектанта 101 при инкубации яиц и санитарно-профилактических обработках в птичниках [131]. Нами проведены экспериментальные исследования по разработке метода и режимов дезинфекции объектов пчеловодства. Результаты показали, что Монклавит-1 является эффективным препаратом для профилактической дезинфекции ульев, пчеловодного оборудования и может быть использован для вынужденной дезинфекции при микозах пчел. Исследования с применением окрашенных растворов позволили нам установить оптимальные дозы расхода дезинфектанта при разработке метода опрыскивания с помощью мелкодисперсного распылителя. При аскосферозе пчел эффективным был аэрозоль при расходе 500 мл 5 %-ного раствора Монклавита-1 на один 12-рамочный улей, 250 мл 5 %-ного раствора дезинфектанта на одну гнездовую сотовую рамку, 125 мл – на одну магазинную с экспозицией 12 часов. Продолжительность жизни пчел, помещенных в энтомологические садки после их дезинфекции Монклавитом-1, без промывания водой была такой же, как и в садках, которые промывали водой. Во всех опытных и контрольной группах продолжительность жизни пчел была 32,0±1,3 суток. Аналогичные результаты получены и по количеству выращенного расплода: в семьях пчел, помещенных в продезинфицированные Монклавитом-1 ульи и соты без последующего промывания, количество выращенного расплода было приблизительно одинаковым с семьями, которые были помещены в продезинфицированные Монклавитом-1 ульи и соты с последующим промыванием водой. Производственные испытания разработанного метода дезинфекции на производственной пасеке тепличного хозяйства СПК «Соревнование» показали высокую эффективность и экологическую безопасность препарата Монклавит-1. Применение дезинфектанта разработанным методом облегчает труд ветеринарных специалистов и пчеловодов при 100 %-ной дезинфекционной эффективности. 102 На следующем этапе исследований была поставлена задача изучить возможность применения пробиотика ТАНГ для стабилизации жизнедеятельности пчелиных семей, работающих в теплицах. Интерес к коррекции резистентности организма животных возник в связи с поисками путей снижения заболеваемости, повышения продуктивности животных и качества получаемой от них продукции. Повышение резистентности направлено в связи с этим на устранение или смягчение причин, отрицательно действующих на организм, и повышение защитно- приспособительных механизмов организма [14, 56, 74, 126, 161, 162, 171]. Выбор пробиотика ТАНГ был неслучайным. Известно, что в естественных условиях Bacilla subtilis, входящая в состав пробиотика, входит в состав кишечной микрофлоры пчелы. Кроме того, пчелы вводят эту бактерию в мед для увеличения его бактериостатических свойств. Из свежей пыльцы также были выделены эти бактерии [118, 197, 208, 210]. В мировом опыте применения пробиотических препаратов в пчеловодстве их используют, в основном, для лучшего усваивания заменителей пыльцы [19, 217]. В нашей стране пробиотик ТАНГ успешно применен против бактериозов взрослых пчел и расплода [92-94]. Литературные данные свидетельствуют об огромной роли нормальной микрофлоры кишечника животных и человека как фактора неспецифической резистентности, который реализуется не только за счет микробного антагонизма, но и неспецифической активации фагоцитарной и цитостатической активности макрофагов, стимуляции лимфоидной ткани, воздействия на иммунокомпетентные Т- и В-клетки [8, 9, 115, 181, 215]. Это дало основание исследовать ТАНГ в условиях защищенного грунта в качестве препарата, стабилизирующего резистентность пчелиных семей в экстремальных условиях. В изучении данного вопроса критериями оценки служили следующие тесты: динамика массы пчелиных семей, воспроизводительная способность 103 маток, продолжительность жизни пчел и степень устойчивости пчелиных семей к инфекционным болезням. По результатам комплексной ранговой оценки выявлена наиболее оптимальная концентрация раствора: 3 млрд. м.к. ТАНГА на одну пчелиную семью. Отработана схема алиментарного применения препарата в зимневесеннем культурообороте. Подкормки рекомендуется проводить с марта. Выбор данного времени связан с тем, что именно с марта начинают проявляться те или иные болезни растений, сбои в инженерной службе обслуживания теплиц, сокращение продолжительности жизни пчел и т.д. Один курс предусматривает 4-кратное скармливание ТАНГА в дозе 3 млрд. м.к., растворенных в 200 мл инвертированного сахарного сиропа, на одну пчелиную семью через каждые 2-3 суток. Курс подкормок повторяли через каждый месяц до конца культурооборота. Результаты производственной проверки подтвердили экспериментальные данные о том, что применение препарата ТАНГ по разработанной схеме замедляет процесс быстрого старения пчел в сравнении с контролем. Это способствовало тому, что продолжительность жизни в опытных семьях через 2,5 месяца снизилась на 1,7 %, а в контроле – на 25 %, количество выращиваемого расплода в опытных семьях осталось без изменений, а в контроле снизилось на 29,3 %. Эффект от применения препарата состоял в том, что в структуре пчелиных опытных семей было такое количество полевых пчел, которые успешно проводили опылительную деятельность на массиве модуля теплицы и вылетали на волю, чтобы принести свежие нектар и пыльцу для нужд семьи. Большинство опытных семей (61,3 %) несмотря на то, что показатель их массы к данному сроку сократился на 26,1 % продолжали справляться со своей основной функцией – опылением культуры огурца. Кроме изучения опылительной деятельности пчел, были изучены дополнительные сведения о качестве опыления растений. Главный агроном хозяйства проводил контрольные обследования женских цветков огурца на нали- 104 чие у них завязей. На массиве модуля не было найдено ни одного цветка, который остался бы неоплодотворенным. В то время как в контрольном модуле на каждые 1000 цветков приходилось 5,6 % неоплодотворенных. Периодические клинические обследования пчелиных семей в процессе культурооборота показали, что аскосфероз в опытных семьях появился в третьей декаде апреля. В 22,2 % пчелиных семей опытной группы была зарегистрирована I степень поражения расплода. В первой декаде мая аскосфероз появился еще в 3 пчелиных семьях. Во всех выявленных больных семьях (7 шт.) болезнь регистрировали до конца культурооборота с I степенью поражения. В контрольных семьях проявление болезни было более существенным. Фактически аскосферозом болели все семьи данной группы. Причем с третьей степенью поражения болело 66,7 %, что привело в конечной итоге к их гибели. Таким образом, установлена возможность коррекции естественной резистентности пчелиных семей с помощью пробиотика ТАНГ. Впервые получены данные о влиянии препарата на репродуктивность маток, развитие и сохранность пчелиных семей, повышение устойчивости к инфекционным болезням. Расчеты экономической эффективности от применения ТАНГА из расчета на каждые 10 пчелиных семей составили 10290,2 руб. Экспериментальные исследования и производственные испытания убедительно показали, что пробиотик ТАНГ способствует увеличению сопротивляемости к воздействию неблагоприятных условий, повышает устойчивость к заболеваниям и экономически целесообразен. 105 ВЫВОДЫ 1. Основные микроклиматические параметры содержания культуры огурца в теплице (температура, относительная влажность, газовый состав, освещенность, состав микрофлоры) являются удовлетворительными для пчелиных семей средней массы (1,5-1,75 кг), опыляющих растения. 2. Сбои в системе контроля микроклимата в процессе зимне-весеннего культурооборота в случае сильных морозов, увеличения интенсивности солнечной активности, повышения температуры воздуха крайне отрицательно сказываются на растениях и пчелиных семьях. 3. Патогены растений свободно попадают в ульи пчелиных семей. При наличии их в большом количестве они могут нанести микробный стресс пчелиным семьям, который проявляется в активизации патогенов пчел аналогичной природы, если они имеются в гнезде. Выявлена величина экономического порога опасности: 34 % удельного веса патогена растений в комплексе микроорганизмов, находящихся в воздухе улья, от общего числа колониальных единиц равных 100. 4. Дестабилизация условий содержания пчелиных семей на фоне активизации патогенов пчел приводит к снижению резистентности пчелиных семей и является запуском к началу инфекционных болезней. 5. Разработаны режимы дезинфекции объектов пчеловодства при микозах пчел препаратом Монклавит-1 с исходной концентрацией 5 %. Расход препарата методом опрыскивания из мелкодисперсного распылителя составил 500 мл на один 12-рамочный улей, 1 л на улей-лежак, 1,2 л на многокорпусный улей (4-корпусный), 0,25 л на стандартную (435х300 мм) корпусную и 0,125 л на магазинную (435х145 мм) сотовые рамки при экспозиции 12 часов. После окончания экспозиции сотовые рамки, ульи высушивают и используют по назначению без промывания. 106 Металлический инвентарь обеззараживается 5 %-ным раствором Монклавита-1 с экспозицией 24 часа. 6. Показано, что использование продезинфицированных ульев и сотов раствором Монклавит-1 без последующего промывания водой не оказывает отрицательного влияния на поведение пчел, яйцекладущую способность маток, выращивание расплода и продолжительность жизни пчел. 7. Для стабилизации жизнедеятельности пчелиных семей разработана схема применения пробиотика ТАНГ. Подкормки начинают проводить с марта. Один курс предусматривает 4-кратное скармливание ТАНГА через каждые 2-3 суток в дозе 3х109 м.к., растворенных в 200 мл инвертированного сахарного сиропа на одну пчелиную семью. Курс подкормок повторяют через каждый месяц до конца культурооборота. 8. Применение препарата ТАНГ по разработанной схеме способствует увеличению сопротивляемости пчелиных семей экстремальным условиям теплиц, повышает устойчивость к заболеваниям и экономически целесообразно. ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ 1. Результаты исследований по применению препаратов Монклавит-1 и ТАНГ вошли в проект «Рекомендации по комплексной системе санитарногигиенических, ветеринарных и зоотехнических мероприятий для обслуживания пасек тепличных хозяйств, специализирующихся на опылении растений в защищенном грунте». 2. Результаты исследований используются в учебном процессе в ФГОУ ВПО МГАВМиБ по дисциплине «Зоогигиена». 107 БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Аветисян Г.А. Пчеловодство. – М.: Колос, 1975. – 330 с. 2. Бабкина Н.Г. Устойчивость медоносной пчелы к гипер- и гипотермии / Дисс… канд. биол. наук. – Рязань, 1992. – 141 с. 3. Белик В.Ф. с соавт. Огурцы, кабачки, патиссоны / В.Ф.Белик, К.Н.Кузьмина, И.П.Соломина. – М.: Россельхозиздат, 1979. – 62 с. 4. Березина Н.В. Экспериментальная оценка системы защиты рассады цветочно-декоративных культур / Н.В.Березина, Ю.И.Мешков // Теплицы России. – 2008. - № 4. – С.50-54. 5. Билаш Н.Г. Недокорм личинок и фенотип рабочих пчел // Пчеловодство. – 1980. - № 8. – С.15-16. 6. Блинов Н.В. Изыскание новых экологически безопасных средств борьбы с аскосферозом пчел / Дисс… канд. вет. наук. – М., 2002. – 131 с. 7. Боднарчук Л.И. Особенности летно-опылительной и сигнальной деятельности некоторых рас медоносной пчелы в условиях теплиц / Дисс… канд. биол. наук. – Киев, 1974. – 127 с. 8. Бондаренко В.М. и др. Дисбактериозы и препараты с пробиотической функцией / В.М.Бондаренко, А.А.Воробьев // Журн. микробиол. – 2004. - № 1. – С.84-92. 9. Бондаренко В.М. Механизм действия пробиотических препаратов / В.М.Бондаренко, Р.П.Чупринина, М.А.Воробьева // Биопрепараты. – 2003. № 3. – С.2-5. 10. Борисов Н.В. Биологические особенности огурца // Картофель и овощи. – 1977. - № 7. – С.11-12. 11. Будынков Н.И. с соавт. Эффективность применения Рапсол против мучнистой росы и паутинного клеща на огурцах в теплицах / Н.И.Будынков, Ю.И.Мешков, В.Н.Юваров, Ф.Ф.Горелов // Теплицы России. – 2008. - № 2. – С.42-45. 108 12. Будынков Н.И. Хитозансодержащий препарат «Экогель». Влияние на растения огурцов и их патогенную микробиоту / Н.И.Будынков, В.Н.Юваров, Ф.Ф.Горелов // Теплицы России. – 2008. – № 4. – С.56-59. 13. Бурмистров А.Н. Опыление тепличных культур пчелами. – Рыбное, 1992. – 36 с. 14. Вагазова Г.И. Совершенствование ветеринарного обслуживания звероводческих хозяйств / Автореф. дисс… канд. вет. наук. – Казань, 2006. – 19 с. 15. Вашков В.И. Антимикробные средства и методы дезинфекции при инфекционных заболеваниях. – М.: Медицина, 1977. – 287 с. 16. Вашков В.И. Методы исследования дезинфекционных, дезинсекционных и дератизационных препаратов. – М.: Медицина, 1961. 17. Викторова И.А. Приемы повышения урожайности огурца и томата в пленочных теплицах Томской области / Автореф. дисс… канд. с.-х. наук. – Томск, 2002. – 21 с. 18. Григорян А.Г. Ветеринарно-санитарные мероприятия при аскосферозе пчел / Автореф. дисс… канд. вет. наук. – М., 1983. – 18 с. 19. Губайдуллин И.Н. Биологические, организационно-технологические особенности опыления пчелоопыляемого огурца в пленочных теплицах / Автореф. дисс… канд. с.-х. наук. – Уфа, 2006. – 23 с. 20. Губайдуллин И.Н. с соавт. Экстерьерные признаки рабочих пчел в защищенном грунте / И.Н.Губайдуллин, А.Г.Маннапов, Н.М.Губайдуллин // Материалы Международной научно-практической конференции. – Уфа, 2005. – С.98-100. 21. Губин А.Ф. и др. Опыление сельскохозяйственных растений пчелами // Пчеловодство. – 1948. - № 2. – С.547-548. 22. Губин А.Ф. и др. Пчеловодство. – М.: Огиз-Сельхозгиз, 1937. – 414 с. 23. Губин А.Ф. Отношение пчел к недостатку кислорода / А.Ф.Губин, Н.П.Смарагдова // Зоологический журнал. – 1946. - № 4. – С.329-338. 109 24. Гургулова К. Микозы пчел // Пчеларство. – 1988. – 36, № 10. – С.2224. 25. Гургулова К. Профилактика аскосфероза // Пчеларство. – 1991. – 89, № 3-6. – С.13-15. 26. Гургулова К., Кънчев К. Проблемы аскосфероза в пчеловодстве // Пчеларство. – 1988. – 96, № 12. – С.17-19. 27. Гургулова К. с соавт. Испытьание антимикотических средств против аскосфероза / К.Гургулова, К.Кънчев, Т.Върбанова, К.Гераксиев // Пчеларство. – 1990. – 88, № 3. – С.4-6. 28. Демидова Л.И. Обзор грибных болезней огурцов в теплицах Ленинградской области / Автореф. дисс… канд. с.-х. наук. – Л., 1968. – 19 с. 29. Ендреяк Р. Аскосфероз пчелиного расплода // Сб. докл. сем. «Инфекционные заболевания пчел и пчелиного расплода в странах средней и восточной Европы». – Братислава, 1996. – С.47-52. 30. Еремия Н.Г. Повышение продуктивности пчелиных семей путем использования комплекса белково-витаминных подкормок / Автореф. дисс… канд. с.-х. наук. – Кишинев, 1986. – 24 с. 31. Еськов Е.К. Микроклимат пчелиного жилища. – М.: Россельхозиздат, 1983. – 191 с. 32. Еськов Е.К. Микроклимат пчелиного улья и его регулирование. – М.: Россельхозиздат, 1978. – 210 с. 33. Еськов Е.К. Микроклимат улья как фактор, влияющий на развитие пчел // Пчеловодство. – 1977. - № 7. – С.15-17. 34. Еськов Е.К. с соавт. Стратегия, используемая пчелами для защиты от переохлаждения / Е.К.Еськов, В.А.Тобоев // Пчеловодство. – 2007. - № 3. – С.18-20. 35. Еськов Е.К. Связь микроклимата пчелиного жилища с физиологическим состоянием его обитателей и условиями внешней среды // Зоологический журнал. – 1977. – Т.56. - № 6. – С.870-880. 110 36. Еськов Е.К. с соавт. Термофактор и развитие маток / Е.К.Еськов, А.И.Торопцев // Пчеловодство. – 1979. - № 2. – С.9-10. 37. Еськов Е.К. Экология медоносных пчел. – Рязань: Русское слово, 1995. – 391 с. 38. Еськов Е.К. Этология медоносной пчелы. – М.: Колос, 1992. – 336 с. 39. Жданова Т.С. с соавт. Зимовка пчел / Т.С.Жданова, Г.К.Костоглодов, О.С.Львов. – М.: Россельхозиздат, 1967. – 156 с. 40. Жданова Т.С. Температура пчелиного гнезда // Тр. Татарской государственной с.-х. станции. – 1961. – Вып.1. – С.27-32. 41. Жеребкин М.В. Возрастные и сезонные изменения некоторых процессов пищеварения у медоносной пчелы // Уч. записки НИИ пчеловодства: Вестник № 11. – М.: Московский рабочий, 1965. – С.1-71. 42. Жеребкин М.В. Зимовка пчел. – М.: Россельхозиздат, 1979. – С.3150. 43. Жеребкин М.В., Шагун Я.Л. Морфологические и физиологические исследования летних и осенних пчел // Тр. НИИ пчеловодства. – Рязань, 1969. – С.25-35. 44. Жеребкин М.В., Шагун Я.Л. О некоторых физиологических изменениях в организме медоносных пчел при подготовке их к зиме // Уч. записки НИИ пчеловодства: Вестник № 20. – М.: Московский рабочий, 1971. – С.157. 45. Жуков А.А. Биологические свойства гриба Ascosphaera apis и меры борьбы с аскосферозом пчел / Автореф. дисс… канд. биол. наук. – М., 1995. – 18 с. 46. Зарецкий Н.Н. Использование пчел в теплицах. – М.: Россельхозиздат, 1985. – 190 с. 47. Зенухина Н.З. Аскосфероз и меры борьбы с ним // Пчеловодство. – 1995. - № 6. С.24-25. 111 48. Зенухина Н.З. с соавт. Лечебные препараты при аскосферозе пчел / Н.З.Зенухина, В.А.Улановский, Л.Ю.Отрищенко // Пчеловодство. – 1993. - № 9. – С.18-19. 49. Зимне-весенняя культура пчелоопыляемого огурца. Биологический подход. – Методические рекомендации. – Мытищи, 2000. – 27 с. 50. Зюман Б.В. Терапия аскосфероза // Научно-технический бюллетень ДальНИВИ. – 1990. – Т.42. – С.37-40. 51. Ибрагимов Г.Р. Критическая характеристика некоторых видов меланкониевых грибов (Gloeosporium и Colletotrichum). – Баку, 1954. – 86 с. 52. Игнатов П.Е. Иммунитет и информация возможности управления. – М.: Время, 2002. – 352 с. 53. Ингольд Ц. Пути и способы распространения грибов. – М.: Издательство иностранной литературы, 1957. – 198 с. 54. Ишмуратов Г.Ю. с соавт. Йодополимеры в пчеловодстве / Н.М.Ишмуратова, С.Г.Салимов, Н.Г.Гиниятуллин // Пчеловодство. – 2005. № 5. – С.29-30. 55. Кодама К. Борьба с известковым расплодом // Сб. докл ХХХ Межд. конгр. по пчеловодству. – Бухарест: Апимондия, 1985. – С.187-193. 56. Каллимулина Р.Г. Профилактика и лечение заболеваний телят // Информ. бюл. МСХ и продов. - Башкортостан. - 2002. - № 1. - с.31-34. 57. Карпуть И.М. Иммунология и иммунопатология болезней молодняка. – Минск: Ураджай, 1993. – 288 с. 58. Кашковский В.Г. Важные условия племенной работы // Пчеловодство. – 1977. - № 3. – С.26-27. 59. Кашковский В.Г. с соавт. Опыление огурцов в теплицах Сибири / В.Г.Кашковский, Н.Д.Машинская // Пчеловодство. – 1978. - № 4. – С.14-15. 60. Клочко Р.Т. Десять правил борьбы с аскосферозом // Пчеловодство. – 1997. - № 1. – С.20-22. 112 61. Клочко Р.Т. с соавт. Диагностика и меры борьбы при аскосферозе пчел / Р.Т.Клочко, Л.С.Малиновская, Г.И.Игнатьева и др. // Ветеринария. – 1994. - № 7. – С.6-8. 62. Гробов О.Ф.с соавт. Болезни и вредители пчел / О.Ф.Гробов, А.К.Лихотин. – М.: Мир, 2000. – 320 с. 63. Ковалевский В.В. Биологическая роль йода // Сб. докл. XXX Межд. конгр. по пчеловодству. – Бухарест: Апимондия, 1985. – С.187-193. 64. Ковалевский В.В. Биологическая роль йода. – М.: Колос, 1972. – С.34-45. 65. Козловцев М.И. Особенности использования систем капельного полива, отопления и дозации СО2 в тепличных хозяйствах. – Гавриш. – 1999. № 5. – С.34-35. 66. Коляков Я.Е. Ветеринарная иммунология. – М.: Агропромиздат, 1986. – 278 с. 67. Королев А.В. с соавт. Некоторые технологические приемы, стабилизирующие состояние пчелиных семей в теплицах блочного типа / А.В.Королев, И.М.Калмыков // Ветеринария и кормление. – 2009. - № 6. – С.99-101. 68. Кочетов А.С. Методические рекомендации, технология содержания и использования медоносных пчел на опылении овощных культур в защищенном грунте. – М., 2004. – 31 с. 69. Кресак М. Влияние некоторых физических факторов на онтогенез пчел // XXIII Международный конгресс по пчеловодству. – Бухарест: Апимондия, 1972. – С.340-341. 70. Кривцов Н.И. с соавт. Пчеловодство / Н.И.Кривцов, Р.Б.Козин, В.И.Лебедев, В.И.Масленникова. – СПб.: Лань, 2010. – 447 с. 71. Кривцов Н.И. с соавт. Пчеловодство / Н.И.Кривцов, В.И.Лебедев, Г.М.Туников. – М.: Колос, 1999. – 390 с. 113 72. Кривцова Л.С. Эффективность фунгицидных препаратов при аскосферозе // Мат. науч.-практ. конф. «Проблемы экологии и развития пчеловодства в России». – Рыбное, 1999. – С.126-128. 73. Кудрин Б.И. Классика технических ценозов. Ценологические исследования. – Вып.31. – М., 2008. 74. Кузнецов А.Ф. Естественная резистентность свиней и пути ее повышения в агропромышленных комплексах / Дисс… д-ра вет. наук. – СПб., 2006. – 285 с. 75. Кузнецов А.Ф. с соавт. Практикум по зоогигиене с основами проектирования животноводческих объектов / А.Ф.Кузнецов, М.С.Найденский, В.М.Кожурин, В.И.Баланин, Н.С.Калюжный. – М.: КолосС, 2006. – 343 с. 76. Лаез Й. Асклсфероз (известковый расплод) – опыт борьбы с заболеванием // Сб. докл. сем. Инфекционные заболевания пчел и пчелиного расплода в странах средней и восточной Европы. – Братислава, 1996. – С.75-78. 77. Ларионова О.С. с соавт. Коррекция сырой массы в организме пчел в условиях защищенного грунта / О.С.Ларионова, И.Н.Губайдуллин, В.П.Мамаев // Материалы междунар. науч.-техн. конф. – Уфа, 2005. – С.180182. 78. Лебедев А.В. Система защитных мероприятий в ОАО «Совхоз «Тепличный» Ивановской области // Теплицы России. – 2008. - № 2. – С.37-38. 79. Лебедев В.И. Техника выращивания силы пчелиных семей // Вопросы промышленной технологии производства продуктов пчеловодства / Науч. тр. по технологии ухода за пчелами. – Рязань, 1978. – С.57-74. 80. Левченко И.А. с соавт. Сухую обножку пчелам / И.А.Левченко, А.К.Бондарь // Пчеловодство. – 1983. - № 12. – С.23. 81. Линд А.Р. Исследование пищевой ценности и безопасности ферментативно-гидролизованной молочной сыворотки, обогащенной лактатами / Автореф. дисс… канд. мед. наук. – М., 1996. – 21 с. 114 82. Лихотин А.К. с соавт. Аскозол – новый препарат для лечения аскосфероза и аспергиллеза пчел / А.К.Лихотин, Д.Н.Удавлиев, Н.И.Попов // Пчеловодство. – 1999. - № 2. – С.25. 83. Мадебейкин И.Н. Температурные режимы воздуха в теплицах // Пчеловодство. – 1979. - № 4. – С.16. 84. Мамаев В.П. Технологические и биологические аспекты управления жизнедеятельностью медоносных пчел в защищенном грунте / Дисс… канд. с.-х. наук. – Уфа, 2005. – 182 с. 85. Маннапов А.Г. с соавт. Технология использования семей пчел для опыления цветков огурца в защищенном грунте / А.Г.Маннапов, Н.М.Губайдуллин, В.П.Мамаев. – М.: Изд-во ФГОУ ВПО РГАУ – МСХА им. К.А.Тимирязева, 2008. – 127 с. 86. Маннапов А.Г. с соавт. Подкормки пчел / А.Г.Маннапов, Г.С.Мишуковская, С.П.Циколенко, В.П.Манаев // Пчеловодство. – 2004. - № 7. – С.16-18. 87. Марковская Е.Ф. Интеграция процессов роста и развития в онтогенезе огурца / Дисс… д-ра биол. наук. – Санкт-Петербург, 1992. – 268 с. 88. Марковская Е.Ф. с соавт. Биологическая продуктивность, холодо- и теплоустойчивость растений огурца в зависимости от температуры выращивания / Е.Ф.Марковская, Н.И.Балагурова // Сб. Влияние внешних факторов на устойчивость, рост и развитие растений. – Петрозаводск, 1992. – С.129-136. 89. Маркосян Ж.К. и др. Действие пестицидов в теплицах // Пчеловодство. – 1980. - № 11. – С.13-14. 90. Маркосян Ж.К. Правильное использование пчел в теплицах / Материалы Закавказского отд. ВАСХНИЛ. – Тбилиси, 1973. 91. Маркосян Ж.К. Пчелы и пестициды // Пчеловодство. – 1972. - № 6. – С.13-14. 92. Масленникова В.И. с соавт. Применение препарата «ТАНГ» при сальмонеллезе пчел / В.И.Масленникова, А.М.Грязнев // Материалы Международной учебно-методической научно-практической конференции, посвя- 115 щенной 85-летию академии. - 4.1. - М.: ФГОУ ВПО МГАВМиБ им.К.И.Скрябина, - 2004. - С.328-330. 93. Масленникова В.И. с соавт. Применение пробиотиков в пчеловодстве / В.И.Масленникова, А.М.Грязнев, А.В.Дудинов, Т.Н.Сычева // Материалы научно-практической конференции. Экологические аспекты производства, переработки и, использования продуктов пчеловодства.- Рыбное: ФГО У «Академия пчеловодства», 2004. - С.84-88. 94. Масленникова В.И. с соавт. Экспериментальное обоснование терапевтической эффективности пробиотического препарата ТАНГ при европейском гнильце / В.И.Масленникова, Т.Н.Сычева // Материалы научно- практической конференции посв. 100-летию со дня рождения Г.Ф.Таранова. Рыбное, 2007.- С. 136-142. 95. Маурицио А. Кормление пыльцой и жизненные процессы у медоносной пчелы / В сб. Новое в пчеловодстве. – М.: Сельхозгиз, 1958. – С.425427. 96. Мачнев А.Н., Яременко Н.А. Эпизоотическая обстановка на пасеках России на рубеже тысячелетий // Пчеловодство. – 2000. - № 1. – С.5. 97. Машинская Н.Д. В теплицах Сибири // Пчеловодство. – 1979. - № 1. – С.12. 98. Машинская Н.Д. Особенности развития пчелиных семей в теплицах и использование их для опыления огурца в условиях Западной Сибири / Дисс…канд. с.-х. наук. – Новосибирск, 1981. – 167 с. 100. Машинская Н.Д. Пчелы в теплицах // Пчеловодство. – 1981. - № 1. – С.33. 101. Методические рекомендации по применению ветеринарного препарата Монклавит-1. –СПБ. -2005. -36с. 103. Мельниченко А.Н. с соавт. Особенности жизнедеятельности и опылительной работы пчел в условиях теплиц Заполярной тундры / А.Н.Мельниченко, Н.В.Никифорова // XXI Международный конгресс по пчеловодству. – М.: Колос, 1967. – С.111-120. 116 104. Михайлов К.И. с соавт. Концентрация углекислого газа в зимнем клубе пчел / К.И.Михайлов, Г.Ф.Таранов // Пчеловодство. – 1960. - № 10. – С.5-10. 105. Михальцевич Г.Н. с соавт. Патогенная флора на фоне варроатоза / Г.Н.Михальцевич, М.Г.Величко // Пчеловодство. – 1996. - № 1. – С.26-27. 106. Мохова М. Известковый расплод в Чешской Республике // Сб. докл. Инфекционные заболевания пчел и пчелиного расплода в странах средней и восточной Европы. – Братислава, 1996. – С.69-72. 107. Мукминов М.Н. Интегрированная система профилактики и борьбы с основными микозами пчел / Автореф. дисс… д-ра биол. наук. – Москва, 2006. – 48 с. 108. Мюллер Э. с соавт. Микология / Э.Мюллер, В.Леффлер. – М.: Мир, 1995. – 212 с. 109. Накане Т. с соавт. Применение медикаментов для лечения больных известковым расплодом чпел / Т.Накане, К.Кажикава // Сб. докл ХХХ Межд. конгр. по пчеловодству. – Бухарест: Апимондия, 1985. – С.194-201. 110. Наумов Н.А. Анализ семян на грибковую и бактериальную инфекцию. – М.: Сельхозгиз, 1960. – 215 с. 111. Никитенко В.И. с соавт. Некоторые новые данные о механизме действия спорообразующих пробиотиков / В.И.Никитенко, М.В.Бородин //Актуальные вопросы военной и практической медицины. – Оренбург, 2000. – С.79-80. 112. Никифорова Н.А. с соавт. Мучнистая роса в закрытом грунте / Н.А.Никифорова, А.Х.Мештакова // Защита растений от вредителей и болезней. – 1961. - № 12. – С.36-39. 113. Никифорова Н.В. Экологические условия, необходимые для жизнедеятельности пчел в теплицах // Эколого-генетические исследования устойчивости и продуктивности популяции. – Нижний Новгород, 1990. – 189 с. 117 114. Обзор распространения главнейших вредителей и болезней сельскохозяйственных культур за 1964 г., прогноз появления их в 1965 г. в Ленинградской области. – Л.: Лениздат, 1965. – 22 с. 115. Оганова Э. Аскохитоз тепличных огурцов // Картофель и овощи. – 1965. - № 4. – С.12-14. 116. Онищенко Г.Г. Иммунобиологические препараты и перспективы их применения в инфектологии / Г.Г.Онищенко, В.А.Алешкин, С.С.Афанасьев. – М., 2002. – 186 с. 117. Плохинский Н.А. Биометрия. – М.: Изд-во Моск. ун-та, 1971. – 192 с. 118. Полтев В.И. Борьба с болезнями пчел // Пчеловодство. – 1977. - № 12. – С.25-27. 119. Полтев В.И. с соавт. Микрофлора насекомых / В.И.Полтев, И.Н.Гриценко, А.И.Егорова, Т.А.Кальвиш, Л.Л.Туркевич, Н.В.Ушакова. – Новосибирск: Наука. Сибирское отделение, 1969. – 270 с. 120. Полтев В.И. с соавт. Болезни и вредители пчел / В.И.Полтев, Е.В.Нешатаева. – М.: Колос, 1977. – С.82-84. 121. Поляков А.А. Ветеринарная дезинфекция. – М.: Колос, 1975. – С.235-237. 122. Попов Е.Т. Аскосфероз – основная болезнь пчел // Пчеловодство. – 1995. - № 4. – С.20-22. 124. Рекомендации по выявлению болезней с.-х. растений. – М.: Россельхозиздат, 1967. – 89 с. 125. Ризаева Г.А. Опыт выращивания гибрида огурца F1 Атлет малообъемным способом на верховом торфе // Теплицы России. – 2009. - № 1. – С.4849. 126. Романова О.В. Респираторный аспергиллез. Решение проблемы // Материалы XI Московского международного ветеринарного конгр.. – М., 2003. – С.141-142. 118 127. Романова О.В. с соавт. Практический опыт применения препарата Монклавит-1 при различных патологических состояниях у лошадей / О.В.Романова, А.Ф.Кузнецов, А.Г.Петропаловский // Материалы 2-й Междунар. науч.-практ. конф.Ветеринарное обеспечение в современном иппобизнесе. – СПб., 2002. – 93 с. 128. Рубинский И.А. Оптимизация системы противоэпизоотических мероприятий в специализированных свиноводческих хозяйствах / Автореф. дисс… д-ра вет. наук. – Екатеринбург, 2007. – 49 с. 129. Рыков А.Н. Технологические системы формирования микроклимата в теплицах // Теплицы России. – 2008. - № 3. – С.53-57. 130. Рямова А.М. Различия в метаморфозе летних и осенних пчел // Пчеловодство. – 1978. - № 12. – С.7-8. 131. Савицкая З. Динамика количества воды и жира в теле насекомых в связи с их холодоустойчивостью // Тр. Института зоологии и биохимии АН УССР. – 1938. - № 5. – С.145-160. 132. Саландаев К.В. Зоогигиеническая оценка применения препарата Монклавит-1 в промышленном птицеводстве / Автореф. дисс… канд. вет. наук. – СПб., 2007. – 19 с. 133. Самосадов Я.М. Мой опыт содержания пчел в теплицах // Пчеловодство. – 1956. - № 1. – С. 25-26. 134. Самосадов Я.М. Опыт организации опыления огурцов в теплицах совхоза им. «1 мая» // Докл. ТСХА. – Вып.62. – 1961. – С.543-545. 135. Свентицкий И.И. с соавт. Развитие тепличного растениеводства исходя из экологической физиологии и энергетической экстремальной самоорганизации / И.И.Свентицкий, Г.А.Старых, Е.О.Алхазова // Теплицы России. – 2008. - № 1. – С.30-33. 136. Симецкий М.А. с соавт. Бактерицидные пены – от разработки до внедрения / М.А.Симецкий, Н.И.Попов // Ветеринария. – 1987. - № 8. – С.8-9. 137. Слабоспицкая А.Т. с соавт. Ферментативная активность бацилл, перспективных для включения в состав биопрепаратов / А.Т.Слабоспицкая, 119 С.С.Крымовская, С.Р.Резник // Микробиологический журнал. - 1990. - Т. 52. № 1. - с. 9-14. 138. Смирнов А.Г. Повышение эффективности функционирования тепличных предприятий в рыночных условиях / Автореф. дисс… канд. экон. наук. – Саратов, 2003. – 24 с. 139. Смирнов А.М. Ветеринарно-санитарные основы профилактики и борьбы с заразными болезнями пчел / Автореф. дисс… д-ра вет. наук. – М., 1980. – 29 с. 140. Смирнов А.М. с соавт. Борьба с аскосферозом пчел / А.М.Смирнов, С.Н.Луганский, Р.Т.Клочко // Ветеринария. – 1990. - № 4. – С.10-14. 141. Смирнов А.М. с соавт. Ветеринарно-санитарные мероприятия при аскосферозе / А.М.Смирнов, А.Г.Григорян. // Пчеловодство. – 1985. - № 3. – С.24-25. 142. Смирнов А.М. с соавт. Новые подходы к лечению аскосфероза пчел / А.М.Смирнов, Г.И.Игнатьева, А.Б.Сохликов // Пчеловодство. – 1990. - № 3. – С.20-22. 143. Смирнов А.М. с соавт. Ветеринарно-санитарные мероприятия на пасеках / А.М.Смирнов, Р.Т.Клочко, С.Н.Луганский // Ветеринария. – 2000. № 8. – С.3-5. 144. Смирнов В.В. с соавт. Рост и спорообразование Bacillus subtilis в различных условиях аэрации / В.В.Смирнов, А.И.Осадчая, В.А.Кудрявцев // Микробиологический журнал. – 1993. - № 3. – С.38-43. 145. Смирнов В.В. с соавт. Дискуссионные вопросы создания и применения бактериальных препаратов для коррекции микрофлоры теплокровных / В.В.Смирнов, С.Р.Резник, И.Б.Сорокулова // Микробиологический журнал. 1992. - № 6. - с. 82-94. 146. Соболев А.Д. Основы вариационной статистики / Соболев А.Д. // уч.пособие – М.: ФГОУ ВПО МГАВМиБ – 2003.-112с. 147. Сокол Й. с соавт. Болезни пчел и пчелиного расплода / Й.Сокол, Й.Кубинец // Сб. докл. сем. Инфекционные заболевания пчел и пчелиного 120 расплода в странах средней и восточной Европы. – Братислава, 1996. – С.1922. 148. Соловьева Л.Ф. Профилактика и лечение аскосфероза пчел. - Рыбное, 1997. – 39 с. 149. Соловьева Л.Ф. Факторы, влияющие на сопротивляемость семей аскосферозу // Пчеловодство. – 2000. - № 1. – С.20-22. 150. Сорокулова И.Б. Сравнительное изучение биологических свойств биоспорина и других коммерческих препаратов на основе бацилл // Микробиологический журнал. – 1997. - № 6. – С.43-49. 151. Спесивцев Н.А. Микозы и микотоксины. – М.: Колос, 1964. – 128 с. 152. Старых Г.А. Оптимизация факторов урожайности овощных культур в защищенном грунте / Автореф. дисс… д-ра с.-х. наук. – Балашиха, 2004. – 43 с. 153. Степанов К.М. Распространение инфекционный болезней растений воздушными течениями // Тр. по защите растений. – 1975. - № 3. – С.12-15. 154. Стройков С.А. Способности пчел к усвоению питательных заменителей пыльцы // Тр. НИИ пчеловодства. – М.: Россельхозиздат, 1967. – С.89106. 155. Сучкова Л.В. Все об огурцах // Теплицы России. – 2008. - № 1. – С.38-40. 156. Сычев М.М. Грибковые болезни пчел: профилактика и меры борьбы // Пчеловодство. – 1995. - № 3. – С.19-22. 157. Тараканов Г.И. с соавт. Овощеводство защищенного грунта / Г.И.Тараканов, Н.В.Борисов, О.В.Климов. – М.: Колос, 1992. – 303 с. 158. Таранов Г.Ф. Биология пчелиной семьи – М.: Колос, 1961. 159. Таранов Г.Ф. О подготовке пчел к зимовке // Пчеловодство. – 1979. - № 7. – С.27-28. 160. Таранов Г.Ф. Пчеловодство. – М.: Огиз-Сельхозгиз, 1948. – С.241242. 121 161. Таранов Г.Ф. с соавт. Продолжительность жизни пчел / Г.Ф.Таранов, Т.Н.Азимов // Пчеловодство. – 1972. - № 3. – С.16-17. 162. Тошков А. с соавт. Дисбактериоз у пчелиных семей / А.Тошков, Г.Камбуров, Я.Караджов, М.Шабанов // Сб. докл. XXIII межд. конгр. по пчеловодству. – Бухарест: Апимондия, 1971. – С.473. 163. Трифонова О.С. Ветеринарно-гигиеническое обоснование использования иммуностимуляторов нового поколения для активизации естественной резистентности свиней / Автореф. дисс… канд. вет. наук. – Чебоксары, 2005. – 20 с. 164. Урбан В.П. с соавт. Болезни молодняка в промышленном животноводстве / В.П.Урбан, И.Л.Найманов. - М.: Колос, 1984. - 207 с. 165. Успенская Г.Д. с соавт. Аскохитоз огурцов в условиях гидропоники / Г.Д.Успенская, А.Леонов, К.Горелик // Картофель и овощи. – 1967. - № 1. – С.37-38. 166. Ушатинская Р.С. Основы холодостойкости насекомых. – М.: АН СССР, 1957. – 314 с. 167. Филиппов А.В. с соавт. Условия содержания пчел / А.В.Филиппов, А.С.Кочетов // Пчеловодство. – 2004. - № 7. – С.11-13. 168. Филоненко О.Г. Пчелы в теплицах // Гавриш. – 2004. - № 3. – С.2425. 170. Харькина Т.Г. Закономерности формирования и функционирования растений с интерминантным типом роста побега / Дисс… канд. с.-х. наук. – Петрозаводск, 1997. – 186 с. 171. Циколенко С.П. с соавт. Защита пчел от отравлений пестицидами в теплицах / С.П.Циколенко, Г.А.Хомченко, Р.Н.Панова, Т.Н.Горяинова // Гавриш. – 2009. - № 5. – С.14. 172. Циколенко СП. Морфофункциональные изменения в организме медоносных пчел в период зимовки и в условиях защищенного грунта после корригирующих подкормок / Автореф. дисс. канд.биол.наук. - Уфа, 2004. - 22 с. 122 173. Цой И.Г. с соавт. Иммуностимулирующее действие лактобактерий на цитотоксичность естественных клеток киллеров и продукцию интерферона / И.Г.Цой, А.С.Сапаров, Н.К.Тимофеев // Микробиология, эпидемиология и иммунобиология. -1994. -№ 6.- С.112-113. 174. Чубанишвили Л.Н. Сравнительное изучение некоторых фитопатогенных бактерий рода Pseudomonas, распространенных в субтропических районах Грузии / Автореф. дисс… канд. биол. наук. – Тбилиси, 1971. – 20 с. 175. Шабуров Д.Г. Влияние препарата Монклавит-1 на рост и морфологию копытной глазури у лошадей / Автореф. дисс… канд. вет. наук. - Екатеринбург, 2004. – 21 с. 176. Шабуров Д.Г. с соавт. Морфологическое обоснование использования препарата Монклавит-1 для профилактики сухости копыт у лошадей. – Пермь, 2003. – 18 с. 177. Шагун Я.Л. Некоторые особенности физиологической подготовки к зиме у медоносных пчел / Автореф. дисс. канд. биол. наук. – Рязань, 1970. – 17 с. 178. Шекунова Е. с соавт. Аскохитоз огурцов / Е.Шекунова, М.Элбакян // Картофель и овощи. – 1969. - № 9. – С.43-44. 179. Шеметков М.Ф. Пчеловодство на службе тепличного овощеводства // Пчеловодство. – 1979. - № 1. – С.2-4. 180. Шеметков М.Ф. с соавт. Использование пчел для опыления культур закрытого грунта / М.Ф.Шеметков, Н.И.Смирнов // Советы пчеловоду. – Минск: Ураджай, 1975. – С.231-250. 181. Шеметков М.Ф. с соавт. На Минской овощной фабрике / М.Ф.Шеметков, А.П.Пученя // Пчеловодство. – 1971. - № 4. – С.12-13. 183. Шендеров Б.А. Медицинская микробная биология и функциональное питание. – М., 2001. – Т.3. – С.288. 184. Шипилов А.Г. Средняя продолжительность жизни рабочих пчел // Пчеловодство. – 2008. - № 8. – С.28-29. 123 185. Шишкина Г.А. Крылатые помощники. О токсичности пестицидов для шмелей // Теплицы России. – 2008. - № 3. – С.41-43. 186. Шмайлов Д.А. Эффективность производства и реализации тепличных овощей / Автореф. дисс… канд. экон. наук. – Воронеж, 2004. – 24 с. 187. Шуваев В.А. Малообъемная технология выращивания огурцов с подкормкой жидкой углекислотой // Теплицы России. – 2007. - № 3. – С.4951. 188. Щукина М.Г. Проведение мероприятий по защите растений огурца на «светокультуре» // Теплицы России. – 2009. - № 1. – С.29-30. 189. Элбакян М.А. с соавт. Аскохитоз / М.А.Элбакян, М.Д.Оликер // Распространенность болезней овощных культур в закрытом грунте (Методические указания). – Ленинград, 1972. – С.18-22. 190. Элбакян М.А. с соавт. Аскохитоз огурцов в закрытом грунте / М.А.Элбакян, Е.Шикунова // Микология и фитопатология. – 1972. – Т.6. – Вып.3. – С.48-52. 191. Armbruster L. Die Warmehaushalt im Bienenvom / L.Armbruster. - Berlin: Pfenningstorff. – 1923. – P.15-18. 192. Bachmetjev P. Experimentalle entomologische studien vom physikalisch-chemischen Standpunkte aus / P.Bachmetjev. – Sophia, 1907. – P.45. 193. Bachmetjev P. Über die Temperatur der Insecten nach Biobachtungen in Bulgarien / P.Bachmetjev //Z. wiss Zool. – 1899. – V.66. – P.521-604. 194. Bailey L. The effect of temperature on the pathogenicity of the fungus Ascosphaera apis for larvae of the honey bee Apis mellifera, “insect Pathology and Microbial Control” // Ed. P.A. vander Laan, Amsterdam, 1966. – P.162-167. 195. Betts A.D. Fungus diseases of bees // Bee World. – 1919. – 1:52. 196. Bierhusen J.F. et al. Some aspects of seed germination in vegetables / J.F.Bierhusen, W.A.Wagenvoort // Sci Hortic. – 1974. – Vol.2. – P.213-219. 197. Borchert A. Krankheiter der Honigbiene. – Berlin: Richard Schoets, 1939. 124 198. Brizard A. et al. Motions essentielles de pathologic apicole / A.Brizard. J.Albisetti // Nademecum de L’information et la documentation en apiculture. – 1982. – P.288. 199. Burgett D.M. Antibiotic system of honey, nectar and pollen in Morse.R.A. (ed) Honey Bee pests, predators and diseases. Comstock and Cornell University Press: Itruca.NY. USA, 1978. 200. Corkins C.L. The metabolism of the honeybee colony during winter / C.L.Corkins // Bull. Wyo. Agric. Exp. Sta. – 1930. – Iss.175. – P.1-54. 201. Darchen R. La thermoregulation et l’écologie de quelques especes d’abeilles sociales d’Alfrique (Apidae, Trigonini) et Apis mellifera var, Adansoniï / R.Darchen // Apidologie. – 1973. – V.4. – Iss.4. – P.341-370. 202. Ditman L.P. Undercooling and freezing of insects / L.P.Ditman, G.P.Vogkt, R.S.Durgh // Econ. Entomol. – 1943. – V.32. – N.2. – P.304-311. 203. Dunham W.E. The influence of external temperature of the hive temperatures during the summer / W.E.Dunham // J. Econ. Entomol. – 1929. – Iss.33. – P.798-801. 204. Eriksson O., Hawksworth D. Outline of the Ascomycetes. Sustema Ascomycetum. – 1984. 4: 1-79. 205. Free J.B. Factors determining the collection of pollen by honeybee foragers / J.B.Free // Anim. Behav. – 1967. – V.15. – Iss.1. – P.134-144. 206. Free J.B. Insect Pollination of crops / J.B.Free. – London and New York: Academic Press, 1970. – 544 p. 207. Free J.B. The seasonal regulation of drone brood and drone adults in a honeybee colony / J.B.Free. Praceedings, VIIIth Congress of the International Union for the Study of Social Insects. – Wageningen, 1977. – P.207-210. 208. Furuya K. et al. Occurrence of chalk brood disease in honey bee larvae in Japan / K.Furuya, K.Takatori, O.Sonobe, T.Mabuchi // Transactions of the Mycological society of Japan. – 1981. – 22 : 127-133. 209. Gates B.N. The temperature of the bee colony / B.N.Gates // Bull. U.S. Dep. Agric. – 1914. – N.96. – P.1-29. 125 210. Gilliam M. Microbiology of pollen and bee bread: The genus Bacillus // Apidologie. – 1979. – 10 : 265-274. 211. Glinski Z. et al. Perspektywy zvalczania grzybic pszczely miodnej z uwzglednieniem immunomodulacych efektow lekow przeciwgrzybiczych / Z.Glinski, J.Rzedzicki, T.Wolski, L.Kauko // Ann. Umes DD. – 1998. - № 53. – P.201-216. 212. Glinski Z., J.Jarosz. Microflora et the honey bee Apis mellifera (in Polish) // Postepy Micribiologii XXVII. – 1988. – 95-108. 213. Gochnauer T. et al. Decontaminating effect of ethylene oxide on honeybee larvae previously killed by chalkbrood disease / T.A.Gochnauer, V.J.Margetts // J. Apis Res.. – 1980. – 19(4): 261-264. 214. Himmer A. Der soziale 1 Wärmehaushalt der Honigbiene, I. Die Wärme im nicht – brütenden Wintervolk / A.Himmer // Erlanger J. Bienen. – 1926. – N.4. – P.1-51. 215. Himmer A. Ein Beitrag zur Kenntnis des Wärmehaus-halts im Nestbau sozialer Huntllü / A.Himmer // Z.Vergl.Physiol. – 1927. – N.5. – P.375-389. 216. Himmer A. Körpertemperaturmessungen an Bienen and anderen Insekten / A.Himmer // Erlanger J. Bienen. – 1925. – N.3. – P.44-115. 217. Hunter J.O. A review of the role of the gut microflora in irritable bowel syndrome and the effects of probiotics / J.O.Hunter, J.A.Madden // Br. J. Nutr. – 2002. – Vol.88 (suppl.1). – P.67-72. 218. Jander R. Grooming and pollen manipulation in bees (Apoidea): the nature and evolution of movements involving the loreleg / R.Jander // Phisiol. Entomol. – 1976. – Iss.1. – P.179-194. 219. Kazimierczak-Baryczko M. et al. Zastosowanie preparatow probiotycznych w zywieniu pszczoly miodnej (Apis mellifera L.) namiastkami pylku kwiatowego / Materialy z XLI naukowej konferencji pszczelarskiej. – Pulawy, 2004. – S.9-10. 220. Krogh A. Determination of temperature and heat production in insect / A.Krogh // Z.Vergl. Physiol. – 1948. – N.31. – P.274-280. 126 221. Lahitte J.D. Les mycoses // Bull. tech. apis. – 1983. – V.23. – P.87-89. 222. Lensky Y. The inhibiting effect of the queen bee (Apis mellifera L.) foot-print pheromone on the construction of swarming queen cups / Y.Lensky, Y.Slabezki // J. Insect Physiol.. – 1981. – V.27. – Iss.5. – P.313-324. 223. Maasen A. Weitere Mitteilungen über die seuchenhatten Brutkraukheiten der Bienen. Mitteilungen ans der Kaiserlinen Austalt fur Landund Forstwirtschaft. – 1913.14. – P.48-58. 224. Martinka E. Prevencion protiv zvapenateniu vcelieho plodu // Vcelar. – 1994. – R.68. – S.52. 225. Maurizio A. Beitrage zur Kenntnis der Pilzflora im Bienenstock. I Die Pericystis-Intection der Bienenlarven // Berichte der Schweizerischen Botanischen Gesellschaft. – 1935. – 44:133-156. 226. Morse R.A., Flottum K. Honey Bee Pests, Predators and Diseases / Al. Root company. – Medina, Ohio, USA, 1997. – 719 p. 227. Nijhout H.F. Juvenile hormone and the physiological basis of insect polymorphisms / H.F.Nijhout, D.E.Wheeler // Quarterly Reviev of Biology. – 1982. – V.57. – Iss.2. – P.109-133. 228. Payne N. Freezing and survival of insects at low temperarures // Journ. Morphol. – 1928. – V.43. – P.521-546. 229. Pirsch G.B. Studies on the temperature of individual insects, with special reference to the honeybee / G.B.Pirsch // J. Agric. Res. – 1923. – Iss.24. – P.275287. 230. Prokschl H. Beitrage zur Kenntnis der Entwicklundsgeschichte von Pericystis apis Maassen // Archiv für Mikrobiologie. – 1953. – 18 : 198-209. 231. Rust K. et al. Effects of temperature and host developmental stage on Ascosphaera torchioi / K.Rust, J.Torchio // Apidologie. – 1992. – 23 : 1-9. 232. Rutz W. On the function of juvenile hormone in worker honeybees / W.Rutz et al. // J. Insect Physiol. – 1976. – Iss.22. – P.1485-1492. 233. Seeley T. Regulation of temperature in the nests of social insects / T.Seeley, B.Heinrich // Insect thermoregulation. – New York, 1981. – P.160-234. 127 234. Simpson J. Humidity in the winter cluster of a colony of honeybees / J.Simpson // Bee World. – 1950. – Iss.31. – P.41-43. 235. Stephen W. et al. Etiologiy and epizootology of chalkbroad in the leafcyttin bee, Megachila rotindata (Fabricius), with notes on Ascosphaera species / W.Stephen, J.Wandenbery, B.Fichter // Bull. Agric. Exper. St. Oregon St. Vniv, 1981. – N.653. Corvallis. 236. Wenner A.M. Infomation transfer in honey-bees. A population approach / A.M.Wenner, L.Krames, T.Alloway // Advances in the study of communication and affect, vol.1 Non-verlal communication. – New York and London: Plenum Press, 1974. – P.133-169. 237. Wilson H.F. Winter protection for the honeybee colony / H.F.Wilson, V.G.Milum // Res. Bull. Wis. Agric. Exp. Sta. – 1927. – Iss.75. – P.1-47. 128 ПРИЛОЖЕНИЕ Приложение 1 Динамика микроклимата теплиц блочного типа в течение технологического цикла выращивания зимне-весеннего культурооборота огурца (февраль, март, n = 30) Наименование Месяц, декада показателя Февраль 1 Март 2 3 1 2 3 день ночь день ночь день ночь день ночь день ночь день ночь 21,7± 17,4± 22,6± 18,0± 22,2± 17,0± 21,5± 15,3± 25,8± 11,1± 26,6± 11,8± 1,44 1,23 0,83 1,64 1,84 1,16 1,30 1,22 1,90 0,92 1,53 1,24 Относительная 68,3± 70,4± 72,5± 75,3± 76,6± 78,1± 78,4± 79,6± 82,3± 85,3± 90,1± 93,2± влажность, % 4,35 1,42 2,13 2,44 2,56 1,86 3,12 2,76 2,36 2,36 3,26 2,86 Углекислый газ, 0,04± 0,05± 0,07± 0,05± 0,8± 0,2± 0,7± 0,6± 1,05± 0,48± 1,1± 0,74± % 0,008 0,011 0,009 0,008 0,15 0,02 0,08 0,09 0,17 0,144 0,16 0,06 Температура, 0С 129 Приложение 2 Динамика микроклимата теплиц блочного типа в течение технологического цикла выращивания зимне-весеннего культурооборота огурца (апрель, май, n = 30) Наименование Месяц, декада показателя Апрель 1 Май 2 3 1 2 3 день ночь день ночь день ночь день ночь день ночь день ночь 27,1± 16,8± 23,5± 20,3± 26,0± 20,0± 25,8± 19,1± 27,5± 19,9± 26,9± 20,3± 1,70 1,62 1,44 1,26 2,30 1,84 1230 1,18 1,36 1,46 2,06 1,12 Относительная 85,0± 89,0± 90,4± 91,0± 88,0± 90,2± 90,1± 94,5± 92,2± 95,2± 95,8± 97,5± влажность, % 2,18 2,00 3,12 2,38 1,68 1,84 2,06 1,92 2,22 1,97 2,08 2,64 Углекислый газ, 1,0± 0,67± 1,2± 0,81± 1,0± 1,2± 0,8± 0,49± 0,7± 0,6± 0,8± 0,5± % 0,23 0,06 0,37 0,08 0,14 0,56 0,04 0,62 0,09 0,10 0,12 0,12 Температура, 0С 130 Приложение 3 Степень поражения пчелиных семей аскосферозом в процессе зимне-весеннего культурооборота огурцов Группа Даты клинического осмотра пчелиных семей 03.03 16.03 29.03 11.04 24.04 07.05 20.05 02.06 22,2 % - 22,2 % - 38,9 % - 38,9 % - I степень I степень I степень I степень поражения поражения поражения поражения Пораженных пчелиных семей, % Опыт Контроль - - - - - - 66,7 % - 66,7 % - 16,7 % - 33,3 % - 33,3 % - 33,3 % - I степень I степень I степень I степень I степень I степень поражения поражения поражения поражения поражения поражения 33,3 % - 33,3 % - 66,7 % - 66,7 % - II степень II степень IIIстепень IIIстепень поражения поражения поражения поражения 33,3 % - 33,3 % - II степень II степень поражения поражения 131 Приложение 4 Зоотехнические показатели производственных испытаний Группа пче- Обработка пче- линых семей линых семей Масса пчелиных семей Инвертированный Падеж нимающих участие в опылении через 3 месяца Контрольная Количество пчелиных семей, при- Δ, кг 0,5±0,17 шт. % % 2 33,3 66,7 11 61,1 38,9 Δ, % сахарный сироп Опытная ТАНГ – 3х109 м.к. на одну пчелиную семью в инвертированном сахарном сиропе 1,1±0,260 +0,6 -27,8 132 Приложение 5 Экономическая эффективность от применения препарата ТАНГ в ценах на 01.05.2010 г. Показатель Контрольная Опытная шт. % шт. % Количество работоспособных пчелиных семей в конце опыта 2 33,3 11 61,3 Количество пчелиных семей, утративших работоспособность через 4 66,7 7 38,9 3 месяца Прибыль от применения препарата ТАНГ в сравнении с контролем Коммерческая стоимость 1 кг пчел с маткой, расплодом (40-50 кв.) 27,8 3000 руб. + 3 кг меда Стоимость 1 опытной семьи массой 1,4-1,5 кг Затраты на препараты и обработки из расчета на каждые 10 пчели- 4300 руб. 1663,8 руб. ных семей Чистый доход от применения препарата ТАНГ из расчета на каждые 10 пчелиных семей 10290,2 руб.