В какой бы форме ни проводился экзамен, главным условием
реклама

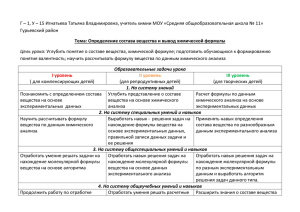
Подготовка школьников к ЕГЭ по химии Пильникова Н.Н. МОУ СОШ № 147 Главным условием успешной сдачи экзамена является хорошее знание предмета. Проведение экзамена в тестовой форме дополнительно требует наличия у испытуемого определённых навыков, развитию которых может и должен помочь учитель. Как же организовать в условиях школы качественную подготовку к ЕГЭ по химии? Прежде всего, подготовка к ЕГЭ должна носить тематический характер. Занятие должно быть посвящено разбору заданий одной темы, а не сплошному выполнению КИМов прошлых лет. После изучения конкретной темы мы предлагаем учащимся работу с тематическими тестами: вначале это фронтальное обсуждение тестовых заданий, затем индивидуальная работа с аналогичными заданиями. Особое место в содержании контрольно-измерительных материалов единого государственного экзамена по химии уделено расчётным задачам. В контрольно-измерительных материалах ЕГЭ нашли отражение все типы расчётных задач, определённые требованиями к уровню подготовки выпускников общеобразовательной школы: 1) вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; 2) расчеты объемных отношений газов при химических реакциях; 3) расчеты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ; 4) расчеты теплового эффекта реакции; 5) расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси); 6) расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества; 7) нахождение молекулярной формулы вещества; 8) расчеты: массовой или объемной доли выхода продукта реакции от теоретически возможного; 9) расчеты массовой доли (массы) химического соединения в смеси. Рассмотрим подробнее формирование у учащихся навыка в решении расчётных задач на примере задания С5 – «нахождение молекулярной формулы вещества». В первую очередь, учитель должен провести «сортировку» задач соответствующего блока с целью планомерного формирования у школьников умений решать различные задачи данного типа. Так, среди задач на вывод молекулярной формулы органического вещества можно выделить следующие разновидности: 1) Определение молекулярной формулы вещества с использованием общей формулы класса и массовым долям образующих его элементов. Пример: Массовая доля кислорода в предельной одноосновной карбоновой кислоте составляет 43,24 %. Определите молекулярную формулу этой кислоты. (С2Н5СООН) 2) Определение молекулярной формулы вещества с использованием общей формулы класса и расчёту молекулярной массы вещества. Пример: Относительная плотность по водороду алкина равна 20. Выведите формулу этого вещества. Какому ещё соединению может отвечать эта формула? (C3H4) 3) Определение молекулярной формулы вещества с использованием плотности или относительной плотности газов. Пример: Установите молекулярную формулу углеводорода, массовая доля углерода в котором равна 82%, а плотность этого газа при нормальных условиях равна 1,97 г/л. (C3H8) 4) Определение молекулярной формулы вещества по продуктам его сгорания. А) Не указана плотность органического вещества. Пример: При сгорании 9 г первичного амина выделилось 2,24 л азота (н.у.). Определите молекулярную формулу амина. (C2H5NH2) Б) Дана плотность (относительная плотность) органического вещества Пример: Плотность паров органического вещества по кислороду равна 1,875. При сгорании 15 г этого вещества образуется 16,8 л углекислого газа (при н.у.) и 18 г воды. Определите состав органического вещества. (C3H8O) 5) Определение молекулярной формулы вещества по уравнениям химических реакций. А) Указана одна химическая реакция. - Используется общая формула одного вещества. Пример: При взаимодействии 16,8 г непредельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 43,2 г. Выведите молекулярную формулу альдегида. (C2H3COH) - Используется общая формула двух веществ. Пример: При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. (C4H10) Б) Указаны две параллельно протекающие химические реакции. Пример: Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного или 101 г дибромпроизводного. (C3H6) В) Указаны две последовательно протекающие химические реакции. Пример: При взаимодействии монохлоралкана с 2,3 г натрия образовался углеводород, который при дегидрировании образовал 1,4 г алкена. Определите состав монохлоралкана. (CH3Cl) На основе анализа задач на вывод формулы органического вещества, приводимых в С5, для подготовки учащихся к их правильному решению необходимо: • Повторить классификацию и свойства органических веществ (не зная формул и свойств веществ, нельзя правильно составить уравнение реакции и решить задачу); • Повторить общие формулы основных классов органических веществ, научить преобразовывать эти общие формулы для записи различных производных органических соединений; • Научить составлять химические уравнения с использованием общих формул; Также необходимо повторить: • Расчёт молекулярной массы вещества по известной относительной плотности паров; плотности газов (г/л), известному объёму и массе газа; • Расчёты по общей формуле органического вещества на нахождение «n»; • Расчёт массовой доли химического элемента в сложном веществе и обратные задачи; • Расстановку коэффициентов в уравнениях реакций горения (используя «n»); • Решение задач на вывод формулы органического вещества по уравнению реакции горения; • Решение задач на объёмные отношения газов; • Качественные реакции на кратную связь и функциональные группы органических веществ; Потренироваться: • В составлении пропорций и их решении; • В решении комбинированных задач (с использованием массовой доли растворённого вещества, молярной концентрации, плотности раствора и т.п.); • В решении задач на последовательно протекающие реакции. Таким образом, при подготовке учащихся к ЕГЭ повторение и углубление теоретического материала должно идти параллельно с его практическим применением (в частности, с решением расчётных задач). Самое главное, что необходимо помнить как учителю, так и ученику: не запоминание, а понимание; не заучивание отдельных тем, а целостный подход к предмету - являются ключом к успешной сдаче единого государственного экзамена.