Федеральное агентство по образованию
реклама

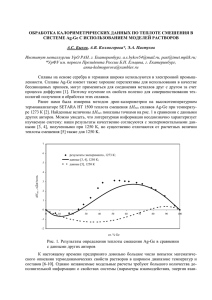
Федеральное агентство по образованию ГОУ ВПО «Уральский государственный технический университет - УПИ» Определение избыточной мольной изобарной теплоемкости раствора Методические указания к электронной лабораторной работе по физической химии для студентов дневной формы обучения химико-технологического факультета и факультета строительного материаловедения Екатеринбург 2008 УДК 544(076)С79 Составитель Е.И.Степановских Научный редактор доц., канд. хим. наук Л.А.Брусницына Определение избыточной мольной изобарной теплоемкости раствора: методические указания к электронной лабораторной работе по физической химии / Е.И.Степановских .Екатеринбург: УГТУУПИ, 2008. 28 с. Методические указания к лабораторной работе содержат краткий теоретический материал, рекомендации по проведению работы, необходимые справочные данные. Библиогр.: 8 назв. Табл. 2. Рис. 7. Прил. Подготовлено кафедрой «Физическая и коллоидная химия». © Уральский государственный технический университетУПИ, 2008 2 В основу электронной лабораторной работы положен анализ температурных зависимостей энтальпий смешения четырех различных растворов. Цели лабораторной работы: проработка теоретического материала по функциям смешения, избыточным функциям; анализ концентрационных и температурных зависимостей мольных энтальпий смешения; графическое определение избыточной мольной изобарной теплоемкости при разных составах растворов; сравнение полученных графических результатов с расчетными значениями избыточной теплоемкости. Для успешного решения поставленных целей в методических материалах приведены краткие теоретические сведения по рассматриваемому вопросу, методика графического определения избыточной изобарной теплоемкости раствора и необходимый материал для расчета избыточной изобарной теплоемкости раствора и анализа зависимостей энтальпий смешения растворов от концентрации и температуры. 1. ИДЕАЛЬНЫЕ И НЕИДЕАЛЬНЫЕ РАСТВОРЫ. ФУНКЦИИ СМЕШЕНИЯ. ИЗБЫТОЧНЫЕ ФУНКЦИИ 1.1. Идеальные и неидеальные растворы В теории растворов рассматриваются два основных класса: идеальные и неидеальные (реальные) растворы. Согласно [1], идеальным считается такой раствор, в котором для каждого компонента при всех значениях давления (p), температуры (T) и мольной доли (Nk) справедливо выражение зависимости химического потенциала компонента в этом растворе kèä (T , p, N k ) следующего вида: 3 kèä (T , p, N k ) kñò (T , p) RT ln N k , (1) где kñò (T , p) – стандартный химический потенциал компонента k раствора, являющийся функцией давления и температуры. Стандартный химический потенциал компонента k – это потенциал при мольной доле этого компонента равной единице. Стандартное состояние может быть реальным и гипотетическим. В зависимости от того, какое состояние компонента принимают за его стандартное состояние, различают три модели идеальных растворов: идеальный газовый раствор, идеальный совершенный раствор и идеальный предель- норазбавленный раствор [2]. В идеальном газовом растворе за стандартное состояние принято состояние компонента k в виде чистого идеального газа kñò (T , p) ko.èä (T , p) , (2) т.е. выражение (1) в этом растворе имеет вид: kèä (T , p, N k ) kî.èä (T , p) RT ln N k . Зависимость (3) ko.èä (T , p) известна, она определяется уравнением для чистого идеального газа вида k: ko,èä (T , p) kx (T , [ p]) RT ln p , [ p] (4) где kx (T , [ p]) – стандартный химический потенциал чистого идеального газа вида k, зависящий от температуры и выбора единиц измерения давления; p – давление газа; [p] – единица размерности давления. Рассматривая совместно уравнения (3), (4), получаем: N p kèä (T , p, N k ) kx (T ,[ p]) RT ln k , (5) p kèä (T , p, N k ) kx (T ,[ p]) RT ln k , (6) [ p] [ p] 4 где p k pN k – парциальное давление компонента k в идеальном газовом растворе. В идеальном совершенном растворе за стандартное состояние любого компонента k раствора принимают его состояние в виде чистого вещества. kñò (T , p) ko (T , p) . (7) Выражение для химического потенциала компонента k в этом растворе будет иметь следующий вид: kèä (T , p, N k ) ko (T , p) RT ln N k . (8) Идеальные совершенные растворы – это растворы, в которых и растворитель и растворенные вещества обладают сходным химическим строением и имеют близкие термодинамические характеристики, например растворы оптических изомеров, или растворы изотопов. Идеальный предельно - разбавленный раствор – это раствор, в котором стандартные состояния для растворителя и растворенных веществ различны. Для растворителя за стандартное состояние здесь тоже принимают состояние в виде чистого вещества, т.е. будут справедливы соотношения (7) и (8), а для растворенных веществ за стандартное состояние принимают их состояние в предельно - разбавленном растворе: 2ñò (T , p) 2θ(T , p) . (9) Это состояние гипотетическое, причем 2θ(T , p) 2o (T , p) . (10) Располагая уравнением для химического потенциала компонента раствора и используя общие термодинамические соотношения, нетрудно получить выражения и для других термодинамических функций. Например, зная, что g g k k ; sk k T h ; g k hk Ts k ; c p ,k k T p , p (11) Получим для компонента k идеального совершенного раствора следующие соотношения 5 g kèä ok (T , p) RT lnN k ; o hèä k hk (T , p) ; o s èä k sk (T , p) R ln N k ; c èäp, k c op ,k (T , p) . (12) Из анализа этих соотношений видно, что парциальные мольные энтальпия и изобарная теплоемкость компонента k идеального совершенного раствора не зависят от его состава и совпадают с мольными свойствами, характеризующими этот компонент как чистое вещество. Зависимость химического потенциала компонента неидеального (реального) раствора ( k (T , p , N k ) ) от концентрации можно записать в виде k (T , p , N k ) ñò k (T , p) RT ln ak , (13) где kñò (T , p) – стандартный химический потенциал компонента k раствора; a k – активность компонента k в растворе, определяемая как a k N k k ( k – коэффициент активности). Использование коэффициентов активности и активностей в уравнениях зависимости химического потенциала компонента неидеального раствора от концентрации позволяет сохранить простое формальное сходство с подобными уравнениями для идеальных растворов. Зависимость химического потенциала компонента k реального раствора от состава раствора в настоящее время устанавливают путем сравнения свойств компонента в реальном растворе с его свойствами в каком-либо идеальном растворе такой же концентрации. Тип идеального раствора выбирают по сходству реального раствора с идеальным: если это смесь газов, то разумно использовать идеальный газовый раствор; если это жидкий раствор с очень малой концентрацией растворенного вещества в растворителе, то удобно использовать идеальный предельно–разбавленный раствор и т.д. Следовательно, имеются три системы сравнения (по числу типов идеальных растворов) [2]: на основе идеального газового раствора, идеального совершенного раствора, идеального предельноразбавленного раствора. Две пер6 вые называются симметричными системами сравнения, последняя – несимметричной. В некоторых учебниках говорится, что существуют два способа нормировки [1] или два способа выбора стандартного состояния: симметричный и несимметричный [3]. В работе [2] подробно рассмотрено различие между этими системами сравнения. Если остановиться на этом кратко, то в симметричной системе коэффициенты активности компонентов k становятся равными единице в каждом из чистых компонентов (или в чистом идеальном газе). В несимметричной системе сравнения условия приближения коэффициентов активности к единице различны: для растворителя 1 1 при N1 1 , а для растворенного вещества 2 1 при N 2 0 . Из одной системы сравнения нетрудно переходить в другую систему сравнения [13]. Обычно принято указывать, в какой системе приведены коэффициенты активности: в симметричной системе сравнения на основе идеального совершенного раствора – ko ; на основе идеального газового раствора – kx и т.д. Выражение для химического потенциала компонента k неидеального раствора в симметричной системе сравнения относительно идеального совершенного раствора имеет вид k (T , p , N k ) ok (T , p) RT ln N k ok . (14) Запишем уравнения состояния, характеризующие реальный раствор, относительно симметричной системы сравнения в Nшкале для парциальных мольных энергии Гиббса ( g k ), энтропии ( sk ), энтальпии ( hk ) и изобарной теплоемкости ( c p ,k ). g k ok (T , p) RT ln N k ok ; ln o o o k s k sk (T , p ) R ln N k k RT T p ,nk 7 ; o o 2 ln k h k hk (T , p ) RT T ; p ,nk o 2 ln k o c p, k c p ,k (T , p) 2 RT T p ,nk o 2 2 ln k RT 2 T . (15) p ,nk Из анализа этих уравнений видно, что для полного описания свойств реального раствора нужно знать сведения о зависимостях коэффициентов активности компонентов от температуры. Известно, что коэффициент активности компонента является мерой отклонения свойств этого компонента в неидеальном растворе от свойств его же в идеальном растворе, в частности частная производная логарифма коэффициента активности по температуре связана с изменением свойств парциальной мольной энтальпии компонента раствора [4] hk hkèä ln k , T p RT 2 (16) где hk , hkèä – парциальные мольные энтальпии компонента k в неидеальном и идеальном растворе соответственно. 1.2. Функции смешения Изменение экстенсивных свойств при образовании растворов удобно оценивать, используя специальные функции – функции смешения [1, 2, 4]. Функция смешения – это изменение термодинамических функций Е при образовании раствора из чистых компонентов. Принято рассматривать процесс смешения, когда все компоненты находятся в одинаковом агрегатном состоянии, при одной и той же температуре и одинаковом давлении. В обозначении этой функции присутствует оператор и верхний индекс m от англ. mix. Известны парциальные мольные функции смешения ( ekm ), мольные функции смешения ( e m ) и полные (или интегральные) функции 8 смешения ( E m ). Между ними существуют те же соотношения, что и между парциальными мольными свойствами компонентов, мольными и полными свойствами раствора. Парциальная мольная функция смешения, записанная для любого экстенсивного свойства E: ekm ek eko , (17) где ekm – парциальная мольная функция смешения компонента k; ek – парциальное мольное свойство компонента k в растворе; eko – мольное свойство чистого вещества k. Мольная функция смешения будет равна e m E m N k ekm . n k (18) Полная функция смешения найдется из соотношения E m ne m nk ekm . (19) k Понятия функций смешения и соотношения (17)(19) можно использовать для любой термодинамической функции и для любого раствора (идеального или реального). Запишем выражения для некоторых парциальных мольных функций смешения для реального раствора относительно симметричной системы сравнения в N шкале: o g km m k RT lnN k k ; ln o m o k s k R ln N k k RT T o m 2 ln k hk RT T ; p ,nk ; p ,nk 9 o 2 ln k m c p, k 2 RT T p ,nk 2 o 2 ln k RT 2 T . (20) p ,nk Если реальный раствор близок к идеальному, т.е. имеем идеальный совершенный раствор, в котором ko равен единице, тогда из соотношений (20) следует: hkm,èä 0; ,èä ñm ð ,k 0. (21) Отсюда следует вывод, что образование идеальных растворов происходит без тепловых эффектов при смешении чистых компонентов при постоянных T и p. Причем, мольная энтальпия смешения идеального раствора тоже равна нулю h m N k hkm 0 , (22) k а мольная энтальпия идеального раствора ( h èä )может быть найдена по формуле h èä N k hko , (23) k где hko мольная энтальпия чистого вещества k. Аналогично рассуждая для мольной изобарной теплоемкости идеального раствора ( ñèä p )можно записать o ñèä p N k c p ,k , (24) k где c op ,k мольная изобарная теплоемкость чистого вещества k. 1.3. Избыточные термодинамические функции Разность между экстенсивным свойством неидеального (реального) раствора и таким же свойством идеального раствора называют избыточной функ- 10 цией. Избыточную функцию принято обозначать соответствующим символом экстенсивного свойства с верхним индексом Е – от англ. Еxcess – избыток). Существуют парциальная мольная функция ( ekE ), избыточная термодинамическая мольная избыточная функция ( e E ), полная избыточная функ- ция ( E E ). Соотношения между ними рассмотрим на примере энергии Гиббса, в симметричной системе сравнения и Nшкале. Парциальная мольная избыточная энергия Гиббса компонента k: o g kE g k g kèä k èä k RT ln k . Мольная избыточная энергия Гиббса будет равна g E GE N k g kE RT N k ln ok . n k k Полная избыточная энергия Гиббса найдется из соотношения G E ng E nk g kE RT nk ln ok . k k С учетом определения избыточных функций выражение (16) преобразуется к виду: hkE ln k , 2 T p RT (25) где hkE – избыточная парциальная мольная энтальпия компонента k . Парциальная мольная избыточная энтальпия найдется из (25): o E 2 ln k hk R T T . p, nk Избыточные термодинамические функции связаны с экспериментально измеряемыми на опыте величинами. Избыточная функция Гиббса связана с давлением пара над раствором. Избыточная мольная энтальпия – это энтальпия смешения реального раствора при постоянном давлении, отнесенная к 1 молю раствора. 2. ОСНОВНЫЕ ТИПЫ РЕАЛЬНЫХ РАСТВОРОВ 11 Процессы, происходящие при образовании растворов сложны и многообразны. Отклонения свойств реального раствора от свойств идеального раствора можно объяснить наличием межмолекулярного взаимодействия в реальном растворе. Как указано в работе [5] условно все соединения, из которых образуются растворы, можно разделить на следующие типы: тип N : молекула не содержит ни протоннодонорных групп, ни электроннодонорных групп, она неполярна (насыщенные углеводороды, CCl4 , CS2, C6H6); тип АВ: молекула содержит и протоннодонорные группы, и электроннодонорные группы (вода, спирты, карбоновые кислоты, первичные и вторичные амины); тип А: молекула содержит протоннодонорную группу, электроннодонорной группы нет (галогенсодержащие соединения с числом атомов галогенов, достаточным для активации водорода: CHCl3 , C2HCl5 и т.д.); тип В: молекула не содержит протоннодонорной группы, но содержит электроннодонорную группу (кетоны, альдегиды, простые и сложные эфиры, третичные амины, олефины). При образовании растворов из соединений разных типов возможно появление систем с разными видами межмолекулярного взаимодействия. Следовательно, и виды зависимостей энтальпий смешения от концентрации и темпе- ратуры будут различны. Прежде всего, все типы систем можно разделить на два больших класса: системы без образования водородных связей и системы с наличием в растворах водородных связей. Водородная связь это взаимодействие, которое существует между функциональной группой АН и атомом или группой атомов В той же или другой молекулы. В водородной связи особое участие принимает атом водорода, уже связанный с каким-то другим атомом. 12 К системам без образования водородных связей относятся растворы, образованные соединениями N+N; N+А; N+B; A+A; B+B. В этой группе систем взаимодействие между молекулами обусловлено чисто дисперсионными силами, и наблюдаемые зависимости наиболее простые. Тепловые эффекты смешения в таких системах невелики, смешение происходит с поглощением тепла ( h m > 0). Многообразие форм зависимостей энтальпий смешения от концентрации и температуры наблюдается во втором классе растворов системах с наличием либо в чистых соединениях, либо образующихся в растворах водородных связей. Взаимодействие с возникновением водородной связи характеризуется значительно большей энергией, чем взаимодействие, обусловленное ван-дер- ваальсовыми силами. Поэтому именно процессы образования и разрыва водородных связей определяют величины энтальпий смешения, их зависимость от концентрации и температуры. В свою очередь бинарные системы, в которых наблюдается образование водородных связей, можно разделить на четыре группы. Рассмотрим особенности каждой из этих групп. Группа растворов типа AB + N. Это системы, в которых водородные связи образуются только между молекулами одного из компонентов (АВ). Следовательно при образовании раствора будет наблюдаться разрыв водородных связей. Рассмотрим межмолекулярное взаимодействие в растворах этой группы на примере смеси спиртов с углеводородами. тетрахлорметаном . При взаимодействии молекул спирта друг с другом главный эффект - образование водородных связей, поэтому чистые спирты являются, как известно, ассоциированными жидкостями. В растворах спиртов в углеводородах также образуются ассоциаты из молекул спирта, причем если концентрация спирта не очень мала, то имеется существенный вклад в наблюдаемое свойство раствора от диполь-дипольного взаимодействия между ассоциатами. Кроме того, значения термодинамических функций смешения зависят от длины углеводородного радикала молекулы спирта и природы неполярного компонента. Для систем 13 рассматриваемой группы характерны положительные значения энтальпий смешения, что и понятно, поскольку определяющим процессом является разрыв водородных связей между молекулами полярного компонента при образовании раствора. Максимум на кривых h m f ( N 2 ) для всех систем данной группы сдвинут в сторону неполярного компонента, что может быть объяснено следующим образом. Растворение полярного соединения (например, спирта) в неполярном растворителе (типа насыщенных углеводородов) ведет к разрыву всех водородных связей, существующих между молекулами полярного соединения; в то же время при противоположном процессе – растворении углеводорода в спирте – значительная доля водородных связей может сохраняться. Естественно, что в первом случае эндотермический эффект растворения будет большим. Температурный коэффициент теплоты смешения достаточно велик и положителен. Возрастание эндотермичности эффекта при повышении температуры, по-видимому, можно объяснить тем, что с ростом температуры водородные связи в растворе разрушаются легче, чем в чистой полярной жидкости. Иначе говоря, степень ассоциации для молекул, например, спирта при повышении температуры уменьшается в растворе в большей степени (относительно), чем в чистом спирте. Группа растворов типа А + В или А + АВ. Это системы, в которых водородные связи образуются только между молекулами разных сортов. Причем в случае растворов типа А + В наблюдается только образование водородных связей в растворе, а для смесей типа А + АВ наблюдается как разрыв имеющихся в чистых веществах связей, так и образование новых. Для систем этой группы характерно, что термодинамические функции образования раствора в основном определяются химическим взаимодействием между разноименными компонентами А и В с образованием молекулярных комплексов типа Ax B y , а «физические» эффекты (универсальное взаимодействие, различие в размерах частиц и т.д.) составляют лишь малый вклад в общее взаимодействие. Такие системы характеризуются очень большими экзотермическими эффектами сме14 шения, достигающими нескольких кДж/моль. Системы этой группы отличаются тем, что молекулы одного компонента характеризуются донорными свойствами , но не содержат активных атомов водорода, а молекулы другого компонента, наоборот, характеризуются только акцепторными свойствами. Кривые h m f ( N 2 ) близки к симметричным, в небольшой степени максимум смещен в сторону акцептора. При повышении температуры уменьшается экзо- h m 0. Избыточные изобарные мольтермический эффект смешения: T p ные теплоемкости достаточно велики. Группа растворов типа AB + В. Это системы, в которых водородные связи образуются между молекулами одного из компонентов и между разнородными молекулами. Системы этой группы отличаются сложностью межмолекулярных взаимодействий. При образовании раствора разрыв водородных связей между молекулами одного из компонентов может частично или полностью компенсироваться образованием новых связей между молекулами разных сортов: значительный вклад в суммарный результат могут внести также ориентационный и индукционный эффекты. Соответственно наблюдается большое разнообразие в диаграммах смешения – состав. Характерной особенностью является несимметричность кривых h m f ( N 2 ) – во многих случаях они принимают S-образную форму. При этом область экзотермического эффекта смешения, как и следовало ожидать, всегда смещена в сторону компонента, молекулы которого обладают большей способностью к образованию водородных связей. Для рассматриваемой группы растворов повышение температуры увеличивает эндотермичность эффектов смешения. Группа растворов типа AB + АВ. Это системы с водородными связями между молекулами всех типов. Системы этой группы имеют много общего с системами, отнесенными к третьей группе. Поскольку оба компонента обладают способностью к образованию водородных связей как между молекулами одного сорта, так и между молекулами разнородными, создается еще больше 15 возможностей для взаимной компенсации эффектов разрыва и появления связей различных типов. По абсолютной величине теплоты смешения обычно сравнительно невелики, что может быть вызвано тем, что отдельные эффекты частично компенсируют друг друга. Для рассматриваемых систем типична резкая зависимость энтальпий смешения от температуры, причем температурный h m 0. коэффициент мольной теплоты смешения T p 3. ОПРЕДЕЛЕНИЕ МОЛЬНОЙ ИЗБЫТОЧНОЙ ИЗОБАРНОЙ ТЕПЛОЕМКОСТИ РАСТВОРА Для каждого раствора энтальпия смешения непосредственно связана с энергией межмолекулярного взаимодействия в жидкой фазе и является суммарной величиной энергетических процессов, сопровождающих образование раствора. В лабораторной работе необходимо проанализировать концентрационные и температурные зависимости мольных энтальпий смешения при образовании одного из предлагаемых растворов и определить двумя способами избыточную мольную изобарную теплоемкость раствора. Поскольку за время, отведенное на лабораторную работу, невозможно получить достаточное количество данных для построения зависимостей энтальпий смешения от температуры, цифровой материал будет взят из литературы, посвященной этому вопросу [58]. Напомним, что разность между мольным экстенсивным свойством e неидеального (реального) раствора и таким же свойством e èä идеального раствора называют мольной избыточной функцией реального раствора относительно идеального e E e e èä . (26) Следовательно, мольная избыточная изобарная теплоемкость бинарного раствора будет равна 16 èä ñE c p (c op ,1 N1 c op ,2 N 2 ) , p cp cp (27) а мольная избыточная энтальпия h E h h èä h (h1o N1 h2o N 2 ) , где c p , c p èä мольные изобарные теплоемкости реального и идеального раствора; c op ,1 , c op ,2 мольные изобарные теплоемкости чистых веществ, образующих данный раствор; h1o , h2o мольные энтальпии чистых веществ, образующих данный раствор; N1 , N 2 мольные доли компонентов бинарного раствора. Отсюда вытекает расчетный способ определения мольной избыточной изобарной теплоемкости раствора при любом составе: он базируется на расчете c Ep по величине изобарной теплоемкости раствора данного состава cp при определенной N2 и известным мольным изобарным теплоемкостям чистых компонентов ñop ,1 и ñ op ,2 (27). Значения c p , ñop ,1 и ñ op ,2 берутся из Приложения к методическим указаниям. С другой стороны любую мольную избыточную функцию e E можно представить как разность между мольными функциями смешения при образовании реального ( e m ) и идеального растворов ( e m ,èä ). Например, мольная избыточная энтальпия h E может быть выражена через мольные функции смешения реального и идеального растворов, h m и h m ,èä : h E h m h m ,èä , (29) но из (22) известно, что h m ,èä = 0 , поэтому h E h m , т.е. избыточная энтальпия численно совпадает с энтальпией смешения реального раствора. Вместе с тем известно (11), что 17 E E h cp T h m . T p, nk p, nk (30) Отсюда появляется возможность определения избыточной мольной изобарной теплоемкости раствора c Ep графически по зависимости мольной энтальпии смешения от температуры. В этом способе ∆h , Дж/моль m определяют (∆h )2 А фициенту касательной тангенсу (∆hm)А m (∆h )1 1 производную h m по угловому коэф T p, nk 2 m графически угла наклона касательной (tg) к кривой h m (T ) в интересующей нас точке А (рис.1). Для выполнения лабораT, K T1 TА T2 торной работы иметь несколько необходимо концентраци- онных зависимостей мольной эн- Рис.1 тальпии смешения раствора, по- лученных при разных температурах, одном и том же давлении и естественно, при одном и том же составе. На их основе формируется табл. 1 с данными по зависимости энтальпий смешения от температуры (в растворе постоянного состава). Примерная форма табл. 1 приведена ниже. Таблица 1 Графическое определение мольной избыточной изобарной теплоемкости Мольная доля второго Мольная энтальпия смешения h m , Дж/моль при температуре 18 компонента 0,4 … 273 К -188 298 К -124 323 К -46 348 К 120 По этим данным строится графическая зависимость h m (T ) . Затем уточняется по заданию, при какой температуре нужно найти избыточную изобарную теплоемкость раствора, и к точке на кривой h m (T ) , соответствующей этой температуре проводится касательная. Затем по ней определяется угловой коэффициент касательной. Он равен h m (2) h m (1) , tg T(2) T(1) (31) где h m (2) , h m (1) ординаты двух произвольно выбранных достаточно удаленных друг от друга точек на касательной (точки 2 и 1); T(2) ,T(1) абсциссы этих точек. h m Но tg , а следовательно, определив угловой коэффициент T p, nk касательной к линии h m (T ) в точке, соответствующей температуре TA, мы графически нашли мольную избыточную изобарную теплоемкость раствора данного состава при этой температуре. Для нахождения c Ep при этой же температуре в растворе другого состава (другой мольной доле второго компонента) нужно повторить действия по построению зависимости h m (T ) (другая мольная доля второго компонента), получится новая зависимость и при температуре TA, опять провести касательную к линии h m (T ) и определить угловой коэффициент этой касательной. Затем полученные данные свести в табл.2, примерная форма которой приведена ниже. Таблица 2 Данные для сравнения значений избыточной изобарной теплоемкости, определенных разными методами 19 N2 0 0,1 0,2 0,3 0,4 … 0,5 ( c Ep )граф, Дж/(мольК) ( c Ep )расч, Дж/(мольК) По данным этой таблицы в отчете нужно будет построить график c Ep (N2), соединив расчетные (формула (27)) значения c Ep плавной линией, и нанести рядом экспериментальные c Ep (графически значения определенные), не соединяя их между собой кривой линией. Например, как это сделано на рис. 2. 4. РЕКОМЕНДАЦИИ ПО ПРОВЕДЕНИЮ ЛАБОРАТОРНОЙ БОТЫ РА- И ОФОРМЛЕНИЮ ОТЧЕТА После собеседования с преподавателем по теме работы студент приступает непосредственно к выполнению работы. Тип системы указывается преподавателем. В программе заложены экспериментальные данные по системам: водаэтанол; пропанолбензол; водаацетон; хлороформацетон. Удобно выбрать следующий ряд мольных долей второго компонента, при которых нужно определить избыточные изобарные теплоемкости: 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9. При работе студент выбирает указанную систему и на экране высвечивается графическая зависимость мольных энтальпий смешения данной системы 20 при разных температурах. Примерный вид зависимостей изображен на рис. 3. Для качественного выполнения работы нужно тщательно «считать» данные с этого рисунка. Принадлежность кривой к той или иной температуре видна по цвету линии. Все точки, соответствующие одной температуре, образуют ряд точек (в примере на рис. 3 таких рядов пять). Мольные теплоты смешения раствора при температурах 283К; 293К; 0 0,1 0,2 0,3 298 К; 313К; 0,4 0,5 0,6 0,7 0 0 -100 -200 -300 Мольная энтальпия смешения, Дж/моль -400 -500 -600 -700 -800 -900 -1000 -1100 -1200 -1300 -1400 -1500 -1600 -1700 -1800 -1900 -2000 -2100 мольная доля бензола Рис.3 Для более точного «считывания» данных можно либо увеличить масштаб рисунка, используя для этого верхнее меню (рис.4), либо 21 воспользоваться данными, которые высвечиваются рядом с интересующей нас точкой, если к ней подвести курсор (рис.5). Рис. 4 Рис.5 На рис.5 показано «считывание» данных для одной из точек кривой, обозначенной черным цветом. Для этой точки имеем по оси абсцисс 0,6; по оси ординат 1700. Это значит, что при мольной доле второго компонента, равной 0,6, мольная энтальпия смешения раствора равна 1700 Дж/моль. Определенные при одном и том же составе раствора значения мольных энтальпий смешения, соответствующие образованию растворов при разных температурах для дальнейшей обработки нужно занести в таблицу программы. Она имеет следующий вид: 22 Температура, К Мольная энтальпия смешения, Дж/моль 283 293 303 313 323 -470 -460 -440 -380 -190 Вносить значения в таблицу нужно только в поле, окрашенное в желтый цвет, обязательно использовать запятую для отделения целой части числа, а не точку. Программа сама строит график. Примерный вид его изображен ни рис.6 . D А С E В Рис. 6 На координатной плоскости рисунка можно видеть две линии: непосредственно зависимость мольной энтальпии смешения от температуры это кривая красного цвета (ACB), и движущаяся касательная это прямая синего цвета (DE). Рассмотрим, как работать с движущейся касательной. Если подвести к ней курсор и нажать левую кнопку мыши, то прямую можно перемещать параллельно исходному положению или менять ее угловой коэффициент, исполь23 зуя для этого соответствующие указатели (рис.6). На рис.7 показано расположение касательной к точке С. M А С N В Рис.7 Для определения углового коэффициента касательной к зависимости мольной энтальпии смешения от температуры, а значит и избыточной изобарной теплоемкости раствора данного состава нужно мысленно выделить на касательной две точки и внести в ячейки программы, окрашенные желтым цветом значения ординат и абсцисс этих точек. Ниже в ячейке, окрашенной голубым цветом, появится значение мольной избыточной изобарной теплоемкости раствора данного состава при данной температуре. В программе не предусмотрено сохранение этой информации, поэтому ее обязательно нужно внести в таблицу отчета (табл.2). Построение касательной довольно субъективная процедура и для более точного определения величины избыточной изобарной теплоемкости лучше это определение проводить не один раз, беря затем среднее значение из полученных величин. Причем, начинать повторное измерение, лучше с отвода касательной от точки С и произвольного изменения ее углового коэффициента. За24 тем нужно повторить процедуру построения касательной и определение углового коэффициента еще раз. Такие вычисления по определению углового коэффициента касательной, проведенной к кривым h m (T ) нужно провести в 9 растворах разного состава при одной и той же температуре. Это однотипные вычисления и поэтому расчетная программа в этой лабораторной работе довольно небольшая, она производит расчет только один раз, а все дальнейшие вычисления проходят аналогично этому, т.е. идет возврат к началу расчета и его повтор. Отчет по лабораторной работе должен содержать: краткую теоретическую часть; примерный вид концентрационных зависимостей мольной энтальпии смешения и его анализ; таблицу со значениями энтальпий смешения в растворах одного состава при разных температурах (таблица 1); один пример графического определения мольной избыточной изобарной теплоемкости в растворе любого состава ( рис.1); один пример расчета мольной избыточной изобарной теплоемкости; таблицу со значениями мольной избыточной изобарной теплоемкости рассчитанными и определенными графически (таблица 2); рисунок, составленный по табл.2; выводы, в которых проанализирован вид концентрационной кривой мольной энтальпии смешения и приведено сравнение величин избыточных мольных изобарных теплоемкостей растворов разного состава, вычисленных и определенных графически. ЗАДАНИЯ НА ЛАБОРАТОРНУЮ РАБОТУ Используя имеющиеся в программе зависимости мольной энтальпии смешения от концентрации (при различных значениях температуры), определить графически величины мольных избыточных изобарных теплоемкостей во всем диапазоне концентрации при указанной в табл.3 температуре. 25 Рассчитать значения мольных избыточных изобарных теплоемкостей. Сравнить графически определенные и расчетные значения избыточных теплоемкостей. Объяснить ход концентрационных зависимостей мольных энтальпий смешения раствора. Таблица 3 Задания на лабораторную работу Вариант Система Температура , К 1 Вода этанол 298 2 Пропанол бензол 305 3 Вода ацетон 298 4 Хлороформ ацетон 288 5 Вода этанол 303 6 Вода ацетон 303 7 Хлороформ ацетон 293 8 Пропанол бензол 310 9 Вода ацетон 308 10 Вода этанол 313 11 Хлороформ ацетон 298 12 Вода ацетон 313 13 Пропанол бензол 315 14 Хлороформ ацетон 303 15 Вода ацетон 323 КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ 1. Что такое идеальный раствор? Виды идеальных растворов. Выражение для химического потенциала компонента раствора в различных моделях идеальных растворов. 26 2. Использование метода активности для описания свойств компонента в реальном растворе. Системы сравнения. 3. Выражение парциальной мольной энтропии и парциальной мольной энтальпии компонента идеального и реального раствора. 4. Парциальная мольная функция смешения, мольная функция смешения, полная функция смешения (на примере энтальпии). 5. Избыточные термодинамические функции. Парциальная мольная и мольная избыточная энергия Гиббса. 6. Алгоритм определения мольной избыточной изобарной теплоемкости системы. 7. Возможные взаимодействия в растворах, образованных различными типами соединений и виды концентрационных зависимостей мольных энтальпий смешения. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Глазов В.М. Основы физической химии: учеб. пособие для вузов /М.: Высш. шк., 1981. 456 с. 2. Булатов Н.К. Термодинамика необратимых физико-химических процессов/ Н.К.Булатов, А.Б.Лундин. М.: Химия, 1984. 336 с. 3. Физическая химия: учеб. пособие для вузов /под ред. Б.П.Никольского / Л.: Химия, 1987. 887 с. 4. Термодинамические характеристики идеальных и реальных растворов: методические указания для самостоятельной работы по физической химии / сост. Е.И. Степановских [и др.] Екатеринбург: УГТУУПИ, 2005. 14 с. 5. Белоусов В.П. Теплоты смешения жидкостей / В.П.Белоусов, А.Г. Морачевский Л: Химия, 1970. 256 с. 27 6. Белоусов В.П. Тепловые свойства растворов неэлектролитов: справочник / В.П. Белоусов, А.Г. Морачевский, М.Ю. Панов . Л.: Химия, 1981. 264 с. 7. Теплоты смешения жидкостей: методические указания к курсовой работе по физической химии / сост. Е.И.Степановских, Е.Н.Уломский, Л.И.Русинова. Екатеринбург: УГТУУПИ, 2000. 36 с. 8. Краткий справочник физико-химических величин /под ред. А.А.Равделя и А.М.Пономаревой. Л.: Химия, 2003. 232 с. ПРИЛОЖЕНИЕ Таблица П.1 Мольная изобарная теплоемкость раствора водаэтанол Мольная доля Мольная изобарная теплоемкость раствора этанола, N2 при температуре 298 К 303 К 313 К 28 0 75,3 75,6 76,0 0,1 90,4 92,5 94,7 0,2 95,4 97,6 100,0 0,3 98,0 100,3 103,4 0,4 100,0 101,8 103,8 0,5 102,9 105,2 107,8 0,6 106,0 108,0 110,4 0,7 107,0 109,1 111,9 0,8 109,7 112,1 115,3 0,9 111,6 114,3 117,9 1,0 112,0 115,3 119,0 Таблица П.2 Мольная изобарная теплоемкость раствора пропанолбензол Мольная доля Мольная изобарная теплоемкость раствора этанола, N2 при температуре 305 К 310 К 315 К 0 145,6 148,2 150,0 0,1 149,2 153,2 158,9 0,2 150,9 155,7 162,8 0,3 151,4 157,2 164,0 0,4 151,0 156,9 164,1 0,5 149,5 155,6 162,5 0,6 148,0 153,8 160,2 0,7 145,9 151,6 157,3 0,8 143,8 149.0 153,9 0,9 140,9 145,1 149,3 1,0 137,0 138,1 139,2 Таблица П.3 Мольная изобарная теплоемкость раствора водаацетон Мольная доля Мольная изобарная теплоемкость раствора этанола, N2 при температуре 298 К 303 К 308 К 313 К 323 К 0 75,3 75,6 75,9 29 76,0 76,3 0,1 89,3 89,6 90,2 90,4 90,8 0,2 94,4 94,9 95,7 96,0 96,4 0,3 101,5 102,0 103,1 103,5 104,0 0,4 107,0 107,7 109,0 109,4 110,0 0,5 111,2 111,8 113,5 114,0 114,7 0,6 115,1 115,8 117,8 118,4 119,1 0,7 118,1 118,9 121,1 121,8 122,6 0,8 121,4 123,9 124,07 125,5 126,3 0,9 123,3 124,3 127,0 127,9 128,8 1,0 125,0 127,0 129,0 130,0 131,0 Таблица П.4 Мольная изобарная теплоемкость раствора хлороформацетон Мольная доля Мольная изобарная теплоемкость раствора этанола, N2 при температуре 288 К 293 К 298 К 303 К 0 115,0 116,0 116,3 117,0 0,1 117.6 120,0 120,7 121,9 0,2 121,6 125,6 129,5 139,8 0,3 125,4 128,4 140,0 146,7 0,4 128,2 129,5 144,0 155,6 0,5 125,0 128,0 130,7 149,5 0,6 124,8 126,8 129,5 139,4 0,7 124,4 125,6 128,4 134,3 0,8 123,4 125,4 127,3 132,2 0,9 123,2 125,0 126,1 128,1 1,0 123,0 124,0 125,0 126,0 30