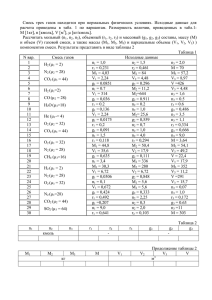
методические указания к прове-дению практических занятий / сост.
реклама

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Белгородский государственный технологический университет им. В.Г. Шухова ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания к проведению практических занятий для студентов направления бакалавриата 280700 – Техносферная безопасность Белгород 2013 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Белгородский государственный технологический университет им. В.Г. Шухова Кафедра безопасности жизнедеятельности Утверждено научно-методическим советом университета ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания к проведению практических занятий для студентов направления бакалавриата 280700 – Техносферная безопасность Белгород 2013 2 УДК 662(07) ББК 24.54я7 Т11 Составители: д-р техн. наук, проф. А. Н. Лопанов канд. техн. наук, доц. Е. А. Фанина инженер И. В. Прушковский Рецензент: канд. хим. наук, проф. Г. И. Тарасова Т11 Теория горения и взрыва: методические указания к проведению практических занятий / сост.: А. Н. Лопанов, Е. А. Фанина, И. В. Прушковский – Белгород: Изд-во БГТУ, 2013. – 96 с. Методические указания к проведению практических занятий по дисциплине «Теория горения и взрыва» составлены в соответствии с государственным образовательным стандартом и предназначены для студентов направления бакалавриата 280700 – Техносферная безопасность. Данное издание публикуется в авторской редакции. УДК 662(07) ББК 24.54я7 © Белгородский государственный технологический университет (БГТУ) им. В.Г. Шухова, 2013 3 Оглавление 1. Расчеты параметров процессов горения……………………..... 4 1.1.Расход воздуха, необходимого для горения веществ……………4 1.2. Расчет объема и состава продуктов горения…………………….15 1.3. Расчет низшей теплоты сгорания веществ и интенсивности тепловыделения……………………………………….……………26 1.4. Уравнение теплового баланса. Расчет температуры продуктов горения и взрыва……………………….………..……..30 2. Концентрационные пределы распространения пламени……40 3. Температурные показатели пожарной опасности……………52 3.1. Расчет температурных пределов распространения пламени (воспламенения)………………………………………….52 3.2. Расчет температур вспышки и воспламенения………………….55 3.3. Расчет стандартной температуры самовоспламенения………….60 4. Энергия и мощность взрыва. Тротиловый эквивалент……65 4.1. Расчет максимального давления взрыва………………………….65 4.2. Расчет тротилового эквивалента взрыва и безопасного расстояния по действию воздушных ударных волн……..……….67 4.3. Определение взрывоопасности смеси горючих газов……...……71 Приложение…………………………………………………...……….80 Библиографический список…………………………………………95 3 1. РАСЧЕТЫ ПАРАМЕТРОВ ПРОЦЕССОВ ГОРЕНИЯ Основой теоретической базы для расчетов параметров процессов горения являются фундаментальные законы сохранения вещества и энергии. 1.1. Расход воздуха, необходимого для горения веществ В качестве окислителя в процессах горения обычно используют атмосферный воздух, в некоторых промышленных установках – воздух, обогащенный кислородом или забалластированный инертными примесями. Состав сухого воздуха, без учета незначительных количеств двуокиси углерода СО2 и редких газов, принимается следующим (в процентах): по объему 21,0 79,0 Кислород Азот по весу 23,2 76,8 Таким образом, объемное соотношение азота и кислорода в воздухе составит: N2 O 2 79 3,76, 21 (1.1) , где N 2 O 2 – соответственно объемное, % (об.), содержание азота и кислорода в окислительной среде. Следовательно, на 1м3 (кмоль) кислорода в воздухе приходится 3,76 м3 азота. Массовое соотношение азота и кислорода в воздухе составляет 23,3 %O2 и 76,7 % N2. Его можно определить, исходя из выражения: N 2 Μ N 2 O 2 M O 2 79 28 3,29, 21 32 4 (1.2) M ,M N2 O2 где – молекулярные массы соответственно азота и кислорода. Горючие вещества разделяют на три типа (табл. 1.1): индивидуальные химические соединения (метан, уксусная кислота и т. п.), вещества сложного состава (древесина, торф, сланцы, нефть и т. п.) и смесь газов (генераторный газ и т. д.). Таблица 1.1 Типы горючих веществ и формулы для расчета объема воздуха при их горении Тип горючего вещества Расчетные формулы VВ 0 Индивидуальное вещество VВ 0 Вещество сложного состава V 0 (1.3 а) nr n nN 2 V0 nr M r O2 VВ0 0,269 ( Смесь газов Размерность nO 2 nN 2 (1.3 б) С S O Н ) 3 8 r nO O i в 2i (1.4) кмоль ; кмоль м3 м3 кмоль кмоль м3 м3 2 (1.5) 21 Примечание. Здесь VВ – теоретическое количество воздуха 0 n r , nO2 , nN 2 – количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М Г – молекулярная масса горючего; V0 – объем 1 кмоль газа при нормальных условиях (22,4 м ); C, H, S, O –массовое содержание соответствующих элементов в 3 составе горючего, %; Гi – концентрация i-го горючего компонента, % (об.); O2 – кон- n 2i центрация кислорода в составе горючего газа, % (об.); – количество кислорода, необходимое для окисления одного кмоль i-го горючего компонента, кмоль. O Для определения объема воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов P0V0 P1V1 T0 T1 5 (1.6) где P – нормальное давление, Па; T – нормальная температура, К; 0 0 V – объем воздуха при нормальных условиях; PV T – соответственно давление, объем и температура воздуха, характеризующие заданные условия горения. V Практическое количество воздуха В – объем воздуха, фактически поступивший в зону горения. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха 1, 1, 1 0 α V V В 0 (1.7) В Разность между практическим и теоретическим объемами воздуха называется избытком воздуха VВ : V V V В В0 В (1.8) Из уравнений (1.7) и (1.8) следует, что V V 1 0 В В (1.9) Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле: V V 21 0 1 O2 П.Г 0 В O2 (1.10) где O2 – концентрация кислорода в продуктах горения, % (об.); VП0. Г – теоретический объем продуктов горения. Для веществ, у которых объем продуктов горения равен объему израсходованного воздуха (например, углерод), формула (1.10) упрощается: 6 21 21 (1.11) O2 В случае образования продуктов неполного сгорания (CO, H2, CH4 и др.) формула (1.11) приобретает вид: 21 21 0,5 0,5 2 (1.11 а) где , , , – содержание соответствующих веществ в продуктах горения, % (об.). Если содержание кислорода в окислительной среде отличается от содержания его в воздухе, то формулу (1.10) можно записать в виде: O2 O2 CO H2 CO H2 CH4 CH4 1 V 0 П.Г V O2 0 0 В O2 O2 (1.12) и соответственно формулу (1.11) 1 0 O2 0 O2 где O (1.13) 2 0O2 – исходное содержание кислорода в окислительной среде, % V (об.); – объем окислительной среды. Часто в пожарно-технических расчетах требуется определить массу воздуха, пошедшего на горение 0 П.Г m V В где – плотность воздуха, Тогда В В кг м В 3 . M M N2 (1.14) В N2 O2 V 0 O2 PT PT 0 0 7 1 (1.15) После подстановки постоянных значений в формулу (1.15) получим 3,47 10 P T 3 В (1.16) где P – атмосферное давление, Па; T –температура воздуха, К. Задача 1.1. Определить теоретические массу и объем воздуха, необходимого для горения 1 м3 метана при нормальных условиях. Решение. Горючее вещество является индивидуальным химическим соединением, поэтому для расчета объема воздуха надо пользоваться формулой (1.3 а). Запишем уравнение химической реакции горения в воздухе CH4 2O2 2 3,76N2 CO2 2H2O 2 3,76N2 n 2; n N 2 3,76 7,52; n CH 1, Из уравнения находим O тогда 3 2 7,52 0 VВ 9,52 м 3 кмоль м или кмоль 1 2 2 4 По формуле (1.14) с учетом уравнения (1.15) рассчитываем массу воздуха mВ 9,52 0, 79 28 0, 21 32 9,52 1, 28 12, 2 кг 3 . м 22, 4 Задача 1.2. Определить теоретический объем воздуха, необходимого для горения 1 кг бензола. Решение. Горючее – индивидуальное химическое соединение, поэтому для расчета по формуле (1.3 б) запишем уравнение химической реакции горения C6H6 7,5O2 7,5 3,76N2 6CO2 3H2O 7,5 3,76N2 , n 1; n O 7,5; n N 7,5 3,76 28,2. найдем Молекулярная масса бензола M 6 12 6 1 78 Объем 1 кмоль газа при нормальных условиях составляет 22,4 м3: 2 2 8 VВ0 7,5 28, 2 22, 4 10,3 1 78 м3 кг. Задача 1.3. Определить объем и массу воздуха, необходимого для горения 1 кг органической массы состава: С – 60 %, Н – 5 %, О – 25 %, N – 5 %, W – 5 % (влажность), если коэффициент избытка воздуха α = 2,5; температура воздуха 305 К, давление 99 500 Па. Решение. Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.4): 3 25 60 VВ0 0, 269 5 5,9 м . кг 8 3 Из формулы (1.7) рассчитаем практическое количество воздуха при нормальных условиях VB VBO 2,5 5,9 14,75 м 3 кг . Находим количество воздуха, пошедшего на горение вещества при заданных условиях горения. Используя формулу (1.6), получим 3 14, 75 101325 305 16,8 м кг , 99500 273 99500 273 VВ В 16,8 1, 28 18,9 кг . кг 305 101325 VВ РТ mВ РТ Задача 1.4. Определить объем воздуха, необходимого для горения 5 м3 смеси газов, состоящих из 20 %; 40 % С2Н2; 10 % СО; 5 % N2 и 25 % O2, если коэффициент избытка воздуха равен 1,8. Решение. Горючее – смесь газов, поэтому для расчета объема воздуха, пошедшего на горение, воспользуемся формулой (1.5). Для определения стехиометрических коэффициентов при кислороде запишем уравнение реакций горения горючих компонентов в кислороде: 9 CH4 2O 2 CO2 2H 2O; C 2 H 2 2,5O 2 2CO2 H 2O; CO 0,5O 2 CO2, Тогда VВ0 3 2 20 2, 5 40 0, 5 10 25 5, 7 м 3 . м 21 Для горения 5 м3 газовой смеси необходимый теоретический объем воздуха составит VВ0 5 5,7 28,5 м3 . Практическое количество воз- V 0 1,8 32,5 м3 духа: В . Задача 1.5. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 м3 воздуха. Решение. Для определения коэффициента избытка воздуха по формуле (1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты 60. CH3COOH 2O2 2 3,76N2 2CO2 2H2O 2 3,76N2 ; VВ0 2 2 3, 76 22, 4 3, 6 1 60 м3 кг . Тогда коэффициент избытка воздуха по формуле (1.7) равен 3,0 0,8. 3,6 Горение протекало при недостатке воздуха. Задача 1.6. Определить объем воздуха, пошедшего на окисление 1м3 аммиака, если в продуктах горения содержание кислорода составило 18 %. Решение. Определяем теоретическое количество воздуха, необходимого для горения 1м3 аммиака: NH3 0,75O2 0,75 3,76N2 0,5N2 1,5H2O 0,75 3,76N2 Тогда 10 , VВ0 3 0, 75 0, 75 3, 76 3, 6 м 3 . м 1 Для определения коэффициента избытка воздуха по формуле (1.10) необходимо рассчитать теоретическое количество продуктов горения 1м3 аммиака, (1.14): VП0. Г 3 1,5 0,5 0, 75 3, 76 4,8 м 3 . м 1 Коэффициент избытка воздуха 18 4,8 9. 3,6(21 18) Объем воздуха, участвующего в процессе горения 1 м3 аммиака, определим по формуле (1.7) 1 3 VВ 9 3,6 32, 4 м м3 . Задача 1.7. Определить объем окислительной среды, состоящей из 60 % О2 и 40 % N2, необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295 К, давление 62,0 кПа. Решение. Так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1) объемное соотношение кислорода и азота 40 : 60 = 0,67. Уравнение реакции горения изопропилового спирта C3H7 OH 4,5O2 4,5 0,67N2 3CO2 4H2O 4,5 0,67 N2 . Теоретический объем окислительной среды при нормальных условиях рассчитаем по формуле (1.3 б). Молекулярная масса горючего равна 60: VO0.C 4,5 4,5 0, 67 22, 4 2,8 1 60 м3 кг . Объем окислительной среды при заданных условиях горения определим из формулы (1.6) 11 VO0.C 3 2,8 295 101,325 4,9 м . кг 62,0 273 C H NO 2 2 , сгоЗадача 1.8. Определить массу динитротолуола 7 6 3 ревшего в герметичном объеме 100 м , если содержание кислорода в продуктах горения составило 12 %. Решение. Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха. Коэффициент избытка определим по формуле (1.10). C7 H6 NO2 2 6,5O2 6,5 3,76N2 7CO2 3H2O N2 6,5 3,76N2 . Молекулярная масса горючего 182. Теоретический объем воздуха VВ0 6,5 6,5 3, 76 22, 4 3,8 м3 1182 кг . Теоретический объем продуктов горения (формула (1.14)): VП0. Г 7 3 1 6,5 3, 76 22, 4 4, 4 1182 12 4,4 1 2,55 . 3,821 12 м3 кг ; Практический объем воздуха, пошедшего на горение VВ 2,55 3,8 9,7 м3 кг. Тогда массу сгоревшего динитротолуола шения mГ m Г определим из соотно- VП 100 10,3 кг. VВ 9, 7 Задачи для самостоятельного решения 1. Определить массу и объем (теоретический) воздуха, необходимого для горения 1 кг метилового, этилового, пропилового и амилово12 го спиртов. Построить график зависимости объема воздуха от молекулярной массы спирта. 2. Определить теоретический объем воздуха, необходимого для горения 1 м3 метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества). 3. Определить теоретическую массу воздуха, пошедшего на горение 1 кг метана, метилового спирта, муравьиного альдегида, муравьиной кислоты. Объяснить причину влияния состава вещества на объем воздуха, требуемого для их горения. 4. Определить объем и массу воздуха, пошедшего на горение 1 кг древесины, состава: С – 47 %, Н – 8 %, О – 40 %, W – 5 %, если коэффициент избытка воздуха равен 2,8; давление 100000 Па, температура 285 К. 5. Сколько воздуха, кг, поступило на горение 1 кг углерода, если в продуктах горения содержание кислорода составило 17 %? 6. Сколько воздуха, кг, требуется подать на сжигание 200 м 3 генераторного газа состава: СО – 29 %, Н2 – 14 %, CH4 – 3 %, СO2 – 6,5 %, N2 – 45 %, O2 – 2,5 %, если коэффициент избытка воздуха равен 2,5? 7. Определить количество сгоревшего толуола, кг, в помещении объемом 400 м3, если после пожара при отсутствии газообмена установлено, что содержание кислорода снизилось до 17 %. 8. Сколько хлора, м3, поступило на горение 300 м3 водорода, если в продуктах горения избыток окислителя составил 80 м 3? 9. Определить избыток воздуха в продуктах горения газовой смеси состава: СО – 15 %, C4 H10 – 45 % О 2 – 30 %, N2 – 10 %, если коэффициент избытка воздуха равен 1,9. 10. Сколько окислительной среды, м3, состоящей из 50 % кислорода и 50 % азота, необходимо для горения 8 кг этилацетата, если коэффициент избытка равен 1,2; температура 265 К, давление 105 Па. 11. Определить коэффициент избытка окислительной среды, состоящей из 70 % кислорода и 30 % азота, если при горении серы содержание кислорода снизилось до 55 %. Определить количество сгоревшей серы, если объем помещения равен 180 м3. 12. Сколько антрацита (принять, что содержание углерода равно 100 %) сгорело в помещении объемом 150 м 3, если горение прекратилось при снижении кислорода до 13 %. Газообмен не учитывать. 13. Рассчитать объем и массу окислительной среды, необходимые для горения i-гo горючего вещества. Данные для расчета представлены 13 в табл. 1.2. Таблица 1.2 Данные для расчета объема и массы окислительной среды, необходимые для горения 1-го горючего вещества № п/п Горючее вещество Химическая формула Кол-во горючего Состав окислительной среды 5 Воздух Условия горения 1 1 2 Метиловый спирт 3 CH3 OH 4 2 кг 2 Анилин C6 H7 N 5 кг 1 3 2 Смесь газов 4 3 м3 4 Нитробензол 3 CO – 45 % N2 –1 5 % C4H8 – 10 % O2 – 30 % C6H5 NO2 30 кг Воздух 200 г Воздух Этилен C – 65 % O – 20 % H–5% S – 10 % C2 H4 T = 280 K P = 98000Па 𝛼 = 2,5 Нормальные 𝛼 = 1,4 5 Сложное вещество 6 5 м3 7 Сера S 2 кг O2 – 25 % N2 – 75 % O2 – 60 % N2 – 40 % 8 Сложное вещество 1 кг Воздух 9 Смесь газов 5 м3 Воздух Нормальные 𝛼 = 1,9 10 Алюминий C – 90 % H–3% N–5% O–2% CH4 – 15 % 𝐶3 𝐻8 – 70 % O2 – 10 % H2 – 5 % Al 15 кг 11 Сплав Mg – 20 % Al – 80 % 8 кг O2 – 42 % N2 – 58 % Воздух 12 Муравьиная кислота Диметиловый CH2 O2 5 кг Воздух (CH3)2O 10 кг Воздух Нормальные 𝛼 = 2,8 T = 265 K P = 92000 Па 𝛼 = 1,5 Нормальные 𝛼 = 1,2 T=282 K 13 14 6 T = 300 K P = 101325 Па 𝛼=3 T = 290 K O2 – 70 % P = 90000 Па N2 – 30 % Продолжение табл. 𝛼 = 2,51.2 5 6 Воздух Нормальные 𝛼 = 1,8 Нормальные 𝛼 = 2,5 T = 350 K P = 120000 Па 𝛼 = 1,8 T = 300 K P = 95000 Па 𝛼 = 1,5 эфир 15 м3 Воздух 0,7 кг Воздух Глицерин H2 S – 25 % SO2 – 15 % CO2 – 15 % H2 – 30 % O2 – 15 % С – 82 % H–8% W – 10 % C3 H8 O 3 17 Ацетилен C2 H2 150 л 20 Метилэтил кетон 2 Смесь газов C4 H8 O 5 кг 3 CH4 – 30 %; O2 – 8 %; N2 – 15 %; H2 – 47 % C4 H8 O 2 4 3 м3 5 кг Воздух C6 H5Cl 7 кг Воздух 14 Смесь газов 15 Сложное вещество 16 1 18 1 кг T = 260 K P = 110000 Па 𝛼 = 1,4 Воздух T = 305 K P = 101300 Па 𝛼 = 1,9 Нормальные Cl2 – 18 % 𝛼 = 1,8 N2 – 82 % Воздух Окончание Нормальные табл. 1.2 𝛼 = 2,5 5 6 Воздух Нормальные 𝛼 = 3,2 21 Этиловый эфируксусной кислоты Хлорбензол 22 Нитротолуол C7H7 NO2 1 кг O2 – 25 % N2 – 75 % 23 Смесь газов 200 л Воздух 24 Бутиловый спирт NH3 – 25 % C4H10 – 25 % C4H8 – 15 % CO2 – 30 % O2 – 5 % C4 H10 O 4 кг Воздух 25 Дибром– гексан C6H12 Br2 3кг O2 – 65 % N2 – 35 % 26 Сложное вещество 15кг Воздух 27 Смесь газов C – 70 %; S – 5 %; H–5% O – 20 % C3H8 – 10 % CO – 79 % H2 – 5 % O2 – 5 % 10 м3 Воздух 19 15 P=101600 Па 𝛼 = 4,2 Нормальные 𝛼 = 1,4 T = 270 K P = 85000 Па 𝛼 = 1,5 T = 305 K P = 1000 Па 𝛼 = 2,8 T = 280 K P = 98000 Па 𝛼 = 1,4 Нормальные 𝛼 = 1,8 T=265 K P=120000 Па 𝛼 = 1,8 T = 280 K P = 98000 Па 𝛼 = 1,7 T = 285 K P = 100000 Па 𝛼 = 2,8 Нормальные 𝛼 = 3,5 N2 – 10 % 1.2. Расчет объема и состава продуктов горения В целях упрощения расчета все горючие вещества разделены на три типа: индивидуальные, сложные, смеси горючих газов, табл. 1.3. Практический (полный) объем продуктов горения состоит из теоретического объема продуктов горения и избытка воздуха V V П.Г V 0 П.Г или VП.Г V О П.Г (1.24) В V ( 1) O B (1.25) Таблица 1.3 Расчетные формулы для определения объема продуктов горения Тип горючего вещества Расчетные формулы nП . Г nr VП . Г Индивидуальное VП0. Г Вещество сложного состава H 2O м3 кмоль ; м3 кмоль (1.17) 11,2 nr M (1.18) (1.19) H W 1,24 100 100 (1.20) s 0,7 100 (1.21) V SO2 м3 кг V0 nП . Гi c 1,86 100 VCO2 V Размерность 1 0 V2 7C 21 H 2,63S 0,8 N 100 8 м3 кмоль ; кг кг N V 0 П.Г Смесь газов V П.ГI V П. ГI 1 n I I 100 n П.Г (1.23) r Н .Г r Примечание. Здесь V (1.22) I 0 П.Г – теоретический объем продуктов горения; ство i-го продукта горения в уравнении реакции, кмоль; 16 nr м3 кмоль ; м3 кмоль nП.Г I – количе- – количество горючего, V V кмоль; 0 – объем одного кмоля газа; М – молекулярная масса горючего; П . Г I – объем i-го продукта реакции; C, H, S, O, N, W – содержание соответствующих элементов (углерода, водорода, серы, кислорода, азота) и влаги в горючем веществе, % (вес); содержание горючего компонента в газовой смеси, % (об.); чего компонента в составе газовой смеси, % (об.). Н . Гi i r – – содержание негорю- Состав продуктов горения, т.е. содержание i-го компонента определяется по формуле П . Г i VП.Г i VП.Г 100, (1.26) где φп.г𝑖 – содержание i -го компонента в продуктах горения, об. V I V i %; – объем i-го компонента, м3, кмоль; – полный объем 3 продуктов горения, м , кмоль. При горении в избытке воздуха в продуктах горения содержится кислород и азот i П.Г П.Г VO 0,21VВ 2 VN VN0 0,79VВ 2 где VN0 2 2 (1.27) (1.28) – теоретический объем азота в продуктах горения, м 3, кмоль. VN0 0,79VВ0 2 (1.29) Задача 1.9. Какое количество продуктов горения выделится при сгорании 1 м3 ацетилена в воздухе, если температура горения составила 1450 К. Решение. Горючее – индивидуальное химическое соединение (формула (1.17)). Запишем уравнение химической реакции горения С2Н2 + 2,5O2 + 2,5∙3,76N2 = 2СO2 + Н2O + 2,5∙3,76N2. Объем продуктов горения при нормальных условиях VП0. Г 2 1 2,5 3,76 12, 4 м 3 . м 1 17 Объем продуктов горения при 1450 К VП0. Г РТ 3 12, 4 1450 65,9 м 3 . м 273 Задача 1.10. Определить объем продуктов горения при сгорании 1 кг фенола, если температура горения 1200 К, давление 95 000 Па, коэффициент избытка воздуха 1,5. Решение. Горючее – индивидуальное химическое соединение (формула (1.18)). Запишем уравнение химической реакции горения С6Н5ОН + 7O2 + 7∙ 3,76N2 = 6СO2 + ЗН2O + 7∙ 3,76N2. Молекулярная масса горючего 98. Теоретический объем продуктов горения при нормальных условиях VП0. Г 6 3 7 3, 76 22, 4 8,1 1 98 м3 кг . Практический объем воздуха при нормальных условиях (1.25) VП0. Г 8,1 7 7 3, 76 1,5 1 22, 4 11,9 1 98 м3 кг . Объем продуктов горения при заданных условиях VП0. Г Р.Т 3 11,9 101325 1200 55,9 м . кг 95000 273 Задача 1.11. Определить объем продуктов горения при сгорании 1 кг органической массы состава: С – 55 %, О – 13 %, Н – 5 %, S – 7 %, N – 3 %, W – 17 %, если температура горения 1170 К, коэффициент избытка воздуха – 1,3. Решение. Горючее вещество сложного состава (формулы (1.19) – (1.22)). Теоретический состав продуктов горения при нормальных условиях: VCO 1,86 2 3 55 1,0 м ; кг 100 18 3 5 17 1,24 0,6 0,2 0,8 м ; кг 100 100 3 7 VSO 0,7 0,05 м ; кг 100 3 1 17 VN 7 55 21(5 ) 2,63 7 0,8 3 4,7 м . кг 100 8 VH O 11,2 2 2 2 Полный теоретический объем продуктов горения при нормальных условиях: 3 VП0. Г 1 0,8 0,05 4,7 6,55 м кг . Практический объем продуктов горения при нормальных условиях: VП . Г 6,55 0, 269 ( 3 55 7 13 5 ) (1,3 1) 6,55 1,8 8,35 м . кг 3 8 Практический объем продуктов горения при температуре горения: VП . Г ( рт) 3 8,35 1170 35,8 м . кг 273 Задача 1.12. Рассчитать объем продуктов горения при сгорании 1м 3 газовой смеси, состоящей изC3H6 – 70 %, С3Н8 – 10 %, СO2 – 5 %, O2– 15 %, если температура горения 1300 К, коэффициент избытка воздуха 2,8. Температура окружающей среды 298 К. Решение. Горючее – смесь газов (формула (1.23)): C3H6 + 4,5O2 + 4,5∙ 3,76N2 = З СO2 + 3H2O + 4,5∙3,76N2; С3Н8 + 5O2 + 5∙ 3,76N2 = ЗСO2+ 4Н2O + 5∙ 3,76N2. Объем продуктов горения определим по формуле (1.23): 3 1 (3 70 3 10 5) 2,45 м 3 ; м 100 3 1 VH O (3 70 4 10) 2,4 м 3 м. 100 VCO 2 2 19 Так как газовая смесь содержит в составе кислород, он будет окислять часть горючих компонентов, следовательно, понизится расход воздуха (формула (1.5)). В этом случае теоретический объем азота удобнее определять по формуле (1.29): VNO 0,79 2 3 4,5 70 5 10 15 13,2 М . 3 21 М Теоретический объем продуктов горения 3 VПO. Г 2, 45 2, 4 13, 2 18,05 м м3 . Практический объем продуктов горения (формулы (1.24), (1.25)) VП . Г 18,05 3 4,5 70 5 10 15 (2,8 1) 42,05 м 3 . м 21 Объем продуктов горения при температуре 1300 К VП . Г ( рт ) 3 42, 05 1300 183, 4 м 3 . м 298 Задача 1.13. Определить состав продуктов горения метилэтилкетона. Решение. При такой постановке задачи рациональнее определять непосредственно из уравнения горения объем продуктов в кмоль, выделившихся при сгорании 1 кмоль горючего: СН3СОС2Н5 + 5,5O2 + 5,5∙ 3,76N2 = 4СO2 + 4Н2O + 5,5∙ 3,76N2, VCO V V V i = 4 кмоль; H O = 4 кмоль; N = 20,7 кмоль; = 28,7 кмоль. 2 2 П.Г 2 По формуле (1.26) находим состав продуктов горения H O CO 2 2 4 100 14 %, N 100 (14 14) 72%. 28,7 2 20 Задача 1.14. Определить объем и состав, % (об.), продуктов горения 1 кг минерального масла состава: С – 85 %, Н – 15 %, если температура горения 1450 К, коэффициент избытка воздуха 1,9. Решение. По формулам (1.19) – (1.22) определим объем продуктов горения: 3 3 85 15 1,6 м ; VH O 11,2 1,7 м ; кг кг 100 100 3 1 VN (7 85 21 15) 9,1 м . кг 100 VN 1,86 2 2 2 Теоретический объем продуктов горения при нормальных условиях 3 VПO. Г 1,6 1,7 9,1 12, 4 м . кг Практический объем продуктов горения при нормальных условиях (формула (1.25)) VП . Г 12, 4 0, 269 ( 3 85 15) (1,9 1) 12, 4 10,5 22,9 м . кг 3 Объем продуктов горения при температуре 1450 К VП . Г ( рт ) 3 22,9 1450 121, 7 м . кг 273 Состав продуктов горения не зависит от температуры горения, поэтому целесообразно определять его при нормальных условиях. По формулам (1.26), (1.28): 1,6 100 0,21 10,5 100 7,1%; O 9,4%; 22,9 22,9 (9,1 0,79 10,5)100 1,7 100 N 76,2%; H O 7,3%. 22,9 22,9 CO 2 2 2 2 Задача 1.15. Определить количество сгоревшего ацетона, кг, если объем выделившейся двуокиси углерода, приведенный к нормальным условиям, составил 50 м3. Решение. Запишем уравнение реакции горения ацетона в воздухе 21 СН3СОСН3+ 4O2 + 4∙3,76N2 = ЗСO2 + ЗН2O + 4∙3,76N2. Из уравнения следует, что при горении из 58 кг (молекулярная масса ацетона) выделяется 3∙ 22,4 м3 двуокиси углерода. Тогда для обраm зования 50 м3 двуокиси углерода должно вступить в реакцию Г горючего: 50 58 mГ 43,2 3 22,4 кг. Задача 1.16. Определить количество сгоревшей органической массы состава: С – 58 %, О – 22 %, Н – 8 %, N – 2 % , W– 1 0 % в помещении объемом 350 м3, если содержание двуокиси углерода составило 5 %. Решение. Определим объем выделившейся двуокиси углерода VCOвыд 350 0,05 17,5 3 м. 2 По формуле (1.19) для вещества сложного состава определим объем СО2, выделяющийся при горении 1 кг горючего: Vco2 1,86 3 58 1,1 М . КГ 100 Определим количество сгоревшего вещества mГ 17,5 15,9 1,1 кг. Задача 1.17. Определить время, когда содержание двуокиси углерода в помещении объемом 480 м3 в результате горения древесины (С – 45 %, Н–50 %, О – 42 %, W – 8 %) составило 8 %, если удельная массовая скорость выгорания древесины 0,008 кг/(м 2.с), а поверхность горения 38 м2. При решении газообмен с окружающей средой не учитывать, разбавлением в результате выделения продуктов горения пренебречь. Решение. Поскольку не учитывается разбавление продуктами горения, определяем объем выделявшейся в результате горения двуокиси углерода, соответствующий 8 % ее содержания в атмосфере: 22 VCO 2 8 480 38,4 100 м3; из выражения (1.19) определим, сколько должно сгореть горючего материала, чтобы выделился данный объем двуокиси углерода: mГ 38,4 46 1,86 0,45 кг. Время горения определим, исходя из соотношения mГ , UM F m U где – время горения; Г – масса выгоревшей древесины, кг; M – 2 массовая скорость выгорания древесины, кг/(м с); F– поверхность горения, м2; 46 151 с 2,5 мин. 0, 008 38 Задачи для самостоятельного решения 14. Определить объем и состав, % (об.), продуктов горения 1 м 3 этилена, пропилена, бутилена, если температура горения 1800 К, давление 98000 Па. Построить график зависимости объема продуктов горения и содержания отдельных компонентов от молекулярной массы горючего. 15. Определить объем продуктов горения и содержание паров воды и кислорода при горении 1 кг гексана, гептана, октана, декана, если температура горения 1300 К, давление 101325 Па, коэффициент избытка воздуха при горении 1,8. Построить график зависимости объема продуктов горения и содержания кислорода т молекулярной массы горючего. 16. Определить объем и состав продуктов горения 10 кг древесины состава С – 49 %, Н – 6 %, О – 44 %, N – 1 %, если температура горения 1250 К, коэффициент избытка воздуха 1,6. 17. Сколько продуктов горения, приведенных к нормальным условиям, образуется в результате сгорания 25 м 3 газовой смеси состава Н2 23 – 45 %, С4Н10 – 20 %, СО – 5 %, NH3 – 15 %, O2 – 15 %, если горение протекало при коэффициенте избытка воздуха, равном 3,2? 18. Определить, сколько сырой нефти состава: C – 85 %, H – 10 %, S – 5 % выгорело в объеме 2500 м𝟑 , если содержание сернистого газа составило 2,5 м𝟑 . Рассчитать при каком содержании кислорода наступило прекращение горения. 19. Через какое время содержаниеCO2 в помещении объемом 300 м𝟑 в результате горения гексанола с поверхности 8 м2 составит 7 %? Массовая скорость выгорания гексана 0,06 кг/(м𝟐 ∙с). 20. Определить содержание SO2, % (об.), в помещении объемом 1200 м𝟑 при горение нефти состава: С – 82 %, H –8 %, S – 10 % со скоростью выгорания 0,4 кг/(м𝟐 ∙с) с площади 5 м𝟐 на 4-й минуте пожара. 21. Определить объем выделившихся на 5-й минуте после воспламенения продуктов горения газовой смеси состава: C2H2 – 30 %, H2 – 22 %, O2 – 15 %, H2S – 18 %, CO2 – 15 %, и содержание двуокиси углерода, если коэффициент избытка воздуха – 1,5, температура горения 1300 К. Расход газа м𝟑 /с, температура газа 295 К. 22. Рассчитать объем образующихся продуктов, м3, и содержание в них азота, % (об.), при горении i-го вещества. Данные для расчета приведены в таблице 1.4. Таблица 1.4 Данные для расчета объема образующихся продуктов и содержание в них азота при горении вещества № п/п Горючее вещество Химическая формула Кол-во горючего 1 1 2 Диэтиловый спирт 3 (C2H5)2O 4 1 кг Состав окислительной среды 5 Воздух 2 Уксусная кислота C2H4O2 5 кг Воздух 3 Сплав Mg – 20 % Al – 80 % 1 кг Воздух 4 Смесь газов CH4 – 20 % C3H8 – 65 % O2 – 15 % 1 м3 Воздух 24 Условия горения 6 TГ = 1500 К P = 101400Па 𝛼 = 2,5 ТГ = 1200 К P = 98000Па 𝛼 = 2,6 ТГ = 2800 К P = 95000Па 𝛼 = 1,6 ТГ = 1480 К P = 101300Па 𝛼 = 2,4 5 Октиловый спирт C8H18O 10 кг Воздух 6 Сложное вещество 1 кг Воздух 7 Смесь газов 1 м3 Воздух 8 Анилин C – 90 % H–5% O–5% NH3 – 10 % C4H10 – 80 % N2 – 7 % O2 – 3 % C6H7N 1 кг Воздух 25 ТГ=1320 К P=102000 Па 𝛼 = 2,5 ТГ = 1320 К P = 97000 Па 𝛼 = 1,6 Т Г= 1600 К P = 101300 Па 𝛼 = 1,2 ТГ=1550 К P=94000 Па 𝛼 = 1,7 Окончание табл.1.4 6 5 1 2 3 4 9 Диэтиловый эфир (C2H5)2O 25 кг Воздух 10 Смесь газов 1 м3 O2 – 42 % N2 – 58 % 11 Сложное вещество 1 кг Воздух 12 Смесь газов 1 м3 Воздух 13 Диметиловый эфир CO –70 % C3H8 – 25 % O2 – 5 % C – 70 % H–6% O – 14 % W – 10 % CH4 – 60 % CO2 – 30 % H2 – 10 % (CH3)2O 10 кг O2 – 30 % N2 – 70 % 14 Глицерин C3H8O3 1 кг O2 – 27 % N2 – 73 % 15 Сложное вещество 1 кг Воздух 16 Смесь газов 1 м3 Воздух 17 Метилэтил кетон C – 80 % H – 12 % O–8% C2H6 – 60 % C3H8 – 30 % H2 – 5 % O2 –5 % C4H8O 1 кг Воздух 18 Сложное вещество 4 кг Воздух 19 Нитротолуол C – 60 % H–7% O – 21 % W – 12 % C7H7NO2 2кг Воздух 20 Смесь газов 1 м3 Воздух 21 Дибромгексан NH3 – 40 % C3H8 – 40 % H2 – 10 % O2 –10 % C6H12Br2 1 кг O2 – 50 % N2 – 50 % 22 Динитробензол C6H4(NO2)2 1 кг Воздух 26 ТГ = 1600 К P = 101300Па 𝛼 = 1,4 ТГ = 1400 К P = 101300 Па α = 2,5 ТГ = 1300 К P = 97000Па α = 1,3 ТГ = 1500 К P = 101300 Па α = 1,2 ТГ = 1800 К P = 87000 Па α = 1,8 ТГ = 1600 К P = 101300Па α = 2,1 ТГ = 1350 К P = 99000Па α = 1,8 ТГ = 165 К P = 101300 Па α = 2,6 ТГ = 1480 К P = 91000 Па α = 1,7 ТГ = 1210 К P = 101300Па α = 1,4 ТГ = 1340 К P = 100000Па α = 2,6 ТГ = 1800 К P = 101300 Па α = 1,7 ТГ = 1400 К P = 92000 Па α = 2,3 ТГ = 1650 К P = 81000 Па α = 1,1 1.3. Расчет низшей теплоты сгорания веществ и интенсивности тепловыделения При расчетах теплового баланса на пожаре определяют, как правило, низшую теплоту сгорания, табл. 1.5. Количество тепла, выделяющегося при сгорании единицы массы (объема) горючего при газообразном состоянии воды Q Q Q , в н ис Q Q Q где в – высшая теплота сгорания; н – низшая теплота сгорания; ис – теплота испарения воды, образующейся при сгорании вещества. Таблица 1.5 Расчетные формулы для определения низшей теплоты сгорания веществ Тип горючего вещества Индивидуальные вещества Вещества сложного состава Расчетные формулы Q (n H n H ) н Q н i i j j (1.30) Размерность кДж/моль кДж/кг =339,4C+1257H–108,9(O–S)–25,1(9H+W) (1.31) Qн Смесь газов H , H Примечание. Здесь i j 1 100 Q Н1 кДж/моль; кДж/м3 Г 1 (1.32) – соответственно теплота образования одного кмоль n n i-го конечного продукта горения и j - г о исходного вещества; i , j – соответственно количество кмоль i-го продукта реакции и j-го исходного вещества в уравнении реакции горения; С, Н, S, W – соответственно содержание, % (масс), углерода, водорода, серы и влаги в составе вещества; О – сумма кислорода и азота, % (вес); сгорания i-го горючего компонента газовой смеси, кДж/кмоль; горючего компонента в газовой смеси, % (об.) QHi Г i – низшая теплота – содержание i-го Расчет теплоты сгорания газовоздушных смесей проводят по формуле: QHсм 1 QH Г 100 27 (1.33) где QH cм Q – теплота сгорания газовоздушной смеси, кДж/м3, кДж/кмоль; H низшая теплота сгорания горючего вещества, кДж/м 3, кДж/кмоль; Г – концентрация горючего в смеси с окислителем, % (об.). Удельная скорость (интенсивность) тепловыделения при горении равна – qQ U , H M (1.34) U где q – удельная интенсивность тепловыделения, кВт/м 2; M – массо2 вая скорость выгорания, кг/(м с). Скорость тепловыделения при горении (теплота пожара) равна q Q U F , П где м𝟐 . H M (1.35) q – интенсивность тепловыделения, кВт; F – площадь горения, П Задача 1.18. Определить низшую теплоту сгорания уксусной кислоты, если теплота ее образования 485,6 кДж/моль. Решение. Для расчета по формуле (1.30) запишем уравнение горения уксусной кислоты в кислороде СН3СООН + 2O2 = 2СO2 + 2Н2O; Q H =(2 . 396,9 + 2 242,2 – l 485,6) = 792,6 кДж/моль = = 792,6–103 кДж/кмоль. Для расчета количества тепла, выделяющегося при горении 1 кг горючего, необходимо полученную величину разделить на его молекулярную массу (64): QH 792, 6 103 13210 кДж кг . 60 Задача 1.19. Рассчитать низшую теплоту сгорания органической массы состава: С – 62 %, Н – 8 %, О – 28 %, S – 2 %. 28 Q Решение. H = 339,462 +1257 8 –108,9(28 – 2) –25,1 9 8 = = 26460 кДж/кг. Задача 1.20. Определить низшую теплоту сгорания газовой смеси, состоящей из CH4 – 40 %, С4Н10 – 20 %, O2 – 15 %, H2S – 5 %, NH3 – 10 %, СO2– 10%. Решение. Для каждого горючего компонента смеси по формуле (1.30) находим теплоту сгорания (табл. 1.6). Таблица 1.6 Расчет теплоты сгорания веществ Уравнение реакции Теплота образования горючего, 10–3кДж/ кмоль Теплота сгорания, 10–3кДж/кмоль CH4 + 2O2 = CO2 + 2H2O 75 Q 1 396,9 2 242,2 75 806,3 C4H10 + 6,5O2 = 4CO2 + 5H2O 132,4 Q 4 396,9 5 242,2 132 2666,1 H2S + 1,5O2 = H2O+SO2 201,1 Q 242,2 297,5 201,1 338,6 NH3+0,75O2=1,5H2O+0,5N2 46,1 Q 1,5 242,2 46,1 317,2 H H H H По формуле (1.32) определим теплоту сгорания газовой смеси QH 1 (806,3 40 2666,1 20 338,6 5 317, 2 10)103 1278,5 103 кДж . кмоль 100 Для определения теплоты сгорания 1 м3 газовой смеси необходимо полученное значение разделить на объем, занимаемый 1 кмоль газа при стандартных условиях (24,4 м3): QH 1278,5 103 57076 кДж 3 . м 24, 4 Задача 1.21. Рассчитать теплоту сгорания 1 м3 стехиометрической гексановоздушной смеси. Решение. Находим стехиометрический состав горючей смеси по уравнению реакции горения C6H14+ 9,5O2 + 9,5∙3,76N2 = 6CO2 + 7Н2O + 9,5∙ 3,76N2. 29 Весь объем вступивших в реакцию компонентов (1+9,5+ 9,5∙3,76) принимаем за 100 %, а количество горючего (1 кмоль) будет соответствовать стехиометрической концентрации: Г 1 100 2,2%. 1 9,5 9,5 3,76 Теплоту сгорания 1 м3 гексана определим по формуле (1.30) Q =6 ∙ 396,9+7 ∙ 242,2 – 167,2 = 3909,6 кДж/моль; 3909, 6 3 QH 10 160, 2 103 кДж 3 . м 24, 4 H Объем одного кмоль газа при стандартных условиях равен 24,4 м3. Теплоту сгорания 1 м3 стехиометрической гексановоздушной смеси определим по формуле (1.33): Q 160, 2 103 2, 2 3525 кДж 3 . м 100 Задача 1.22. Определить интенсивность тепловыделения на пожаре органической массы (состав в примере 2), если скорость выгорания 0,015 кг/(м2.с), а площадь пожара 150 м2. Решение. Согласно формуле (1.35) q П = 26460∙0,015∙150=59,5∙103 кВт =59,5 МВт Задачи для самостоятельного решения 23. Определить низшую теплоту сгорания 1 м 3 этана, пропана, буQ тана, пентана и гексана. Построить зависимость H от молекулярной массы горючего. Теплота образования горючих веществ: этана – 88,4 кДж/моль, пропана – 109,4 кДж/моль, бутана – 232,4 кДж/моль, пентана – 184,4 кДж/моль, гексана–211,2 кДж/моль. 24. Рассчитать теплоту сгорания 1 м3 ацетиленовоздушной смеси на нижнем и верхнем концентрационных пределах воспламенения, а так30 же при стехиометрической концентрации. Концентрационные пределы воспламенения (КПВ) ацетилена равны 2,0–81,0 %. Примечание. Построить график зависимости низшей теплоты сгорания от концентрации горючего в воздухе. При расчете теплоты сгорания смеси на ВКПВ необходимо учесть, что только часть горючего способна полностью окислиться в воздухе, остальное количество горючего не вступит в реакцию горения вследствие недостатка окислителя. 25. Определить низшую теплоту сгорания 1 кг древесины состава С – 49 %, Н – 8 %, О – 43 %. Какова удельная интенсивность тепловыделения на пожаре, если массовая скорость выгорания составляет 0,01 кг/(м2 ∙с)? 26. Для условия предыдущей задачи определить изменение теплоты сгорания и удельной интенсивности тепловыделения при содержании влаги в древесине (сверх 100 %) в количестве 3, 5, 10 и 15 %. Скорость выгорания влажной древесины соответственно снизится до 0,009, 0,008, 0,006 и 0,005 кг/(м2 ∙с). Построить график зависимости QH и q от содержания влаги в горючем материале. Примечание. Для решения задачи необходимо пересчитать состав древесины с учетом влаги таким образом, чтобы содержание всех компонентов равнялось 100 %. 27. Определить интенсивность тепловыделения, кВт, при горении газовой смеси состава: СО – 15 %, С4Н8 – 40 %, O2 – 20 %, Н2 –14 %, СO2 11 %, если скорость истечения 0,8 м3/с. 1.4. Уравнение теплового баланса. Расчет температуры продуктов горения и взрыва Температура горения – температура продуктов горения в зоне химической реакции. Это максимальная температура зоны пламени. Температура горения и взрыва определяется из уравнения теплового баланса Q C n H i 1 p ( V )i V П . Гi (T Т ) Г О При этом адиабатическая температура горения 31 (1.36) TГ* Т О QH C p (V )iVП . Гi , (1.37) а действительная температура горения QП . Г TГ Т О C piVП . Гi , (1.38) o * T и T – соответственно адиабатическая и действительная темпеТ – начальная температура; V i – практический ратуры горения; где Г Г П.Г О O V i объем i-го продукта горения; – теоретический объем i-гo продукта Q Q горения; H – низшая теплота горения вещества; П . Г – теплота, поС шедшая на нагрев продуктов горения; i – теплоемкость i-го продукта C горения при постоянном объеме; i – теплоемкость i-го продукта горения при постоянном давлении. При этом П.Г V P QП.Г QH (1 ) , (1.39) где – доля теплопотерь в результате излучения энергии, химического и механического недожога. Расчет температуры горения по формуле (1.37) или (1.38) может быть проведен только методом последовательных приближений, поскольку теплоемкость газов зависит от температуры горения, табл. 1.7. Таблица 1.7 Определение температуры горения № п/п 1 1 2 Определяемые параметры Примечание 2 Объем и состав продуктов горения Низшая теплота сгорания или количество тепла, пошедшего на нагрев продуктов горения (при наличии теплопотерь) 3 V П.Г (п.1.2) кмоль/кмоль, м3/кг Q Q П.Г П.Г или (п.1.3) кДж/кмоль, кДж/кг 32 3 4 1 5 Среднее значение энтальпии продуктов горения Q ` П.Г ‹ Q Н П.Г , (в том случае, если Q `` П.Г то Q П.Г T ‹T 2 T 1 › 3 Q ` П.Г 9 Q ` П.Г ‹ Q HV i П . Гi (1.41) 1 Q Н П.Г , Hi – энтальпия i-го продукта горения; объем i-го продукта горения V i – ) – по формуле (1.41) неравенства (1.40) П . Гi Окончание табл. 1.7 Расчет проводим до получения 8 H (П.Г ) V T › 2 ` Q – 2 Теплосодержание продуктов горения с температурой T1 (табл. 1а или 1б приложения) то 7 cp Температура горения T1 по средней энтальпии с помощью табл. 1а или 1б приложения, ориентируясь на азот (наибольшее содержание в продуктах горения) Если 6 H Н П.Г ‹ Q – `` П.Г TГ Т 1 Температура горения (QH ( П . Г ) QП` . Г )(T2 T1 ) QП" . Г QП` . Г Температура взрыва, протекающего в изохорно-адиабатическом режиме (при постоянном объеме) рассчитывается по уравнению теплового баланса (1.36) по методике, приведенной в табл. 1.7. Отличие заключается в том, что при расчетах вместо средней энтальпии продуктов горения и их теплосодержания (п.п. 3–7) используется значение внутренней энергии газов (табл. 2 приложения). Внутренняя энергия газов U C T V , CV где – теплоемкость при постоянном объеме, кДж/(моль.К), 3 кДж/(м К). Действительная температура горения на пожаре для большинства газообразных, жидких и твердых веществ изменяется в достаточно узких пределах (1300–1800 К). В связи с этим расчетная оценка действительной температуры горения может быть значительно упрощена, 33 если теплоемкость 1500 К продуктов горения выбирать при температуре TГ Т О QH * CPiVП . Гi , (1.43) * где Ci P – теплоемкость i–го продукта горения при 1500 К, табл. 1.8. Таблица 1.8 Теплоемкость некоторых продуктов горения Теплоемкость Вещество CO2 кДж/(м3К) 2,27 кДж/(моль.К) SO2 2,28 50,85 10 3 51,07 10 H2O(пар) 1,78 39,87 10 3 N2 1,42 31,81 10 3 Воздух 1,44 3 32,26 10 3 Задача 1.23. Определить адиабатическую температуру горения этилового спирта в воздухе. Решение. Расчет проводим по схеме, приведенной в табл. 1.7. 1. Так как горючее – индивидуальное вещество, для определения объема и состава продуктов горения запишем уравнение химической реакции горения С2Н5ОН + 3O2 + 3∙ 3,76N2 = 2СO2 + ЗН2O + 3∙3,76N2. Следовательно, продукты горения состоят из: VCO 2 = 2 моль, VH O 2 = 3 моль, VN 2 = 11,28 моль, V П.Г = 16,28 моль. 2. Низшую теплоту сгорания определим по формуле (1.30). Из табл. 3 приложения находим теплоту образования горючего – 278,2 кДж/моль: Q H = 2 396,9 + 3 242,2 – 278,2 = 1242,2 кДж/моль. 34 3. Средняя энтальпия продуктов горения 1242, 2 76,3 кДж моль 16, 28 . H cp H 4. Так как величина выражена в кДж/моль, по табл. 1 а приложения выбираем, ориентируясь на азот, первую приближенную темпеT ратуру горения 1 = 2100 °С. 5. Рассчитываем теплосодержание продуктов горения при 2100 °С по формуле (1.41): cp QП` . Г 114, 7 2 93, 4 3 70, 4 11, 28 1303, 7 кДж моль . ` Q Q` 6. Сравниваем H и П . Г так как QП . Г QН , выбираем температуру горения, равную 2000 °С. 7. Рассчитываем теплосодержание продуктов горения при 2000 °С: " Q = 108,6 ∙ 2 + 88,1,6 ∙ 3 +66,8 ∙ 11,28 = 1235кДж/моль. П.Г " 8. Так как QП" . Г < муле (1.42): Q < Q , определим температуру горения по форП.Г H TГ0 2000 1242, 2 1235 2100 2000 2010 1303, 7 1235 C Задача 1.24. Определить адиабатическую температуру горения органической массы, состоящей из С–60%,Н–7%,О–25%,W – 8 %. Решение. 1 . Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам (1.19) – (1.21): 3 60 1,12 м ; кг 100 3 7 8 11,2 1,24 0,88 м ; кг 100 100 VСО 1,86 2 VH O 2 35 VN 2 3 1 25 7 60 2(7 ) 5,01 м . кг 100 8 3 V 0 7,01 м . кг Общий объем продуктов горения равен П . Г 2. Определим низшую теплоту сгорания вещества по формуле Д. И. Менделеева (1.31): QН 339, 4 60 1157 7 108,9 25 25,1 9 7 8 23958, 4 кДж кг . 3. Определим среднюю энтальпию продуктов горения H СР 23958, 4 3417,7 кДж 3 . м 7,01 4. Так как величина энтальпии рассчитана в кДж/м3, первую приближенную температуру выбираем по табл. 1б приложения, ориентиo руясь на азот. Принимаем T1 2100 C . 5. Рассчитываем теплосодержание продуктов горения при 2100 °С по формуле (1.41): QП` . Г 5118, 2 1,12 4166,1 0,88 3142,9 5, 01 25144,5 кДж кг . Q Q` Q Q` 6. Из сравнения H и П . Г ( H > П . Г ) выбираем вторую приближенную температуру, равную 1900 °С. 7. Рассчитываем теплосодержание продуктов горения при 1900 °С: Q " П.Г =4579,7 ∙ 1,12 + 3693,5 ∙ 0,88 + 2818,2 ∙ 5,1 = 22498,8 кДж/кг. 8. Так как Q " П.Г < Q H TГ0 1900 < Q ` П.Г определим температуру горения: (23958, 4 22498,8) (2100 1900) 2010 C 25144 22498,8 36 Задача 1.25. Рассчитать действительную температуру горения феH нола ( = 4,2 кДж/моль), если потери тепла излучением составили Q 25 % от H , а коэффициент избытка воздуха при горении – 2,2. Решение. 1 . Определим состав продуктов горения: обр . С6Н5ОН + 7O2 + 7 3,76N2 = 6СO2 + ЗН2O + 7 3,76N2, VCO V V = 6 моль, H O = 3 моль, N = 26,32 моль, VB =(7 + 7∙3,76)(2,2–l) = 39,98 моль, VП . Г = 75,3 моль. 2 2 2 2 . Определим низшую теплоту сгорания фенола (формула (1.30): Q = 6∙ 3969 + 3 ∙ 242,2 – 1 ∙ 4 , 2 = 3102,7 кДж/моль, Н так как по условию задачи 25 % тепла теряется, определим количество тепла, пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения) (формула (1.39)): Q = 3102,7(1–0,25) = 2326,5 кДж/моль. П.Г По формуле (1.43) определим действительную температуру горения Tr 273 2326,5 1185 K. 103 50,85 6 39,87 3 31,81 26,32 32, 26 39,97 Задача 1.26. Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава. Решение. Расчет проводим по схеме, представленной в табл. 1.7. 1. Объем и состав продуктов горения CH 4 + 2O 2 + 2 ∙3,76 N2 = CO2 + 2H 2 O + 2∙ 3,76 Продукты горения: VCO 2 = 1 кмоль/кмоль, 37 VH O 2 = 2моль/моль, N2 . VN 2∙3,76=7,5кмоль/кмоль. 2 2. Низшая теплота сгорания: Q = 1∙ 396,6 + 2∙ 242,2 –75 = 806 кДж/моль. Н 3. Средняя внутренняя энергия продуктов горения U СР QН 806 76,8 VП . Г 10,5 кДж/моль. 4. По табл. 2 приложения принимаем первую приближенную темT пературу взрыва (по азоту) 1 = 2700 °С. T 5. Рассчитываем внутреннюю энергию продуктов горения при 1 : U V U П.Г , 1 i 1∙128,9+ 2 ∙ 102,4 + 7,5∙ 70,2 = 860,2 кДж/моль. Q U T 6. Сравнение значение Í и 1 показывает, что 1 завышена. T 7. Выбираем 2 = 2500 °С. U2= 1 118,3 + 2∙ 94,3 + 7,5∙ 64,3 = 789,2 кДж/моль. 8. Так как U › Q › U , то 1 Н TВЗР 2500 2 806 789, 2 2700 2500 2524 C 860, 2 789, 2 Задачи для самостоятельного решения 28. Определить, как изменяется адиабатическая температура горения в гомологическом ряду предельных углеводородов (на примере метана, пропана, пентана и гептана). Построить график зависимости температуры горения от молекулярной массы горючего вещества. 29. Определить, как изменяется адиабатическая температура горения древесины состава: С – 49 %, Н – 8 %, О – 43 %, если содержание влаги (сверх 100 %) составляет 0, 5, 15 %. Построить график зависимо38 сти температуры горения от влажности горючего. Примечание. При решении задачи необходимо состав древесины пересчитать так, чтобы количество всех компонентов (в том числе и воды) составляло 100 %. 30. Определить, как изменится адиабатическая температура горения бензола в воздухе и окислительной среде, содержащей 25, 30, и 40 % кислорода. Построить график зависимости температуры горения от содержания кислорода. 31. Рассчитать действительную температуру горения газовой смеси, состоящей из 45 % Н2, 30 % С3Н8, 15 % O2, 10 % N2, если потери тепла составили 30 % от QÍ , а коэффициент избытка воздуха при горении равен 1,8. 32. Определить количество сгоревшего антрацита (С = 100 %) в помещении объемом 180 м3, если среднеобъемная температура возросла с 305 до 625К 33. Рассчитать действительную температуру горения бутановоздушной смеси стехиометрической концентрации на нижнем концентрационном пределе воспламенения (1,9 % бутана и 98,1 % воздуха), если потери тепла излучением составили 20 % от низшей теплоты сгорания. 34. Определить, как изменится температура горения ацетилена при разбавлении его азотом в количестве 10, 20, 30 %, если потери тепла излучением составляют 25 % от низшей теплоты сгорания, коэффициент избытка воздуха 1,2. Построить график зависимости температуры от содержания азота в ацетилене. 35. Определить время горения толуола, при котором температура в помещении объемом 400 м3 повысится с 295 до 375 К, если скорость его выгорания 0,015 кг/(м2 с), а площадь пожара 50 м2. При расчете пренебречь приращением объема продуктов горения над расходуемым воздухом. 36. Рассчитать температуру горения i-го вещества (табл. 1.9.) Таблица 1.9 Данные для расчета температуры горения вещества № п/п 1 1 Горючее вещество 2 Смесь газов Химическая формула 3 CO – 40 % C3H8 – 50 % 39 Состав окислительной среды 4 Воздух Условия горения 5 α = 1,4 η = 0,25 CO2 – 10 % 2 Вещество сложного состава Воздух = 1,6 η = 0,3 α = 1,3 η = 0,4 α = 1,0 η = 0,35 α = 1,4 η = 0,15 α = 1,5 η = 0,2 α = 1,0 η = 0,35 C3H8O3 O2 – 25 % N2 – 75 % Воздух Уксуснобутиловый эфир Этилбензол C6H12O2 Воздух C8H10 Воздух 7 Вещество сложного состава Воздух 8 Смесь газов C – 82 % H–8% O–5% W–5% CO – 60 % H2 – 40 % 1 9 2 Аммиак 3 NH3 4 Воздух 5 α = 1,0 η = 0,2 10 Гексан C6H14 Воздух 11 Нитроэтан C2H5NO2 Воздух 12 Гексиловый спирт C6H14O Воздух 13 Вещество сложного состава Воздух 14 Смесь газов 15 Муравьиная кислота Вещество сложного состава C – 75 % H–8% C – 12 % W–5% CH4 – 70 % NH3 – 20 % O2 – 10 % CH2O2 α = 1,4 η = 0,15 α = 1,5 η = 0,2 α = 2,0 η = 0,1 α = 1,0 η = 0,4 3 4 5 6 Пропионовая кислота глицерин C – 80 % H–5% S–6% W–9% C3H6O2 Воздух α = 1,8 η = 0,4 Окончание табл. 1.9 16 17 Вещество сложного состава 18 Смесь газов C – 56 % H – 14 % O – 20 % W – 10 % C – 78 % H – 12 % O – 10 % CO –75 % CH4 – 25 % 40 Воздух α = 1,8 η = 0,2 O2 – 25 % N2 – 75 % Воздух α = 2,2 η = 0,3 α = 1,0 η = 0,4 Воздух α = 1,6 η = 0,15 Воздух α = 1,9 η = 0,2 19 Смесь газов 20 Вещество сложного состава 21 Смесь газов 22 Вещество сложного состава 23 Смесь газов 24 Вещество сложного состава 25 Этилен C3H8 – 70 % C4H10– 20 % O2– 10 % С – 85 % H – 10 % O–5% C2H6– 75 % CH4– 20 % O2 – 5 % С – 70 % H – 16 % O – 14 % CO –50 % CH4 – 30 % CO2 –20 % С – 77 % H – 13 % N–4% O–6% C2H4 41 Воздух α = 1,8 η = 0,2 Воздух α = 1,4 η = 0,3 Воздух α = 1,7 η = 0,22 Воздух = 1,2 η = 0,35 Воздух α = 1,9 η = 0,15 Воздух α = 1,0 η = 0,45 O2 – 25 % N2 – 75 % α = 1,0 η = 0,4 2 . КОНЦЕНТРАЦИОННЫЕ ПРЕДЕЛЫ РАСПРОСТРАНЕНИЯ ПЛАМЕНИ Нижний (верхний) концентрационный предел распространения пламени – минимальная (максимальная) концентрация горючего в окислителе, способная воспламениться от высокоэнергетического источника с последующим распространением горения на всю смесь. Нижний концентрационный предел воспламенения определяют по предельной теплоте горения. Установлено, что 1 м 3 различных газовоздушных смесей на НКПВ выделяет при горении постоянное среднее количество тепла – 1830 кДж, называемое предельной теплотой горения. Следовательно Н QПР 100 QН (2. 1) если принять среднее значение QПР равным 1830 кДж/м, то 𝜑н будет равно н 1830 100 QН где QН – низшая теплота сгорания горючего вещества, кДж/м3. Нижний и верхний КПВ могут быть определены по аппроксимационной формуле Н В 100 an b (2. 2) где n – стехиометрический коэффициент при кислороде в уравнении химической реакции; a и b – эмпирические константы, значения которых приведены в табл. 2.1. Концентрационные пределы воспламенения паров жидких и твердых веществ могут быть рассчитаны, если известны температурные пределы Н В PН В 100 P0 42 (2. 3) где PН(В) – давление насыщенного пара вещества при температуре, соответствующей нижнему (верхнему) пределу воспламенения, Па; P0 – давление окружающей среды, Па. Таблица 2.1 Значение эмпирических констант Концентрационные пределы воспламенения Нижний Верхний n ≤ 7,5 n > 7,5 Значения коэффициентов a b 8,684 4,679 1,550 0,768 0,560 6,554 Давление насыщенного пара может быть определено по уравнению Антуана или по табл. 4 приложения lg P A B C t (2. 4) где А, В, С – константы Антуана (табл. 12 приложения); t – температу ра, C (температурные пределы). Для расчета концентрационных пределов воспламенения смесей см H(в) горючих газов используют правило Ле-Шателье: см H(в) где Н(в) 1 i H (в)i , (2. 5) – нижний (верхний) предел воспламенения i-го горючего газа, % (об.); i – мольная доля i-го горючего газа в смеси. i Следует при этом иметь в виду, что = 1, т. е. концентрация горючих компонентов газовой смеси принимается за 100 %. Если известны концентрационные пределы воспламенения при T T температуре 1 , то при температуре 2 они вычисляются по формулам: i 43 Т 2 Т1 ); Т 2 Т1 нг нг (1 2 вг где 1 (2. 6) Т Т1 вг (1 2 ); Т 2 Т1 2 1 (2. 7) НГ , НГ – нижний концентрационный предел воспламенения соот И ВГ ветственно при температурах 𝑇1 и 𝑇2 ; ВГ – верхний концентрационный предел воспламенения соответственно при температурах 𝑇1 и 𝑇2 ; 𝑇г – температура горения смеси. Приближенно при определении НКПВ 𝑇г принимают 1550 К, при определении ВКПВ – 1100 К. При разбавлении газовоздушной смеси инертными газами (N2, СO2, пары Н2O и т. п.) область воспламенения сужается: верхний предел снижается, а нижний – возрастает. Концентрация инертного газа (флегматизатора), при которой нижний и верхний пределы воспламенения смыкаются, называется минимальной флегматизирующей кон центрацией ф . Содержание кислорода в такой системе называют ми нимальным взрывоопасным содержанием кислорода (МВСК) o . Некоторое содержание кислорода ниже МВСК называют безопасным О без . Расчет указанных параметров проводят по формулам: 1 2 1 2 2 2 ф h'f H Of hф' h 1 " ф O 2 O без 2 h m 100 h m " i ' i i i ; (2.8) 100 ф 4,844 ; 1,2O 4,2 2 (2. 9) , (2. 10) H h' где – стандартная теплота образования горючего, Дж/моль; i , hi" h , – константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора (табл. 11 приложения); mi – количество атомов i-го элемента (структурной группы) в молекуле горючего. O f " ф 44 Расчет этих параметров может проводиться по другой физически более прозрачной методике – решением уравнения теплового баланса (1.36) при следующих двух условиях: – в точке флегматизации горючая смесь имеет предельную температуру горения примерно 1500 К; – смесь является стехиометрической при окислении углерода до СО, водорода – до Н2O. Уравнение теплового баланса (1.36) в случае разбавления нейтральным газом представляем в виде: Q (T Т )[ C i П . Гi C Ф Ф ] * г H О pn P n (2. 11) С C Т* где г – предельная температура горения примерно 1500 К; i , Pф – соответственно теплоемкость i-го продукта горения и нейтрального n i газа (флегматизатора), кДж/(моль К); – количество молей i-го n продукта горения стехиометрической смеси, моль/моль; Ф – количество молей нейтрального газа в точке флегматизатора, моль/моль. Из формулы (2.11) p П.Г Q (T Т ) C i n * n Ф г H О P П . Гi C Ф (Т Т ) * г P О , (2. 12) Приняв объем всех компонентов газовоздушной смеси за 100 %, определяем концентрацию, % (об.), каждого из них: i ni 100 . n Г nO nN nф 2 (2.13) 2 Задача 2.1. Зная предельную теплоту сгорания определить нижний концентрационный предел воспламенения бутана в воздухе. Решение. Для расчета по формуле (2.1) в табл. 3 приложения находим низшую теплоту сгорания вещества 2882,3 кДж/моль. Эту величину надо перевести в другую размерность – кДж/м3 QH 2882,3 1000 128, 7 103 кДж 3 . м 22, 4 45 По формуле (2.1) определим НКПВ н 1830 100 1,42 %. 128,710 3 По табл. 4 приложения находим, что экспериментальное значение Н = 1,9 %. Относительная ошибка расчета, следовательно, составила Н 1,9 1, 42 100 25 % 1,9 Задача 2.2. Определить концентрационные пределы воспламенения этилена в воздухе. Решение. Расчет КПВ проводим по аппроксимационной формуле. Определяем значение стехиометрического коэффициента при кислороде C2H4 +3O2 = 2CO2 +2H2O. Таким образом, n = 3, тогда 100 3,25 %; 8,684 3 4,679 100 В 18,23 %. 1,55 3 0,56 н Определим относительную ошибку расчета. По табл.4 приложения экспериментальные значения пределов составляют 3,0–32,0: 3, 25 3,0 8 % В 19, 23 32, 0 40 % 3,0 32 ; Следовательно, при расчете НКПВ этилена результат завышен на 8 %, а при расчете ВКПВ – занижен на 40 %. Задача 2.3. Определить концентрационные пределы воспламенения насыщенных паров метанола в воздухе, если известно, что его температурные пределы составляют 280–312 К. Атмосферное давление нормальное. Н 46 Решение. Для расчета по формуле (2.3) необходимо определить давление насыщенных паров, соответствующее нижнему (7 °С) и верхнему (39 °С) пределам воспламенения. По уравнению Антуана (2.4) находим давление насыщенного пара, воспользовавшись данными табл. 12 приложения: lg PН 8,22777 1660,454 1,65999 P 245,818 7 ; Н 45,7 мм рт. ст. = = 45,7∙133,2 = 6092,8 Па; lg PВ 8,22777 1660,454 2,39789 245,818 39 ; Рг = 250 мм рт.ст. = 250 133,2 = 33300 Па. По формуле (2.3) определим НКПВ н 6092,8 100 33300 100 6 %; н 32,9 %. 101325 101325 Задача 2.4. Определить концентрационные пределы воспламенения газовой смеси, состоящей из 40 % пропана, 50 % бутана и 10 % пропилена. Решение. Для расчета КПВ смеси газов по правилу Ле-Шателье (2.5) необходимо определить КПВ индивидуальных горючих веществ, методы расчета которых рассмотрены выше: Н В (С3Н8) = 9,5 %; φн (С3Н6) = 2,2 %; (С3Н6) = 10,3 %; (С4Н10) = 1,9 %; В (С4Н10) = 9,1 %; 1 1 см 2,0 %; см 9,38 %. н н 0,4 0,1 0,5 0,4 0,1 0,5 2,1 2,2 1,9 9,5 10,1 9,1 В (С3Н8) = 2,1 %; Н Задача 2.5. Каково минимальное количество диэтилового эфира, кг, способное при испарении в емкости объемом 350 м 3 создать взрывоопасную концентрацию? Решение. Концентрация будет взрывоопасной, если Н П.Г П.Г – концентрация паров горючего вещества). Расчетом 47 (см. примеры 1–3) или по табл. 5 приложения находим НКПВ диэтилового эфира. Он равен 1,7 %. Определим объем паров диэтилового эфира, необходимый для создания в объеме 350 м3 этой концентрации V П.Г 1,7 350 5,95 100 м3. Таким образом, для создания НКПВ диэтилового эфира в объеме 350 м3 необходимо ввести 5,95 м3 его паров. Принимая во внимание, что 1 кмоль (74 кг) пара, приведенный к нормальным условиям, занимает объем, равный 22,4 м3, находим количество диэтилового эфира mr 74 5,95 19,7 22,4 м3. Задача 2.6. Определить, возможно ли образование взрывоопасной концентрации в объеме 50 м3 при испарении 5 кг гексана, если температура окружающей среды 300 К. Решение. Очевидно, паровоздушная смесь будет взрывоопасной, П . Г В . При 300 К объем паров гексана, образующийся в если Н результате испарения 5 кг вещества, найдем, принимая во внимание, что при испарении 1 кмоль (86 кг) гексана при 273 К объем паровой фазы будет равен 22,4 м3 VП . Г 5 22,4 300 1,43 86 273 м3. Концентрация паров гексана в помещении объемом 50 м 3 будет равна п .г . 1,43 100 2,86 %. 50 Определив концентрационные пределы воспламенения гексана в воздухе (φн = 1,2; φв = 7,5 %), по таблицам или расчетом устанавливаем, что образующаяся смесь является взрывоопасной. 48 Задача 2.7. Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара, содержащего 60 % диэтилового эфира (ДЭ) и 40 % этилового спирта (ЭС), при температуре 245 К? Решение. Концентрация паров будет взрывоопасной, если СМ Н НСМ. П ВСМ НСМ. П – концентрация насыщенных паров смеси жидкостей). Очевидно, что в результате различной летучести веществ состав газовой фазы будет отличаться от состава конденсированной фазы. Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных растворов жидкостей. 1. Определим мольный состав жидкой фазы: i g i /M i g /M i i , g где i – мольная доля i-го вещества; i – весовая доля i-го веще(M 74, M ЭС 46). M ства; i – молекулярная масса i-го вещества ДЭ ДЭ 0,6 0, 4 74 46 0,479 ЭС 0,521. 0,6 0,4 0, 6 0, 4 74 46 74 46 ; 2. По уравнению (2.4), используя значения констант Антуана из табл. 12 приложения, находим давление насыщенных паров диэтилового эфира и этилового спирта при температуре 19 °С (245 К): 3. 1098,945 lg P 6,9979 1,84753 232,372 19 ; ДЭ Рдэ= 70,39 мм рт. ст. = 382,6 Па. 1918,508 lg P 8,68665 0,45713 252,125 19 ; ЭС Рэс= 2,87 мм рт. ст. = 382,6 Па. 49 4. Согласно закону Рауля, парциальное давление насыщенных паров i-й жидкости над смесью равно произведению насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе, т. е. Рпар(дэ)= 9384,4∙ 0,479 = 4495,1 Па; Рпар(эс)= 382,6∙ 0,521 = 199,3 Па. 5. Приняв сумму парциальных давлений насыщенных паров диэтилового эфира и этилового спирта, равной 100 %, определим: а) концентрацию паров в воздухе СМ Н.П 4495,1 199,3 100 4,6 101325 %; б) мольный состав газовой фазы (закон Рауля–Дуартье) ДЭ( Д ) 4495,1 0,958 ; ЭС ( П ) 1,00 0,960 0,958. 4495,1 199,3 6. Определив расчетом или по справочным данным (табл. 5 приложения) КПВ индивидуальных веществ (диэтиловый эфир н = 1,7; в = 59 %; этиловый спирт н = 3,6; в =19 %), по правилу ЛеШателье рассчитаем КПВ паровой фазы: СМ Н 1 0,958 0,042 1,7 3,6 1,7 СМ В ; 1 46,1 0,958 0,042 49 19 . 7. Сравнивая полученные в п. 4 а концентрацию паровоздушной смеси с концентрационными пределами распространения пламени ( н = 1,7; в = 46,1 %), делаем заключение, что при 245 К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров в воздухе. Задача 2.8. Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом смеси паров ацетона в воздухе. Решение. По табл. 3 приложения находим теплоту образования ацетона 248,1 103 Дж/моль. Из химической формулы ацетона (С 3Н6О) следует, что mС = 3, mН = 6, mО = 1. Значения остальных параметров, 50 необходимые для расчета по формуле (2.8), выбираем из табл. 11 приложения для двуокиси углерода ф 0,735 105 248 103 0,579 1, 251 3 0, 418 6 0,542 1 100 48,1 %; 2,020 1 4,642 3 1,160 6 2,3211 100 48,1 O 10,7 %; 4,844 1,2 10,7 4,2 8,6 %. 2 O 2 без Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 8,6 % смесь становится взрывобезопасной. При содержании же кислорода, равном 10,7 %, эта смесь будет предельной по взрываемости. Согласно справочным данным (справочник «Пожарная опасность веществ и материалов, применяемых в химической промышленности»), МВСК ацетоновоздушной смеси при разбавлении ее двуокисью углерода составляет 14,9 %. Определим относительную погрешность расчета: 10, 7 14,9 28 %. 14,9 Таким образом, результаты расчета МВСК занижены на 28 %. Задача 2.9. Рассчитать параметры точки флегматизации (МФК, МВС, концентрацию горючего) при разбавлении бутановоздушной смеси диоксидом углерода. Решение. Расчет проведем по уравнениям (2.11) – (2.13). Запишем уравнение химической реакции окисления бутана до СО и Н2O С4H10 + 4,5O2 + 4,5 3,76N2 = 4СО + 5Н2O + 4,5 3,76N2. По формуле (1.30) рассчитаем низшую теплоту этой реакции. Из табл. 3 приложения находим теплоты образования продуктов реакции и рассчитываем: Q H = 4 112,7 + 5 242,2 – 1 132= 1529,4 кДж/моль. По формуле (2.12), имея данные по теплоемкости продуктов горения и нейтрального газа при температуре 1500 К (см. табл. 1.8), рас51 считываем количество молей диоксида углерода в точке флегматизации: nф 1529, 4 (1500 295) (33,73 4 39,85 5 31,81 4,5 3,76) 103 моль 7,8 . 50,85 103 (1500 295) моль МФК диоксида углерода определим по формуле (2.13) 7,8 100 ф 26 %; 1 4,5 4,5 3,76 7,8 По формуле (2.13) рассчитывается и МВСК, и концентрация горючего в точке флегматизации 4,5 100 ф 14,9 %; 1 4,5 4,5 3,76 7,8 1100 ф 3,3 %. 1 4,5 4,5 3,76 7,8 Задачи для самостоятельного решения 37. По предельной теплоте сгорания определить, как изменится нижний концентрационный предел воспламенения в воздухе от положения предельных углеводородов (этан, пропан, бутан, гептан, гексан) в гомологическом ряду. Построить график зависимости НКПВ от молекулярной массы горючего. 38. По аппроксимационной формуле рассчитать, как изменяются концентрационные пределы жирных спиртов (метилового, этилового, гексилового, октилового) в воздухе. Построить график зависимости нижнего и верхнего пределов воспламенения от молекулярной массы горючего. 39. Определить концентрационные пределы воспламенения сероуглерода при атмосферном давлении, равном 99 000 Па, если его температурные пределы составляют 223 – 299 К. 40. Рассчитать концентрационные пределы воспламенения бензола, если его температурные пределы составляют 259–283 К. Определить ошибку расчета. 41. Определить концентрационные пределы воспламенения парогазовой смеси, состоящей из 20 % этана, 60 % этилена, 20 % паров этилового спирта. 42. Определить концентрационные пределы воспламенения в воздухе смеси паров, состоящей из 50 % бензола, 35 % толуола и 15 % фенола при увеличении температуры с 298 до 373 К. 52 44. Определить, образуется ли взрывоопасная концентрация при испарении в помещении объемом 220 м3 15 кг деканола, если температура 310 К, давление 110 500 Па. 45. Определить, возможно ли образование взрывоопасной концентрации при температуре 298 К над поверхностью жидкой фазы, состоящей из 25 % уксусно-метилового эфира, 40 % уксусного альдегида и 35 % амилового спирта. 46. Определить состав двухкомпонентной газовой смеси, состоящей из паров аммиака и сероводорода, если известно, что ее нижний концентрационный предел воспламенения в воздухе составляет 5,8 %. 47. Определить безопасную концентрацию кислорода при разбавлении паров уксусно-пропилового эфира ( = 513,7 103 кДж/моль) в воздухе двуокисью углерода, водяным паром и азотом. Объяснить причину различной флегматизирующей эффективности инертных газов. 48. Рассчитать концентрационные пределы воспламенения паров iго вещества в воздухе. Результаты расчета сравнить с имеющимися справочными данными и определить относительную ошибку. Данные для расчета представлены в табл. 2.2. Таблица 2.2 Данные для расчета концентрационных пределов воспламенения паров вещества в воздухе № п/п 1 1 2 Смесь газов 3 4 Ацетилен Уксусный альдегид Химическая формула 3 C7H16 C8H18 – 40 %, C6H14 – 60 % C2H2 C2H4O 5 Бензол C6H6 6 Ацетон C3H6O 7 Смесь газов CH4 – 40 % CO – 50 % C3H – 10 % 8 Амиловый спирт C5H12 O 9 Этан C2H6 10 Толуол C7H8 Горючее вещество 2 Гептан Условие задачи 4 По предельной теплоте сгорания По формуле Ле-Шателье По аппроксимационной формуле По предельной теплоте сгорания По температурным пределам воспламенения По температурным пределам воспламенения По формуле Ле-Шателье По температурным пределам воспламенения По предельной теплоте сгорания По температурным пределам воспламенения 53 11 Смесь газов 12 14 15 16 Уксусная кислота Уксусно – этиловый эфир Глицерин Ацетон Стирол 17 Фенол 13 CO – 70 % CH4 – 25 % C2H6 – 5 % C2H4O2 По формуле Ле-Шателье По аппроксимационной формуле По температурным пределам воспламенения По аппроксимационной формуле По аппроксимационной формуле По температурным пределам воспламенения По предельной теплоте сгорания C4H8O2 C3H8O3 C3H6O C8H8 C6H6O 54 Окончание табл.2.2 1 18 19 2 Гексиловый спирт Смесь газов 20 Диэтиловый спирт 3 C3H14O CO – 12 % C2H2 – 78 % CH4 – 10 % (C2H5)2O 21 Сероуглерод CS2 22 23 Масляная кислота Бензиловый спирт C4H8O2 C7H8O 24 25 Метилэтилкетон Анилин C4H8O C6H7N 4 По аппроксимационной формуле По формуле Ле-Шателье По температурным пределам воспламенения По температурным пределам воспламенения По аппроксимационной формуле По температурным пределам воспламенения По аппроксимационной формуле По предельной теплоте сгорания 3. ТЕМПЕРАТУРНЫЕ ПОКАЗАТЕЛИ ПОЖАРНОЙ ОПАСНОСТИ Для полной оценки пожарной опасности твердых веществ и материалов, а также жидкостей и газов необходимы температурные показатели. К ним относятся температурные пределы распространения плаТ Т ТЗ мени: нижний Н и верхний В температура вспышки в закрытом ВС ТО Т и открытом ВС приборах, температура воспламенения ВП , температуТ Т ра самовоспламенения ВС , температура зажигания З , температура Т горения Г , (п. 1.4). В порядке возрастания они могут быть расположены в виде ряда TH TВСЗ TВСО TВП Т СВ Т З Т Г . 3.1. Расчет температурных пределов распространения пламени (воспламенения) Нижний (верхний) температурный предел воспламенения – температура жидкости, при которой концентрация насыщенных паров равна нижнему (верхнему) концентрационному пределу распространения пламени. 55 Существует несколько полуэмпирических методов расчета температурных пределов распространения пламени, однако они мало отличаются друг от друга по точности. Температурные пределы воспламенения (ТПВ) жидкостей рассчитывают по температуре кипения t( H ) В ktкип l где t (H )В , (3.1) – нижний (верхний) температурный предел воспламене- t ния; кип – температура кипения, °С; k, l – константы для определенных групп (гомологических рядов) жидкостей (табл. 6 приложения). Температурные пределы воспламенения могут быть определены по известным значениям концентрационных пределов P(H)В где Р( Н ) В Н ( В) РО 100 , (3.2) – давление насыщенного пара, соответствующее нижнему (верхнему) концентрационному пределу воспламенения; ( Н ) В – нижний Р (верхний) концентрационный предел воспламенения; 0 – атмосферное давление. Из уравнения Антуана (2.4) или по табл. 7 приложения определяем температуру вещества, при которой достигается данное давление. Эта температура будет являться соответственно нижним (верхним) пределом воспламенения. Задача 3.1. Определить ТПВ метилового спирта, если температура его кипения равна 65 °С. Решение. Расчет проводим по формуле (3.1),значение констант определяем по табл. 6 приложения для нормальных жирных спиртов: t( H ) = 0, 5746 65–33, 7 = 3, 6 С = 276, 6 К; t( В ) = 0, 6928 65–15, 0 = 30 С = 303 К. Определим относительную ошибку расчета. По табл.5 приложения находим, что ТПВ метилового спирта составляют 280 – 312 К: 56 276, 6 280 303 312 100 1, 2 % В 100 2, 9 % 280 312 , . Следовательно, результаты расчета занижены менее чем на 3 %. Задача 3.2. Определить температурные пределы воспламенения ацетона, если его концентрационные пределы в воздухе равны 2,2 – 13,0 %. Атмосферное давление – нормальное. Решение. По формуле (3.2) определим давление насыщенного пара ацетона, соответствующее нижнему и верхнему температурным пределам воспламенения: Н 2,2 101325 13,0 101325 2230 РВ 13172 100 100 Па ; Па ; 2230 13172 РН 16,73 Р 98,8 16,73 133,32 13332 мм. рт. ст.; мм. рт. ст. РН В Из уравнения Антуана (2.4) следует B t C A lg P . Из табл. 12 приложение находим значения констант A, B и С для ацетона: А = 7,25058; В = 1281,721; С = 237,088. lg PH = 1,2235; lg PВ = 1,9994; 1281,721 t 237,088 25 C 248 7,25058 1,2235 К; H tВ 1281,721 237,088 7 C 280 7,25058 1,9994 К. Для решения этой же задачи можно воспользоваться данными табл. 7 приложения. Из табл. 7 следует, что НТПВ находится между температурами 241,9 – 252,2 °С, а ВТПВ – между 271,0 и 280,7 К. Линейной интерполяцией определим ТПВ: Т Н 2417,9 (22,3 13,33) (252,2 241,9) 248,8 26,66 13,33 К; 57 Т Н 271 (131,7 79,99) (280,7 271) 280,4 133,32 79,99 К. Задачи для самостоятельного решения 49. Определить температурные пределы воспламенения в гомологическом ряду жирных углеводородов: бутана, пентана, гексана, октана, температуры кипения которых соответственно равны 273,5, 309, 341,7, 398,7 К. Построить график изменения ТПВ от положения горючего в гомологическом ряду. 50. Сравнить температурные пределы воспламенения n-бутиловых эфиров муравьиной и уксусной кислот. На основании полученных данных сделать вывод от их сравнительной пожарной опасности. Температура кипения бутилформиата равна 379,8 К, а бутилацетата 399 К. 51. Определить температурные пределы воспламенения бутилбензола по его концентрационным пределам. Значения последних рассчитать по аппроксимационной формуле. 52. По концентрационным пределам воспламенения, значения которых следует установить по аппроксимационной формуле, определить температурные пределы воспламенения ацетона и метилэтилкетона. По результатам расчета сделать вывод о сравнительной пожарной опасности этих веществ. 3.2. Расчет температур вспышки и воспламенения Температура вспышки – минимальная температура жидкости, при которой в условиях специальных испытаний происходит воспламенение паров жидкости при кратковременном воздействии высокоэнергетического источника без последующего перехода горения в стационарный диффузионный режим. Температура воспламенения – минимальная температура жидкости, при которой в условиях специальных испытаний происходит воспламенение паров при кратковременном воздействии высокоэнергетического источника с последующим переходом горения в стационарный диффузионный режим. Наиболее распространенным и достаточно точным является расчет температур вспышки и воспламенения по формуле В. И. Блинова 58 TВС ( ВП ) где А , РН . П Д О n (3. 3) TВС ( ВП ) – температура вспышки (воспламенения); А – константа меР тода определения, табл. 3.1; Н . П – давление насыщенного пара при температуре вспышки (воспламенения); Д0 – коэффициент диффузии паров горючего в воздухе; n – стехиометрический коэффициент при кислороде – количество молей кислорода, необходимое для полного окисления (до СO2, О, SO2) одного моля горючего вещества. Коэффициенты диффузии некоторых газов и паров в воздухе при нормальных условиях Д0 приведены в табл. 12 приложения. При их отсутствии последние определяют по формуле Д О 10 4 М m i i , (3.4) где Д0 – коэффициент диффузии, м2/с; – количество i-го элемента в M i – атомные (элементные) составлямолекуле горючего вещества; ющие, табл. 3.2. Таблица 3.1 Температура вспышки в закрытом, открытом тигле, температура воспламенения Определяемый параметр Значение параметра А, м 2 К Па с Температура, К, вспышки в закрытом тигле вспышки в открытом тигле воспламенения 28,0 45,3 53,3 При температуре, отличающейся от нормальной, коэффициент диффузии Д может быть рассчитан по соотношению n Т Д Д0 , 273 59 (3.4 а) где n – показатель, значение которого приведено в табл. 12 приложения. Таблица 3.2 Значение M, зависящее от числа атомов углерода и их положения в молекуле горючего Значение М * 25–50 1 17 16 48 37 79 104 16 Название i-го элемента Углерод (С) Водород (Н) Кислород (О) Азот (N) Сера (S) Хлор (Сl) Бром (Вr) Йод (I) Фтор (F) * Значение M зависит от числа атомов углерода и их положения в молекуле горючего: 1) ∆M = 25 – для атомов углерода, входящих в ароматический цикл; 2) ∆M = 25 + ЗС – для атомов углерода в открытой цепи, если их количество меньше или равно восьми (С, 8); 3) ∆M = 50 – для атомов углерода в открытой цепи при С > 8, 4) ∆M = 25 + 2С – для атомов углерода, входящих в неароматический цикл при С<8; 5) ∆M = 42 – для атомов углерода, входящих в неароматический цикл, если С > 8. Простым, но менее точным является расчет температур вспышки в закрытом тигле по формуле Элея: tвс tкип 18 k , (3.5) t t где вс – температура вспышки, ; кип – температура кипения, °С; k – коэффициент, определяемый по формуле: k 4mC mH 4mS mN 2mO 2mCL 3mF 5mBr , (3.5а) m ,m ,m ,m ,m ,m ,m ,m где C H S N O CL F Br – количество элементов углерода, водорода, серы, азота, кислорода, хлора, фтора, брома в молекуле горючего вещества. 60 Температура вспышки в закрытом тигле может быть определена по нижнему температурному пределу воспламенения: tвс tH 2 0,875 . Эта формула применима, если 0 < (3.6) t < 160. вс Задача 3.3. По формуле В. И. Блинова определить температуру воспламенения бутилового спирта. Р е ш е н и е . Определим значение стехиометрического коэффициента C4H9OH + 6O2 = 4СO2 + 5Н2O. Следовательно, п = 6. Определим значение коэффициента диффузии по формуле (3.4). Для этого по табл. 3.2 устанавливаем, что ∆M = 25 + 3 . 4 = 37, тогда ДО 2 104 75,8 107 м с 37 4 110 17 1 . 1. По табл. 3.1 выберем значение А = 53,3 и по формуле (3.3) определим произведение 53,3 1172 103 К Па. 75,8 10 7 6 По табл. 7 приложения задаемся температурой 326,4 К, при которой давление насыщенного пара равно 5333 Па. ТР Произведение 1 1 = 326,4 5333 = 1740 103К П а . Сравнивая полученное значение с вычисленным в п. 3, устанавлиТ Р T1 P1 . ваем, что ВП Н . П 2. Задаемся по табл. 7 приложения меньшей температурой 314,5 К. Давление насыщенного пара при этом равно 2666 Па. Т ВП РН . П TP 2 2 = 314,5 2666 = 5840 103К П а . TP T P Так как 2 2 > ВП Н . П линейной интерполяцией находим значение температуры воспламенения: 61 Т ВП 314,5 103 (1172 840)(326, 4 314,5) 319 К . 103 (1740 840) Справочное значение температуры воспламенения составляет 314 К. 319 314 100 1, 6 %. 314 Погрешность расчета Задача 3.4. По формуле Элея определить температуру вспышки бензола в закрытом тигле. Решение. Для расчета по формуле (3.5) необходимо знать температуру кипения бензола (С6H6) и значение коэффициента k . Температура кипения бензола 353 К или 80 °С. Величину k определим по формуле (3.5а) k = 4 6 + 6 = 30. Определим искомую величину температуры вспышки t 80 18 30 18,6 С или 254,4 К вс Согласно справочным данным, температура вспышки бензола равна 259 К. Определим ошибку расчета 254,4 259 100 1,8%. 259 Результат расчета занижен менее чем на 2 %. Задачи для самостоятельного решения 53. По формуле В. И. Блинова определить температуру вспышки в открытом сосуде уксусно-метилового эфира. 54. По формуле В. И. Блинова рассчитать температуру воспламенения бензола. 55. По формуле Элея рассчитать температуру вспышки 2– t метилгексана кип = 90,1 °С). 56. Рассчитать температуру вспышки в закрытом тигле стирола (C8H8) по формулам В. И. Блинова и Элея. Оценить точность расчета, T если ВС стирола по справочным данным равна 303 К. 62 57. Определить температуру вспышки в закрытом тигле акриловой кислоты по формулам В. И. Блинова и Элея. 58. Рассчитать температуру вспышки (воспламенения) i-го вещества по формуле В. И. Блинова. Значение Д 0 взять из справочной литературы или определить по формуле (3.4). Сравнить вычисленные значения температуры вспышки (воспламенения) с имеющимися справочными данными и оценить погрешность расчета. Данные для расчета приведены в табл. 3.3. Таблица 3.3 Данные для расчета температуры вспышки (воспламенения) вещества по формуле В. И. Блинова № п/п 1 2 3 4 5 6 7 8 9 10 11 1 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Горючее вещество Уксусный альдегид Ацетон Пропилбензол Окись этилена Сероуглерод Метиловый спирт Толуол Этилбензол Диэтиловый эфир Метилэтилкетон Бутилформиат 2 Амиловый спирт Бутиловый спирт (третичный) 2-метилбутан Октан Этилциклопентан Уксуснопропи– ловый эфир Уксусно-этиловый эфир Пропиловый спирт (вторичный) Бутилбензол Изобутиловый спирт Бензиловый спирт Этиловый спирт Ацетон Уксусный ангидрид Амиловый спирт Бромистый бензол Химическая формула С2Н4O С3Н6О С9Н12 С2Н4O СS2 СН4O С7H8 С8H10 (С2Н5)2O С4Н8O С5Н10O2 3 С5Н12O Температура вспышки в закрытом тигле Температура воспламенения Температура вспышки в открытом тигле Температура воспламенения Температура воспламенения Температура вспышки в закрытом тигле Температура воспламенения Температура воспламенения Температура вспышки в открытом тигле Температура воспламенения Температура вспышки в открытом тигле 4 Температура вспышки в открытом тигле С4Н10О Температура воспламенения С5H12 С8H18 С7H14 Температура вспышки в закрытом тигле Температура воспламенения Температура воспламенения С5Н12O Температура вспышки в закрытом тигле С4Н10О Температура воспламенения Условие задачи С3Н8О Температура воспламенения С10Н14 С4Н10О С7Н8О С2Н6О С3Н6О С4Н6O3 С5Н12О С6Н5Вг Температура вспышки в открытом тигле Температура вспышки в закрытом тигле Температура воспламенения Температура вспышки в открытом тигле Температура вспышки в закрытом тигле Температура воспламенения Температура вспышки в закрытом тигле Температура воспламенения 63 3.3. Расчет стандартной температуры самовоспламенения Самовоспламенением называется явление быстрого нарастания скорости химической реакции, приводящее при определенных внешних условиях к воспламенению горючей смеси. Температура самовоспламенения – минимальная температура порога воздушной смеси, при которой происходит ее воспламенение без влияния высокоэнергетического источника зажигания. Расчет температуры самовоспламенения проводят в следующей последовательности. Определяют количество углеродных цепей mц М Р (М Р 1) 2 , (3.7) m где – общее число цепей; МР – количество функциональных групп в молекуле горючего вещества –С , –ОН, фенил. Фенильная группа может быть как концевой, так и в середине цепи. Определяют длину каждой цепи (количество атомов углерода) и среднюю длину цепи mC I m , (3.8) ц i i CP ц C – количество атомов углерода в i-й цепи. C При определении надо иметь в виду, что группа –ОН удлиняет цепь, а фенильная группа уменьшает ее на один атом углерода. По табл. 8 – 1 0 приложения по средней длине цепи определяют температуру самовоспламенения. Температуру самовоспламенения можно также рассчитать по формулам: где i i tc 300 116 5 I CP при tc 300 38 I CP 5 при I 5 CP I 5 CP ; (3.9) . (3.10) Задача 3.5. Рассчитать температуру самовоспламенения 2,2диметилгексана. 64 Решение. 1. Запишем структурную формулу горючего вещества и определим количество цепей: 7 СН3 1 2| 3 4 5 6 СН3 — С — СН2 — СН2 — СН2 — СН3, 8| СН3 МР = 4, так как в молекуле содержится четыре группы –СН3. 4(4 1) m 6 2 . 2. Находим длину каждой из шести цепей и среднюю длину ц m 1–6 7–6 8–6 1–7 1–8 7–8 C 6 6 6 3 3 3 i i I CP 3 6 33 4,5. 6 По табл. 8 приложения определяем, что температура самовоспламенения равна 643 К. По формуле (3.9) tc 300 116 5 4,5 382 С или 655 К. Задача 3.6. Рассчитать температуру самовоспламенения изопропилового спирта. Решение. 1. Исходя из структурной формулы вещества, определим количество целей 1 2 3 СН3 – СН – ОН, 4│ СН3 65 МР = 3, так как в молекуле содержатся две группы –СН3 и одна группа –ОН. Мц 3(3 1) 3. 2 2. Находим длину каждой цепи и среднюю длину 1–3 m 4–3 1–4 i 2+1 2+1 3 C В цепях 1–3 и 3 – 4 содержатся по два атома углерода и одна группа –ОН, которая удлиняет цепь на один атом углерода i I CP 33 3. 3 3.По табл. 10 приложения находим температуру самовоспламенения изопропилового спирта (706 К); по формуле (3.9) t 300 116 5 3 464 C или 737 К. c Согласно справочным данным, температура самовоспламенения равна 693 К. Относительная ошибка расчета с использованием таблицы составляет 706 693 100 1,9 %. 693 Если расчет вести по формуле (3.9), она возрастет 737 693 100 6,3 %. 693 Задача 3.7. Определить температуру самовоспламенения вещества 1-метил-4-этилбензола. Решение. 1. Структурная формула вещества 66 2 4 1 3 H3C CH2 CH3 МР = 3, так как в молекуле две метильные и одна фенильная группы. 2. Определим длину цепей m 1–4 1–2 2–4 C 3–1 1–1 2–1 i i Длина цепи уменьшается на один атом углерода, так как в нее входит фенильная группа I CP 1 2 1 0 11 1,0. 3 3. По табл. 9 приложения определяем, что температура самовоспламенения равна 712 К. Таблица 3.4 Данные для расчета температуры самовоспламенения вещества № п/п 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Горючее вещество Структурная формула 1,3-диметил-4-пропил-бензол 2-метил-З-этил-гексан 1-метилбутанол Дифенилметан Толуол 3,3-диметилпентан Октан 1,3-диметилбутанол-1 Дифенилэтан 1-метил-2-этил-4-пропилбензол 3,3-диметил-пентанол-1 2-этил-3-метил-пентанол-1 2,2-диметил-гексан 1,2-диметил-4-этилбензол 2,3-диметил-пентан Метилдифенил-метан 2-метил-пропанол-2 (CH3)2C6H3(С3Н7) C3Н7СН(С2Н5)СН(СН3)СН3 C3Н7СН(СН3)ОН СН2(С6Н5)2 СНзС6Н5 С2Н5С(СН3)2С2Н5 C8Н18 СН3СН(СН3)СН2СН(СН3)ОН С2Н4(С6Н5)2 (СН3)(С2Н5)(С3Н7)С6Нз С2Н5С(СН3)2С2Н4ОН С2Н5СН(СН3)СН(С2Н5)СН2ОН С4Н9С(CH3)2СН3 C6Н3(CH3)2(С2Н5) СН3СН(СН3)СН(СН3)С2Н5 (CН3)CH(C6H5)2 (CH3)3СОН 67 18 19 20 21 22 23 24 25 26 27 28 29 3-метил-пентанол-2 2,2,3,3-тетра-метилбутан 2,3-диметил-октан 4-метил-4-этилгептан 3-метил-пентанол-2 1,2,3-триметил-гексано-1 1,2,3,4-тетра-метилбензол 2,3,4-триметил-5-этилдекан 3,3-диметил-4,4-диэтил-нонан 3,3-диметил-гептанол-2 2,2,4-триметил-пентан 3-метил-пентанол-1 СН3СН(ОН)СН(СН3)С2Н5 СН3С(СН3)2С(СН3)2СН3 СН3СН(СН3)СН СН3С5Н11 С3Н7С(СН3)(С2Н5)С3Н7 С2Н5СН(СН3)СН(ОН)СН3 С3Н7СН(СН3)СН(СН3)СН(СН3)ОН С6Н2(СН3)4 СН3СН(СН3)СН(СН3)СН(СН3)СН(C2H5)С5Н11 С2Н5С(СН3)2С(С2Н5)2С5Н11 СН3СН(ОН)С(СН3)2С4Н9 СН3С(СН3)2СН2СН(СН3)СН3 С2Н5СН(СН3)СН2СН2ОН Задачи для самостоятельного решения 59. Рассчитать температуру самовоспламенения нормального бутилового спирта, вторичного бутилового спирта и третичного бутилового спирта. Сделать вывод о влиянии разветвления углеродной цепи на температуру самовоспламенения. 60. Определить температуру самовоспламенения этана, бутана, гексана, декана. Построить график зависимости температуры самовоспламенения от их положения в гомологическом ряду. 61. Определить температуру самовоспламенения веществ: 2-метил4 изопропилгептана и 2-метил-4-изопропилгептанола. Сделать вывод о сравнительной пожарной опасности предельных углеводородов и предельных одноатомных спиртов. 62. Рассчитать температуру самовоспламенения веществ: толуола и 1,4-диизопропилбензола и сделать вывод о влиянии длины боковой цепи на сравнительную пожарную опасность ароматических соединений. 63. Рассчитать температуру самовоспламенения октана, октанола-1 и этилбензола и сделать вывод о влиянии строения вещества на их сравнительную пожарную опасность. 64. Рассчитать стандартную температуру самовоспламенения i-го вещества. Сравнить расчетное значение с имеющимися справочными данными и определить относительную ошибку расчета. Данные для расчета приведены в таблице 3.4. 4. ЭНЕРГИЯ И МОЩНОСТЬ ВЗРЫВА. ТРОТИЛОВЫЙ ЭКВИВАЛЕНТ 68 К показателям взрывоопасности веществ относятся такие параметры взрыва, как максимальное давление взрыва, тротиловый эквивалент взрывчатой системы или вещества, тротиловый эквивалент взрыва (мощность взрыва). 4.1. Расчет максимального давления взрыва Максимальное давление взрыва – это давление, которое возникает в результате горения или детонации парогазовых смесей при условии реализации изохорно-адиабатического процесса. Максимальное давление взрыва для парогазовых смесей углеводородных топлив рассчитывается по формуле: max pвзр POTвзрnП . Г ncTO , (4.1) p Р Т n где – максимальное давление взрыва, Па; О , О , c – давление, температура, количество смеси до взрыва, соответственно, в Па, К, T n моль; вз р , П . Г – температура взрыва, количество продуктов горения, соответственно, в К, моль. Задача 4.1. Рассчитать максимальное давление взрыва бутано– воздушной смеси стехиометрического состава. На момент взрыва давР ление и температура были близки к нормальным условиям ( О = 105 Па, Т= 273 К). Температура взрыва 2905 К. Решение. 1. Определяем состав и объем исходной смеси и продуктов горения в соответствии с формулами п.п. 1 и 2. Запишем уравнение химической реакции: max вз р С4Н10+ 6,5O2+ (6,5 3,76)N2 = 4СO2+5Н2O + (6,5 3,76)N2. Из уравнения реакции следует: количество исходной смеси стехиометрического состава равно 31,9 моль, количество продуктов сгорания 33,4 моль. 2. Рассчитываем максимальное давление взрыва бутано-воздушной смеси (формула (4.1)). 69 max pвзр POTвзрnП . Г 105 2905 33,4 11,14 105 Па. ncTO 31,9 273 3. Избыточное давление взрыва Р будет равно: Р р max взр 1 10 Па 11,14 10 1 10 10,14 10 Па. 5 5 5 5 4.2. Расчет тротилового эквивалента взрыва и безопасного расстояния по действию воздушных ударных волн Тротиловый эквивалент вещества – это отношение теплоты взрыва 1 кг вещества (в смеси с окислителем) к теплоте взрыва 1 кг тротила (тринитротолуола). Тротиловый эквивалент вещества рассчитывается по формуле: тнт Qвз р Qтнт , (4.2) Q Q где – тротиловый эквивалент парогазовой смеси , H – теплота Q взрыва вещества, кДж/кг; ( тнт = 4,187.103 кДж/кг – теплота взрыва тротила (тринитротолуола). Тротиловый эквивалент взрыва (мощность взрыва) – это отношение энергии, выделившейся при взрыве, к теплоте взрыва 1 кг тротила. Из определения тротилового эквивалента взрыва следует, что тротиловый эквивалент взрыва есть условное количество взорвавшегося тротила. Тротиловый эквивалент взрыва (мощность взрыва) парогазовых смесей рассчитывается по формуле: Q my M Q , (4.3а) вз р вз р тнт тнт или с учетом формулы (4.2): 70 M тнт m y , (4.3б) M где тнт – масса условно взорвавшегося тротила; m – количество горючего вещества пожаровзрывоопасной смеси; у – доля потенциальной энергии, перешедшей в кинетическую энергию взрыва. При взрыве парогазовой смеси углеводородных топлив в ограниченном объеме (помещении, оборудовании) коэффициент у принимается равным 1, при взрыве в неограниченном объеме (взрыв облака парогазовой смеси) коэффициент у, как правило, принимают равным 0,4. Размер безопасной зоны по действию давления воздушной ударной волны взрыва рассчитывают по формуле: R 15 М 3 без тнт , (4.4) R где без – безопасное расстояние по действию ударной волны взрыва, М м; тнт – тротиловый эквивалент взрыва, кг. Задача 4.2. Рассчитать тротиловый эквивалент взрыва бутана. Решение. 1. Теплота взрыва бутана принимается равной его низшей теплоте Q сгорания. Значения H для бутана составляет 2,67 10 кДж/моль. При перечете на 1 кг бутана теплота взрыва составит: 3 Qвзр кДж 2, 67 103 моль 46,103 кДж . кг 58 103 кДж моль 2. Согласно соотношению (4.2),тротиловый эквивалент взрыва бутана в смеси стехиометрического состава будет равен: C4 H10 тнт 46 103 10,9 11. 4,187 3 Задача 4.3. Рассчитать тротиловый эквивалент возможного аварийного взрыва 20 кг бутана с воздухом: а) в технологическом оборудовании; 71 б) в облаке. Решение. 1. Тротиловый эквивалент взрыва бутана в смеси стехиометрического состава равен 10,9 (задача 4.2). 2. Тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании рассчитывается по формуле (4.3б) при условии у = 1: М тнт = η m y = 10,9 20 1 = 220 кг (тротила). 3. Тротиловый эквивалент возможного аварийного взрыва при взрыве облака рассчитывается по формуле (4.3б) при условии у = 0,4. М тнт = η m y = 10,9 20 0,4 = 90 кг (тротила). Задача 4.4. Для случаев взрывов, рассмотренных в задаче 4.3, рассчитать безопасное расстояние по действию ударной воздушной волны. Решение. 1. Безопасное расстояние по действию ударной воздушной волны при взрыве в технологическом оборудовании, согласно формуле (4.4), будет равно: Rбез 15 3 М тнт 15 3 220 91 м. 2. Безопасное расстояние по действию ударной воздушной волны при взрыве облака, согласно формуле (4.4),будет равно: Rбез 15 3 М тнт 15 3 90 67 м. Задачи для самостоятельного решения 65. Определить тротиловый эквивалент аварийного взрыва облака из смеси паров ацетона с воздухом и безопасное расстояние по действию ударной воздушной волны взрыва. Концентрация паров горючего в смеси 0,2 кг/ м 3 . Объем облака 2500 м 3 . 66. Определить количество взорвавшихся паров бензола, если после аварии отмечены разрушения на расстоянии 100 м. от эпицентра взрыва. Взрыв произошел в помещении. 72 67. Рассчитать максимальное давление взрыва и безопасное расстояние по действию ударной воздушной волны взрыва для парогазовоздушной смеси i-го вещества. При расчете максимальное давление Р 105 Па, взрыва принять давление и температуру до взрыва равным: О Т0 = 298 К. 68. Определить возможность разрушения металлического резервуара, рассчитанного на давление 5.1 0 5 П а , при взрыве паров толуола. 69. Рассчитать максимальное давление взрыва и безопасное расстояние по действию ударной воздушной волны взрыва для парогазовоздушной смеси i-го вещества. При расчете максимальное давление Р 105 Па, взрыва принять давление и температуру до взрыва равным: О Т0 = 298 К. 7 0 . Расчет безопасного расстояния выполнить как для условия взрыва в ограниченном объеме, так и для взрыва в открытом пространm стве. Расчет выполнить для горючего вещества массой i (табл. 4.1) Таблица 4.1 Данные для расчета максимального давления взрыва и безопасного расстояния по действию ударной воздушной волны взрыва для парогазовоздушной смеси № п/п 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Горючее вещество Диметиловый эфир Диэтиловый эфир n-бутиловый спирт Нитроэтан Окись углерода n-пентан Пропан Сероводород Этилбензол Этилен Толуол Этиленгликоль Этан Уксусно-бутиловый эфир n-гексиловый спирт Уксусно-этиловый спирт Химическая формула C2H6O C4H10O C4H10O C2H5NO2 CO C5H12 C3 H 8 H2 S C8H10 C2 H 2 C7 H 8 C2H6O C2 H 6 C6H12O2 C6H14O C4H8O2 73 Масса горючего, кг 10 150 15 2 3 50 100 20 15 120 80 5 60 20 70 30 17 18 19 20 21 22 23 24 25 26 Метиловый спирт Пропиловый спирт Метан Глицерин Этиловый спирт Изобутан Аммиак n-гептан Анилин n-гексан CH4O C4H8O CH4 C3H5(OH)3 C2H5OH C4H10 NH3 C2 H16 C6H7N C6H14 130 30 10 25 75 75 200 100 250 30 4.3. Определение взрывоопасности смеси горючих газов Взрывы горючих газов на предприятиях относятся к наиболее опасным авариям и приводят, как правило, к групповому травматизму с тяжелыми последствиями. Наиболее распространенными горючими газами, которые могут выделяться на предприятиях в аварийных ситуациях и образовывать с воздухом взрывоопасные смеси, являются метан, оксид углерода, водород, этан, ацетилен. Пределы взрываемости в воздухе находятся: оксида углерода от 12,5 % до 75 %; водорода от 4,1 % до 74 %; этана от 3,2% до 12,5 %; ацетилена от 3,0 % до 65 %. По мере снижения концентрации кислорода в газовой смеси (например, за счет добавки инертных газов) пределы взрываемости этих горючих газов уменьшаются. Наиболее часто встречающаяся в шахтах метано-воздушная смесь взрывается при концентрации метана от 5 до 15 %. Смесь, содержащая до 5 % метана, не взрывчата, но может гореть при наличии источника высокой температуры. При концентрации метана более 15 % смесь не взрывчата и не поддерживает горения, а с притоком кислорода извне горит спокойным пламенем в зоне перемешивания этих газов. Наибольшей силы взрыв достигает при концентрации метана 9,5 %, так как в этом случае на его сжигание используется весь кислород воздуха. Температура взрыва метано-воздушной смеси может достигать 2650 °С, если взрыв произошел в замкнутом пространстве, и 1850 °С, если продукты взрыва могут свободно распространяться. При перемешивании метана с воздухом концентрация кислорода в смеси снижается по линейной зависимости от 21 % (содержание кислорода в атмосферном воздухе) до 0 при 100 % содержании метана (рис. 4.1) 74 При концентрации метана от 5 % до 15 %, что соответствует содержанию кислорода в смеси от 18 % до 20 %. смесь горит и взрывается. Однако в реальных условиях шахты концентрация кислорода может быть существенно меньше обозначенных пределов из-за сорбции кислорода углем, поглощения при горении, а также образованна и выделения инертных газов. Поэтому пределы взрываемости смесей метана с воздухом при различных концентрациях кислорода (Ск) можно определить по треугольнику взрываемости (рис. 4.1). Треугольники взрываемости горючих газов строят по экспериментальным данным, полученным на лабораторной установке. Эксперименты, проведенные со смесями газов, показали, что взрывоопасные концентрации расположены в области, имеющей форму треугольника (область 2). Из рис. 4.1 видно, что наблюдается постепенное сужение нижнего и верхнего концентрационного предела взрываемости смеси метана с воздухом вплоть до выхода в точку при объемной доле кислорода, равной 12,2 %. Это связано в цепным механизмом передачи теплового импульса зажигания. В области 3 для осуществления цепной реакции окисления недостаточно молекул метана, в области 4 – молекул кислорода. Треугольник взрываемости» для других горючих газов имеет тот же вид, что и для метана, но различные размеры. Взрываемость смеси горючих газов при подземных пожарах также определяется с помощью «треугольника взрываемости». Нижний концентрационный предел взрываемости смеси горючих газов (в об. %) определяется по формуле, предложенной Ле Шателье: N 100 n n1 n2 n3 ... i N1 N 2 N3 Ni (4.5) где n1,n2,…ni – объемное содержание каждого горючего компонента в смеси горючих газов, %; N1,N2,…Ni – нижние концентрационные пределы взрываемости каждого из этих компонентов, %. 75 24 Cк, % 1 2 16 3 4 8 0 0 8 16 24 32 См, % Рис. 4.1. Объемные пределы взрываемости метано-воздушных смесей: 1 – несуществующая смесь; 2 – взрывчатая смесь; 3 – невзрывчатая смесь; 4 – смесь, способная стать взрывчатой при добавлении воздуха Объемное содержание каждого горючего компонента в смеси горючих газов определяют по формуле ni 100Ci (4.6) n C i i где Сi – концентрация соответствующего горючего газа в смеси с воздухом, %. Формула Ле Шателье верна для большинства углеводородов. Однако для смесей, состоящих из сильно различающихся по структуре органических компонентов, применяемость этой формулы ухудшается. Для оценки взрываемости смеси горючих газов вначале определяется общее суммарное содержание горючих газов (%). Для наиболее распространенных в угольных шахтах горючих газов используется формула Cг См Со Св (4.7) где См , Со , Св – концентрация соответственно метана, оксида углерода и водорода, %. Затем рассчитывают долю каждого горючего газа в смеси по выра76 жениям: Рм См /Cг ; Pо Cо / Cг ; Pв Cв / Cг . (4.8) Правильность расчета проверяется по соотношению Pм Pо Pв 1 (4.9) По полученным данным выбирают соответствующий треугольник взрываемости. Затем концентрацию кислорода в смеси наносят на ось ординат, а сумму концентраций горючих газов на ось абсцисс на соответствующем графике (рис. 4.2–4.7) и в точке их пересечения определяют местонахождение данной смеси. В случае, если найденная точка находится внутри «треугольника взрываемости», то газовая смесь может взорваться при появлении источника огня или повышении температуры газа. Так, произведенный отбор проб газа из атмосферы пожарного участка показал, что газовая смесь содержит кислорода ( Cк ) 15 %, оксида углерода ( Cо ) 0 %, метана ( C м ) 2,1 % и водорода ( Cв ). 2 4 Cк, % Р0 = 0 A 16 X С Рм = 1,0 Р0,9 0,8 0,7 0,6 0,5 0,4 0,3 м= 8 B 0 0 Сг, % 8 16 24 3 2 Рис. 4.2. Треугольники взрываемости смеси горючих газов при отсутствии оксида углерода 77 24 Р0 = 0,1 Cк, % .A 16 С 0 . Рм 0,9 0,8 0,7 0,6 0,5 0,4 0,3 = 8 .B Сг, % 0 8 16 32 24 Рис. 4.3. Треугольники взрываемости смеси горючих газов при доле оксида углерода 0,1 24 Р0 = 0,2 Cк, % . A 16 С Рм = 0,8 0,7 0,6 0,5 0,4 0,3 8 0 . 0 . Сг, % B 8 16 24 32 Рис. 4.4. Треугольники взрываемости смеси горючих газов при доле оксида углерода 0,2 78 24 Р0 = 0,3 Cк, % . A 16 С Рм = 0,7 0,6 0,5 0,4 0,3 8 . 0 . Сг, % B 0 16 8 24 32 Рис. 4.5. Треугольники взрываемости смеси горючих газов при доле оксида углерода 0,3 24 Р0=0,4 Cк, % . A 16 С Рм = 0,6 0,5 0,4 0,3 8 0 . 0 . B 8 16 24 32 Сг, % Рис. 4.6. Треугольники взрываемости смеси горючих газов при доле оксида углерода 0,4 79 24 Р0 = 0,5 Cк, % . A 16 С Рм = 0,5 0,4 0,3 8 0 . 0 B . Сг, % 8 16 24 32 Рис. 4.7. Треугольники взрываемости смеси горючих газов при доле оксида углерода 0,4 Затем по формуле (4.7) подсчитываем, что концентрация суммы горючих газов ( Cг ) равна 3,5 %. Даля оксида углерода в смеси горючих газов ( Ро ) равна 0, а доля метана Рм – составляет 0,6. Исходя из расчетных данных, выбираем соответствующий треугольник взрываемости (рис. 4.2). Затем на оси графика рис. 4.2 наносим значения концентраций кислорода и суммы горючих газов и находим точку X, соответствующую состоянию атмосферы пожарного участка. Из графика видно, что точка X расположена вне «треугольника взрываемости», поэтому на данный момент смесь горючих газов не может взорваться. Однако найденная точка находится вблизи нижнего концентрационного предела взрываемости смеси и незначительное изменение, способствующее увеличению концентрации горючих компонентов в рудничной атмосфере, может переместить точку X в зону взрываемоcти. По графику расположения зовы взрываемости горючих газов можно определить, куда будет смешаться точка, отображающая соответственную газовую смесь, в случае изменения концентрации составляющих ее компонентов (кислорода, горючих газов и инертных газов). Так, линия, 80 соединяющая полученную точку X с точкой А, покажет, куда будет смещаться смесь в случае увеличения подачи свежего воздуха и, соответственно, роста в ней концентрации кислорода. Из рис. 7.2 видно, что добавление свежего воздуха приведет к снижению концентрации горючих газов и удалению смеси от треугольника взрываемости. Перемещение точки X по линии, соединяющей ее с точкой В, происходит в случае, если в смесь газов будут добавляться инертные газы. С этой целью в опасную зону могут нагнетать азот, углекислый газ, аргон и другие газы, не поддерживающие горения в снижающие концентрации в смеси кислорода и горючих газов. Согласно рис. 4.2 такое воздействие также удаляет смесь от треугольника взрываемости, что уменьшает опасность взрыва смеси. В случае дополнительного выделения горючих газов, приводящего к увеличению их концентрации в смеси, точка X отображающая состояние смеси газов, начнет перемешаться к точке С. Для приведенного на рис. 4.2 примера это означает вхождение в треугольник взрываемости и образование взрывчатой смеси. Увеличение концентрации горючих газов в рудничной атмосфере может происходить при изоляционных работах, снижении притока свежего воздуха при сохраняющейся интенсивности выделения горючих газов. Таким образом, использование «треугольников взрываемости» в шахтах при тушении пожаров позволяет не только оценить возможность взрыва образующейся смеси газов, но и проанализировать, как будет изменяться ситуация в пожарном участке в случае увеличения выделения горючих газов, повышения или снижения количества подаваемого свежего воздуха или при подаче инертных газов. Соответственно появляется возможность выбора наиболее эффективного способа предотвращения взрыва горючих газов. Задача для самостоятельного решения 1. Из предложенных в табл. 4.2 вариантов выбирают заданный состав смеси газов, возникший в атмосфере пожарного участка. По формулам (4.5) и (4.6) определяют нижний концентрационный предел взрываемости смеси этих горючих газов. Затем по формуле (4.7) рассчитывают общее содержание горючих газов, а по формуле (4.8) долю каждого горючего газа в смеси. По формуле (4.9) проверяют правильность расчета. 2. По рассчитанным данным на рисунках 4.2–4.7 выбирают соответствующий доли оксида углерода треугольник взрываемости горючих газов и перечерчивают его в тетрадь. 81 3. Наносят на выбранный график заданную точку и определяют возможность взрыва смеси горючих газов. 4. Анализируют опасность взрыва в случае увеличения интенсивности выделения горючих газов, усиления проветривания свежим воздухом и при подаче инертных газов. 5. Выбирают оптимальный путь предотвращения взрыва смеси горючих газов. Таблица 4.2 Исходные данные для оценки взрываемости смеси горючих газов при пожаре в шахте № п/п Состав атмосферы пожарного участка, % Метан Оксид углерода 3 4 4 0 1 1 Кислород 2 17 Водород 5 0 2 3 4 5 8 10 16 12 6 7,2 1,9 8 2 1,8 0 1,6 1 2 3 4 6 14 7 1 2 7 8 18 16 3,2 6,4 0 0,8 4,8 0,8 9 10 11 15 16 13 3 12 3,6 2 0 1,8 5 0 4,6 12 13 12 14 4 8 1,6 0 2,4 2 14 15 11 16 4,2 4,8 1,4 1,2 1,4 0 16 17 18 19 20 17 18 16 15 14 1,5 1,6 4 7,2 10,5 1,5 1,2 2,4 3,6 4,5 12 1,2 1,6 1,2 0 21 22 14 13 4,8 7,2 6,4 7,2 4,8 3,6 23 12 10 8 2 12 9 1,9 6,4 Окончание табл.4.2 82 5 24 25 26 10 13 11 14,4 7,2 8 9,6 12 10 0 4,8 2 27 28 9 14 8 5 8 1 0 29 7 7 3 4 30 12 4 4 3 2 ПРИЛОЖЕНИЕ Таблица 1 а Энтальпия (теплосодержание) газов при постоянном давлении Теплосодержание, кДж/моль Температура, С 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 O2 3,0 6,0 9,1 12,4 15,7 19,1 22,5 26,0 29,6 33,1 36,8 40,4 44,0 N2 2,9 5,8 8,8 11,8 14,9 18,1 21,3 24,6 28,0 31,3 34,8 38,2 41,7 Воздух 2,9 5,8 8,9 11,9 15,1 18,3 21,5 24,8 28,2 31,6 35,1 38,6 42,1 83 CO2 3,8 8,0 12,5 17,3 22,3 27,5 32,8 38,2 43,8 49,4 55,1 60,9 66,8 H2 O 3,3 6,8 10,4 14,0 17,8 21,7 25,8 29,9 34,2 38,6 43,2 47,8 52,6 SO2 4,1 8,5 13,2 18,2 23,3 28,5 33,9 39,3 44,8 50,3 55,9 61,5 67,2 1400 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400 2500 2600 2700 2800 2900 3000 47,7 51,5 55,2 59,0 62,8 66,6 70,4 74,2 78,1 82,0 85,9 89,9 94,0 97,9 101,8 105,1 110,1 45,3 48,8 52,4 55,9 59,5 63,1 66,8 70,4 74,1 77,8 81,5 85,1 89,0 92,6 96,4 100,5 103,8 45,6 49,2 52,8 56,4 60,0 63,6 67,3 71,0 71,7 78,4 82,1 85,9 89,3 93,1 96,8 100,5 104,2 72,7 78,6 84,6 90,5 96,6 102,6 108,6 114,7 120,8 126,9 133,0 139,1 145,3 101,5 107,6 163,8 169,9 57,4 62,3 67,3 72,4 77,6 82,8 88,1 93,4 98,8 104,2 109,6 115,1 119,4 124,8 130,3 135,8 141,2 72,8 78,4 84,1 89,8 95,6 101,2 107,1 112,7 110,5 124,2 130,0 135,8 141,6 147,3 153,0 158,8 164,7 Продолжение прил. Таблица 1 б Энтальпия (теплосодержание) газов при постоянном давлении Теплосодержание, кДж/ м3 ∙10–2 Температура, С 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 O2 N2 Воздух CO2 H2 O SO2 1,3 2,7 4,1 5,5 6,7 8,5 10,0 11,6 13,2 14,8 16,4 18,0 19,7 21,3 1,3 2,6 3,9 5,3 6,7 8,1 9,5 11,0 12,5 14,0 15,5 17,1 18,6 20,1 1,3 2,6 3,9 5,3 6,7 8,1 9,6 11,1 12,6 14,1 15,6 17,2 18,8 20,4 1,7 3,6 5,6 7,7 9,3 12,3 14,6 17,1 19,5 22,1 24,6 27,2 29,8 32,4 1,5 3,0 4,7 5,9 6,3 9,7 11,5 13,4 15,3 17,2 19,3 21,3 23,5 25,6 1,8 3,8 5,9 8,2 10,3 12,7 15,1 17,5 19,9 22,4 24,9 27,4 29,8 22,4 84 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400 2500 2600 2700 2800 2900 3000 23,0 24,6 26,3 28,0 29,7 31,4 33,1 35,0 36,6 49,4 40,0 41,8 43,7 45,5 47,3 49,4 21,8 23,4 25,0 26,6 28,2 29,8 31,4 33,0 34,7 46,3 38,0 39,5 41,4 43,0 44,7 46,3 21,9 23,6 25,2 26,8 28,4 30,0 31,7 33,3 35,0 46,5 38,3 40,0 41,6 43,2 44,8 46,5 35,1 37,7 40,4 43,1 45,8 48,5 51,2 53,9 56,6 75,9 62,1 64,9 67,6 70,3 73,1 75,9 27,8 30,0 32,3 34,6 36,9 39,3 41,7 44,1 46,7 64,3 51,4 53,9 56,4 59,0 61,6 64,3 34,9 37,5 40,0 42,6 45,3 47,9 50,6 53,4 56,1 76,6 61,7 64,6 67,5 70,5 73,5 76,6 Продолжение прил. Таблица 2 Внутренняя энергия Теплосодержание, кДж/моль Температура, С 100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 O2 N2 Воздух CO2 H2 O SO2 2,2 4,1 6,6 9,1 11,5 14,1 16,7 19,4 22,1 24,8 27,7 30,4 33,2 35,1 39,0 41,9 2,1 4,1 6,3 8,5 10,7 13,1 15,5 18 20,5 23 25,7 28,2 30,9 33,7 36,3 39,1 2,1 4,1 6,4 8,6 10,9 13,3 15,7 18,1 20,7 23,3 26,0 28,6 31,3 34,0 36,7 39,5 2,9 6,3 10,0 14,6 18,1 22,5 27,0 31,6 36,3 41,1 46,0 50,9 56 61,1 66,1 71,3 2,5 5,1 7,0 10,7 13,6 16,7 20 23,3 27,7 30,3 34,1 37,8 41,8 45,8 49,8 54,0 3,3 6,8 10,7 14,9 19,1 23,5 28,1 32,7 37,3 42 46,8 51,5 56,4 61,2 65,9 70,8 85 1700 1800 1900 2000 2100 2200 2300 2400 2500 2600 2700 2800 2900 3000 44,9 47,8 50,8 53,8 56,7 59,8 62,9 65,9 69,1 72,4 75,5 78,5 81,0 85,2 41,8 44,5 47,3 50,2 52,9 55,8 58,7 61,6 64,3 67,4 70,2 73,1 76,4 78,9 42,3 45,0 47,8 50,7 53,5 56,4 59,3 62,2 65,1 67,7 70,7 73,5 76,9 79,3 86 76,4 81,6 86,8 92,0 97,2 102,5 107,8 113,0 118,3 123,7 128,9 134,2 139,7 145,0 58,3 62,6 67,0 71,5 75,9 80,5 85,1 89,7 94,3 97,8 102,4 107,0 111,7 116,3 75,7 80,6 85,4 90,5 95,2 100,2 105,1 110,1 115 120,0 124,9 130,0 134,7 139,8 Продолжение прил. Таблица 3 Теплота образования веществ Вещество Теплота образования, кДж/моль Альдегид: муравьиный (ж) уксусный (ж) Аммиак (газ) Анилин (ж) Антрацен (тв) Ацетилен (газ) Ацетон (ж) Бензол (ж) Бутадиен-1,3 (ж) n-бутан (газ) n-бутан (ж) 121,1 166,3 46,1 29,7 –101,4 –224,6 248,1 –34,8 –104,3 132,4 153,8 Бутен-1 (газ) Винилхлорид (газ) Винилхлорид (ж) Вода (ж) Вода (газ) n-гексан n-гептан Глицерин Двуокись: серы углерода Диоксон (ж) Дифенил (тв) Изобутан (ж) Кислота: бензойная (ж) масляная муравьиная (ж) олеиновая пропионовая (ж) стеариновая (тв) уксусная (ж) Метан Мочевина Нафталин Нитроэтан (ж) Окись углерода n-пентан (ж) Пропан (газ) 6,3 –37,7 –17,2 286,6 242,2 167,2 239,7 675,4 297,5 396,6 375,4 –80,4 159,2 394,3 525,0 419,0 625,1 458,4 937,7 485,6 75,0 – –62,8 144,1 112,7 184,4 109,4 87 Продолжение прил. Окончание табл.3 1 Пропан (ж) Сероводород Сероуглерод (ж) Спирт: n-амиловый n-бутиловый n-гексиловый метиловый (ж) пропиловый (ж) этиловый (ж) Теофен Тетралин Толуол (ж) Фенол (тв) Этан (газ) Этилбензол (ж) Этилен Этиленгликоль (ж) 2 125,3 201,1 –88,0 359,1 341,5 385,1 239,0 307,1 278,2 –81,7 81,7 4,19 171,4 88,4 33,1 –48,6 455,4 Таблица 4 Показатели пожарной опасности некоторых газов Газы Плотность по воздуху Температура самовоспламенения, К Аммиак Ацетилен Бутан Бутилен Водород Метан Окись углерода Окись этилена Окись пропилена Пропан Пропилен Сероводород Этан Этилен 0,59 0,9 2,0 1,93 0,069 0,55 0,967 1,5 2,0 1,56 1,45 1,19 1,04 0,97 903 608 678 657 783 810 883 702 673 739 683 519 745 813 88 Пределы воспламенения, % нижний верхний 15,0 2,0 1,9 1,6 4,0 5,0 12,5 3,0 2,0 2,1 2,2 4,3 2.9 3,0 28,0 81,0 9,1 9,4 75,0 15,0 74,0 80,0 22,0 9,5 10,3 46,0 15,0 32,0 Продолжение прил. Таблица 5 Показатели пожарной опасности некоторых жидкостей Жидкость Анилин Альдегид уксусный Ацетон Бензол Глицерин Кислота уксусная (ледяная) Сероуглерод Спирт: изоамиловый бензиловый n-бутиловый изобутиловый метиловый n-пропиловый изопропиловый этиловый Стирол Толуол Этиленгликоль Эфир диэтиловый Эфир уксусноизоамиловый Эфир уксусно-этиловый Температурные пределы воспламеТемператунения, К Плотность, ра самовоспламенения, нижний кг/ К (темпераверхтура ний вспышки) 1022 835 343 363 780 458 235 – 790 738 253 279 879 813 259 283 1260 673 431 513 1049 727 308 349 1263 363 223 299 816 1050 814 820 795 803 785 789 902 866 1114 713 870 628 673 683 828 881 673 310 360 304 299 280 293 281 284 299 273 385 228 276 737 643 693 803 809 653 437 703 89 335 418 333 323 312 326 310 314 332 303 397 386 330 Концентрационные пределы воспламенения, К нижний верхний 1,3 4,0 2,2 1,4 – 4,2 5,0 13,0 7,1 – 3,3 1,0 22,0 50,0 1,07 1,0 1,52 1,89 6,0 2,02 2,25 3,6 1,08 1,3 3,8 1,7 0,2 5,0 15,5 7,9 7,3 34,7 13,55 11,65 19,0 6,2 6,7 6,35 49 4,35 Продолжение прил. Таблица 6 Величины параметров k и l для вычисления температурных пределов воспламенения некоторых жидкостей Параметры Формулы n= 1, 2, 3, 4,… Гомологический ряд k l 0,6957 73,8 Нормальные алканы CH3-(CH2)n-CH3 0,7874 50,3 0,6885 74,9 2-метилалканы (CH3)2-CH(CH2)n-CH3 0,7900 52,2 0,6867 74,5 Нормальные 1-алканы (CH3)2=CH-(CH2)n-CH3 0,7976 49,5 Нормальные жирные 0,5746 33,7 CH3-(CH2)n-ОH спирты 0,6928 15,0 0,6582 44,1 2-метилкарбинолы (CH3)2 CH-(CH2)n-OH 0,7278 21,5 0,5359 47,6 n-алкилформиаты HCOO-(CH2)n-CH3 0,6050 25,0 0,5940 50,9 n-алкилацетаты CH3 COO-(CH2)n-CH3 0,7761 40,8 Примечание. Числитель параметра относится к нижнему температурному пределу воспламенения, знаменатель – к верхнему температурному пределу воспламенения. Таблица 7 Давление насыщенных паров некоторых индивидуальных веществ, Па Вещество 1 Акриловая кислота Альдегид уксусный Ангидрид уксусный Ацетон Бензол Бромистый этил Бутилбензол Бутилформиат Метилэтилкетон 133,322 2 1333,22 2666,44 5332,88 7999,32 13332,2 26664,4 Температура, К 3 4 5 6 7 8 53328,8 101325 9 10 276,5 312,0 325,0 339,2 348,0 359,1 376,3 395,0 414,0 191,5 216,2 225,2 235,2 241,6 250,4 263,0 277,9 293,3 274,7 309,0 321,8 335,1 343,8 355,2 373,0 392,8 412,6 213,6 236,3 241,9 261,5 252,2 270,4 163,6 280,6 271,0 288,4 280,7 299,1 295,7 315,2 312,5 333,6 329,5 353,1 198,7 225,5 235,2 246,3 253,5 263,2 287,5 294,0 311,4 295,7 246,6 335,0 271,1 349,3 291,0 365,4 304,6 375,6 312,8 389,2 324,0 409,9 340,9 432,2 359,2 456,1 379,0 224,2 255,3 266,5 279,0 287,0 298,0 314,6 333,0 352,6 90 Продолжение прил. Окончание табл.7 1 Метилциклогексан 3-метил2-бутанол 1 2-метилбутан Окись этилена Октан Пропилбензол 2 3 4 5 6 7 8 9 10 237,1 269,8 281,7 295,0 303,5 317,1 332,6 252,6 373,9 253,1 283,3 291,3 302,6 309,2 318,5 332,0 346,8 361,9 2 190,1 198,0 259,0 279,3 3 216,0 224,0 281,3 316,4 4 225,7 233,7 304,5 329,8 7 – 8 267,1 275,1 356,0 386,5 9 283,5 290,8 377,0 408,7 10 300,8 307,5 398,6 432,2 Аллиловый Амиловый Бензиловый Бутиловый Бутиловый (вторичный) Изобутиловый Метиловый н-пропиловый Пропиловый (вторичный) Этиловый 253,0 286,6 331,0 271,8 283,5 317,9 365,6 303,2 294,7 328,8 378,8 314,5 5 6 236,5 243,4 244,5 251,7 318,1 326,8 344,6 354,1 СПИРТЫ 306,4 313,3 341,0 348,5 392,8 402,3 326,4 333,3 323,0 358,8 414,7 343,1 337,5 375,0 433,0 357,3 353,2 392,8 456,0 373,8 369,6 410,8 477,7 390,5 270,8 389,9 300,3 311,1 318,2 327,1 340,9 356,9 372,5 264,0 229,0 258,0 287,3 256,8 287,7 294,7 267,0 298,3 317,1 278,8 309,4 324,7 285,1 316,5 334,58 294,2 325,8 348,9 307,8 339,8 364,4 322,9 365,0 381,0 337,7 370,8 249,1 275,4 285,7 296,8 303,5 312,5 326,0 340,8 355,5 241,7 270,7 231,0 292,0 299,0 309,9 321,4 336,8 351,4 Стирол Сероуглерод Толуол Этилбензол 266,0 199,2 246,3 263,2 303,8 228,3 279,4 298,9 317,6 238,7 291,4 311,6 355,0 267,9 324,9 347,1 374,3 283,4 342,5 365,7 395,5 301,0 362,5 386,8 418,2 319,5 383,6 409,2 Диэтиловый Уксуснометиловый Уксуснопропиловый Уксусноэтиловый 198,7 224,9 234,5 332,8 342,5 250,5 257,7 304,8 313,3 325,8 334,8 ЭФИРЫ 245,2 251,2 261,5 275,2 290,9 376,0 215,8 243,7 253,9 265,1 272,5 282,4 297,0 313,0 330,8 246,3 278,4 289,0 301,8 310,0 320,8 337,0 – 374,8 229,6 259,5 270,0 282,1 289,6 300,0 315,0 332,3 350,1 – 261,0 338,7 Таблица 8 Температура самовоспламенения предельных углеводородов в зависимости от средней длины углеводородной цепи ср 1 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Тсв, К 2 743 738 733 728 723 717 712 ср 1 6,0 6,1 6,2 6,3 6,4 6,5 6,6 Тсв, К 2 507 505 504 503 502 501 500 ср 1 9,0 9,1 9,2 9,3 9,4 9,5 9.6 Тсв, К 2 482 481 481 481 480 480 480 ср 1 12,0 12,1 12,2 12,3 12,4 12,5 12,6 Тсв, К 2 477 477 477 477 477 477 477 91 Продолжение прил. Окончание табл.8 1 3,7 3,8 3,9 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 4,9 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 5,9 – 2 706 699 693 686 680 673 665 654 643 631 617 601 581 560 547 535 528 522 517 513 511 509 508 – 3 6,7 6,8 6.9 7.0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 78 7,9 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 8,9 – 4 499 498 497 496 495 494 494 493 492 491 490 489 489 488 487 486 486 485 484 484 483 483 482 – 5 9,7 9,8 9,9 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 10,8 10,9 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 11,8 11,9 – 6 480 479 479 479 479 479 479 478 478 478 478 478 478 478 478 478 478 478 478 477 477 477 477 – 7 12,7 12,8 12,9 13,0 13.1 13,2 13,3 13,4 13,5 13,6 13,7 13,8 13,9 14,0 14,1 14,2 14,3 14,4 14,5 14,6 14,7 14,8 14,9 15,0 8 477 477 477 477 477 477 477 477 476 476 476 476 476 476 476 476 476 476 476 476 476 476 476 475 Таблица 9 Температура самовоспламенения некоторых ароматических углеводородов в зависимости от средней длины углеродной цепи ср 1 –2 –1,9 –1,8 –1,7 –1,6 –1,5 –1,4 –1,3 –1,2 –1,1 –1 –0,9 –0,8 Тс, К 2 843 842 841 840 840 839 838 837 837 836 835 835 834 ср 3 – 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1,1 1,2 Тс, К 4 – 810 794 774 753 733 723 718 715 713 712 711 710 ср 5 – 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 2,9 3 3,1 3,2 Тс, К 6 – 702 701 701 700 700 699 699 698 698 697 697 697 92 Окончание табл.9 1 –0,7 –0,6 –0,5 –0,4 –0,3 –0,2 –0,1 0 2 833 832 831 830 829 827 824 819 3 1,3 1,4 1,5 1,6 1,7 1,8 1,9 2 4 709 708 707 706 705 704 703 703 5 3,3 3.4 3,5 3,6 3,7 3,8 3,9 4 6 697 696 696 696 696 696 696 695 Таблица 10 Температура самовоспламенения некоторых предельных одноатомных спиртов в зависимости от средней длины углеродной цепи ср 1 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 3,9 4,0 4.1 4,2 4,3 Тсв, К 2 737 736 734 732 730 728 725 721 716 711 706 696 693 636 678 669 658 649 642 634 628 623 619 614 ср 3 4,4 4.5 4,6 4,7 4,8 4,9 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 5,9 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Тсв, К 4 610 606 602 599 595 592 588 585 582 579 577 574 572 569 567 564 562 560 557 555 553 551 549 547 ср 5 6,8 6,9 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 7,9 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 8,9 9,0 9,1 Тсв, К 6 545 543 542 540 539 537 536 535 534 533 531 530 529 528 527 526 525 524 523 522 521 520 519 519 ср 7 9,2 9,3 9,4 9,5 9,6 9,7 9,8 9,9 10,0 10,5 11,0 11,5 12,0 12,5 13,0 13,5 14,0 14,5 15,0 15,5 16,0 16,5 17,0 17,5 Тсв, К 8 518 517 516 516 515 514 513 513 512 509 507 506 505 505 504 504 503 503 502 502 501 501 500 500 93 Продолжение прил. Таблица 11 Значение параметров для расчета минимальной флегматизирующей концентрации инертных газов Значение параметров при разбавлении смеси азотом, водяным паром, двуокисью углерода, ×10-5 ×10-5 ×10-5 2 3 4 0,864 0,800 0,735 1,256 0,780 0,579 2,5277 1,651 1,251 0,7592 0,527 0,418 0,197 1,446 0,542 –0,151 –0,147 –0,135 1,500 1,500 1,500 2,800 2,236 2,020 5,946 5,000 4,642 2 3 4 1,486 1,250 1,160 –2,973 –2,500 –2,321 0 0 0 0 0 0 Параметры, моль/Дж 1 h'f h'Ф h'C h'Н h'o h'N h'C=C h''Ф h''C 1 h''H h''O h''C=C h''N Таблица 12 Значения констант уравнения Антуана Вещество 1 n-амилацетат Амилен n-амиловый спирт Аммиак Химическая формула Молекулярная масса 2 C7H14O2 C5H10 C5H12O Константы уравнения Антуана А В С 3 130 70,1 4 7,17 6,79 5 1579,5 1014,3 6 221,4 229,8 7 0,0520 0,0690 8 1,87 1,84 88,2 7,18 1287,6 161,3 0,0661 1,87 – 1457,0 2 1093,6 – 1281,7 902,28 1252,8 NH3 17 – Анилин C6H7N 93,1 6,9 Ацетальдегид Ацетилен Ацетон C2H4O C2H2 C3H6O 44,1 26 58,1 C6H6 78,1 7,19 – 7,25 6,49 6,98 Бензол Коэффи- Показациент тель «n» в диффу- уравнении зии, см2/с (3.4 а) – 0,198 1,88 176,2 0,0622 1,87 233,4 – 237,1 178,1 225,2 0,11 0,18 0,109 1,83 1,79 1,90 0,0775 1,86 94 Продолжение прил. Продолжение табл.12 1 Бутадиен 1,3 n-бутан Бутен-1 транс-Бутен-2 n-бутилацета n-бутиловый спирт Водород Винилхлорид n-гексадекан n-гексан n-гексиловый спирт n-гептан Гидразин Глицерин n-декан Дивиниловый эфир Диметиловый эфир Диметилформамид Диоксан-1,4 Дифтордихлорме тан 1,2-дихлорэтан Диэтиламин Диэтиловый эфир n-додекан Изобутан Изобутилен Изобутиловый спирт Изопентан Изопропилбензол Изопропиловый спирт м-ксилол о-ксилол n-ксилол Метан 2 C6H6 C4H10 C4H8 3 54,1 58,1 56,1 4 – – – 5 – – – 6 – – – 7 0,0806 0,0605 0,0801 8 1,82 1,87 1,83 C4H8 56,1 – – – 0,0801 1,82 C6H12O2 116 7,01 1340,8 199,8 0,06 1,87 C4H10O 74,1 9,6 2664,7 279,7 0,068 1,86 H2 C2H3Cl C16H34 C6H14 2,02 62,5 227 86,2 – – 6,79 6,87 – – 136,87 223,66 0,66 0,104 0,034 0,066 1,70 1,82 1,86 1,55 C6H14O 102 7,28 165,47 0,059 1,87 C7H16 N2H4 C3H8O3 C10H22 100 32,1 92,1 142 6,95 8,87 9,05 7,39 – – 1656,4 1166,3 1420,2 7 1295,4 2266,5 3074,2 1809,9 219,82 266,32 214,71 227,7 0,061 0,17 0,08 0,05 1,54 1,86 1,9 1,45 C4H6O 70,1 6,98 1055,3 228,6 0,077 1,84 C4H6O 46,1 – – – 0,108 1,85 C3H7NO 73,1 7,03 1482,9 204,34 0,089 1,87 C4H8O2 88,1 7,52 1632,4 250,73 0,076 1,85 CF2Cl2 121 – – – 0,081 1,81 C2H4Cl2 C4H11N C4H10O C12H26 C4H10 C4H8 98,9 73,1 74,1 170 58,1 56,1 7,66 7,22 6,99 8,17 – – 1640,2 1267,6 1098,9 2463,7 – – 259,72 236,33 232,37 253,88 – – 0,08 0,076 0,077 0,04 0,082 0,08 1,86 1,85 2,14 1,88 1,87 1,82 C4H10O 74,1 8,71 2058,4 245,64 0,08 1,87 C5H12 C9H12 72,2 120 6,79 6,94 1022,6 1460,7 233,49 207,65 0,07 0,06 1,76 1,87 C3H8O 60,1 8,38 1733 232,38 0,083 1,9 C8H10 C8H10 C8H10 CH4 106 106 106 16 7,01 6,99 6,99 – 1461,9 1474,7 1454,3 – 215,07 213,69 215,41 – 0,067 0,07 0,07 0,196 1,87 1,88 1,87 1,76 95 Продолжение прил. Продолжение табл.12 1 Метиловый спирт Метилпропилкетон Метилэтилкетон 2 3 4 5 CH4O 32 8,23 1660,5 C5H10O 86,1 7,86 1870,4 C4H8O 72,1 1292,8 Нафталин C10H8 128 3123,3 2206,7 n-нонан Окись углерода Окись этилена C9H20 CO C2H40 128 28 44,1 n-октан C8H18 114 n-гептадекан C15H32 212 n-Пентан *Пиколин *Пиридин Пропан Пропилен n-пропиловый спирт Сероводород Сероуглерод Стирол Тетрагидрофуран n-тетрадекан Толуол n-тридекан 2,2,4триметилпентан Уксусная кислота Идеальный газ Уксусная кислота n-ундекан Формальдегид Фталевый ангидрид Фтортрихлорметан Хлорбензол Хлолрэтан Циклогексан C5H12 C6H7N C6H5N C3H8 C3H6 72,2 93,1 79,1 44,1 42,1 7,02 10,5 6 7,68 7,05 – – 1379 ,6 1739 ,1 6,85 7,3 6,79 – – C3H8O 60,1 C2S CS2 C8H8 C4H8O H30 C7H8 C13H28 34,1 76,1 104 72 198 92,1 184 C8H18 6 7 8 0,129 1,08 273,2 0,07 1,86 232,34 0,0760 1,86 243,57 245,13 0,0622 1,89 1510,7 – – 211,5 – – 0,05 0,15 0,11 1,57 1,72 1,83 1379,6 211,89 0,05 1,77 1739,1 157,55 0,04 1,90 1062,6 1632,3 1217,7 – – 231,81 224,79 196,34 – – 0,07 0,08 0,08 0,09 0,09 1,83 1,88 1,87 1,80 1,82 8,31 1751,9 225,13 0,08 1,88 – 7 7,94 5,99 7,27 6,95 7,96 – 1202,5 2113,1 753,81 1950,5 1345,1 2468,9 – 245,62 272,99 175,79 190,51 219,52 250,31 0,14 0,09 0,07 0,06 0,04 0,08 0,04 1,82 1,69 1,88 1,84 1,89 1,65 1,89 114 6,81 1259,2 221,09 0,04 1,86 C2H4O2 60,1 – – – – 2 C3,7H7,4О3,7 С11H24 CH2O 111 153 30 7,79 7,68 6,28 1789,8 2102,9 607,4 245,91 242,57 197,63 0,11 0,04 0,15 1,90 1,88 1,81 C8H4O3 148 7,99 2879,1 277,5 0,06 1,9 CCL3F 137 – – – 0,06 1,83 C6H5CL C2H5CL C6H12 113 64,5 84,2 7,26 6,82 6,65 1607,3 954,12 1095,5 235,35 229,55 210,06 0,06 0,09 0,06 2,09 1,82 1,89 245,82 96 Продолжение приложения. Продолжение табл.12 1 2 Этан C2H6 Этилацетат C4H8O2 Этилбензол C8H10 Этилен C2H4 Этиленгликоль C2H5O2 Этиловый спирт C2H6O Этилцеллозоль C4H10O2 Бензин А-72 (зимний) ГОСТ C6,991H13,108 2084-67 Бензин АИ-93 (летний) ГОСТ С7,024H13,706 2084-67 Бензин АИ-93 (зимний) ГОСТ С6,911H12,168 2084-67 Бензин авиационный БС7,267Н14,796 70 ГОСТ 1012-72 Дизельное топливо «З» С12,343Н23,88 ГОСТ 305-73 Дизельное топливо «Л» С14,511Н29,12 ГОСТ 305-73 Керосин осветительный С13,595Н26,86 КО-20 ГОСТ 4753-68 Керосин осветительный С10,914Н21,832 КО-22 ГОСТ 4753-68 Керосин осветительный С11,054Н21,752 КО-25 ГОСТ 4753-68 Ксилол (смесь изомеров) С7,99Н9,98 ГОСТ-9410-71 Уайт-спирит С10,5Н21,0 ГОСТ 3134-52 3 30,1 88,1 106 28,1 62,1 46,1 90,1 4 – 6,99 6,96 – 9,01 8,68 8,74 5 – 1200,1 1425,5 – 2753,2 1918,5 2392,6 6 – 214,26 213,35 – 252,01 252,13 273,15 7 0,12 0,07 0,07 0,11 0,09 0,11 0,07 8 1,78 1,89 1,87 1,80 1,87 1,51 1,86 97,2 5,07 682,88 222,07 –60-85 2 98,2 4,99 664,98 221,7 –60-95 2 95,3 5,14 695,02 223,22 –60-90 2 102 8,42 2629,7 384,2 –40-110 2 172 5,95 1255,7 199,52 40-210 2 204 5,88 1314,04 192,47 60-240 2 192 5,69 1211,7 194,68 40-240 2 153 6,47 1394,7 204,26 40-190 2 155 6 1223,9 203,34 40-190 2 106 7,05 1478,2 220,54 0-50 2 147 8,01 2218,3 273,15 20-80 2 97 Окончание прил. Окончание табл.12 1 2 Масло АМТ-300 ТУ 38-1Г-1-68 Масло АМТ-300Т ТУ 38 10142-72 Растворитель М (n-бутилацетат30; этилацетат-5; этиловый спирт60; изобутиловый спирт-5) Растворитель РМЛ ТУКУ 46756 (толуол-10; этиловый спирт64;n-бутиловый спирт-10; этилцеллозольв-16) Растворитель РМЛ-218 МРТУ610-729-68 (nбутилацетат-9; этилацетат-16; ксилол -21,5; толуол-21,5; этиловый спирт16; n-бутиловый спирт-3; этилцеллозольв-13) Растворитель РМЛ-215 ТУ6-10-1013-70 (n-бутилацетат18; ксилол -25; толуол-25;n бутиловый спирт15; этилцеллозольв-17) Растворитель Р-4 (n-бутилацетат12; толуол-62; ацетон-26) Растворитель Р-4 (ксилол -15; толуол-70; ацетон-15) С21,74Н42,28 S0,04 С19,04Н24,58 S0,196N0,07 3 4 5 6 7 8 313 6,99 2240 167,85 170-376 2 260 6,49 2023,8 164,09 171-396 2 59,4 8,93 2083,6 267,74 0-50 2 C2,645Н5,910 О1,038 55,2 9,57 2487,7 290,92 0-50 2 C4,791Н8,318 О0,971 81,5 8,08 1761 251,55 0-50 2 C5,962Н9,779 О0,845 95,0 7,71 1699,7 241 0-50 2 C5,452Н7,606 О0,535 81,7 7,17 1373,7 242,83 –15-100 2 C6,231Н7,798 О0,223 86,3 7,15 1415,2 244,75 –15-100 2 C2,761Н7,147 О1,187 98 Библиографический список 1. Лопанов, А.Н. Физико-химические основы теории горения и взрыва: учебное пособие / А.Н. Лопанов. – Белгород: Изд-во БГТУ, 2012. – 149 с. 2. Кумагаи С. Горение. Перевод с японского С.К. Орджоникидзе, Б.С. Ермолаева. – 1979. – 256 с. 3. Льюис, Г. Эльбе. Горение, пламя и взрывы в газах. М.: Мир. – Изд. 2. – 1968. – С. 263–267. 4. Зельдович Я.Б., Баренблатт Г.И., Либрович В.Б., Махвиладзе Г.М. Математическая теория горения и взрыва. М.: Наука.–1980.-478 с. 5. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. Изд 2. М.: Высш. Школа. – 1969. – 432 с. 6. Андросов А.С., Салеев В.П. Примеры и задачи по курсу «Теория горения и взрыва»: Учеб. Пособие. – М.: Академия ГПС МЧС России, 2008. – 80 с. 7. Абдурагимов И.М., Андросов А.С., Исаева Л.К., Крылов Е.В. Процессы горения. – М.: ВИПТШ, 1984. – 268 с. 8. Демидов П.Г., Шандыба В.А., Щеглов П.П. Горение и свойства горючих веществ. – М.: Химия, 1973. – 272 с. 9. Карапетьянц М.Х. Химическая термодинамика. М.: Химия. – 1975. – 584 с. 10. . Лопанов, А. Н. Взрывы и взрывчатые вещества: монография / А. Н. Лопанов; БГТУ им. В. Г. Шухова. – Белгород: Изд-во БГТУ им. В. Г. Шухова, 2008. – 516 с. 11. Марков В. Ф., Маскаева Л. И., Миронов М. П., Пазникова С. Н. Физико-химические основы развития и тушения пожаров. Учебное пособие для курсантов, студентов и слушателей образовательных учреждений МЧС России /под Ред. В.Ф. Маркова. Екатеринбург: УрО РАН. – 2009. – 274 с. 12. Портола В.А. Расчет процессов горения и взрыва: учебное пособие / В.А. Портола, Н.Ю. Луговцова, Е.С. Торосян; Юргинский технологический институт.- Томск: Изд-во Томского политехнического университета, 2012.-108 с. 99 Учебное издание ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания к проведению практических занятий для студентов направления бакалавриата 280700 – Техносферная безопасность Составители: Лопанов Александр Николаевич Фанина Евгения Александровна Прушковский Игорь Валентинович Подписано в печать 28.10.13. Формат 60х84/16. Усл. печ. л. 5,6. Уч.-изд. л. 6,1. Тираж 130 экз. Заказ Цена Отпечатано в Белгородском государственном технологическом университете им. В.Г. Шухова 308012, г. Белгород, ул. Костюкова, 46 100