2.2.2. Проточная цитометрия. Для выявления
реклама

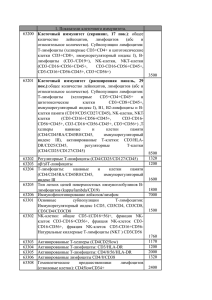
2.2.2. Проточная цитометрия. Для выявления поверхностных и внутриклеточных антигенов был использован метод специфические прямой иммунофлюоресценции, моноклональные определенными антитела при котором конъюгированы флюорохромами: флюоресцеинизотиоцианат с (FITC), фикоэритрин (PE), перидинин-хлорофилл протеин (PerCP). Выявление флюоресценции каждого из этих флюорохромов и усиление светового сигнала на фотоумножителях проточного цитометра позволяло одновременно получать информацию о физических параметрах клетки (размер и гранулярность) и о наличии/отсутствии нескольких антигенов. Для лизирования эритроцитов был использован лизирующий раствор (FACS Lysing solution (BD)), разведенный 1:10 (объем/объем) дистиллированной водой, длительность инкубации с которым в темноте при комнатной температуре не превышала 10-12 минут. При необходимости разведения суспензий клеток был использован буфер (50 mM Tris-HCl, 150 mM NaCl) для проточных цитометров FacsFlow (BD). Для фиксации был использован фиксирующий раствор (CellFIX (BD)), разведенный 1:10 (объем/объем) дистиллированной водой. Для получения возможности выявлять внутриклеточные антигены был использован пермеабилизирующий раствор (Permeab (BD)), разведенный 1/10 (объем/объем) дистиллированной водой, длительность инкубации с которым в темноте при комнатной температуре не превышала 30 минут. Нарушение целостности мембраны мертвых клеток было определено по позитивности окрашивания с 7-AAD (рис. 3). 7-AAD (PharMingen, BD) был внесен из расчета 20 мкл на 1х106 клеток/мл, время инкубации составило 30 минут. Учет результатов был осуществлен по третьему каналу флюоресценции (FL3); положительные события отражали относительное содержание нежизнеспособных клеток в анализируемом образце. SSC 7-AAD CD45 7-AAD FSC Рис. 3. Выявление нежизнеспособных клеток по позитивности окрашивания с 7AAD. В данном случае мертвые 7AAD-позитивные клетки (стрелка) составили менее 1% (0,64) от всех анализируемых событий. Клоны-производители антител были тщательно отобраны по их реактивности и отсутствию фонового (неспецифического) окрашивания. Для анализа субпопуляций лимфоцитов были использованы коммерческие наборы моноклональных антител: • SimultestPlus (BD), включающий положительный контроль CD45(D1)/CD14(MфP9), специфические МАТ CD3(SK7)/CD19(4G7), CD4(SK3)/8(SK1), CD3(SK3)/CD16(B73.1)+CD56(MY31), CD3(SK7)/HLADR(L243) и соответствующие изотипические контроли; • CD3(UCHT1)/CD19(HD37)/CD45(T29-33), CD8(DK25)/CD4(MT310)/CD3(UCHT1), CD3(UCHT1)/CD16(DJ130c)/CD45(T29-33) и соответствующие изотипические контроли (DAKO). Для анализа моноклональные лейкозных мышиные бластов античеловеческие, были использованы конъюгированные с различными флюорохромами антитела следующих специфичностей: CD2, CD3, CD4, CD5, CD7, CD8, CD10, CD13, CD14, CD15, CD16, CD19, CD20, CD22, CD23, CD25, CD33, CD34, CD38, CD45, CD56, CD61, CD64, CD117, HLA-DR, гликофорин А, миелопероксидаза, каппа-цепь, ламбдацепь, µ-цепь, Tdt (табл. 22). Таблица 22 Специфичность антител для выявления клеток методом проточной цитометрии Выявляемый антиген Используемый клон1 Производитель 1 2 3 CD2 MT910 DAKO, BD CD3 SK7 BD CD4 MT310 DAKO CD5 L17F12, DK23 DAKO, BD CD7 M-T701 BD CD8 DK25 BD CD10 W8E7 BD CD13 TUK1 BD, Caltag CD14 TUK4 CD15 BD CD19 Leu-12, SJ25-C1 BD, Immunotech CD20 L27 BD CD22 S-HCL-1 BD CD23 BD CD25 BD CD33 WM54 DAKO CD34 HPCA-2 BD CD38 BD CD45 2D1 BD CD56 Leu-19 BD CD61 RUUPL7F12 BD CD65 VIM2 An Der Grub CD117 95C3 BD, Immunotech 2 3 JC159 DAKO G20-127 BD 1 GPhA IgM Kappa BD HLADR L243 BD Lambda F0435 BD Tdt HT-6 DAKO 1 Если клон не указан, то использованы аффинно очищенные антитела. В каждом случае были использованы также отрицательные изотипические контроли, соответствующие применяемым специфическим (целевым) антителам.