Типы заданий
реклама

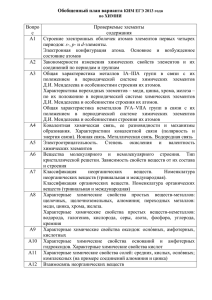
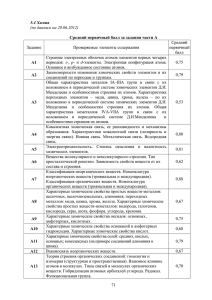
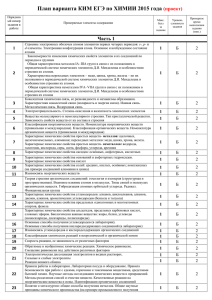
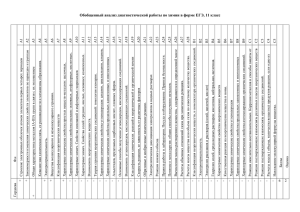
А1 А2 А3 А4 А5 А6 А7 А8 А9 А10 А11 А12 А13 А14 А15 А16 А17 А18 А19 А20 А21 А22 А23 А24 А25 А26 А27 А28 А29 А30 Современные представления о строении атомов. Изотопы. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов Периодический закон и периодическая система химических элементов Д.И. Менделеева. Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи Электроотрицательность. Степень окисления и валентность химических элементов Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки Классификация неорганических веществ. Классификация и номенклатура органических соединений Общая характеристика металлов главных подгрупп I—III групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов Общая характеристика неметаллов главных подгрупп IV-VII групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов – меди, цинка, хрома, железа. Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния Характерные химические свойства оксидов: основных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка). Взаимосвязь неорганических веществ Теория строения органических соединений. Изомерия – структурная и пространственная. Гомология Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов. Характерные химические свойства ароматических углеводородов: бензола и толуола Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки Взаимосвязь органических веществ Классификация химических реакций в неорганической и органической химии Скорость реакции, ее зависимость от различных факторов Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов Диссоциация электролитов в водных растворах. Слабые и сильные электролиты Реакции ионного обмена Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная Реакции, характеризующие основные свойства и способы получения углеводородов Реакции, характеризующие основные свойства и способы получения кислородсодержащих соединений Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Методы исследования объектов, изучаемых в химии. Определение характера среды водных растворов веществ. Индикаторы. Качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений Общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной и азотной кислот, чугуна и стали, метанола). Промышленное получение веществ и охрана окружающей среды. Природные источники углеводородов, их переработка. Основные методы синтеза высокомолекулярных соединений (пластмасс, синтетических каучуков, волокон) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции Часть B В1 B2 B3 B4 B5 Классификация неорганических веществ. Классификация и номенклатура органических соединений Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительновосстановительные Электролиз расплавов и растворов (солей, щелочей, кислот) Гидролиз солей Характерные химические свойства неорганических веществ B6 Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов. Механизмы реакций замещения и присоединения в органической химии. Правило В.В. Марковникова B7 Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола; альдегидов, предельных карбоновых кислот, сложных эфиров B8 Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки B9 Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей B10 Расчеты: массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ Образцы заданий части С С1 Используя метод электронного баланса, составьте уравнение реакции: KNO2 + … + H2SO4 → I2 + NO + … + … . Определите окислитель и восстановитель. С2 Даны четыре вещества: оксид серы (VI), вода, концентрированная серная кислота и иодид калия. Напишите четыре уравнения реакций между этими веществами. С3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: С4 Смешали 100 мл 30%-ного раствора хлорной кислоты (плотность1,11 г/мл) и 300 мл 20%-ного раствора гидроксида натрия (плотность 1,10 г/мл). Какой объем воды следует добавить к полученной смеси, чтобы массовая доля перхлората натрия в ней составила бы 8%? С5 Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.