8 класс Вопросы к зачетам № п/п Тема
реклама
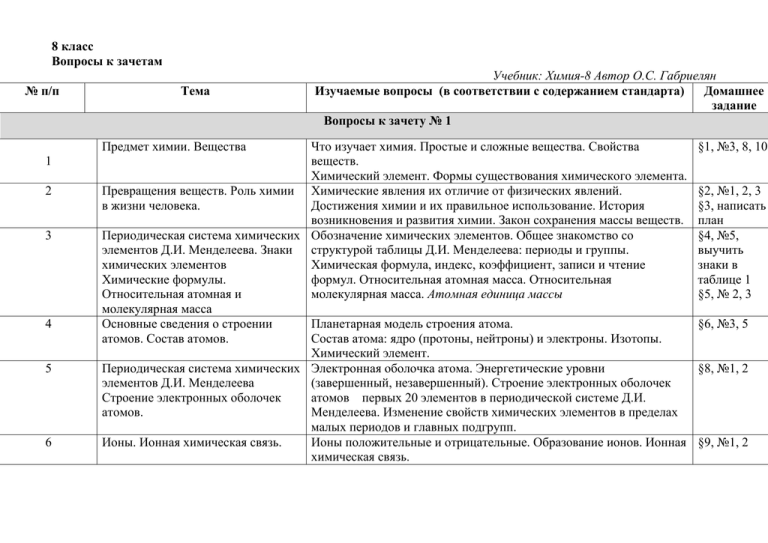
8 класс Вопросы к зачетам № п/п Тема Предмет химии. Вещества 1 2 3 4 5 6 Учебник: Химия-8 Автор О.С. Габриелян Изучаемые вопросы (в соответствии с содержанием стандарта) Домашнее задание Вопросы к зачету № 1 Что изучает химия. Простые и сложные вещества. Свойства веществ. Химический элемент. Формы существования химического элемента. Превращения веществ. Роль химии Химические явления их отличие от физических явлений. в жизни человека. Достижения химии и их правильное использование. История возникновения и развития химии. Закон сохранения массы веществ. Периодическая система химических Обозначение химических элементов. Общее знакомство со элементов Д.И. Менделеева. Знаки структурой таблицы Д.И. Менделеева: периоды и группы. химических элементов Химическая формула, индекс, коэффициент, записи и чтение Химические формулы. формул. Относительная атомная масса. Относительная Относительная атомная и молекулярная масса. Атомная единица массы молекулярная масса Основные сведения о строении Планетарная модель строения атома. атомов. Состав атомов. Состав атома: ядро (протоны, нейтроны) и электроны. Изотопы. Химический элемент. Периодическая система химических Электронная оболочка атома. Энергетические уровни элементов Д.И. Менделеева (завершенный, незавершенный). Строение электронных оболочек Строение электронных оболочек атомов первых 20 элементов в периодической системе Д.И. атомов. Менделеева. Изменение свойств химических элементов в пределах малых периодов и главных подгрупп. Ионы. Ионная химическая связь. Ионы положительные и отрицательные. Образование ионов. Ионная химическая связь. §1, №3, 8, 10 §2, №1, 2, 3 §3, написать план §4, №5, выучить знаки в таблице 1 §5, № 2, 3 §6, №3, 5 §8, №1, 2 §9, №1, 2 7 Ковалентная связь. 8 МЕТАЛЛИЧЕСКАЯ СВЯЗЬ 8 класс Взаимодействие атомов элементов – неметаллов между собой. Ковалентная неполярная и ковалентная полярная связь. Электроотрицательность. 8 §10, № 2, 5 11, §11, №2 § 11 Обобщение и систематизация знаний, умений и навыков по теме «Атомы химических элементов» Теоретические вопросы 1. Состав атома. Основные характеристики элементарных частиц атома. Определение числа протонов, нейтронов и электронов в атоме. 2. Определение изотопа. Докажите, что изотопы - это атомы одного и того же химического элемента. 3. Изотопы водорода. Отличие изотопов водорода от изотопов других химических элементов. 4. Строение электронной оболочки атома. s- и р-орбитали и их форма. Энергетические уровни: завершенные и незавершенные. Электронная формула атома. 5. Что такое периодичность? Почему свойства химических элементов в Периодической системе Д.И. Менделеева повторяются периодически? 6. Физический смысл порядкового номера химического элемента, номера периода и номера группы в Периодической системе Д.И. Менделеева. 7. Опишите пути завершения внешнего энергетического уровня: а) для атомов химических элементов - металлов; б) для атомов химических элементов - неметаллов. 8. Как и почему изменяются свойства химических элементов в пределах одного периода; в пределах главной подгруппы? 9. Что такое ионы? Как образуются положительно и отрицательно заряженные ионы? Чем отличается процесс образования иона от процесса образования изотопа? 10. Определение ионной связи. Механизм образования ионной связи. 11. Электроотрицательность (ЭО) атомов химических элементов. Как изменяется ЭО у химических элементов в пределах одного периода; в пределах главной подгруппы? 12. Определение ковалентной связи. Виды ковалентной связи. Механизм образования ковалентной полярной и ковалентной неполярной связи. 13. Металлическая связь. Сходства и различия между металлической и ионной связью; между ковалентной связью. 14. Кристаллические решетки: ионные, атомные, молекулярные, металлические. Примеры веществ, свойства, характерные для веществ с разным типом кристаллич решеток. Практические вопросы Тест. Атомы химических элементов А1. Электронная формула 1s22s22p2 соответствует атому химического элемента, расположенного: 1) во 2-м периоде 2) во 2-м периоде, 11 группе, главной подгруппе 3) во 2-м периоде, IY группе, побочной подгруппе 4) во 2-м периоде, IY группе, главной подгруппе А2. Расположите в порядке уменьшения неметаллических свойств химические элементы: 1 - сурьма; 2 - фосфор; 3 - хлор; 4 - сера; 5 - мышьяк: 1) 3, 4, 2, 5, 1 3) 3, 4, 5, 1, 2 2) 5, 1, 2, 4, 3 4) 3, 4, 2, 1, 5 А3. В ядре атома какого химического элемента 7 протонов и 8 нейтронов? 1) фтора 3) фосфора 2) азота 4) кислорода А4. На что указывает номер группы химического элемента (для главной подгруппы)? 1) на число электронов на внешнем энергетическом уровне 2) на число энергетических уровней 3) на заряд ядра атома 4) на количество нейтронов в ядре атома Вl. Установите соответствие. Номер периода или группы Общие признаки строения атомов данного периода или группы главной подгруппы А). IV группа, главная подгруппа 1) На внешнем энергетическом уровне расположены три электрона 2) Электроны в атоме распределены по трем энергетическим уровням Б). 3-й период 3) Электроны в атоме распределены по четырем энергетическим уровням В). III группа, главная подгруппа 4) На внешнем энергетическом уровне расположены четыре электрона Г). 2-й период 5) Электроны в атоме распределены по двум энергетическим уровням В2. Установите соответствие. Обозначение частицы (атом, ион) Электронная формула частицы (атом, ион) А) 1s Б) 1s22s22p3 В) 1s22s22p6 Г) 1s22s2 2 1) N0 2) Na+ 3) Li+ 4) Na0 5) ВеО 6) Са2+ С1. Дополните электронную формулу атома ... 2s22p1, определите химический элемент и опишите его положение в Периодической системе химических элементо Менделеева. Напишите символы и назовите химические элементы, сходные с ним по строению внешнего энергетического уровня и свойствам. С2. Даны вещества: натрий, хлор и водород. Напишите возможные формулы соединений с ионной и ковалентной неполярной связью, которые могут образовать эт веще 8 класс «Строение атома. Виды химической связи» 1) Для элемента с порядковым номером №___ (вторая колонка) составьте схему строения атома, электронную формулу. 2) Для приведенных веществ (3-6 колонка) определите тип химической связи, составьте схемы образования связей. Вариант Номер ХЭ Формулы веществ 0 №7 H2 LiCl OF2 Ca 1 №4 Zn Cl2 CaCl2 SCl2 2 №5 O2 Na Na2O Br2O 3 №6 CaBr2 H2 O Mg N2 4 №8 Al Br2 CaO CH4 5 №9 AlF3 K S2 NH3 6 №12 Li N2 K2O CCl4 7 №13 I2 Be BeF2 PCl3 8 №14 Li3N Cl2 Mg SiF4 9 №15 Na AlF3 O2 Cl2O 10 №16 Br2 K MgF2 SF2 11 №17 CaO S2 Ba NF3 12 №19 Al MgO I2 CF4 13* №33 H2O2 K2SiO3 CS2 HOCl 14* №52 N2H4 Na2O2 CO2 HOF 15* №34 H2S2 K2CO3 SiS2 HOBr Контрольная работа по химии в 8 классе по теме: «Строение атома. Химическая связь» 1 вариант 1. Расположите элементы в порядке возрастания а) неметаллических свойств: О ; Р ; N б) металлических свойств: Na ; К ; Мg 2. Определите чему равны а) относительные атомные массы химических элементов: Mg; К; Р б) относительные молекулярные массы веществ: Na2O; NH3; H3PO4 3. Дайте характеристику химическому элементу О (кислороду) по плану: а) положение в периодической системе химических элементов; б) строение атома; в) электронная схема, электронная формула, электронно-графическая формула 4. а) Определите виды химических связей в веществах: MgO ; О2 ; NH3 ; Mg б) Запишите схемы образования химических связей Вопросы к зачету № 2 1 Простые вещества -металлы. Положение элементов металлов в П.С.Х.Э. Д.И. Менделеева Строение атомов металлов. Общие физические свойства металлов. §13, №5 2 Простые вещества -неметаллы. Положение элементов неметаллов в периодической системе. Строение атомов неметаллов Ковалентная неполярная связь. Физические свойства неметаллов. Аллотропия. §14, №3, таблица 3 3 Количество вещества Количество вещества и единицы его измерения: моль, ммоль, кмоль. Постоянная Авогадро. Молярная масса. §15, №1, 2, 3 4 Степень окисления §17, №1, 2 5 6 Важнейшие классы бинарных соединений. Основания. Бинарные соединения. Понятие о степени окисления. Определение степени окисления в бинарных соединениях. Составление формулы бинарных соединений по степени окисления., общий способ их названия. Оксиды и летучие водородные соединения: Составление химических формул, их название. Расчеты по формулам оксидов. Состав и название оснований. Их классификация. Индикаторы. 7 Кислоты. Состав и название кислот. Их классификация. Индикаторы. §20, №1, 3 8 Соли. Состав и номенклатура солей. Составление формул солей. 9 Аморфные и кристаллические вещества. Кристаллические решетки. Чистые вещества и смеси. Вещества молекулярного строения. Закон постоянства веществ. Молекулярные, ионные ,атомные и металлические кристаллические решетки. Зависимость свойств веществ от типа кристаллической решетки. §21, № 1, 2, 3 §22 10 11 12 Массовая доля компонентов смеси. Явления физические и химические. Химические реакции. Понятие о чистом веществе и смеси, их отличие. Примеры смесей. Способы разделения смесей. Очистка веществ. Понятие о доле компонента в смеси. Вычисление массовой доли компонента в смеси. Физические явления. Понятие о химических явлениях и их отличие от физических явлений. Химическая реакция. Признаки и условия протекания химических реакций. Экзотермические и эндотермические реакции. §18, № 1, 2 §9, № 2, 3, 4 §23, № 4 §24, № 2 - 7 §25, № 3, 4 §26, № 3, 5 13 Химические уравнения. Закон сохранения массы веществ. Понятие о химическом уравнении. Значение индексов и коэффициентов. Составление уравнений химических реакций. §27, № 2, 3 14 Расчеты по химическим уравнениям. Типы химических реакций. Решение расчетных задач. §28, №1, 2 Сущность реакций разложения, соединения, замещение и обмена. Понятие о скорости химических реакций. Катализаторы. Составление уравнений реакций указанных типов. §29, № 1 §30, № 2 §31, № 2 §32, № 4 §33, №1, 2, 3 15 Типы химических реакций на примере свойств воды. Растворение как физико – химический процесс. Типы растворов. Химические свойства воды. Типы химических реакций. Растворы. Гидраты. Кристаллогидраты. Тепловые явления при растворении. Насыщенные, ненасыщенные и перенасыщенные растворы. Значение растворов. §34, №2, 3 18 Электролитическая диссоциация 19 Ионные уравнения реакций §35 §36, № 1, 4, 5 §37, № 1, 2, 3 20 Кислоты, их классификация и свойства. Основания, их классификация и свойства. Электролиты и неэлектролиты. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Диссоциация кислот, оснований и солей. Сущность реакций ионного обмена и условия их протекания. Составление полных и сокращенных ионных уравнений реакций. Таблица растворимости кислот, оснований и солей в воде. Определение кислот как электролитов. Классификация кислот по различным признакам. Типичные свойства кислот: взаимодействие их с металлами, основными оксидами, основаниями и солями. Ряд напряжения металлов. Определение оснований как электролитов. Классификация оснований. Типичные свойства оснований; взаимодействие с кислотами (реакция нейтрализации), взаимодействие щелочей с растворами солей и оксидами неметаллов. 16 17 21 §38, №1 - 4 §39, № 3 Разложение нерастворимых оснований. 22 23 25 26 Оксиды, их Состав оксидов, их классификация несолеобразующие и солеобразующие классификация и свойства (кислотные и основные). Свойства кислотных и основных оксидов. Соли, их свойства. Определение солей как электролитов. Химические свойства солей, особенности взаимодействия с металлами. Взаимодействие с кислотами, щелочами и солями (работа с таблицей растворимости) Генетическая связь между Понятие о генетической связи и генетических рядах металлов и неметаллов. классами неорганических соединений ОкислительноПонятие окисление и восстановление, окислители и восстановители, определение восстановительные степени окисления элементов. реакции. Тест. Валентность. Степень окисления. 1. Степень окисления- это 1)число химических связей, образуемых атомом химического элемента 2)условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу 3)число, равное количеству электронов в атоме 4)число, равное количеству электронов внешнего уровня атома 2.Максимальная валентность атома фосфора: 1)+5 2)V 3)+4 4)IV 3.Минимальная валентность атома хлора: 1)VI 2) -6 3) I 4)-1 4.Максимальная степень окисления хлора: 1) VII 2)-2 3)II 4)-1 §40, №1, 3 §41, № 1, 2 §42, №2 §43, №1, 3 5. Минимальная степень окисления атома углерода6 1)V 2)-4 3)II 4)+2 6.Отрицательное значение степени окисления не может иметь атом химического элемента: 1) Br 2)N 3)Mg 4)P 7.Максимальное значение степени окисления +2 может иметь атом химического элемента: 1)Al 2)S 3)Si 4)O 8.Степень окисления -3 азот имеет в веществе: 1)NH3 2)N2O3 3)N2 4)NF3 9.Вещество, в котором степень окисления хрома равна +6: 1)Cr2O3 2)CrO 3)CrO3 4)Cr 10.В соединении SCl6 степени окисления серы и хлора соответственно равны: 1)+6 и -1 2)-6 и +1 3)+3 и -2 4)+12 и -2 Проверочная работа по темам "Оксиды. Основания. Кислоты". 2 вариант 1.(1 балл) Что такое основания? 2.(2 балла) Запишите формулы веществ: оксид калия, оксид азота (V), гидрид натрия. 3. (2 балла) Назовите вещества и укажите заряды ионов, формулы которых: Ca(OH)2, HNO3, H3PO4. К каким классам относятся эти вещества? 4. (2 балла) Дан ряд химических формул веществ, из которых выпишите отдельно: а) оксиды металлов; б) оксиды неметаллов; в) основания; г) кислоты. N2O5, CaO, H2SO3, NaOH, Li2S, Al(OH)3, HBr, Fe2O3, H2SiO3. 5. (1 балл) Определите степени окисления всех элементов -H2SO4. 6.(1 балл) Какой оксид соответствует H2CO3? 7. (2 балла) Запишите химические формулы кислот: сернистая, бромоводородная, азотистая, хлороводородная, кремниевая, фтороводородная. 8. (2 балла) Рассчитайте количество вещества, которое соответствует 130 г гидроксида калия. 9. (2 балла) Для вещества выпишите соответствующие характеристики - Fe(OH)2 (ответ цифры). 1) Основание. 2) Кислота. 3) Бескислородная кислота. 4) Кислородсодержащая кислота. 5) Двухосновная кислота. 6) Одноосновная кислота. 7) Растворимое вещество в воде. 8) Нерастворимое вещество в воде. 9) Стабильная кислота. 10) Нестабильная кислота. 11) Cоответствует оксид SO2. 12) Cоответствует оксид SO3. 13) Cоответствует оксид Fe2O3. 14) Cоответствует оксид FeO. Проверочный тест Химические реакции 1. Расставьте коэффициенты, определите тип реакции: а) H2 + N2 →NH3 б) CO +O2 → CO2 в) HNO3 → NO2+H2O+O2↑ г ) Ca3N2 + H2O → Ca(OH)2 + NH3↑ д) Ba + H2O → Ba(OH)2 + H2↑ 2. Дописать уравнения реакций, расставить коэффициенты, назвать сложные вещества. а) Реакция соединения: Ag + O2 → б) Реакция соединения: P +Cl2→ в) Реакция замещения: Сr2O3 + C → г) Реакция обмена: Al2 O3 + HCI → 3 . В реакции меди с кислородом (О2) образовалось 800 г оксида меди (II). Рассчитать, какая масса меди вс 4. Какие реакции называются реакциями горения? тупила в реакцию с кислородом? Сu +O2 → CuO Проверочная работа по теме: «Электролитическая диссоциация» Напишите понятие, о котором идёт речь 1 вариант. 1. Процесс распада электролита на ионы – 2. Вещества, растворы которых не проводят электрический ток – 3. Электролиты, которые при диссоциацииобразуют катионы металла и анионы гидроксогрупп – 4. Электролиты, которые при диссоциации образуют катионы металла ( или аммония) и анионы кислотных остатков – 5. Электролиты, которые при растворении в воде практически полностью диссоциируют на ионы – 6. Отрицательно заряжённые ионы – 7. Ионы, имеющие водную оболочку – Самостоятельная работа Ионные уравнения реакций 1. Закончите уравнения возможных реакций. Запишите уравнения в молекулярном и ионном виде: а) FeCl3 + NaNO3 --> б) AgNO3 + BaBr2 --> в) H2S + Pb(NO3)2 --> г) Ca(OH)2 + HCl --> д) ZnSO4 + CuCl2 --> 2. Приведите по два молекулярных уравнения, соответствующих сокращенным ионным уравнениям: а) 2Ag+ + 2OH- = Ag2O + H2O б) ZnCO3 + 2H+ = CO2 + H2O + Zn2 Тестовая работа "Химические свойства оснований" 1. С веществами какой группы будет реагировать раствор NaOH: а) Cu, CO2, Cu(OH)2 б) HCl, SO3, CuSO4 в) Fe2O3, H2SO4, CaCO3 г) S, SO2,Na2S. 2. С какими оксидами не взаимодействует раствор KOH:: а) SО2 б) CO2 в) N2O5 г) MgO. 3. Что образуется при взаимодействии раствора Ca(OH)2 и P2O5: а) соль и вода в) новое основание и новый оксид б) соль и водород г) соль и кислота. 4. Что образуется при взаимодействии раствора Ba(OH)2 и H2SO4: а) BaSO4 и H2 б) BaSO4 и SO2 в) BaSO4 и H2O г) BaSO4 и SO3. 5. В каком случае реакция протекает до конца: а) Na2SO4 + NaOH б) K2CO3 + LiOH в) KNO3 + Ca(OH)2 г) K2SO4 + Ba(OH)2. Задания по теме: «Кислоты. Получение кислот. Свойства». 1. Какими двумя способами можно получить: а) ортофосфорную кислоту; б) сероводородную кислоту. Напишите уравнения соответствующих реакций. 2. Приведите по три уравнения химических реакций, характеризующих химические свойства кислот. Отметьте, к какому типу реакций они относятся. 3. Какие из веществ, формулы которых приведены, реагируют с соляной кислотой: а) CuO; б) Cu; в) Cu(OH)2; г) Ag; д) АI(ОН)3 4. Напишите уравнения реакций, которые осуществимы. 1) Na + HCI → 13) Mg+HCI → 2) AI + HCI → 14) Мg+Н3РО4 → 3) Са+Н3РО4 → 4) AI+H2S04 → 5) Zn+НСI → 6) NaCI+HCI → 7) Fе(ОН)3+НNО3 → 8) CaO+HCI → 9) Fе203+Н2S04 → 10) МgО+Н3РО4 → 11) Cu+HCI → 12) Н3РО4+Н2S04→ 15) Zn+Н2S04 → 16) MgO+H2S04 → 17) Mg+H2S04 → 18) Na2S04+HCI → 19) Zn+НNО3 → 20) Fе203+НСI → 21) Li2О+Н3РО4→ 22) АI2О3+Н2S04 → 23) Au+H2S04 → 24) Nа2СО3+НСI 7. В реакции алюминия с серной кислотой образовалось 3,42 г сульфата алюминия. Определите массу и количество алюминия, вступившего в реакцию. 8. В реакции с азотной кислотой прореагировало 0,1 моль оксида меди (II). Найдите массу и количество нитрата меди (II), получившегося в результате реакции. 9. Напишите уравнения реакций между серной кислотой и следующими веществами: а) цинком; б)оксидом кальция; в) карбонатом магния; г) оксидом железа (III). 10. Рассчитайте массовые доли элементов в следующих кислотах: а) H2S; б) Н2SОз. 11. В некоторой кислоте массовые доли элементов равны: водорода – 1,25%, фосфора – 38,75%, кислорода - 60,0%,. Определите формулу этой кислоты. Итоговое тестирование за курс 8 класса Уровень А А 1.Что такое химические явления: 1)Явления, в результате которых изменяются агрегатное состояние и состав вещества, 2)Явления, в результате которых из одних веществ образуются другие. 3)Явления, в результате которых изменений веществ не наблюдается. А 2.В каком ряду расположены сложные вещества? 1)S, AL, N2 2)CO2, Fe, H2O 3) HNO3, CaO, PH3 4) Si, P4, Fe2O3 А 3.Определите элемент, если в его атоме 40 электронов: 1)Алюминий 2) Цирконий 3) Германий 4) Галлий. А 4.Чему равно число электронов на внешнем энергетическом уровне атома: 1) Порядковому номеру 2) Номеру периода 3) Номеру группы 4) Числу нейтронов в ядре А5 каком ряду расположены формулы оксидов: 1) NH3, CuO, K2O 2) OF2, CO2, Al2O3 3) CaO, N2O5, Cr2O3 4) CS2, P2O5, B2O3 А 6.Что такое кислоты? 1) Сложные вещества 2) Сложные вещества, в состав которых входит водород 3) Сложные вещества, в состав которых входит кислотный остаток 4) Сложные вещества, в состав которых входят атомы водорода и кислотный остаток. 7А.Что относится к химическим явлениям? 1) Испарение воды 2) Горение дров 3) Перегонка нефти 4) Плавление олова А 8. В каком ряду расположены электролиты (вещества проводящие эл.ток)? 1) Эфир, поваренная соль, соляная кислота 2) Глюкоза, спирт, бензин, 3) Азотная кислота. нитрат бария, гидроксид натрия 4) Серная кислота, хлорид серебра, 5) Сульфат калия А 9. В каком ряду последовательно расположены формулы основания, кислоты, основного оксида, кислой соли 1) KOH HCl, CuO, Na(HSO4) 2) Ca(OH)2, SO2, CaO, KHS 3) (CuOH)2CO3, CO2, HNO3, MgO, Ca(HCO3)2 4) NaOH, HCN, BaO, K2S Уровень В 1В. Установите соответствие: Химические явления А. Ржавление железа Б. Скисание молока В. Гниение мяса Г. Горение дров 2В. Установите соответствие Название кислоты А. Серная Б. Кремниевая В.Азотная Г.Соляная 3В. Установите соответствие: Формула соединения Признаки химических явлений 1) Выпадение осадка 2)изменение цвета 3)выделение газа(запаха), изменение цвета 4) Изменение цвета, возможно выделение газа (запаха) Выделение тепла и света Формула кислоты 1)HCl 2)HNO3 3)H2SO4 4)HNO3 5) H2S 6)H2SiO3 Название вещества А. ZnO Б. Ca (NO3)2 В.H2SiO3 Г Mn(OH)2 4В.Установите соответствие: Тип химической реакции А. реакция разложения Б. реакция обмена В.Реакция замещения Г.Реакция соединения 1) Гидроксид магния 2) Оксид цинка 3) Серная кислота 4) Гидроксид марганца 5) Нитрат кальция 6) Кремниевая кислота Схема химической реакции 1. MgCO3 = CO2 + MgO 2. CuO + AL = Cu + AL2O3 3. NO + O2 = NO2 4. BaCL2 +Na2SO4 = BaSO4 + NaCL Уровень С 1С.Предложите способы и методы разделения смеси состоящей из речного песка и поваренной соли. 2С. Химическая связь в молекуле азота N2?Покажите механизм образования связи. 1) ковалентная полярная 2) ковалентная неполярная 3) металлическая 4) ионная 3С.В каком соединении сера проявляет валентность, равную IV? 1) SO2 2) H2S 3) SO3 4) Na2S 4С.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Укажите тип реакции. Расставьте коэффициенты. Fe(OH)2 → FeО → FeSO4 → Fe

