Подготовка к контрольной работе 1. Найдите величину рН, при
реклама

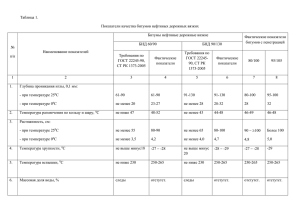
Подготовка к контрольной работе 1. Найдите величину рН, при которой в насыщенном водородом растворе с содержанием ионов соответствующего металла 1 мкМ будут самопроизвольно растворяться Fe, Сu, Pb, Al, Ag, Cr, Co. Предполагайте, что оксидные пленки на поверхности металлов не образуются. 2. Найдите свободную энергию сольватации и энтальпию сольватации отдельных ионов и электролита LiCl при температуре 298 К. Диэлектрическая постоянная воды 78.3. Радиус катиона 0.07 нм. Радиус аниона 0.18 нм. Производная диэлектрической постоянной по температуре при постоянном давлении –0.36 К-1. 3. Найдите эквивалентные электропроводности раствора 0.01 M LiCl в воде и метаноле при температуре 298 К. Диэлектрические постоянные этих растворителей составляют 78.3 и 32.6, вязкости – 0.89 и 0.55 мПа⋅с соответственно. Предельное значение эквивалентной электропроводности в воде 115⋅10-4, в метаноле 91⋅10-4 См⋅м2⋅г-экв-1. 4. Рассчитайте ионный состав 0.01 М раствора L-лизина в воде по данным о его ступенчатых константах диссоциации при температуре 25оС. Ступень т-ра pKа 5. Найдите потенциал внешней плоскости Гельмгольца в растворе 0.01 М NaF при температуре 298 К и удельном заряде поверхности идеально поляризуемого электрода 0.15 Кл/м2. 6. Стандартные потенциалы редокс-систем Cu+/Cu и Cu2+/Cu составляют при температуре 298 К 0.520 и 0.337 В (с.в.э.) cоответственно. Определите стандартный потенциал редокссистемы Cu2+/Cu+. Чему он равен в шкале RHE (обратимого водородного электрода в том же растворе) при рН 1.5? 7. Найдите интервал значений аттракционной постоянной в изотерме Фрумкина, при которых изотерма становится S-образной. Предложите упрощенные соотношения, к которым можно свести изотерму Фрумкина в области низких, высоких и средних заполнений.