Новошинский
реклама
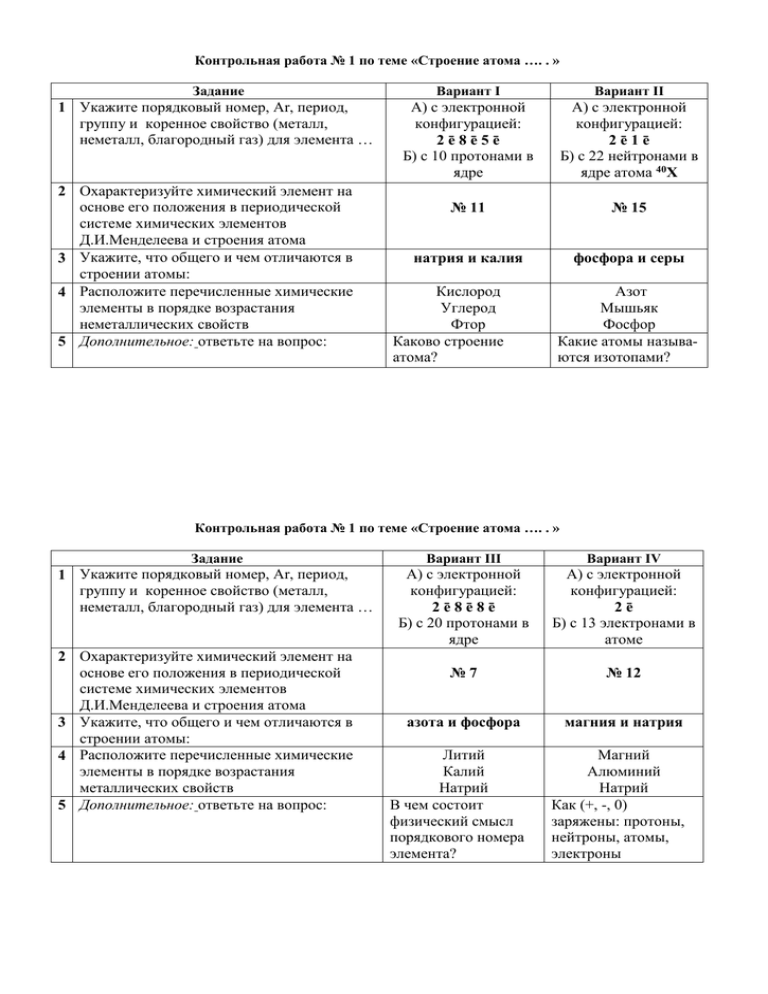
Контрольная работа № 1 по теме «Строение атома …. . » Задание Вариант I Вариант II 1 Укажите порядковый номер, Аr, период, группу и коренное свойство (металл, неметалл, благородный газ) для элемента … А) с электронной конфигурацией: 2ē8ē5ē Б) с 10 протонами в ядре А) с электронной конфигурацией: 2ē1ē Б) с 22 нейтронами в ядре атома 40Х № 11 № 15 натрия и калия фосфора и серы 2 Охарактеризуйте химический элемент на основе его положения в периодической системе химических элементов Д.И.Менделеева и строения атома 3 Укажите, что общего и чем отличаются в строении атомы: 4 Расположите перечисленные химические элементы в порядке возрастания неметаллических свойств 5 Дополнительное: ответьте на вопрос: Кислород Углерод Фтор Каково строение атома? Азот Мышьяк Фосфор Какие атомы называются изотопами? Контрольная работа № 1 по теме «Строение атома …. . » Задание Вариант III Вариант IV 1 Укажите порядковый номер, Аr, период, группу и коренное свойство (металл, неметалл, благородный газ) для элемента … А) с электронной конфигурацией: 2ē8ē8ē Б) с 20 протонами в ядре А) с электронной конфигурацией: 2ē Б) с 13 электронами в атоме №7 № 12 азота и фосфора магния и натрия Литий Калий Натрий В чем состоит физический смысл порядкового номера элемента? Магний Алюминий Натрий Как (+, -, 0) заряжены: протоны, нейтроны, атомы, электроны 2 Охарактеризуйте химический элемент на основе его положения в периодической системе химических элементов Д.И.Менделеева и строения атома 3 Укажите, что общего и чем отличаются в строении атомы: 4 Расположите перечисленные химические элементы в порядке возрастания металлических свойств 5 Дополнительное: ответьте на вопрос: Контрольная работа № 2 по теме «Химическая связь. Строение вещества» № п/п 1 2 3 5* или 6 4 Вариант I Вариант II Для приведенных ниже соединений определите: А) тип химической связи (* ответ поясните), Б) степени окисления атомов элементов. Na2O, S8, Р2O5 Al2S3, NO, N2 А) Составьте схему образования химической связи между атомами в молекуле …, Б) напишите структурную формулу молекулы …, В) укажите валентность и степень окисления атомов каждого элемента. NH3 O2 А) Составьте химические формулы веществ, образованных …; для элементов – неметаллов положительную степень возьмите в ее максимальном значении: фосфором и хлором магнием и азотом Установите простейшую формулу вещества, Установите простейшую формулу вещества, состоящего из атомов серы и кислорода, состоящего из атомов магния и кислорода, ω(O) = 50% ω(Mg) = 60% Определите, какое число частиц (молекул) Определите, сколько весят 48,16х1023 содержат 29,4г H2SO4. молекул водорода Н2. Рассчитайте массу серной кислоты (H2SO4) Рассчитайте число частиц, содержащихся в 8 количеством вещества 0,3 моль. моль водорода Н2. ___________________________________________________________________ Контрольная работа № 2 по теме «Химическая связь. Строение вещества» № п/п 1 2 3 5* или 6 4 Вариант III Вариант IV Для приведенных ниже соединений определите: А) тип химической связи (* ответ поясните), Б) степени окисления атомов элементов. N2O5, MgS, O2 SO3, P4, CaO А) Составьте схему образования химической связи между атомами в молекуле …, Б) напишите структурную формулу молекулы …, В) укажите валентность и степень окисления атомов каждого элемента. F2 CH4 А) Составьте химические формулы веществ, образованных …; для элементов – неметаллов положительную степень возьмите в ее максимальном значении: фосфором и кислородом углеродом и кислородом, Установите простейшую формулу вещества, состоящего из атомов магния и кислорода, ω(О) = 40% Определите, сколько весят 12,04х1023 молекул водорода Н2. Рассчитайте число частиц, содержащихся в 2 моль воды Н2О. Установите простейшую формулу вещества, состоящего из атомов серы и кислорода, ω(S) = 50% Определите, какое число частиц (молекул) содержат 160г SO3. Рассчитайте массу SO3 количеством вещества 1,5 моль. Контрольная работа № 3 по теме «Химические реакции» № п/п Вариант I Вариант II Ответьте на вопрос: 1 2 Что такое физическое явление? Каковы признаки химической реакции? Укажите, к какому явлению (физическому или химическому) относится приведенное описание? Ответ поясните (!!!) А) Вода кипит при t =100 0С, а замерзает при А) Под действием электрического тока вода t =0 0С. разлагается на водород и кислород. Б) Углекислый газ и вода в процессе Б) При нагревании парафин вначале фотосинтеза образуют крахмал. размягчается, а затем плавится. В приведенных схемах расставьте коэффициенты и укажите тип реакции: 3 4 Cu + S = Cu2S Zn(OH)2 = ZnO + H2O MnO2 + Al = Al2O3 + Mn Cu(OH)2 + H2SO4 = CuSO4 + H2O Mg + H2O = MgO + H2 N2 + H2 = NH3 Какую массу хлорида алюминия можно получить при взаимодействии 0,3 моль хлора с алюминием? Реакция протекает по уравнению: 2Al + 3Cl2 = 2Al Cl3. Какую массу оксида фосфора (V) можно получить при взаимодействии 0,4 моль фосфора с кислородом? Реакция протекает по уравнению: 4P + 5O2 = 2P2O5. Контрольная работа № 3 по теме «Химические реакции» № п/п 1 2 Вариант III Вариант IV Ответьте на вопрос: Что такое химическое явление? Что является признаками физического явления? Укажите, к какому явлению (физическому или химическому) относится приведенное описание? Ответ поясните (!!!) А) Сера горит синеватым пламенем. А) Водород плохо растворим в воде. Б) Азот сжижается при очень низкой Б) Расплавленная сера соединяется с температуре. водородом в ядовитый газ. В приведенных схемах расставьте коэффициенты и укажите тип реакции: 3 MnO2 + C = CO + Mn KOH + HNO3 = KNO3 + H2O Al(OH)3 = Al2O3 + H2O 4 HgO = Hg + O2 Zn + H2SO4 = ZnSO4 + H2 P + O2 = P2O5 Какую массу сульфида меди (I) можно Сколько грамм кислорода потребуется для получить при взаимодействии 3 моль меди с реакции с 1,2 моль магния? Реакция серой? Реакция протекает по уравнению: протекает по уравнению: 2Mg + О2 = 2MgO. 2Cu + S = Cu2S. Контрольная работа № 4 по теме «Растворы. Электролитическая диссоциация» № Вариант I Вариант II Ответьте на вопрос: 1 2 3 Что такое электролитическая диссоциация? Приведите примеры веществ-электролитов, относящихся к классу оснований, напишите уравнения их диссоциации. А: Расставить коэффициенты, составить полные и сокращенные ионные уравнения реакций. Назовать продукты реакций. Б, В: Составить молекулярные уравнения (ФОРМУЛЫ веществ, КОЭФФИЦИЕНТЫ), полные и сокращенные ионные уравнения реакции. А) MgСO3 + HNO3 = Mg(NO3)2 + H2O + СО2 Б) Al(NO3)3 + NaOH = В) гидроксид меди (II) + соляная кислота = хлорид меди (II) + вода А) NaOH + H2SO4 = Na2SO4 + H2O Б) KOH + MgCl2 = В) оксид натрия + азотная кислота = нитрат натрия + вода Укажите вещества, в растворах которых лакмус окрасится в синий цвет. Укажите вещества, в растворах которых метиловый оранжевый окрасится в розовый цвет. HNO3, Mg(NO3)2, KOH, Cu(OH)2 4 Что такое «электролиты»? Приведите примеры веществ-электролитов, относящихся к классу солей, напишите уравнения их диссоциации. HCl, CaCl2, KOH, H2SiO3 Какой объем газа (СО2) выделится при Рассчитайте массу соли, которую можно взаимодействии 16,8 грамм карбоната маг- получить при взаимодействии 40 грамм ния с избытком раствора азотной кислоты? гидроксида натрия с избытком серной кислоты. Контрольная работа № 4 по теме «Растворы. Электролитическая диссоциация» № 1 2 3 Вариант III Ответьте на вопрос: Что такое «неэлектролиты»? Приведите Что такое «электролиты»? Приведите припримеры веществ-неэлектролитов. меры веществ-электролитов, относящихся к Почему их растворы не проводят электриче- классу кислот, напишите уравнения их ский ток? диссоциации. А: Расставить коэффициенты, составить полные и сокращенные ионные уравнения реакций. Назовать продукты реакций. Б, В: Составить молекулярные уравнения (ФОРМУЛЫ веществ, КОЭФФИЦИЕНТЫ), полные и сокращенные ионные уравнения реакции. А) MgСO3 + HNO3 = Mg(NO3)2 + H2O +СО2 А) NaOH + H2SO4 = Na2SO4 + H2O Б) Fe2O3 + HCI = В) гидроксид меди (II) + серная кислота = сульфат меди (II) + вода Б) Cu(OH)2 + HCl = В) оксид магния + азотная кислота = нитрат магния + вода Укажите вещества, в растворах которых лакмус окрасится в красный цвет. Укажите вещества, в растворах которых метиловый оранжевый окрасится в желтый цвет KOH, HNO3, KNO2, H2SO4 4 Вариант IV NaOH, H2SO4, Na2SO4, Ba(OH)2 Какой объем газа (СО2) выделится при Рассчитайте массу соли, которую можно взаимодействии 16,8 грамм карбоната маг- получить при взаимодействии 40 грамм ния с избытком раствора азотной кислоты? гидроксида натрия с избытком серной кислоты.

