Предсессионные тесты для студентов ИТФ 1 курс
реклама
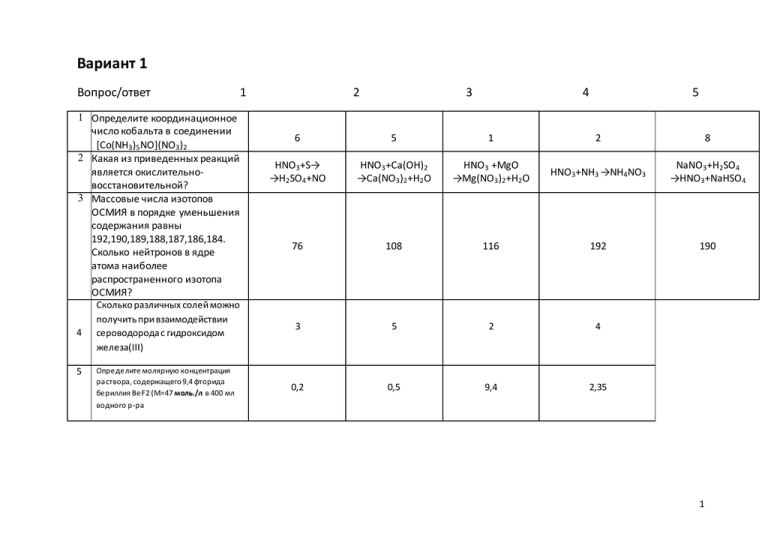
Вариант 1 Вопрос/ответ 1 Определите координационное число кобальта в соединении [Co(NH3)5NO](NO3)2 2 Какая из приведенных реакций является окислительновосстановительной? 3 Массовые числа изотопов ОСМИЯ в порядке уменьшения содержания равны 192,190,189,188,187,186,184. Сколько нейтронов в ядре атома наиболее распространенного изотопа ОСМИЯ? 4 5 1 Сколько различных солей можно получить при взаимодействии сероводорода с гидроксидом железа(III) Определите молярную концентрация ра створа, содержащего 9,4 фторида бериллия BeF2 (М=47 моль./л в 400 мл водного р-ра 2 3 4 5 6 5 1 2 8 HNO3+S→ →H2SO4+NO HNO3+Ca(OH)2 →Ca(NO3)2+H2O HNO3 +MgO →Mg(NO3)2+H2O HNO3+NH3 →NH4NO3 NaNO3+H2SO4 →HNO3+NaHSO4 76 108 116 192 190 3 5 2 4 0,2 0,5 9,4 2,35 1 6 Как изменится равновесие реакции диссоциации синильной кислоты HCN ↔ H++CN-, если к её раствору добавили р-р KCN? Сместится влево Сместится вправо Не изменится Увеличится 7. Укажите промышленный способ получения водорода. А) Zn + H2SO4 → ZnSO4 +H2 B) 2Na + 2 H2O → 2 NaOH + H2 C) CaH2 +2H2O → 2H2 + Ca(OH)2 D) CH4 + H2O → 3 H2 + CO 8.Какие оксиды азота относятся к кислотным? A) N2O, N2O3, N2O5 B) N2O3, N2O4, N2O5 C) NO, N2O4, N2O5 D) N2O, N2O4, N2O3 9.В результате гидролиза какой соли рН раствора будет > 7? A) MgS B) CuCl 2 C) Zn(NO3) 2 D) FeSO4 E) Fe(NO3) 2 2 Вариант 2 Вопрос/Ответ 1 2 Укажите формулу комплексного соединения состоящего из ионов Zn2+,Hg2+, CNS- 1 2 3 4 5 Zn2[Hg(CNS) 8] Zn2[Hg(CNS) 4] Hg[Zn (CNS) 4] Zn[Hg(CNS) 4] Hg[Zn (CNS) 6] 2 3 6 8 10 197 275 79 118 - Cu(OH) 2 CuCl 2 H2S MgHPO4 41,3кПа 1,13 мПа 0,05МПа 0,5кПа Сколько молекул щелочи необходимо для протекания ОВР Cr2(SO4)3+KOH+H2O2→ K2CrO4+K2SO4+H2O 3 Сколько протонов в ядре атома ЗОЛОТА? 4 Рассчитайте эквивалент, какого из приведенных соединений равен 67,5 5 Чему равно осмотическое давление раствора, содержащего 11,6 ацетона СН3СОСН3( М=58а.е.м) в 400 мл раствора (0º С)? 3 6 Пользуясь схемой, составьте ионное уравнение: Co(NO3 )2 + NaOH → Co(NO3 )2 + 2OH- ↔ Co(OH)2 ↓ + 2NO3 - Co 2+ + 2OH- ↔ Co(OH)2 ↓ 2NaOH + Co 2+ ↔ Co(OH)2 ↓ + 2Na+ NO3 - + Na+ ↔ NaNO3 7.Укажите электронную формулу иона Ве+2; электронной конфигурации какого инертного газа она соответствует? [ Ne ] А) 1s22s 2 2 2 [ He ] B) 1s 2s 2 [ He ] C) 1s 2 [ Ne ] D) 1s 8.Сульфиды, нерастворимые в кислотах концентрированной азотной кислотой CuS + HNO3 → CuSO4 + NO + H2O – неокислителях, переводят в раствор действием Определите эквивалент восстановителя. A) M/8 B) M/2 C) M/6 D) M/3 9.В результате гидролиза какой соли рН раствора будет >7? A) Hg(NO3)2 B) CuCl2 C) Al2(SO4)3 D) FeSO4 Е) K2CO3 4 Вариант 3 Вопрос/ответ 1 Укажите значение константы нестойкости комплексной соли Na3[Co(NO2)6] 2 В каком из приведенных превращений имеет место процесс окисления? 3 Сколько электронов заполняет уровень n=4 в атоме ЛАНТАНА? 4 Чему равен эквивалент гидросульфата магния 5 На сколько градусов повысится температура кипения, если в 1000 г воды растворить 18 г глюкозы C6H12O6 1 2 3 4 5 [Na+]3[Co3+][NO2-]6 [Na3[Co(NO2) 6]] [Na+]3[Co3+][NO2-]6 [[Co(NO2) 6]3-] [Na+]3[[Co(NO2) 6]3-] [Na3[Co(NO2) 6]] [Na+]3[[Co(NO2) 6]3-] [[Co(NO2) 6]3-] [Co3+][NO2-]6 [[Co(NO2) 6]3-] Zn ↓ K2ZnO2 Ni 2+ ↓ Ni MgCl 2 ↓ Mg(OH)2 BeO ↓ Na2BeO2 SO4-2 ↓ S0 18 19 32 27 218 218\3 218\2 121 0,26ºС 0,052ºС 1,0ºС 1,52ºС Не изменится Сместится влево Сместится вправо Не знаю 29 (М=180 а.е.м ); Е кипН2О=0,52? 6 Как изменится равновесие диссоциации сероводородной кислоты H2S ↔ 2H+ + S2- , если к р-ру добавить ионы Zn2+. 5 7.Напишите уравнение гидролиза гидрида магния А) MgH2 + 2H2O → Mg(OH)2 + 2 H2 B) Mg(OH)2 + n H2O → Mg2+(H2O)k + 2OH-(H2O)m C) MgH2 + 2H2O → Mg(OH)2 + 2H+ D) MgH2 + H2O → MgO + 2H2 8. К какому типу реакций относится реакция взаимодействия с водой межгалогеновых соединений : BrCl + HOH → HCl + HBrO BrF5 + 3HOH → 5HF + HBrO3 JF7 + 6H2O → 7HF + H5JO6 А) ОВР В) гидролиза C) нейтрализации D) комплексообразования 9. Масса никелевой пластики изменится после выдерживания ее в растворе: A) Pb(NO3)2 B) CaCl2 C) Ba(NO3)2 D) MgCl2 E) Al2(SO4)3 6 Вариант 4 Вопрос/ответ 1 2 3 4 5 Представьте кристаллогидрат CuSO4*5H2O в виде комплексной соли (координационное число меди -4) Вычислить восстановительный эквивалент Na2SO3, согласно электронному уравнению S4+-2e →S6+ Сколько подуровней заняты электронами на уровне с n=4? Сколько веществ из перечисленных будут реагировать с Na2O: вода, Cl 2O7, BeO, H2SO4, Zn(OH) 2 Ка кова эквивалентная (норма льна я) концентрация щелочи, если на нейтра лиза цию 40 мл изра сходовано 20 мл 0,2н ра створа кислоты? 1 2 [Cu(H2O)4]SO4*H2O 3 [CuSO4(H2O)4]H2O 4 [CuSO4][H2O]5 5 [Cu(H2O)3SO4](H2O)2 [Cu(H2O)3]SO4(H2O) 2 42 а.е.м 126 а.е.м 21 а.е.м. 31,5 а.е.м 63 а.е.м 1 2 3 4 5 5 4 3 2 1*10-1н 0,01н 2*10-4н 0,4н 7 6 Какие продукты образуются при гидролизе соли Cr(NO3 )3 ? Сильное основание и кислая соль Слабая кислота и сильное основание Сильная кислота и слабое основание Сильная кислота и основная соль 7.Укажите рН раствора хлорида натрия: A) pH = 7 B) pH < 7 C) pH > 7 D) pH ≈ 7 8. Укажите соединения с sp-гибридизацией орбиталей атома углерода: СН4, СО2, СS2, CO3-2, графит, карбин, алмаз А) карбин, СО2, CS2 B) графит, С2Н6 С) алмаз, CS2, CO2 D) карбин, СО3-2, СО2 9. В каком соединении Mn проявляет только окислительные свойства? A) NaMnO4 B) MnCO3 C) K2MnO4 D) MnSO4 E) Mn3(PO4)2 8 Вариант 5 Вопрос/ответ 1 2 3 4 5 Определите координационное число кобальта в соединении [Co(NH3)3(Co)(H2O)2](NO3)3 Укажите соединение, в состав которого входит атом, проявляющий функцию только окислителя Сколько электронов находится на 3pподуровне атома КОБАЛЬТА? Какое соединение является ангидридом азотной кислоты Какова эквивалентная (нормальная) концентрация щелочи, если на 15 мл его эквивалента взаимодействует с 30 мл 1 2 3 4 5 6 3 4 9 0 H2SO3 H2SO4 PH3 H2S HPO2 5 2 4 6 8 NO N 2 O3 NO2 N 2 O5 0,2н 0,3н 0,4н 0,1н 0,1 н р-ра кислоты? 9 6 Какая соль из укакзанных не подвергается гидролизу? KNO2 K2CO3 K2SiO3 KI 7.Составьте уравнение реакции: Ca + H2SO4 (k) → … и опрелелите молярную массу эквивалента кальция А) Мэкв = 40 г/моль В) Мэкв = 80 г/моль С) Мэкв = 20 г/моль D) Мэкв = 10 г/моль 8. Закончите уравнение реакции: Рb + NaOH + H2O … A) Na2[Pb(OH)4] + H2 ↑ B) Na2PbO2 + H2 ↑ C) PbO2 + NaOH D) Na2[Pb(OH)2] + H2O 9.Какая из электронных формул соответствует Со+2 A) 3d74s 2 B) 3p63d7 C) 3d94s 2 D) 3d24s 2 E) 3s 23р6 10 Вариант 6 Вопрос/ответ I Какое комплексное соединение соответствует кристаллогидрату CoCl2*6H2O 1 2 3 4 5 [Co(H2O)6]Cl 2 [CoCl 2][H2O]6 [CoCl 2(H2O)4](H2O]2 [CoCl(H2O)6]Cl [Co(H2O)5Cl]Cl*H2O 2 Какая из приведенных реакций является окислительновосстановительной? Cu+Hg(NO3) 2 →Cu(NO3) 2+Hg Cu(OH) 2 → CuO+H2O CuSO4+ NaOH →Cu(OH) 2+Na2SO4 CuO+ HNO3 →Cu(NO3) 2+H2O Cu(OH) 2+ H2SO4 →CuSO4+H2O 3 Сколько нейтронов в ядре атома наиболее распространенного изотопа ЗОЛОТА? 197 275 79 118 - 4 Сколько различных солей можно получить при взаимодействии гидроксида алюминия с сероводородом 2 4 3 5 0,83 1,50 166,5 16,65 5 Определить молярную концентрацию раствора содержащего 33,0 г сульфида калия K2S (М=110 а.е.м) в 200 мл водного раствора 11 6 Укажите выражение суммарной константы диссоциации кремниевой кислоты. К= [SiO3 2-] [H+]2 К= [HSiO3 -] [H+] [H2 SiO3 ] К= [H+]2 [SiO3 2-] [H2 SiO3 ] К= [H+] [SiO3 2-] [HSiO3 2-] 7. Какие свойства проявляют ионы Н+ и Н- при взаимодействии с молекулами NH3 и AlH3 соответственно? A) свойства доноров B) Н+ является акцептором, Н- - донором C) свойства акцепторов D) Н+ является донором, Н- - акцептором 8. Как изменяется потенциал ионизации галогенов с возрастанием порядкового номера? A) не изменяется B) возрастает C) убывает D) изменяется не монотонно 9. Какая из электронных формул соответствует иону Ti+4? A) 3d24s 2 B) 3d64s 2 C) 3p64s 2 D) 3s 23p6 E) 3p63d2 12 Вариант 7 Вопрос/ответ II II ІІ IV 2 ІІ Укажите значение константы нестойкости комплексной соли K2[Ni(CN)6] Сколько молекул щелочи необходимо для протекания ОВР KMnO4+Na2SO3+KOH →K2MnO4+Na2SO4+H20 Сколько протонов в ядре атома МОЛИБДЕНА? 1 2 3 [K+]2[[Ni(CN)6]2-] [K2[Ni(CN)6]] [K+]2[[Ni(CN)6]2-] [[Ni(CN)6]2-] [K+]2[Ni4+][CN-]6 [K2[Ni(CN)6]] [K+]2[Ni4+][CN-]6 [[Ni(CN)6]2-] 4 2 10 42 54 3 96 6 84 4 138 5 Между какими веществами возможно протекание реакции Li 2O и N2O5 Li 2O и Cr2O3 Li 2O и Cr(OH) 3 Li 2O и HNO3 Чему равно осмотическое давление раствора, содержащего 12г уксусной к-ты СН3СООН (М=60а.е.м.) в 200 мл р-ра ( 0ºС)? 22,4кПа 2,27МПа 0,1кПа 1,0МПа 2Na+ + ZnO22- ↔ H+ + OH- ↔ Zn(OH) 2 + 2OH- ↔ NaOH + 2OH- ↔ Na2ZnO2 H2O ZnO22- + 2H2O Na+ + H2O Пользуясь схемой, составьте сокращенное ионное уравнение : Zn(OH)2 + NaOH → [Ni4+][CN-]6 [[Ni(CN)6]2-] 13 7.Укажите электронную формулу иона Rb+ ; электронной конфигурации какого инертного газа она соответствует? А) 1s 22s 22p63s 23p63d104s 24p65s 1 [Kr] 2 2 6 2 6 10 2 6 1 B) 1s 2s 2p 3s 3p 3d 4s 4p 5s [Xe] 2 2 6 2 6 10 2 6 C) 1s 2s 2p 3s 3p 3d 4s 4p [Kr] 2 2 6 2 6 10 2 6 [Xe] D) 1s 2s 2p 3s 3p 3d 4s 4p 8. Укажите уравнение получения силана: A) Mg2Si + 4HCl → SiH4 ↑ + 2MgCl2 B) SiO2 + 2C +2Cl2 → SiCl4 + 2CO ↑ C) 3SiF4 + 3H2O → 2H2[SiF6] + H2SiO3 ↓ D) SiCl4 + 3H2O → 4HCl + H2SiO3 9. В результате гидролиза какой соли рН раствора >7 ? A) CH3COONa B) FeSO4 C) Fe(NO3)3 D) ZnCl2 E) AgNO3 14 Вариант 8 Вопрос/ответ 1 2 Укажите формулу комплексного соединения состоящего из Cd2+;NH3 и OHОпределите степень окисления Cl в указанных соединениях a)NaCl b)NaClO c)Ca(ClO3)2 d)HClO4 3 4 5 Сколько электронов заполняет уровень с n=3 в атоме ПЛАТИНЫ? Между какими веществами возможно протекание реакции Сколько граммов CaCO3 выпадает в осадок, если к 200 мл 0,5 н р-ра CaCl 2 прибавить стехиометрическое количество Na2CO3? 1 2 3 4 5 [Cd(NH3 )6 ](OH)4 [Cd(OH)4 ](NH3 )2 [Cd(OH)6 ](NH3 )4 [Cd(OH)6 ](NH3 )2 [Cd(NH3 )4 ](OH)2 a)1- a)7+ a)5+ a)1+ a)1- b)1+ c)5+ d)7+ b)5+ c)1+ d)1- b)7+ c)1d)1+ b)5+ c)7+ d)1- b)5+ c)7+ d)1+ 8 17 32 18 50 Rb2O и SO2 RbOH и Al(OH) 3 RbOH и Ca(OH) 2 Rb2O и ZnO 10 100 20 5 15 6 При добавлении NH4CN к раствору синильной кислоты (HCN ↔ H+ + CN-) равновесие сместилось влево. Как изменилась степень диссоциации HCN? Увеличилась в 6 раз Не изменилась Увеличилась в 2 раза Уменьшилась 7. При сгорании на воздухе какой из перечисленных металлов: Li, Na, K, Rb – дает соединение типа Э2О A) Na2O B) Li2O C) K2O D) Rb2O 8. В лаборатории PbO2 обычно получают окислением ацетата свинца белильной известью по уравнению: Pb(CH3COO)2 + Ca(OCl)2 +H2O → PbO2 ↓ + CaCl2 + 2CH3COOH . Укажите эквивалент окислителя. A) M/2 B) M/1 C) M/4 D) M/3 9. Масса железной пластинки изменится после выдерживания ее в растворе: A) Mg(NO3)2 B) BaCl2 C) Al2(SO4)3 D) Na2CO3 E) Pb(CH3COO)2 16 Вариант 9 Вопрос/ответ 1 2 3 4 5 Какое комплексное соединение соответствует двойному соединению 2NaCl*PtJ4 1 2 3 4 5 [NaCl]2 [PtJ4 ] Na2 [PtJ4 Cl2 ] Na2 [PtJ4 ]Cl2 Na2 [PtCl2 ]J4 [PtCl2 Na2 ]J4 122,5 а.е.м 61,25 а.е.м. 30,8 а.е.м 40,8 а.е.м 20,4 а.е.м Сколько электронов находится на 5d-подуровне атома ТАНТАЛА? 5 1 2 3 6 Между какими веществами возможно протекание реакции? H2O и CO2 H2O и CaO H2O и Na H2O и N2 Крископическая константа для воды равна 1,86. Найти конечные температуры замерзания р-ра, если в 100 г воды растворено 0,2 моля фенола С6Н5ОН 0,24 ºС 3,7 ºС 1 ºС 0,8 ºС Вычислить окислительный эквивалент KClO 3 согласно электронного уравнения CL+5 +6e →Cl- 17 6 Какие продукты образуются при гидролизе соли K2SiO3? Сильное основание и кислая соль Слабая кислота и сильное основание Сильная кислота и слабое основание Сильная кислота и основная соль 7. Укажите рН раствора хлорида натрия: А)pH = 7 В)pH < 7 С)pH > 7 Д)pH ≈ 7 8. Какова сокращенная электронная формула атома брома в нормальном состоянии? A) 4s24p5 B) 4s 23p5 C) 4s 14p6 D) 4s 23p4 9.В каком соединении Mn проявляет только окислительные свойства? А)Mn(NO3)2 В)MnO С)Mn2O7 Д)Mn2O3 Е)MnSO4 18 Вариант 10 Вопрос/ответ 1 Какое комплексное соединение т кристаллогидрату CaCl2*4H2O 4 5 [Ca(H2O)4 Cl]Cl [CaCl 2(H2O)3 ]H2O [Ca(H2O)4]Cl 2 As3+ ↓ As5+ As5+ ↓ As3+ P 5+ ↓ P3+ Al3+ ↓ Al0 Zn2+ ↓ Zn0 112 261 187 75 186 1 2 4 3 Как изменится концентрация рра Ca(NO3) 2, если к 150 мл 0,2 н р-ра прилить 300 мл воды? Увеличится в 2 раза Увеличится в 3 раза Уменьшится в 3 раза Уменьшится в 2 раза Какие продукты образуются при гидролизе соли NaCN? Слабое основание и слабая кислота Сильное основание и слабая кислота Сильное основание и кислая соль Сильная кислота и основная соль 3 Сколько нейтронов в ядре атома наиболее распространенного изотопа РЕНИЯ? Массовое число 187? 6 3 [CaCl 2(H2O)2](H2O) В каком из приведенных превращений имеет место процесс окисления? 5 2 [CaCl 2](H2O)4 2 4 1 Сколько различных солей можно получить при взаимодействии хлорноватой кислоты и гидроксида хрома (III) 19 7. Закончите приведенную схему, чтобы получить уравнение реакции, идущей до конца: NaOH +… → NaCl +… A) NaOH + KCl → NaCl + KOH B) 2NaOH + BaCl2 → Ba(OH)2 + 2NaCl C) NaOH + NH4Cl → NaCl + NH4OH D) NaOH + LiCl → NaCl + LiOH 8. Рассчитать эквивалент окислителя в реакции: Au + HNO3 + HCl → AuCl3 + NO + H2O A) B) C) D) M/2 M/1 M/3 M/5 9. Какая из электронных формул соответствует Са+2: A) 3p64s 2 B) 3d24s 2 C) 3s 23p4 D) 3p64s 1 E) 3s 23p6 20 Вариант 11 Вопрос/ответ 1 2 3 4 5 Определите координационное число кобальта в соединении [Co(NH3)5NO](NO3)2 Какая из приведенных реакций является окислительновосстановительной? Сколько нейтронов в ядре атома наиболее распространенного изотопа ВОЛЬФРАМА? Сколько различных солей можно получить при взаимодействии фосфорной кислоты и гидроксидом кальция Определите молярную концентрация раствора, содержащего 6,0 г карбамида (мочевины) CO(NH2) 2 (М=60 а.е.м.) в 200 мл водного раствора 1 2 3 4 5 6 5 1 2 8 NH3+HCl →NH4Cl N2O3+H2O →HNO2 N2+O2 →NO NH4OH →NH3+H2O N2O5+H2O →HNO3 184 74 258 110 - 2 4 3 5 0,1 0,5 1,0 1,5 21 6 Укажите выражение константы диссоциации для раствора рубидия. К= [Rb+]3 [PO43-] К= [Rb3PO4] [Rb+]3[PO43-] К= [PO43-] [Rb+]3 К= [Rb+]3[PO43-] [Rb3PO4] 7. Укажите электронную формулу иона Ва2+. Электронной конфигурации какого инертного газа она соответствует? [Xe] А) 1s 22s 22p63s 23p63d104s 24p64d106s 2 B) 1s 22s 22p63s 23p63d104s 24p64d105s 25p6 [Xe] C) 1s 22s 22p63s 23p63d104s 24p64d105s 25p66s 2 [Rn] D) 1s 22s 22p63s 23p63d104s 24p64d105s 25p6 [Rn] 8. Все оксиды элементов IIIА группы твердые вещества, только один из них растворяется в воде по реакции: Э2О3 + 3Н2О → 2Н3ЭО3. Какой это оксид? A) Al2O3 B) Ga2O3 C) Tl2O3 D) B2O3 9. В каком из указанных растворов будет происходить растворение цинка? A) Na2SO4 B) CH3COONa C) NH4Cl D) NaOH E) H2O 22 Вариант 12 Вопрос/ответ 1 2 3 4 5 Определите координационное число хрома в комплексном соединении [Cr(NH3)4(H2O)2]J3 Сколько молекул кислоты необходимо для протекания ОВР K2Cr2O7+NaNO2+H2SO4→ Cr2(SO4)3+NaNO3+K2SO4+ H2 O Сколько протонов в ядре атома СВИНЦА? Чему равен эквивалент карбоната калия Чему равно осмотическое давление раствора содержащего 3,8 г метилгликоля CH3OH2CH2OH (М=76 а.е.м) в 200 мл раствора ( 0ºС) 1 2 3 4 5 2 6 4 3 1 1 3 4 6 7 82 125 207 289 - 138 138\2 138\3 100 3,28кПа 0,57Мпа 5,26кПа 1,02МПа 23 Пользуясь схемой, составьте сокращенное ионное уравнение : K2CO3 + HCl → 6 K+ + Cl - ↔ CO32- + 2H+ ↔ KCl H2O + CO2 2HCl + CO32- ↔ H2CO3 + 2Cl - K2CO3 + Cl - ↔ 2KCl + CO32- 7. Что объясняет уменьшение потенциала ионизации щелочных металлов в ряду: Li Na K 5,14 4,34 4.18 I (эВ) 5,39 Rb Cs 3,89 А) рост атомного радиуса В) уменьшение атомного радиуса С) увеличение числа электронов в атоме D) увеличение заряда атома 8. В ряду хальководородов угол между связями ( ∠ НЭН) равен Н2О Н2S H2Se H2Te о 92о 91о 90о ∠ НЭН 104,5 Какая молекула наиболее полярна и почему? А) Н2Те, т.к. чем меньше угол НЭН, тем больше полярность В) Н2О т.к. чем больше угол НЭН, тем больше полярность С) Н2Те т.к. отсутствие гибридизации увеличивает полярность D) неполярные молекулы 9. Какая из электронных формул соответствует иону Cr+6? A) B) C) D) E) 3s23p6 3d54s1 3d64s2 3p63d6 3p64s2 24 Вариант 13 Вопрос/ответ 1 2 3 Определите заряд комплексообразователя в соединении [Cr(CO)4(CN)2]Cl В каком из приведенных превращений имеет место процесс окисления? Сколько электронов заполняет уровень с n=3 в атоме ПЛАТИНЫ? 1 2 3 4 5 2 4 6 3 0 Zn ↓ K2ZnO2 Ni2+ ↓ Ni MgCl2 ↓ Mg(OH)2 BeO ↓ Na2BeO2 SO4-2 ↓ S0 8 17 32 18 50 4 Чему равен эквивалент гидросульфата кальция 234 234\2 210\2 210 5 Чему равно осмотическое давление раствора, содержащего 6,9г этилового спиртаС2Н5ОН (М =46а.е.м) в 100 мл раствора ( 0ºС)? 24кПа 3,4МПа 22,6Па 0,84кПа HCOONa KNO3 Давление NaOH 6 Какой из четырёх факторов будет смещать равновесие диссоциации HCOOH ↔ H+ + HCOO- вправо? 25 7. К какому типу гидроксидов относится гидроксид бария? А) амфотерный В) основной С) кислотный D) не образует гидроксида 8.По величине ∆ G0f в реакции Н2 + Э → Н2Э сделайте вывод об изменении окислительной активности в ряду О- S –Se -Te H2O(г) H2S(г) H2Se(г) H2Te(г) ∆G A) B) C) D) 0 f (дж/моль) -288 -33,8 +19,7 +85,2 уменьшается увеличивается не изменяется изменяется не линейно 9.Масса цинковой пластинки увеличивается после выдерживания ее в растворе: A) CuCl2 B) Mg(NO3)2 C) K2SO4 D) MgSO4 E) Al2(SO4)3 26 Вариант 14 Вопрос/ответ 1 2 3 4 5 6 Укажите значение константы нестойкости для комплексного соединения K2[PtCl4] Какой из перечисленных атомов проявляет функцию окислителя? Сколько электронов находится на 3d-подуровне атома КОБАЛЬТА? 1 2 [K+]2[Pt2+][Cl -]4 [K2[PtCl 4]] H0 1 3 [K+]2[Pt2+][Cl -]4 [[PtCl 4]2-] 4 [Pt2+] [Cl -]4 [[PtCl 4]2-] 5 [K+][[PtCl 4]2-] [K2[PtCl 4]] P3- K0 Cr6+ 2 6 4 [K+]2[[PtCl 4]2-] [[PtCl 4]2-] J1- 7 Сколько различных солей можно получить при взаимодействии фосфорной кислоты и гидроксидом кальция 2 4 3 5 Каким из приведенных способов приятно выражать молярную концентрацию раствора? Число молей в-ва в 1 л р-ра Число молей в-ва в 1000г растворителя Число молей в-ва в 1000 г раствора Число молей в-ва в 100 г раствора Какие продукты образуются при Сильное основание и гидролизе соли Cr(NO3) 3? кислая соль Слабая кислота и сильное основание Сильная кислота и слабое основание Сильная кислота и основная соль 27 7. Укажите продукты гидролиза сульфата бериллия A) Be(OH)2 и H2SO4 B) (BeOH)2SO4 и H2SO4 C) Be(HSO4)2 и Be(OH)2 D) гидролиз не идет 8. Известны три аллотропные модификации углерода: алмаз, графит, карбин. Какова гибридизация атомных орбиталей углерода в них? A) sp3 sp2 sp B) sp sp2 sp3 C) sp3 sp3 sp3 D) sp sp sp 9. В результате гидролиза какой соли рН раствора будет >7? A) Fe(NO3)3 B) CuSO4 C) Na2SiO3 D) AgNO3 E) Fe2(SO4)3 28 Вариант 15 Вопрос/ответ 1 2 3 4 5 6 Какое комплексное соединение соответствует двойной соли KCl*AuCl3 Укажите соединение, в состав которого входит атом, проявляющий функцию восстановителя Сколько электронов находится на 5d-подуровне атома ОСМИЯ? У какого гидроксида наиболее ярко выражены основные свойства Чему равна процентная концентрация раствора, полученного при растворении 30г сахара в 120 г воды Укажите среду водного раствора соли Al 2(SO4) 3. K[AuCl3]Cl K[AuCl]Cl3 [AuK]Cl4 K[AuCl4] K[AuCl 2]Cl2 Fe2O3 Al2O3 NH3 H2O Na2O 4 10 8 6 2 Ca(OH) 2 RbOH LiOH NaOH 20 25 30 40 pH=7 pH>7 pH<7 Не знаю 29 7. Расставьте коэффициенты и найдите молярную массу эквивалента пероксида натрия: Na2O2+ BaJ2 + H2SO4 → J2 + BaSO4 + H2O A) Мэкв = М/2 В) Мэкв = М С) Мэкв = 2М D) Мэкв = М/4 8.Закончите уравнение реакции: AlF3 + 3KF → … A) K3[AlF6] B) Al[KF4] C) K2[AlF5] D) K[AlF4] 9.Какая из электронных формул соответствует Са+2: А)3p64s 2 В)3d24s 2 С)3s 23p4 D)3p64s 1 E)3s23p6 30


