d-элементы I
реклама
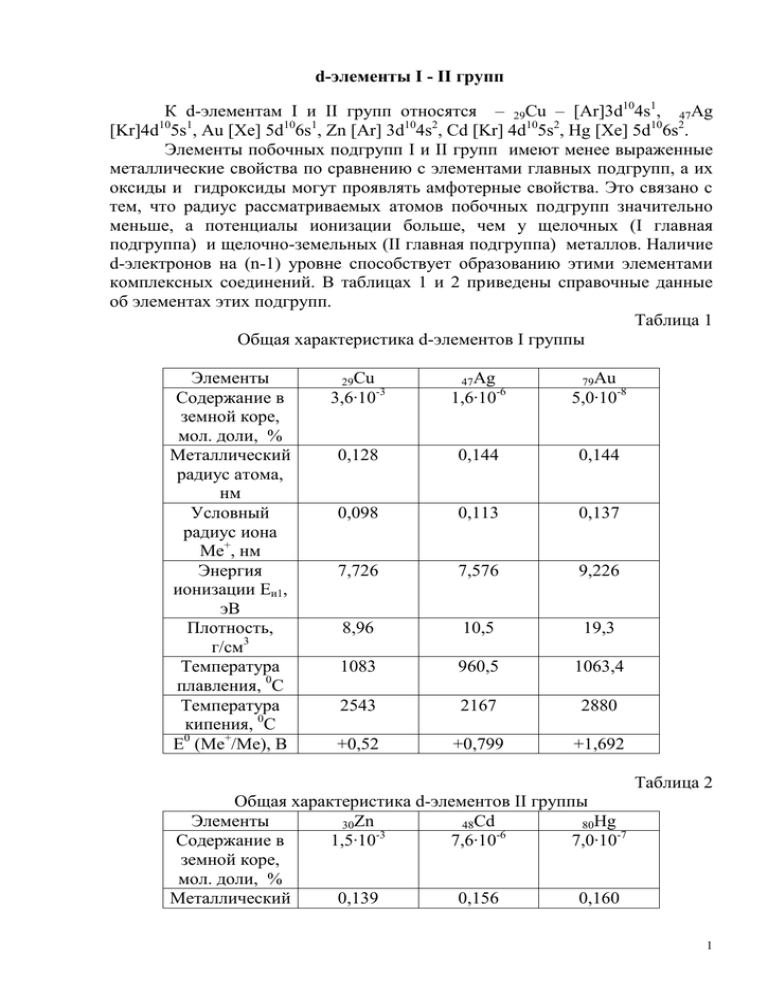
d-элементы I - II групп К d-элементам I и II групп относятся – 29Сu – [Ar]3d104s1, 47Ag [Kr]4d105s1, Au [Xe] 5d106s1, Zn [Ar] 3d104s2, Cd [Kr] 4d105s2, Hg [Xe] 5d106s2. Элементы побочных подгрупп I и II групп имеют менее выраженные металлические свойства по сравнению с элементами главных подгрупп, а их оксиды и гидроксиды могут проявлять амфотерные свойства. Это связано с тем, что радиус рассматриваемых атомов побочных подгрупп значительно меньше, а потенциалы ионизации больше, чем у щелочных (I главная подгруппа) и щелочно-земельных (II главная подгруппа) металлов. Наличие d-электронов на (n-1) уровне способствует образованию этими элементами комплексных соединений. В таблицах 1 и 2 приведены справочные данные об элементах этих подгрупп. Таблица 1 Общая характеристика d-элементов I группы Элементы Содержание в земной коре, мол. доли, % Металлический радиус атома, нм Условный радиус иона Ме+, нм Энергия ионизации Еи1, эВ Плотность, г/см3 Температура плавления, 0С Температура кипения, 0С Е0 (Ме+/Ме), В 29Cu 3,6·10 -3 47Ag 1,6·10 -6 79Au 5,0·10-8 0,128 0,144 0,144 0,098 0,113 0,137 7,726 7,576 9,226 8,96 10,5 19,3 1083 960,5 1063,4 2543 2167 2880 +0,52 +0,799 +1,692 Таблица 2 Общая характеристика d-элементов II группы Элементы 30Zn 48Cd 80Hg -3 -6 Содержание в 1,5·10 7,6·10 7,0·10-7 земной коре, мол. доли, % Металлический 0,139 0,156 0,160 1 радиус атома, нм Условный радиус иона Ме2+, нм Энергия ионизации Еи1, эВ Плотность, г/см3 Температура плавления, 0С Температура кипения, 0С Е0 (Ме2+/Ме), В 0,083 0,099 0,112 9,394 8,994 10,438 7,1 8,7 13,55 419 321 -39 907 767 357 -0,763 -0,403 +0,854 Еи1 у элементов подгрупп Cu и Zn существенно выше, чем у sэлементов соответствующих групп. Это и многие другие особенности объясняется проникновением внешнего s-электрона под орбитали 10 предвнешних d -электронов. Резкое же возрастание радиусов ионов и Еи1 у Au и Hg по сравнению с остальными элементами подгрупп обусловлено проникновением 6s-электронов не только под орбитали 5d10-электронов, но и под орбитали 4f14-электронов. Особо высокая устойчивость 6s2 конфигурации у атомов ртути (см. ее Еи1) по сравнению с другими s- и dэлементами II группы откладывает отпечаток на все ее свойства. Так, для ртути характерны производные иона Hg22+, в котором реализуется ковалентная связь (Hg-Hg)2+. Такое объединение обеспечивает сохранение конфигурации 6s2. В производных Hg22+ степень окисления Hg принимают равной +1. Нахождение в природе Соединения d-элементов I и II групп разнообразны и часть из них представлены в таблице 3. Таблица 3 Примеры наиболее важных природных соединений Элемент Cu Свободное состояние Самородки Ag Самородки Au Самородки Zn Оксиды Cu2Oтенорит Природные соединения Сульфиды, Галогениды теллуриды Cu2S-халькозин, CuFeS2-халькопирит, Cu5FeS4-борнит α-Ag2S-акантит, AgClхлораргирит, -Ag2S-аргенит, AgBrAg3AsS3-прустит, бромаргирит Ag2Te-гессит AuTe2-калаверит, AuAgTe4-сильванит ZnS-сфалерит Карбонаты CuCO3 Cu(OH)2малахит ZnCO3-смитсонит 2 Cd Hg Самороданая, амальгамы с Au, Ag CdS-гринокит α-HgS-киноварь Основные способы получения металлов Извлечение металлов определяется формой нахождения в природе dэлементов I и II групп. Получение металлов основано на предварительном обогащении природных руд и дальнейшем выделении металлов одним из трех способов: 1) пирометаллургия – выплавка металлов при высоких температурах. Основная реакция пирометаллургических процессов заключается либо в непосредственном восстановлении: Cu2O + C =2Cu + CO 2Cu2O + Cu2S = 6Cu + SO2 HgS + O2 =Hg + SO2, либо в предварительном окислении сульфидных руд и дальнейшем восстановлении в отсутствие кислорода: 2ZnS + 3O2 =2ZnO + 2SO2 Zn + C = Zn + CO 2) гидрометаллургия – перевод руд в водные растворы с помощью кислот, щелочей, солей и дальнейшее восстановление металлов электролизом или более активными металлами. Медь, цинк и кадмий в раствор переводят, как правило, серной кислотой: MeO + H2SO4 = MeSO4 + H2. Для получения металлов с высокой степенью чистоты используют электролиз. K Me 2+ + 2e = Me A 2H2O - 4e = O2 + 4H+ Получение серебра и золота осуществляют главным образом цианидным методом: а) перевод в комплексные цианиды AgCl + 2KCN = K[Ag(CN)2] + KCl Ag2S + 4KCN = 2K[Ag(CN)2] + K2S 4Au + 8NaCN + O2 + 2H2O = 4Na[Ag(CN)2] + 4NaOH б) восстановление цинком или алюминиевой пылью: 2Na[Ag(CN)2] + Zn =Na2[Zn(CN)4] + 2Ag Na[Ag(CN)2] + Al + 4NaOH + 2H2O= 2NaCN + Ag +Na3[Al(OH)6] +H2 2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au 3) комбинированный метод сочетания пиро- и гидрометаллургии. В основном используется для получения рафинированных металлов. Черновые металлы: медь, содержащая примеси других металлов, в том числе и серебро, формуется в виде анодных пластин и в кислом растворе подвергается электролизу A Cu – 2e = Cu2+ 3 Примеси (Fe,Ni, Co,Zn) Me – 2e =Me2+ Серебро при этом в виде шлама собирают на дне электролизера и потом извлекают цианидным методом K Cu2+ + 2e = Cu Аналогично идет процесс рафинирования чернового серебра. Применение d-элементов I-II групп Медь, серебро, золото обладают хорошей электропроводностью и поэтому являются материалом для изготовления проводов, кабелей (медь), покрытия деталей и контактов в электротехнике и электронике. Устойчивость меди к коррозии позволяет использовать ее в процессах водопользования. Широко используются сплавы на основе меди: латунь(Cu,Zn), бронза(Cu,Sn), нейзильбер(Cu,Zn,Ni), мельхиор(Cu,Ni). Основным потребителем ртути является электротехническая промышленность (изготовление люминесцентных ламп и выпрямителей переменного тока). Ртуть идет также для производства измерительных приборов (манометров, барометров, термометров и т.п.). Цинк и кадмий используются как гальваническое покрытие железа и стали. Все эти элементы используются для производства гальванических источников тока (от эталонных до бытовых). Соединения d-металлов используют для изготовления белил (ZnO), красок (ZnCl2, ZnS+BaSO4, CdS+ZnS+BaSO4, HgHAsO4 - краска для защиты морских судов от обрастания), AuCl3 или H[AuCl4] – краска для золочения стекол и керамики. Кадмий обладает свойством поглощать нейтроны, поэтому используется для регулирования цепной реакции деления урана в ядерных реакторах. Взаимодействие металлов с простыми окислителями Непосредственное взаимодействие d-элементов I и II групп с неметаллами, как правило, происходит при нагревании. Продукты этих реакций представлены в таблице 4. Таблица 4 Бинарные соединения d-элементов I и II групп с неметаллами Металл Медь Серебро Золото Цинк Кадмий Ртуть O2 CuO Cu2О S Cu2S CuS Ag2S ZnO CdO HgO ZnS CdS HgS P F CuF2 Cl2 CuCl2 ZnF2 CdF2 HgF2 AuCl3 ZnCl2 CdCl2 HgCl2 Cu3P2 Zn3P2 Cd3P2 Оксиды серебра(I) и золота(I) получают косвенным путем 2AgNO3 + 2KOH = Ag2O + H2O + 2KNO3 4 2AuCl + 2NaOH = Au2O + H2O + 2NaCl. Бинарные соединения d-элементов I и II групп, за исключением некоторых галогенидов (см. таблицу растворимости), в воде нерастворимы. Растворимые хлориды металлов подвергаются гидролизу, и дают кислую реакцию раствора: MeCl2 + H2O MeOHCl + HCl Me2+ H2O MeOH+ + H+. Взаимодействие металлов со сложными окислителями Взаимодействие металлов с кислотами, щелочами, солями обусловлено положением этих металлов в ряду напряжений. Водород из кислот могут вытеснить только цинк и кадмий, имеющие отрицательный электродный потенциал: Zn + H2SO4(разб.) = ZnSO4 + H2 Cd + 2HCl = CdCl2 + H2. Цинк также легко растворяется в щелочах: Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2. Продукты реакции d-элементов I и II групп с некоторыми окислителями приведены в таблице 5. Таблица 5 Схемы реакций d-элементов I и II групп с окислителями Металл Cu Cu Cu(изб.) Cu(нед.) Cu, Ag Cu, Ag Cu,Ag,Au Au Zn Zn Окислитель O2 O2 O2 O2 . HNO3(разб.) HNO3(конц.) O2 HNO3(конц.) H2SO4(конц/) HNO3(разб.) Zn,Cd Cd Hg(нед.) HNO3(конц.) H2SO4(конц.) HNO3(конц.) H2SO4(конц.) HNO3(конц.) H2SO4(конц.) Hg(изб.) Среда HCl(конц.) CO2 + H2O NH3 + H2O NH3 + H2O KCN + H2O HCl Продукты реакции H[CuCl2] + H2O (CuOH)2CO3 [Cu(NH3)2]OH [Cu(NH3)4](OH)2 Cu(NO3)2 + NO + H2O Cu(NO3)2 + NO2 + H2O K[Me(CN)2] + KOH H[AuCl4] + NO +NO2 + H2O ZnSO4 + H2S + H2O Zn(NO3)2 +NO или NH4NO3 + H2O Me(NO3)2 + NO2 + H2O CdSO4 +SO2 + H2O Hg(NO3)2 + NO2 + H2O HgSO4 +SO2 + H2O Hg2 (NO3)2 + NO2 + H2O Hg2SO4 +SO2 + H2O Важнейшие соединения d-элементов I и II групп и их реакционная способность Оксиды МеО и гидроксиды Ме(ОН)2, за исключением серебра и ртути, и оксид Au2O3 имеют амфотерный характер. Растворение в щелочах происходит при нагревании с образованием комплексов [Me(OH) 4]2- и [Au(OH)4]-. Все гидроксиды в воде нерастворимы и их получение основано на обменной реакции между солью и щелочью. Способность образовывать комплексные соединения позволяет переводить нерастворимые осадки в 5 аммиачные, тиосульфатные, цианидные комплексы, если константа нестойкости этих комплексов значительно меньше, чем произведение растворимости соли, находящейся в осадке. Наиболее характерные примеры можно представить уравнениями: MeГ + 2Na2S2O3 = Na3[Me(S2O3)2] + 2NaГ, где Me+ – Cu+, Ag+, Г- – Cl-, Br-, I-. Me(OH)2 + 4NH3 е 2+ 2+ 2+ 2+ где Me – Cu , Zn , Cd ZnS + 4KCN = K2[Zn(CN)4] + K2S Окислительно-восстановительные реакции с участием соединений d-элементов I и II групп Отличительной способностью Cu+, Au+, Hg22+ является склонность к диспропорционированию: 2CuCl(к) = CuCl2(р) + Cu(к) 3AuCl(к) + KCl(р) = K[AuCl4] (р) + 2Au(к) Hg2Cl2 = Hg + HgCl2 Соединения Cu, Au, Hg с переменной степенью окисления могут играть роль как окислителей, так и восстановителей. В качестве окислителей выступают Cu2+ и Hg2+ в соответствующих реакциях: 2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4 - окислитель 2HgCl2 + SnCl2 = Hg2Cl2 + SnCl4 - окислитель Восстановителями являются Cu+ и Hg22+ в реакциях: 4CuCl + O2 + 4HCl = 4CuCl2 + H2O - восстановитель 2Hg2Cl2 + Cl2 = 2HgCl2 - восстановитель 6
