ЛЕКЦИЯ ДИСПЕРСНЫЕ № 4 СИСТЕМЫ
реклама

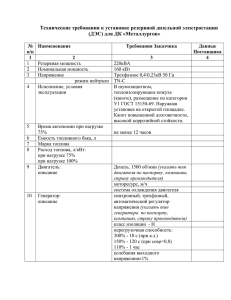
ЛЕКЦИЯ № 4 ДИСПЕРСНЫЕ СИСТЕМЫ Классификация коллоидных дисперсных систем 1. По агрегатному состоянию фаз 2. По структуре 3. По дисперсности 4. По межфазному взаимодействию Поверхностные явления в коллоидных дисперсных системах Об ра зо ва ние и с тро е ние д во йно г о электричес кого с л оя Возникновение двойного межфазной границе. электрического слоя (ДЭС) на 1.Адсорбционный механизм образования ДЭС (на примере образования ДЭС на кристалле AgCl) ϕ(фи)-потенциал (-) K+ Cl- NO3- K+ mAgCl - K+ Cl - Cl- NO3 K+ I mAgCl ClNO3 ClK+ ClCl + Cl-- K Cl K+ Cl NO3 Cl слой адсорбированных потенциалопределяющих ионов 1 II ζ (дзета)-потенциал (-) противоионы 0 Cl + - K K+ Cl Cl- K+ mAgCl Cl- + Cl K K+ Cl + -K Cl плотный адсорбционный слой диффузный слой 2.Поверхностная диссоциация (на примере образования ДЭС на частицах SiO2) ϕ(−) mSiO2 SiO2 SiO2 SiO2 SiO2 SiO2 SiO2 + H2O mSiO2 ζ (− ) Si OH Si O- H+ Si OH Si O- H+ Si OH O- H+ mSiO2 Si Si OH Si O- Si OH Si O- H+ H+ Изменение поверхностной энергии коллоидной системы в процессе образования ДЭС Уравнение Липпмана: Влияние различных факторов на строение ДЭС и величину ζ потенциала 1. Влияние индифферентных электролитов Индифферентные электролиты а) Электролит содержит ион, одинаковый с противоионами ДЭС 2 б) Электролит не содержит ионов, одинаковых с противоионами ДЭС 2. Влияние неиндифферентных электролитов Неиндифферентные электролиты а) Электролит содержит потенциалопределяющими ионами ион, одинаковый с ζ сэ л б) Электролит содержит ион, способный достраивать кристаллическую решетку, но противоположный по знаку. ζ ,ϕ 0 сэ л 3. Влияние разбавления и концентрирования 4. Влияние температуры и природы дисперсионной среды 3 Строение частиц дисперсной фазы (коллоидных частиц) Частица дисперсной фазы вместе с двойным электрическим слоем –– мицелла. Строение мицеллы изображается следующей формулой, где m — число формульных единиц AgCl в агрегате; n — число адсорбированных потенциалопределяющих ионов Cl–; (n–x) — число противоионов K+ в плотном адсорбционном слое;x — число противоионов K+ в диффузном слое. Мицелла отрицательного золя AgCl, полученного реакцией AgNO3 с KCl, при соблюдении двух условий: растворы реагентов разбавленные и одно из веществ берется в избытке, например, когда к раствору KCl постепенно, по каплям добавляется раствор AgNO3, т. е. в системе имеется избыток KCl. Внутренняя часть мицеллы — кристаллический агрегат AgCl. Агрегат с потенциалопределяющими ионами (Cl–) — ядро. На его поверхности ϕ потенциал, отрицательный. Ядро с противоионами (K+) плотного адсорбционного слоя — гранула. На поверхности гранулы ζ -потенциал, отрицательный. Гранула заряжена 4 Мицелла положительного золя AgCl, полученного реакцией AgNO3 с KCl, при соблюдении двух условий: растворы реагентов разбавленные и одно из веществ берется в избытке, например, когда к раствору AgNO3 постепенно, по каплям добавляется раствор KCl, т. е. в системе имеется избыток AgNO3. Приложение к лекции № 4 Величины, характеризующие дисперсные системы Величина Удельная поверхность Обозначение и формула Частичная концентрация Весовая концентрация м–1 S0 S0 = mд.ф. Vд.ф. ρ д.ф. м2/кг ν = Nчастиц Vд. с. м–3, л–1 сν = W /m VД.С . N А S уд = W — масса вещества дисперсной фазы; m — масса частицы Массовая концентрация Объемная концентрация S0 Vд. с. S уд = Частичная концентрация (численная) с* = mд. ф. Vд. с. V сυ = д. ф. ⋅ ( 100% ) Vд. с. с= Размерность mд. ф. ⋅ ( 100% ) 100 г д.с. моль/л кг/м3 безразмерная величина (доли единицы или %) безразмерная величина (доли единицы или %) Примечание: д.с. — дисперсная система; д.ф. — дисперсная фаза. 5