H2 C CH этилен этен пропен бутен
реклама
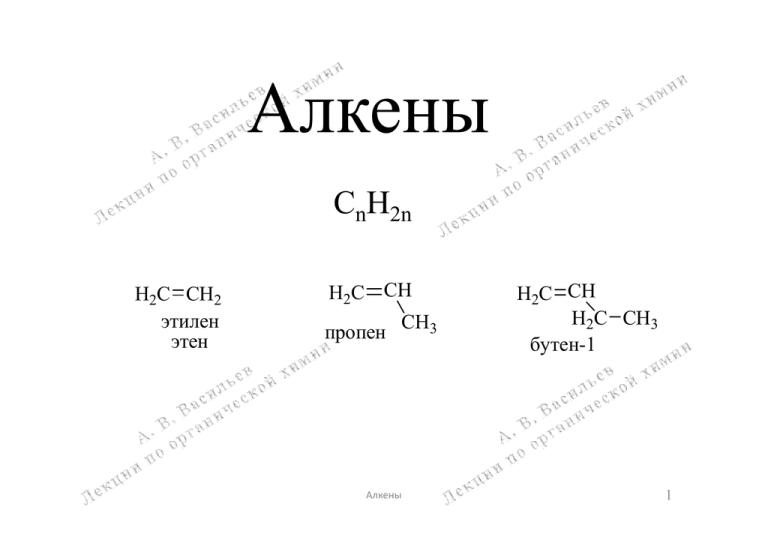
Алкены СnH2n H2C CH2 этилен этен H2C CH пропен CH3 Алкены H2C CH H2C CH3 бутен-1 1 Номенклатура и изомерия алкенов 1 1 2 H3C H2C CH 3 4 H2C CH3 бутен-1 1 4 CH3 H 2C C3 H H цис-бутен-2 Z-бутен-2 1 5 CH CH3 C C 4 H2C CH H2C CH2 4 2 3 H3C H транс-бутен-2 E-бутен-2 2 3 4 H 2 5 H2C CH3 C C3 H3C CH3 1 CH3 H3C 6 Е-3-метилпентен-2 5-метилгексен-1 Алкены 2 Физические свойства алкенов С2-С4 – газы; С5-С17 – жидкие; >С18 – твёрдые Алкен Этилен Пропен Цис-бутен-2 Транс-бутен-2 Гексен-1 Т.пл., С -169 -186 -139 -105 -140 С2Н4 С3Н6 С4Н8 С4Н8 С6Н12 Децен-1 С10Н20 -87 Алкены Т.кип., С -104 -47 4 1 63.5 171 3 sp2-Гибридизация атома углерода. Строение этилена 2p 2p -связь H H 2 sp2 C C sp H H -связь 2p 2s s 1s2 2p 3 sp2-гибридные орбитали p-орбиталь C H s H s + H C H H sp2 sp2 2 sp sp C p H 2 C H sp2 sp2 1.33Å C H 121.7o Алкены C H H -связь перекрывание p-орбиталей H H 116.6 H C H H -связи, s s 2 образуемые sp -орбиталями o p C 1.076Å H 4 Способы получения алкенов 1. Реакции отщепления (элиминирования) C C C C X Y X=Y=H X = Y = Hlg -XY X = H, Y = Hlg X = H, Y = OH X = H, Y = +NR3 1.1 Дегидрирование алканов (промышленный способ получения алкенов) H3C CH3 Cr2O3, 450oC H2C CH2 Алкены H2 5 1.2 Дегалогенирование вицинальных дигалогеналканов Zn H3CHC CH2 Br Br 1,2-дибромпропан CH3CH2OH или CH3CO2H H3CHC CH2 пропен o t ZnBr2 1.3 Дегидрогалогенирование галогеналканов H H3C C CH2 Cl H 2-хлорпропан KOH CH3CH2OH to H3CHC CH2 KCl H2O 1.4 Дегидратация спиртов H2C CH2 H OH H2SO4 180oC H2C CH2 H2O Реагенты для дегидратации спиртов: H2SO4, H3PO4, Al2O3, ThO2, цеолиты; реакция протекает при нагревании 100 – 350С Алкены 6 Александр Михайлович Зайцев (1841-1910), русский химик. Правило Зайцева (1875 г.) При отщеплении галогеноводородов от галогеналканов или воды от спиртов водород преимущественно отрывается от наименее гидрогенизированного (имеющего меньшее число атомов водорода) атома углерода, при этом образуется алкен с наибольшим числом заместителей при двойной связи. CH3 CH2 H C CH3 Br KOH наименее гидрогенизированный атом углерода CH3 H3C C CH2 OH CH3 H2SO4 CH3 CH CH CH3 бутен-2 (80%) по правилу Зайцева CH3 CH2 CH CH2 бутен-1 (20%) против правила Зайцева CH3 H3C C CH CH3 H3C 2-метилбутен-2 (90%) по правилу Зайцева Алкены H2C C H2C CH3 2-метилбутен-1 (10%) против правила Зайцева 7 Объяснение правила Зайцева. В результате реакций дегидрогалогенирования и дегидратации образуются термодинамически более стабильные, наиболее замещённые алкены. Ряд термодинамической стабильности алкенов: R2C CR2 > R2C CHR > R2C CH2 > RHC CHR > RHC CH2 Алкены 8 1.5 Пиролиз тетраалкиламмониевых солей по Гофману (1851 г.). Август Гофман (1818-1892), немецкий химик Реакция идёт против правила Зайцева! CH3 H C CH3 NMe3 OH CH2 to - NMe3, - H2O CH3 CH2 CH CH2 бутен-1 (100%) отщепление по Гофману, против правила Зайцева Стерические факторы в отщеплении по Гофману вид вдоль связи С1-С2 H3CH2C H H H H NMe3 по Гофману вид вдоль связи С2-С3 антиотщепление Me3N H CH3 H CH3 неблагоприятное стерическое перекрывание H по Зайцеву Алкены 9 2. Частичное гидрирование алкинов R C C R' + H2 Катализатор Линдлара: Pd, PbO, CaCO3 R R' C C H H цис-алкен Na-NH3 R R C C R' H C C H LiAlH4 R' транс-алкен Алкены 10 Химические свойства алкенов Реакции присоединения по двойной связи алкенов XY C C C C X Y X, Y = H, Hlg, OH и др. 1. Гидрирование C C H2 Катализатор p, to C C H H Каталитическое гетерогенное гидрирование. Гетерогенные катализаторы: Pt, Pd, Ni, PtO2, Pd/C, Rh/C, Ru/Al2O3 H2C CH2 этилен H2 Pd p, to H3C CH3 этан Поль Сабатье (1854-1941), Нобелевский лауреат (1912 г) за гетерогенное гидрирование, французский химик. Каталитическое гомогенное гидрирование. Гомогенные катализаторы: трис(трифенилфосфин)родийхлорид [(C6H5)3P]3RhCl, гидрохлорид трис(трифенилфосфин)рутения [(C6H5)3P]3RuHCl H2 циклогексен [(C6H5)3P]3RhCl 20oC циклогексан Алкены 11 2. Электрофильное присоединение к связи С=С + C C E электрофил C C Y- E карбокатион C C E Y продукт присоединения Е+ – Электрофил – частица (атом или группа атомов), имеющая вакантную орбиталь, которая может принять электронную пару для образования новой химической связи. Многие электрофилы являются положительно заряженными частицами. Они испытывают сродство к имеющим повышенную электронную плотность (обогащённым электронами) частям органических молекул: кратным связям (С=С, С≡С), ароматическим кольцам, гетероатомам (O, N, S и др.). Примеры электрофилов: H+, Br+, NO2+, H3C+ и пр. 2.1 Галогенирование – присоединение галогенов C C Hlg2 Hlg = F, Cl, Br, I C C Hlg Hlg Алкены 12 H2C CH2 Br2 растворитель: CCl4 H2C CH2 Br Br 1,2-дибромэтан Механизм реакции Стадия 1 – образование -комплекса H2C CH2 Br Br электрофил H2C CH2 смещение электронов Br Br -комплекс Стадия 2 – образование -комплекса H2C CH2 -Br- Br Br -комплекс резонансные структуры H2C CH2 Br циклический бромониевый ион -комплекс H2C CH2 Br 2-бромэтилкатион перемещение пары электронов Стадия 3 – присоединение бромид-иона H2C CH2 Br- Br перемещение пары электронов H2C CH2 Br Br Алкены 13 Анти-присоединение галогенов к алкенам Br- Br2 -Br - Br анти- циклогексен Br Br транс-1,2-дибромциклогексан 2.2 Гидрогалогенирование – присоединение галогеноводородов C C HHlg Hlg = F, Cl, Br, I H2C CH2 C C H Hlg HBr H3C CH2 Br бромэтан Механизм реакции HBr H2C CH2 H2C CH2 H Br -комплекс -Br- H3C CH2 этильный катион Алкены Br- H3C CH2 Br 14 2.3 Гидратация – присоединение воды H2C CH2 H2O H+ C C H2O (HOH) H+ C C H OH H3C CH2 OH этанол Присоединение в присутствии H2SO4 конц. H2C CH2 O SO2 OH H (H2SO4) H3C CH2 OSO3H этилсульфат H 2O -H2SO4 H3C CH2 OH Присоединение в присутствии H2SO4 разб. и др. минеральных кислот неподелённая электронная пара H2C CH2 H+(кислота) H3C CH2 этильный катион H2O Алкены H3C CH2 -H+ O H H этилгидроксоний-ион H3C CH2 OH 15 Правило Марковникова (1869 г.) Присоединение галогеноводородов и воды к алкенам подчиняется правилу Марковникова. Владимир Васильевич Марковников (1837-1904), русский химик. При присоединении галогеноводородов и воды к алкенам водород присоединяется к наиболее гидрогенизированному (имеющему большее число атомов водорода) атому углерода двойной связи. HC CH2 H3C HCl H3C CH Cl CH3 2-хлорпропан наиболее гидрогенизированный атом углерода H3C C CH2 H3C H OH H2SO4 CH3 H3C C CH3 2-метилпропанол-2 (трет.-бутиловый спирт) OH Алкены 16 Объяснение правила Марковникова. С1 2 1 HC CH2 H3C H+ С2 HC CH2 H3C Cl- H3C CH CH3 изопропильный катион вторичный катион (более устойчив) H3C CH2 CH2 н-пропильный катион H3C CH CH3 Cl 2-хлорпропан H3C HCl CH Cl CH3 первичный катион (менее устойчив) Современная трактовка правила Марковникова. Реакции электрофильного присоединения к двойной связи алкенов протекают через образование наиболее стабильного карбокатиона. Ряд стабильности карбокатионов третичные > вторичные > первичные > метильный CH3 H3C C CH3 > H3C CH CH3 > H3C CH2 > H3C этильный метильный трет.-бутильный изопропильный катион катион катион катион Алкены 17 Гидридный сдвиг и перегруппировка углеродного скелета в реакциях электрофильного присоединения к алкенам H H2C C C CH3 H CH3 3-метилбутен-1 H+ H H3C C C CH3 H CH3 вторичный катион ~H гидридный сдвиг H3C CH2 C CH3 CH3 третичный катион (более устойчив) Br- Br H3C CH2 C CH3 CH3 2-бром-2-метилбутан (60%) BrH H H3C C C CH3 2-бром-3-метилбутан Br CH3 (40%) CH3 H+ H2C C C CH3 H CH3 3,3-диметилбутен-1 CH3 CH3 Cl CH3 Cl~CH3 H3C C C CH3 H3C C C CH3 H3C C C CH3 H H сдвиг группы СН3, CH3 CH3 H CH3 перегруппировка вторичный третичный катион 2,3-диметил-2-хлорбутан углеродного катион (более устойчив) (70%) скелета ClCH3 H H3C C C CH3 2,2-диметил-3-хлорбутан Cl CH3 (30%) Алкены 18 2.4 Присоединение хлорноватистой и бромноватистой кислот C C HO Hlg C C OH Hlg Hlg = Cl, Br HC CH2 H3C HO Cl H H3C C CH2Cl OH 1-хлорпропанол-2 Механизм реакции HC CH2 H3C Cl+(электрофил) присоединение по правилу Марковникова H3C CH CH2 Cl HO- H H3C C CH2Cl OH 2.5 Присоединение интергалогенов H3C C CH2 H3C I Cl CH3 H3C C CH2 1-иод-2-метил-2-хлорпропан Cl I Алкены 19 2.6 Присоединение других галогенсодержащих электрофильных реагентов Hlg Y R C CH2 H присоединение по правилу Марковникова I N3 иодазид Br N3 бромазид H R C Y CH2 Hlg I NCO иодизоцианат 2.7 Гидроборирование 6 H2C CH2 B2H6 2 (CH3CH2)3B триэтилборан B2H6 диборан H 2 BH3 B H H HC CH2 BH3 электрофил H3C 2 H3C C CH2 H вакантная (пустая) орбиталь электрофильный центр H3C CH H (CH3CH2CH2)3B трипропилборан CH2 B H H H3C H2O2, HO- CH2 CH3CH2CH2 пропанол OH Алкены CH2 BH2 Герберт Браун (1912-2004), Нобелевский лауреат (1979 г) за гидроборирование, американский химик. Формально присоединение против правила Марковникова! 20 3. Радикальные реакции алкенов 3.1 Гидрогалогенирование в присутствии перекисей – эффект Караша (1929 г.) HC CH2 H3C HC CH2 H3C HBr HBr в отсутствии перекисей CH CH3 присоединение по правилу Br Марковникова 2-бромпропан H3C в присутствии перекисей H3C CH2 CH2 Br Морис Караш (1895-1957), американский химик. присоединение против правила Марковникова 1-бромпропан Перекисные соединения RO2R' (RO-OR'): O2 (кислород) H2O2 (перекись водорода) (H3C)3CO OH (гидроперекись трет.-бутила) C6H5 O O C C C6H5 (перекись бензоила) O O Алкены 21 Механизм перекисного гидробромирования 1-ая стадия – разложение пероксида 2-ая стадия – инициирование цепи RO OR RO h или tо H Br ROH 2 RO Br 3-ая стадия – рост цепи С2 2 1 HC CH2 H3C H3C Br 1 С CH2 Br CH2 CH2 Br вторичный радикал (более устойчив) H3C CH2 первичный радикал (менее устойчив) HBr H3C CH2 CH2 Br Br 4-ая стадия – обрыв цепи Алкены 22 3.2 Радикальное аллильное замещение Cl2, 400оС -HCl H2C C CH3 H аллильное положение H2C C CH2 H Cl2, 400оС -HCl CH3 H2C C CH2 H Cl 3-хлорпропен (аллилхлорид) H2C C CH2 CH3 H Cl 3-хлорбутен-1 Механизм реакции Cl2 Cl 2 Cl H2C C CH3 H -HCl H2C C CH2 H Cl2 H2C C CH2 H Cl Cl H2C C CH2 H аллильный радикал (стабильный резонансно-стабилизированный) Алкены 23 Аллильное бромирование с помощью N-бромсукцинимида циклогексен 1) H2C H2C O C N Br C O O O Br (C6H5COO)2 или h C C H2C H2C перекись бензоила N H N Br o H C CCl4, 80 C H2C 2 C C 3-бромциклогексен O O N-бромсукцинимид сукцинимид Механизм реакции (C6H5COO)2 перекись бензоила Br или h 2) Br HBr радикал аллильного типа 3) H2C H2C O C N Br C O HBr H2C H2C O C N H C O Br2 Br 4) Br2 Алкены Br 24 4. Окисление алкенов Николай Александрович Прилежаев (1877-1944), русский химик. 4.1 Эпоксидирование. Реакция Прилежаева (1909 г.) O R C C C H O O пероксикарбоновая кислота (надкислота) эпоксид (оксиран) C C O O C CH2 H O пропеноксид (метилоксиран) C H3C C CH2 H OOH пропен Cl мета-хлорпероксибензойная кислота Механизм реакции. Согласованное син-присоединение H R C C H R цис-алкен C C O C O O H H R син-присоединение Промышленное получение оксирана (этиленоксида, окиси этилена) H2C CH2 Алкены C OH Cl мета-хлорбензойная кислота R' H R R'CO3H O H3C R H C O C -R'CO2H R O2, Ag, 150oC R R C C H O H H цис-оксиран H2C CH2 O 25 4.2 Гидроксилирование C C [O] C C HO OH диол (гликоль) [O] - окислитель: H2O2/H+, KMnO4 , OsO4 Анти-гидроксилирование (H2O2/H+) H C C H2O2 C C O H+ H2O2-CF3CO2H H H циклогексен H2O анти- C C O H O C C OH H -H+ OH C C OH H HO транс-циклогександиол-1,2 OH H Алкены 26 Син-гидроксилирование Егор Егорович Вагнер (1849-1903), русский химик. Окисление KMnO4. Реакция Вагнера (1888 г.) KMnO4, H2O H o H2O H 0-5 C, pH 7.5-8 H H -MnO2 , -KOH H H циклогексен O O OH OH цис-циклогександиол-1,2 Mn O OK Окисление OsO4 O Os O O O OsO4 H H H H NaHSO3-H2O H H -H2OsO4 O O OH OH Os O O Алкены 27 4.3 Окислительное расщепление связи С=С C C [O] C C HO OH [O] : KMnO4/H+, CrO3/H+, K2Cr2O7/H+ R2 R3 C C 1 R R4 1 R HC CHR 2 O [O] C OH карбоновые кислоты O или C кетоны R2 KMnO4, H2SO4-H2O 80-100oC K2Cr2O7, H2SO4-H2O R3 C O R1 кетон O R1 C OH карбоновая кислота Алкены O C R4 кетон O C R2 HO карбоновая кислота 28 4.4 Озонолиз R R C C H R R R O3 озон H C C R O O O мольозонид разрыв связи С=С H2C CH H2C CH3 бутен-1 H3C C H 1. O3 2. Zn, H2O, CH3CO2H C CH3 H бутен-2 1. O3 2.H2O2 R O O R C C O R H озонид H2C O формальдегид (метаналь) Zn, H2O, CH3CO2H восстановительное расщепление R R C O H альдегид R H2O2 C O окислительное расщепление HO карбоновая кислота O C R кетон R O C R кетон O CH H2C CH3 пропаналь O 2 H3C C OH уксусная кислота Алкены 29 5. Полимеризация алкенов n H2C CH2 этилен - мономер полимеризация CH2 CH2 n полиэтилен - полимер n - степень полимеризации 5.1 Свободнорадикальная полимеризация n C C R - свободно радикальная частица R C C X n Источники R: O2 H2O2 O O O O H 3C C C CH3 C6H5 C C C6H5 O O (перекись бензоила) O O (перекись ацетила) (H3C)2C N N C(CH3)2 CN CN [азо-бис(изобутиронитрил)] Примеры полимеризации n H2C CH2 перекись бензоила 200oC, p CH2 CH2 n полиэтилен H2O2 , FeSO4 , H2O n F2C CF2 тетрафторэтилен CF2 CF2 тефлон n Алкены 30 Механизм свободнорадикальной полимеризации алкенов O O 1-ая стадия – инициирование – генерирование радикальной частицы R C tо - 2 CO2 2R CH2 CH2 CH2 C R O O 2-ая стадия – рост цепи R H2C CH2 ... R CH2 R CH2 CH2 CH2 CH2 m H2C CH2 R CH2 CH2 3-я стадия – обрыв цепи R CH2 R R CH2 CH2 CH2 m YH -Y CH2 CH2 CH2 CH2 m R CH2 CH2 CH2 m R CH3 -H R CH2 CH2 Алкены C H m CH2 31 Инициируется катионными частицами: Н+, R+ и др. Катализаторы: H2SO4, H3PO4, HF, BF3, AlCl3, AlBr3 и пр. 5.2 Катионная полимеризация "голова" CH3 "хвост" CH3 H2C C H+ CH3 изобутилен 5.3 Анионная полимеризация ... H3C C "голова" CH3 "хвост" CH3 CH3 H3C C H2C C CH3 CH3 CH3 H2C C CH3 n полиизобутилен CH3 CH3 CH3 H2C C C C H3C C H CH 3 CH3 CH3 m ... (CH3)3C Li+ трет.-бутиллитий CH3 H2C C "голова" CH 3 "хвост" присоедиение по типу "голова к хвосту" Инициируется анионными частицами: H2N-, RO-, R- и др. Катализаторы: NaNH2, CH3ONa, (CH3)3CLi и пр. (H3C)3C CH2 CH2 Li+ карбанионная частица H2C CH2 (H3C)3C CH2 CH2 CH2 m CH3 Алкены CH2 CH2 n полиэтилен 32 Карл Циглер (1898-1973), Нобелевский лауреат (1963 г) за полимеризацию алкенов, немецкий химик. 5.4 Координационная полимеризация Катализатор Циглера-Натта (1950-е гг.): TiCl4 + Al(CH2CH3)3 Cl Cl TiCl4 (C2H5)3Al Al(CH2CH3)3 C2H5 Ti Cl Cl каталитический свободное комплекс координационное положение Cl Cl Cl C2H5 Ti (C2H5)3Al HC CH3 Cl Cl HC Cl Ti (C2H5)3Al CH2 HC CH3 CH3 C C2H5 H H2C Cl Cl 2 пропен (пропилен) CH3 Cl CH2 C C2H5 H Ti (C2H5)3Al HC CH3 Cl Cl H2C Cl ... Cl (C2H5)3Al Cl (C2H5)3Al Cl Cl Ti Cl Cl Cl Ti Cl CH2 CH3 C C2H5 H m Алкены CH2 CH3 C C2H5 H 2 CH3 CH2 C H n полипропилен Джулио Натта (1903-1979), Нобелевский лауреат (1963 г) за полимеризацию алкенов, итальянский химик. 33 Регулярные и нерегулярные полимеры CH3 H2C CH пропилен CH3 H2C CH пропилен координационная полимеризация H CH3 H CH3 H CH3 H CH3 стереорегулярный (изотактический) полипропилен катионная полимеризация H CH3 H CH3 CH3 H H CH3 нестереорегулярный (атактический) полипропилен Алкены 34





