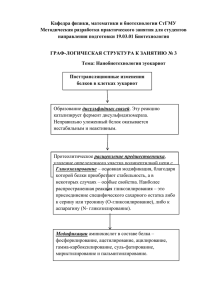
Документ 2350845
реклама

Федеральное государственное бюджетное учреждение науки Институт биологии гена Российской академии наук На правах рукописи Скородумова Любовь Олеговна Анализ статуса экспрессии раково-тестикулярных генов как мишеней для терапии и профилактики онкологических заболеваний Диссертация на соискание учёной степени кандидата биологических наук (Специальность 03.01.03 – молекулярная биология) Научный руководитель: к.б.н. С.С. Ларин Москва 2015 2 СОДЕРЖАНИЕ Введение ........................................................................................................................ 6 1. Обзор литературы. Раково-тестикулярные антигены как прогностические маркеры и мишени иммунотерапии опухолей ...................................................... 14 1.1. Генно-клеточные вакцины, разработанные в ИБГ РАН........................... 14 1.2. Общая характеристика группы раково-тестикулярных антигенов ........ 16 1.2.1. История изучения и номенклатура раково-тестикулярных антигенов ..... 16 1.2.2. Классификация раково-тестикулярных антигенов .................................... 18 1.2.3. Регуляция экспрессии раково-тестикулярных-антигенов ......................... 19 1.2.4. Функции раково-тестикулярных-антигенов .............................................. 21 1.2.5. Раково-тестикулярные антигены как мишени для иммунотерапии.......... 23 1.3. Характеристика отдельных групп раково-тестикулярных антигенов ... 24 1.3.1. Раково-тестикулярные гены и антигены семейства MAGE-A .................. 24 1.3.1.1. Номенклатура семейства MAGE ....................................................... 24 1.3.1.2. Экспрессия генов и антигенов семейства MAGE-A в нормальных тканях и в опухолях .................................................................. 25 1.3.1.3. Иммунногенность раково-тестикулярных антигенов семейства MAGE-A ......................................................................................... 27 1.3.2. Раково-тестикулярные гены и антигены семейства BAGE ....................... 29 1.3.2.1. Номенклатура семейства BAGE ........................................................ 29 1.3.2.2. Экспрессия генов и антигенов семейства BAGE в нормальных тканях и в опухолях .................................................................. 30 1.3.2.3. Иммуногенность раково-тестикулярных антигенов семейства BAGE................................................................................................................. 31 1.3.3. Раково-тестикулярные гены и антигены семейства GAGE ....................... 32 1.3.3.1. Номенклатура семейства GAGE ....................................................... 32 1.3.3.2. Экспрессия генов и антигенов семейства GAGE в нормальных тканях и в опухолях .................................................................. 32 1.3.3.3. Иммуногенность раково-тестикулярного антигена GAGE ............. 33 1.3.4. Раково-тестикулярные антиген и ген NY-ESO-1 ....................................... 34 1.3.4.1. Номенклатура семейства NY-ESO-1 ................................................. 34 1.3.4.2. Экспрессия гена и антигена NY-ESO-1 в нормальных тканях и в опухолях ............................................................................................................ 34 1.3.4.3. Иммуногенность антигенов семейства NY-ESO-1 ........................... 36 1.4. Раково-тестикулярные гены и антигены при раке молочной железы .... 41 3 1.5. Раково-тестикулярные гены и антигены при лейкоплакии слизистой оболочки полости рта ............................................................................................ 47 2. Материалы и методы ............................................................................................ 51 2.1 Пациенты и биообразцы .................................................................................. 51 2.1.1. Сбор биологического материала................................................................. 51 2.1.2. Пациенты с лейкоплакией и образцы слизистой оболочки полости рта .. 51 2.1.3. Пациенты с плоскоклеточным раком слизистой оболочки полости рта и характеристика собранных образцов опухолей ................................................... 51 2.1.4. Пациенты с раком молочной железы и характеристика собранных образцов опухолей ................................................................................................ 52 2.2. Стабилизация РНК в образцах ...................................................................... 52 2.3. Выделение тотальной РНК из стабилизированных образцов ................... 53 2.4. Обработка РНК ДНКазой ............................................................................... 53 2.5. Реакция обратной транскрипции .................................................................. 53 2.6. Система контрольных образцов для исследования экспрессии раковотестикулярных генов человека ............................................................................ 54 2.7. Полимеразная цепная реакция ...................................................................... 56 2.7.1. Состав реакции ............................................................................................ 56 2.7.1.1. Состав реакционной смеси ................................................................. 56 2.7.1.2. Праймеры............................................................................................. 56 2.7.2. Условия проведения ПЦР ........................................................................... 56 2.8. Порядок проведения ПЦР для исследованных образцов .......................... 57 2.9. ДНК-электрофорез в агарозном геле ............................................................ 57 2.10. Регистрация результатов исследования ..................................................... 58 2.11. Учет результатов исследования .................................................................. 58 2.12. Анализ транскриптома клеточной линии MelP, входящей в состав генно-клеточной противоопухолевой вакцины «Аллоген» ............................. 59 2.12.1. Клеточная линия меланомы MelP............................................................. 59 2.12.2. Выделение тотальной РНК, оценка количества, качества, обработка ДНКазой ................................................................................................................ 59 2.12.3. Выделение мРНК ....................................................................................... 60 2.12.4. Построение фрагментной библиотеки...................................................... 60 2.12.5. Секвенирование РНК-библиотек .............................................................. 61 4 2.12.6. Биоинформатическая обработка результатов секвенирования транскриптомов меланомы ................................................................................... 61 2.13. Статистическая обработка результатов анализа экспрессии генов ...... 62 3. Результаты и обсуждение...................................................................................... 63 3.1. Разработка набора реагентов для молекулярно-генетической диагностики экспрессии РТ-генов методом полимеразной цепной реакции 63 3.1.1.Выбор генов для набора реагентов .............................................................. 63 3.1.3. Подготовка документов для регистрационного досье «Набора реагентов для молекулярно-генетической диагностики экспрессии РТ-антигенов методом полимеразной цепной реакции (РТ-антиген)» ..................................................... 67 3.1.4. Состав набора реагентов ............................................................................. 69 3.1.5.1. Технические испытания ...................................................................... 71 3.1.5.2. Медицинские испытания..................................................................... 72 3.1.5.3. Получение регистрационного удостоверения ................................... 74 3.2. Результаты исследования экспрессии раково-тестикулярных генов в образцах рака молочной железы .......................................................................... 76 3.2.1. Исследование экспрессии раково-тестикулярных генов в образцах нормальной ткани молочной железы ................................................................... 77 3.2.2. Исследование экспрессии раково-тестикулярных генов в образцах рака молочной железы .................................................................................................. 78 3.2.3. Сопоставление профиля экспрессии РТ-генов в образцах рака молочной железы с набором РТ-генов клеточных линий противоопухолевых вакцин «Компливак» и «Аллоген».................................................................................... 82 3.3. Результаты исследования экспрессии раково-тестикулярных генов в образцах лейкоплакии и плоскоклеточного рака слизистой оболочки полости рта .............................................................................................................. 84 3.3.1. Экспрессия раково-тестикулярных генов в образцах нормальной слизистой оболочке полости рта .......................................................................... 84 3.3.2. Экспрессия раково-тестикулярных генов в образцах плоскоклеточного рака слизистой оболочки полости рта.................................................................. 85 3.3.3. Результаты исследования экспрессии раково-тестикулярных генов в образцах лейкоплакии слизистой оболочки полости рта .................................... 87 3.4. Теоретическое обобщение литературных данных для обоснования перспективных направлений исследований функций MAGE-A антигенов .. 89 4. Заключение ........................................................................................................ 100 5. Выводы ............................................................................................................... 103 5 6. Список сокращений .......................................................................................... 104 7. Список литературы ............................................................................................. 107 Приложение А. ......................................................................................................... 127 Приложение Б........................................................................................................... 130 Приложение В........................................................................................................... 132 6 Введение Актуальность работы и степень её разработанности Превращение нормальной клетки в опухолевую, или злокачественная трансформация, – событие, происходящее вследствие накопления в геноме соматических клеток мутаций в ключевых генах опухолевых супрессоров и протоонкогенах. Генетические аберрации в опухолевых клетках приводят к неконтролируемой пролиферации и изменению профиля экспрессии генов, и появляются так называемые опухоль-ассоциированные антигены. К ним относят уникальные опухолевые белки – мутированные варианты обычных белков, и белки, в норме отсутствующие или экспрессирующиеся менее интенсивно в данной ткани. Клетки иммунной системы распознают такие белки как чужеродные. Чужеродные белки могут индуцировать развитие противоопухолевого иммунного ответа. Опухоль-ассоциированные перспективными мишенями антигены, для появившиеся в опухоли, молекулярно-генетической являются диагностики и иммунотерапии злокачественных опухолей. Возможность диагностировать и лечить опухоль на ранней стадии увеличивает вероятность положительного исхода. Одной из групп опухоль-ассоциированных антигенов являются раковотестикулярные (РТ) антигены [1, 2]. Они характеризуются нормальной экспрессией преимущественно в зародышевых клетках человека и аберрантным присутствием в опухолях. В зрелых соматических клетках РТ-антигены отсутствуют, и их появление может служить молекулярным маркёром опухолевой ткани и запускать иммунный ответ. Однако если бы иммунный ответ всегда запускался, то, вероятно, опухолевые заболевания были бы не так распространены. На самом деле, образование опухоли происходит одновременно с изменением окружающих тканей, формируется так называемая опухолевая строма, клетки которой, как и опухолевые клетки, активно подавляют развитие иммунных реакций [3-8]. Иммунный ответ на РТ-антигены может быть запущен с помощью генноклеточных противоопухолевых вакцин [9]. При этом пациенту вводятся инактивированные опухолевые клетки, которые несут РТ-антигены и продуцируют факторы, стимулирующие распознавание опухолевых антигенов и их презентацию 7 антиген-презентирующими клетками [10, 11]. В результате этого формируется пул антиген-специфических Т- и В-лимфоцитов, которые воздействуют на опухолевые клетки, и теоретически должны вызывать элиминацию опухоли. Ранее в лаборатории генной терапии ИБГ РАН были разработаны генноклеточные вакцины, на основе клеточных линий меланомы человека модифицированных с использованием генов tag7 и/или GM-CSF, экспрессирующие в том числе и РТ-антигены [9, 12-15]. Проведены клинические испытания данных вакцин для терапии и профилактики метастазирования меланом и рака почки [15, 16]. Потенциально данный подход может быть применим и для других видов рака. Например, для рака молочной железы (РМЖ), который является самым распространённым онкологическим заболеванием среди женщин [17]. Разработка иммунотерапевтических подходов, направленных на РТ-антигены, является важной и актуальной задачей на пути борьбы за снижение смертности от злокачественных новообразований вообще и рака молочной железы в частности. Перспектива внедрения в практическое использование методов активной специфической иммунопрофилактики и иммунотерапии злокачественных новообразований, в том числе и генно-клеточных противоопухолевых вакцин, разработанных в ИБГ РАН, делает особо актуальным вопрос о рациональной селекции пациентов-участников клинических испытаний с учётом сведений о профиле экспрессии раково-тестикулярных генов в опухолях пациентов и его пересечении с таковым в составе терапевтических вакцин. В связи с этим встаёт вопрос о разработке валидированного и одобренного уполномоченными государственными органами инструментария для оценки экспрессии раковотестикулярных генов в опухолевых образцах. Наличие валидированной системы оценки уровня экспрессии РТ-генов обеспечивает не только обоснованность подбора пациентов для иммунотерапии опухолей, но и возможность истинных иммуно-профилактических подходов в случае потенциально злокачественных заболеваний. В настоящее время известна вакцина «Гардасил» для профилактики распространения рака шейки матки, вызванного вирусом папилломы человека [18-20]. Однако данная вакцина не является в чистом виде «раково-профилактической», а её эффект на снижение 8 заболеваемости опосредован через предотвращение появления этиологического фактора – вирусной инфекции. Профилактических вакцин, индуцирующих специфический иммунный ответ против именно раковых антигенов/клеток в настоящее время нет в практическом использовании. Таким образом, изучение фундаментальных основ специфической иммунопрофилактики опухолей на ранних стадиях её развития остаётся по-прежнему важной и актуальной задачей. Гипотеза данного исследования состоит в том, что предраковые заболевания, с большей вероятностью прогрессирующие в злокачественные, будут отличаться по наличию и характеру генетических и молекулярных нарушений от тех предраковых заболеваний, которые не будут прогрессировать. Такие отличия могут стать молекулярными маркерами, которые помогут разработать наиболее оптимальную стратегию лечения и профилактики. На примере плоскоклеточного рака слизистой оболочки ротовой полости (СОПР) известно, что существуют трудности в дифференциальной диагностике плоскоклеточного рака СОПР и предраковых заболеваний [21, 22]. Почти половина плоскоклеточных карцином полости рта развивается из потенциально злокачественных образований. Самым распространённым потенциально злокачественным заболеванием полости рта является лейкоплакия. Особенности экспрессии РТ-генов в лейкоплакии практически неизвестны. Возможно, появление мРНК РТ-генов или их продуктов, РТ-антигенов, в патологически изменённых тканях слизистой оболочки полости рта является показателем повышенного риска злокачественной трансформации. Цели и задачи работы В связи с вышеизложенным, целью нашей работы было изучение экспрессии РТ-генов в образцах опухолей, потенциально злокачественных заболеваний и нормальных тканей в рамках разработки метода диагностики и рационального выбора пациентов-участников клинических испытаний генно-терапевтических противоопухолевых вакцин Для достижения экспериментальные задачи: указанной цели были поставлены следующие 9 1) Разработать и валидировать набор реагентов для молекулярно-генетической диагностики РТ-антигенов методом ПЦР 2) Сопоставить профиль экспрессии РТ-генов в образцах рака молочной железы и нормальной ткани молочной железы с набором РТ-генов в генноклеточных противоопухолевых вакцинах «Компливак» и «Аллоген» 3) Изучить экспрессию РТ-генов в образцах нормальной ткани и плоскоклеточного рака слизистой оболочки полости рта 4) Изучить экспрессию РТ-генов в образцах лейкоплакии слизистой оболочки полости рта. Научная новизна, теоретическая и практическая значимость работы В ходе диссертационной работы Скородумовой Л.О. было выявлено, что в нормальной ткани и в лейкоплакиях слизистой оболочки полости рта с низким риском злокачественной трансформации не экспрессируются раково- тестикулярные гены MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12 и NY-ESO-1. При этом вышеперечисленные раково-тестикулярные гены экспрессируются с высокой частотой в плоскоклеточном раке слизистой оболочки полости рта. Полученные результаты дают основание использовать экспрессию раковотестикулярных генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12 и NY-ESO-1 для подтверждающей дифференциальной диагностики нормальной ткани и лейкоплакии от плоскоклеточного рака слизистой оболочки полости рта. В результате выполнения диссертационной работы было показано, что экспрессия раково-тестикулярных генов, входящих в состав набора «РТ-антиген», может служить критерием отбора пациентов для участия в клинических испытаниях генно-клеточных противоопухолевых вакцин, разработанных в ИБГ РАН. Практическая значимость работы была подтверждена в ходе официальных медицинских испытаний разрабатываемого набора в трёх независимых клинических учреждениях: РОНЦ им. Н.Н. Блохина РАМН, ФГУ «ФНКЦ ДГОИ» Росздрава, ГОУ ДПО РМАПО. Апробированный набор прошёл регистрацию в 10 Федеральной службе по надзору в сфере здравоохранения и социального развития «Набор реагентов для молекулярно-генетической диагностики раково- тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)» номер регистрационного удостоверения ФСР 2010/09180 от 9 ноября 2010 года. Таким образом, результаты представленной диссертационной работы обладают не только научной новизной, но и несомненной практической значимостью как для обеспечения дальнейших научных исследований и проведения клинических испытаний новых вариантов генно-клеточных вакцин, разработанных в ИБГ РАН, так и для текущего проведения дифференциальной диагностики атипичной пролиферации СОПР, а в будущем для расширения потенциального спектра применения этих вакцин для отличных от меланомы видов злокачественных опухолей. Положения, выносимые на защиту 1. Анализ экспрессии выбранного набора РТ-генов может применяться для рациональной селекции пациентов при включении в клинические испытания генно-клеточных противоопухолевых вакцинах «Компливак» и «Аллоген» для различных гистологических типах опухолей. 2. Экспрессия раково-тестикулярных генов может быть использована для дифференциальной подтверждающей диагностики нормальной ткани и лейкоплакии с низким риском злокачественной трансформации от плоскоклеточного рака слизистой оболочки полости рта. Личный вклад соискателя Диссертационная работа основана на собственных данных, полученных в период 2009-2014 гг. Вся экспериментальная работа по изучению экспрессии генов раково-тестикулярных антигенов, анализу и обработке результатов выполнены автором самостоятельно. Скородумова Л.О. является автором и соавтором 11 материалов регистрационного досье набора реагентов «РТ-антиген», использованного в ходе её научных исследований: «Лабораторного регламента на производство набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТантиген)», «Опытно-промышленный регламента на производство набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)», нормативного документа «Набор реагентов для молекулярно-генетической диагностики раково- тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген) (Технические условия)», «Инструкции по применению набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)». Скородумова Л.О. являлась ключевым исполнителем со стороны ИБГ РАН при проведении технических и медицинских испытаний набора «РТ-антиген». Автором были сформулированы основные положения диссертации, составляющие её новизну и практическую значимость, а также подготовлены материалы публикаций в научных журналах. Ключевая роль в проведении исследования и интерпретации результатов подтверждается первой позицией Л.О. Скородумовой в авторских коллективах, опубликованных по теме диссертации работ. Имена соавторов указаны в соответствующих публикациях. Предварительные работы по дизайну праймеров к раково-тестикулярным генам был проведены Шепелевым М.В. Свежие и консервированные образцы потенциально злокачественных, злокачественных и нормальных тканей были получены в ходе сотрудничества с к.м.н. Мураевым А.А., к.м.н. Задеренко И.А., к.м.н. Тихоновой О.А. 12 Методология и методы работы Работа Скородумовой Л.О. выполнена на высоком методическом уровне с использованием современного оборудования и методов молекулярной биологии, в том числе полимеразной методов цепной молекулярного реакции и клонирования, полного цикла различных работ вариаций по выполнению полнотранскриптомного секвенирования и биоинформатической обработке его результатов. Степень достоверности и апробация результатов Цель, поставленная в работе, достигнута, решены все исследовательские задачи. Все представленные в диссертационной работе результаты в полном объёме отражены в публикациях журналов, входящих в «Перечень ведущих рецензируемых научных журналов и изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание учёной степени доктора и кандидата наук» («Вопросы онкологии», «Доклады академии наук») и доложены на российской и международных конференциях. Публикации в научных журналах: 1. Скородумов Л.О., Мураев А.А., Володина Е.В., Иванов С.Ю., Гнучев Н.В., Георгиев Г.П., Ларин С.С. Молекулярные маркеры риска злокачественной трансформации лейкоплакии слизистой оболочки полости рта // Вопросы онкологии. – 2012. – Т.58.- №3. – Стр. 327-332. 2. Скородумова Л.О., Мураев А.А., Захарова Е.С., Шепелев М.В., Коробко И.В., Задеренко И.А., Иванов С.Ю., Гнучев Н.В., Георгиев Г.П., Ларин С.С. Изучение экспрессии раково-тестикулярных генов в образцах лейкоплакии и плоскоклеточного рака слизистой оболочки полости рта // Вопросы онкологии. – 2012. – Т.58.- №4. – Стр. 486-492. 13 3. Скородумова Л.О., Мураев А.А., Володина Е.В., Иванов С.Ю., Гнучев Н.В., Георгиев Г.П., Ларин С.С. Лейкоплакия слизистой оболочки полости рта: классификация, гистопатология, методы диагностики и лечения // Вопросы онкологии. – 2013.- №5. – Стр. 548-554. 4. Скородумова Л.О., Лукашина М.И., Сальникова Л.Е., Тихонова О.А., Иванов С.Ю., Ларин С.С. Исследование экспрессии раково-тестикулярных генов в образцах рака молочной железы // Доклады Академии наук. - 2013, №6, - Стр. 694–696. Материалы конференций: 1. Скородумова Л.О., Захарова Е.С., Мураев А.А., Иванов С.Ю., Задеренко И.А., Шепелев М.В., Коробко И.В., Ларин С.С. Изучение экспрессии раково-тестикулярных антигенов в образцах лейкоплакии и плоскоклеточного рака ротовой полости. Сборник трудов VII Всероссийской научно-практической конференции с международным участием «Молекулярная диагностика - 2010», г. Москва. 2. Скородумова Л.О., Лукашина М.И., Сальникова Л.Е., Тихонова О.А., Иванов С.Ю., Ларин С.С. «Исследование экспрессии раково- тестикулярных генов в образцах рака молочной железы» Зимняя школа «Современная биология и биотехнологии будущего 2014», 2014, Звенигород. 3. Скородумова Л.О. «Анализ статуса экспрессии раково-тестикулярных генов как мишеней для терапии и профилактики онкологических заболеваний» IX Симпозиум «Биологические основы терапии онкологических и гематологических заболеваний» II Международный симпозиум «Трансляционная и регенеративная медицина», 2015, Москва. 14 1. Обзор литературы. Раково-тестикулярные антигены как прогностические маркеры и мишени иммунотерапии опухолей 1.1. Генно-клеточные вакцины, разработанные в ИБГ РАН Одним из распространённых направлений разработки противоопухолевых препаратов является создание противоопухолевых терапевтических вакцин на основе генетически модифицированных опухолевых клеток. Впервые идея подхода была предложена в начале 90-х G. Dranoff [23]. Суть подхода состоит в получении линий трансформированных аутологичных или аллогенных опухолевых клеток, секретирующих после генетической модификации различные иммуноактиваторные цитокины или костимуляторные молекулы. При таком подходе онкобелки опухолевых клеток иммуноактиваторные являются молекулы, универсальным например, источником цитокины, антигенов, а экспрессирующиеся вследствие генетической модификации, выполняют иммуностимуляторную роль, являясь своеобразными адъювантами. Достоинством такого подхода являются наличие широкого спектра естественных опухолевых антигенов в препарате вакцины, содержащем полный набор белков опухолевой клетки, что в меньшей степени позволяет ускользать опухолям от иммунного надзора, а недостатком – необходимость наличия высокотехнологичного производства клеточных культур и квалифицированного персонала для работы на нем. Однако до сих пор идут дискуссии по выбору наиболее эффективного набора антигенов и адъюванта для противоопухолевой вакцинации. С учётом последних достижений в области молекулярной иммунологии, показавших необходимость активации врождённого иммунного ответа для развития эффективного приобретённого ответа, актуальным стало использование в качестве адъювантов для противоопухолевых вакцин молекул влияющих на активацию врождённого иммунного ответа [9]. Одной из таких молекул является белок Tag7/PGRP, ген которого ранее был клонирован в ИБГ РАН [24]. Оказалось, что tag7 генетически 15 модифицированные опухолевые клетки способны существенным образом защищать организм от формирования опухоли из исходных клеток и тормозить развитие уже сформированных опухолей из исходных клеточных линий. В ИБГ РАН был разработан и экспериментально реализован новый метод биотерапии злокачественных новообразований, основанный на применении аутологичных генетически модифицированных опухолевых клеток для индукции противоопухолевого иммунного ответа [25]. В результате совместной работы сотрудников Института биологии гена РАН и РОНЦ им Н.Н. Блохина РАМН, НИИ онкологии им. Н.Н. Петрова была разработана схема аутологичной противоопухолевой иммунотерапии, при которой опухолевые клетки пациента, полученные при биопсии или хирургической операции, культивировали in vitro, трансфицировали генетическими конструкциями, кодирующими иммунорегуляторные белки (Tag7 или GM-CSF), а затем облучали и вводили пациентам. Позднее на основе созданного в ходе работ банка клеточных линий меланомы и рака почки человека были разработаны препараты для аутологичной и аллогенной иммунотерапии рака: «Аллоген», «Мелавак» и ряд других [12, 14], которые прошли I/II фазы клинических испытаний. Была показана их безопасность и, в отдельных случаях, терапевтическая эффективность разрабатываемых подходов [15, 26]Применение генно-терапевтических вакцин уже на стадии I/II фаз испытаний привело к выраженным клиническим эффектам в 20% случаев больных с исчерпанными возможностями традиционного лечения [15]. К сожалению, процедура получения индивидуальных аутологичных опухолевых линий для вакцинации технически сложна и не всегда осуществима, к тому же плохо поддаётся масштабированию. В итоге это привело к ограниченности таких работ лишь рядом исследовательских центров с высокой квалификацией сотрудников. Для дальнейшего внедрения иммунотерапевтичесих подходов в практическое использование рациональным явился переход от схем с аутологичной вакцинацией к использованию аллогенных клеток в составе для стимуляции противоопухолевого ответа. В связи с этим актуальным стал вопрос об определении молекулярного или антигенного соответствия аллогенных клеток в составе иммунотерапевтических вакцин антигенному профилю опухолей 16 конкретных пациентов. В этом ключе наибольшее внимание исследователей всего мира сосредоточено на раково-тестикулярных антигенах, являющихся, с одной стороны, высоко-иммунногенными, а с другой, достаточно специфичными для опухолевых клеток. 1.2. Общая характеристика группы раково-тестикулярных антигенов Раково-тестикулярные антигены – это большая группа семейств антигенов, которые в норме экспрессируются преимущественно в зародышевых клетках человека и в трофобласте [1, 2]. Другой характерной чертой, определяющей принадлежность белка к группе РТ-антигенов, является наличие экспрессии в различных опухолях. Экспрессия РТ-антигенов и кодирующих их РТ-генов может служить биомаркером злокачественных новообразований. Кроме того, избирательная экспрессия РТ-антигенов в семенниках и мозге, которые являются иммунопривилегированными органами, делает эту группу антигенов привлекательными объектами для создания противоопухолевых вакцин. Пептиды РТ-антигенов, которые гистосовместимости презентируются молекулами главного комплекса (MHC – Major Histocompatibility Complex) I класса, теоретически и практически доступны для распознавания цитотоксическим лимфоцитам [27-29]. Далее рассматриваются основные положения, касающиеся всей группы РТантигенов и РТ-генов: история изучения, классификация, регуляция экспрессии, общий обзор функций и иммуногенные свойства. 1.2.1. История изучения и номенклатура раково-тестикулярных антигенов Раково-тестикулярные антигены были впервые обнаружены в 1991 году Тьерри Буном и его коллегами, которые использовали очень трудный и длительный метод клонирования эпитопов Т-клеток [30]. Первый успешно 17 клонированный опухолевый антиген был назван сначала MZ2-E, а затем MAGEA1. В ходе дальнейших исследований было обнаружено, что MAGE-A1 в нормальных тканях взрослого организма экспрессируется только в семенниках. С помощью метода клонирования эпитопов Т-клеток были открыты BAGE, GAGE1. Их экспрессия в норме также была ограничена семенниками. В 1995 году Pfreundschuh M. et al. предложили технологию клонирования опухолевых антигенов, распознающихся антителами сывороток больных опухолевыми заболеваниями – SEREX (serological expression cloning) [31]. С помощью технологии SEREX были обнаружены SSX-2, NY-ESO-1, SYCP-1. Эти антигены также экспрессировались исключительно в семенниках и опухолях. Для того чтобы объединить выявленные антигены со схожим паттерном экспрессии Chen Y.T. с соавторами, был предложен термин «раково-тестикулярные» [32]. В дальнейшем разработка RDA (representational difference analysis) [33], дифференциального дисплея (differential display), анализа кДНК-микрочипов (cDNA microarray analysis), SAGE (serial analysis of gene expression) и секвенирования EST (expressed sequence tag) способствовала поиску дополнительных продуктов генов с профилем экспрессии мРНК, ограниченным семенниками и опухолями. Накопленная информация позволила подсчитать, что РТ-антигены выявляются в 40% случаев опухолевых заболеваний. Открываемым РТ-антигенам присваивались названия, имеющие окончание «AGE», однако из-за бурного роста списка РТ-антигенов возникла задача разработки новой номенклатуры. Для этого было предложено использовать идентификационный номер, состоящий из букв CT («cancer-testis» – раковотестикулярный) и цифры. Присваиваемый номер обычно соответствовал хронологическому порядку открытия. Если в семействе несколько членов, то каждому из них присваивался номер через точку [34]. При этом название генов совпадает с названием антигенов. Например, первым открытым семейством РТантигенов стало семейство MAGE-A, которое впоследствии получило идентификационный номер CT1, а первый открытый антиген MAGE-A1 – CT1.1. Вторым обнаруженным семейством РТ-антигенов стало семейство BAGE (CT2), третьим – MAGE-B (CT3), четвертым – GAGE (CT4), пятым – SSX (synovial sarcoma X) (CT5). Шестое семейство включает в себя гены LAGE1a, LAGE1b и NY- 18 ESO-1 (CT6), седьмое – MAGE-C (CT7). Эти 7 семейств РТ-антигенов на сегодняшний день являются наиболее изученными. Всего обнаружено 276 РТантигенов, которые объединены в 138 семейств, и все время открываются новые антигены. Для упорядочивания огромного потока информации, касающейся РТантигенов и РТ-генов, была создана электронная база данных – CTDatabase [35]. 1.2.2. Классификация раково-тестикулярных антигенов В группу РТ-антигенов входят белки с разным строением, объединяемые лишь схожим паттерном экспрессии. Гомология в строении наблюдается только внутри семейств между их членами. Принято классифицировать РТ-антигены по расположению генов, их кодирующих, в геноме. Так выделяют РТ-гены, расположенные на Х-хромосоме – CT-X (cancer-testis Х) гены (например, MAGE-A, MAGE-B, MAGE-C, LAGE, NY-ESO-1, GAGE, SSX). РТ-гены, расположенные на других хромосомах называются non-X CT гены (например, BAGE, ACRBP, ADAM2, AKAP3, BORIS, SPO11, SYCP1). Из 276 РТ генов 129 локализованы на Ххромосоме, а на Y-хромосоме расположены 9 генов, принадлежащих одному семейству TSPY. По результатам исследования экспрессии 153 РТ-генов, проведенного Hoffman O. с соавторами [1], была предложена другая классификация, подразделяющая РТ-гены на 3 группы, в зависимости от того, в каких органах регистрируется их экспрессия: тестикулярно-ограниченные; тестикулярно-энцефалитно ограниченные; тестикулярно-селективные. К группе тестикулярно-ограниченных РТ-генов отнесли 39 генов, которые экспрессируются только в семенниках и больше ни в какой другой нормальной зрелой ткани, кроме плаценты (например, MAGE-A1, MAGE-B1, LAGE1a). К группе тестикулярно-энцефалитно ограниченных РТ-генов отнесли 14 генов, мРНК которых обнаруживается помимо семенников в другом иммунопривилегированном органе – мозге (например, GAGE1, MAGE-A9, MAGE-C2). Группа тестикулярноселективных РТ-генов объединила 85 генов, которые, помимо семенников, 19 яичников, мозга, плаценты, экспрессировались в некоторых других органах, например, в поджелудочной железе, печени, почках, молочной железе, легких (MAGE-A3, -A4, -A6, -A11, -A12, BAGE, NY-ESO-1). Была выявлена интересная закономерность, связывающая паттерн экспрессии РТ-генов с их локализацией в хромосомах. Большинство non-Х СТ генов являются тестикулярно-селективными, в то время как большинство СТ-Х генов являются тестикулярно-ограниченными или тестикулярно-энцефалитно ограниченными [1]. 1.2.3. Регуляция экспрессии раково-тестикулярных-антигенов Экспрессия раково-тестикулярных антигенов и генов носит яркий тканеспецифический характер, что указывает на наличие сложных эпигенетических механизмов реализации генетического материала. Для того чтобы понимать, почему в одной опухоли экспрессируются РТ-гены, а в другой — нет, необходимо, во-первых, знать, какими механизмами регулируется экспрессия генов в данной опухоли, а во-вторых, знать, с какими другими молекулярными процессами связана работа этих механизмов. Не менее актуальным является исследование механизмов регуляции трансляции мРНК, кодирующих РТ-антигены. Знание закономерностей, которые определяют, будет ли в клетке синтезирован белок или нет, исключительно важно как для диагностических целей, так и для целей иммунотерапии. В настоящее время известно, что процесс метилирования отвечает за эктопическую депрессию РТ-генов. При использовании деметилирующих агентов, таких как 5-аза-2-дезоксицитидин, экспрессия РТ-генов в культурах опухолевых клеток усиливается. 5-аза-2-дезоксицитидин захватывает ДНК-метилтрансферазы в комплекс с ДНК, что ведет к потере метильных групп на ДНК и разрушению транскрипционного блока. Такая зависимость наблюдается для MAGE-1, -2, -3, and -6, CTAG2, SSX-2, CAGE, NY-ESO-1 [36, 37]. Дело в том, что два главных элемента промотора генов MAGE-A имеют сайты связывания Ets, которые содержат CpG динуклеотиды. Эти CpG динуклеотиды деметилированы в тех культурах опухолевых клеток, которые экспрессируют гены MAGE-A [38, 39]. 20 Экспрессия генов определяется не только метилированием промотора, но и конфигурацией хроматина [40]. Ацетилтрансферазы и деацетилазы гистонов участвуют в посттранскрипционных модификациях, приводящих к ремоделированию хроматина. Деацетилазы гистонов в одиночку или в сочетании с 5-аза-2-дезоксицитидином также могут индуцировать экспрессию РТ-генов, включая членов семейств MAGE, SSX, NY-ESO-1. Однако при детальном исследовании этих механизмов оказалось, что для индукции и репрессии экспрессии разных ацетилирование РТ-генов гистонов и имеют антигенов разную метилирование значимость. промоторов При и исследовании иммортализированных мезенхимальных стволовых клеток было обнаружено, что для экспрессии GAGE деметилирование промоторов необходимо, но его недостаточно [37]. Для экспрессии генов и белков GAGE необходимо ацетилирование гистонов. Экспрессия белков MAGE не была обусловлена степенью метилирования проксимальных промоторов генов MAGE-A. В другой работе было выяснено, что для экспрессии генов LAGE-1 и NY-ESO-1 в опухолевых стволовых клетках необходимым условием является деметилирование промоторов, а ацетилирование гистонов увеличивает уровень экспрессии незначительно [41]. То есть ингибиторы деацетилаз гистонов и репрессоры ДНКметилтрансфераз являются потенциальными препаратами для терапии опухолей, экспрессирующих РТ-гены [39]. При поиске внутриклеточных агентов, контролирующих степень метилирования промоторов MAGE-A, MAGE-B, MAGE-C было обнаружено, что метилирование зависит от экспрессии KIT-тирозинкиназы [42]. К сожалению, работ, исследующих подобные ключевые механизмы, очень мало. Интересно, что один из РТ-генов – BORIS (Brother of the Regulator of Imprinted Sites) является паралогом CTCF (CCCTC-binding factor) у млекопитающих с такими же центральными 11-тью цинковыми пальцами, которые опосредуют его взаимодействие с сайтами-мишенями размером около 50 пар нуклеотидов. Так как CTCF активен во всех соматических клетках, только в клетках взрослых самцов, дефицитных по CTCF и 5-метилцитозину, BORIS может замещать CTCF в выполнении его функций. Промоторы РТ-генов активируются во время сперматогенеза при деметилировании в BORIS-позитивных зародышевых 21 клетках и при дерепрессировании в разных опухолях. BORIS в определенных условиях активирует РТ-гены в нормальных фибробластах. То есть существует и независимый от гипометилирования путь дерепрессирования РТ-генов через CTCF/BORIS механизм [39]. Обобщая вышеизложенное, к настоящему времени выявлены следующие механизмы, регулирующие экспрессию РТ-генов: метилирование промоторов генов и ацетилирование гистонов. Индукция экспрессии РТ-генов в опухолевых клетках связана с глобальным деметилированием, но оно не может объяснить все особенности экспрессии РТ-генов, которые наблюдаются в разных типах опухолей. Несмотря на то, что успех применения иммунотерапии зависит от наличия белкамишени в опухолевых клетках, механизмы регуляции трансляции РТ-антигенов пока изучены слабо. Скорее всего, она определяется интенсивностью экспрессии на уровне мРНК. 1.2.4. Функции раково-тестикулярных-антигенов Функциональный анализ экспрессии РТ-генов в процессе гаметогенеза может дать ключ к разгадке их возможной роли в опухолях. Экспрессия РТ-генов ограничена сперматогенными клетками, тогда как другие клетки семенника (Сертоли, Лейдига) не экспрессируют РТ-гены. Причем экспрессия каждого из генов сопряжена с разными стадиями сперматогенеза. Можно предположить, что их функция многогранна, начиная от регуляции циклов митоза в сперматогониях, мейоза в сперматоцитах и заканчивая созреванием спермия. Для NY-ESO-1, MAGE-A3, -A4, -A8-11, некоторых представителей XAGE, BAGE описана экспрессия в плаценте. Gjerstorff M. F. с коллегами обнаружили, что небольшое количество ооцитов в примордиальных покоящихся фолликулах и созревающих фолликулах экспрессирует GAGE [43]. Экспрессия GAGE также обнаруживается на протяжении всего фетального периода и продолжается до полового созревания, в отличие от MAGE-A1, NY-ESO-1, экспрессия которых происходит только в быстро пролиферирующих зародышевых клетках [44]. Возможно, экспрессия РТ- 22 антигенов в опухолевой клетке придает им свойства, характерные для зародышевых клеток и способствующие их выживанию. Функции белков, гены которых расположены на Х-хромосоме, остаются наименее понятными и наиболее противоречивыми. Гены РТ-антигенов с известной функцией чаще всего локализованы не на Х-хромосоме. Из 224 генов функции известны для 89 генов (по данным CTDatabase) [35]. При этом из них на Х-хромосоме располагаются 30 генов (AKAP4, ARX, CXorf48, IL13RA2, MAGEA2-12, MAGE-B1-6, MAGE-C1-3, NXF2, PLAC1, TAF7L, TEX101, TFDP3, ZNF645). Известные функции РТ-антигенов можно разделить на три группы в зависимости от того, на каких хромосомах расположены их гены. Только на аутосомах расположены РТ-гены белков, играющих роль в оплодотворении, обеспечении энергетических процессов в иммунопривилегированных органах (семенниках, роговице глаза), митозе (сборка веретена деления, образование метафазной пластинки, сегрегация хромосом), цитокинезе, рекомбинации хромосом, моторные белки ворсинок, жгутиков, клеток и т.д. Только на Ххромосоме расположены гены, кодирующие белки, участвующие в процессах убиквитинилирования, развития плаценты, транспорта РНК, образования рецепторного комплекса интерлейкина и т.д. Как на Х-хромосоме, так и на аутосомах могут быть расположены РТ-гены, продукты которых участвуют в процессах спермиогенеза (образования акросомы, особых элементов цитоскелета и жгутика), регуляции транскрипции генов, регуляции пролиферации и апоптоза клеток и т.д. Таким образом, нельзя сказать, что функция РТ-антигенов совершенно неизвестна, но все же для многих давно известных антигенов она остается неустановленной или противоречивой. В первую очередь это относится к РТантигенам, которые кодируются генами, расположенными на Х-хромосоме: MAGE, BAGE, GAGE, LAGE, NY-ESO-1. 23 1.2.5. Раково-тестикулярные антигены как мишени для иммунотерапии Раково-тестикулярные антигены, для которых разрабатываются методы иммунотерапии (семейства MAGE-A и NY-ESO-1), экспрессируются в зародышевых клетках семенников и преимущественно не экспрессируются в нормальных зрелых тканях, но часто присутствуют в опухолях. Семенники являются иммунопривилегированным органом, поэтому к РТ-антигенам отсутствует толерантность и может быть индуцирован достаточно сильный иммунный ответ. С другой стороны, формирование иммунного ответа на эти белки не должно сопровождаться сильными аутоиммунными реакциями. Это подтверждается успешными испытаниями на безопасность вакцин против РТантигенов [45, 46]. Для преодоления состояния иммуносупрессии и достижения выраженного клинического ответа существует возможность сочетания терапии, направленной против РТ-антигенов, с анти-CTLA-4-терапией (Cytotoxic TLymphocyte Antigen 4) [47]. РТ-антигены являются внутриклеточными белками, поэтому иммунотерапия в основном направлена на формирование клеточного иммунитета с помощью вакцин, а не на использование пассивной терапии, основанной на антителах. В последнее время появилось альтернативное направление терапии опухолей через воздействие на РТ-антигены. Было установлено, что MAGE-C2 связывается белком KAP1 (Krüppel-associated protein 1), что приводит к репрессии p53. Ингибировать экспрессию MAGE можно с помощью РНК-интерференции. Это восстанавливает активность p53 и подавляет рост опухоли. Однако существовали трудности с доставкой малых интеферирующих РНК в ткани. Bhatia N. et al. были изолированы малые молекулы, которые могут ингибировать взаимодействие KAP1 и MAGE-C2 в клетках меланомы [48]. Авторы надеются, что найденные ими молекулы могут быть использованы для создания нового терапевтического подхода для пациентов с меланомами. Суммируя вышеизложенное, методы иммунотерапии наиболее интенсивно разрабатываются против РТ-антигенов семейств MAGE-A и NY-ESO-1, экспрессия 24 которых изучалась в ходе данной работы, поэтому более подробно они будут описаны в соответствующих разделах литературного обзора (1.3.1.3. и 1.3.4.3.). 1.3. Характеристика отдельных групп раково-тестикулярных антигенов 1.3.1. Раково-тестикулярные гены и антигены семейства MAGE-A 1.3.1.1. Номенклатура семейства MAGE Название группы семейств MAGE расшифровывается как Melanoma Associated Gene – гены, ассоциированные с меланомой (англ.). Антиген MAGE-A1, принадлежащий семейству MAGE-A, был обнаружен первым из всех РТ- антигенов. Было установлено, что ген MAGE-A1 расположен на Х-хромосоме в локусе q28. Оказалось, что в локусе Xq28 существует целый кластер из 12 генов, высоко гомологичных гену MAGE-A1. Они были объединены в семейство MAGEA [49]. Все кодирующие белки последовательности лежат в последних экзонах. У 11 представителей семейства кодирующие последовательности на 68-85% идентичны MAGE-A1. Гены различаются промоторами и первыми экзонами, что свидетельствует о том, что различные транскрипционные факторы запускают разные гены этого семейства, а функции белков сходные. Было выяснено, что антигены семейства MAGE-A экспрессируются исключительно в зародышевых клетках (семенниках) и в ряде опухолей. Поиск генов, ответственных за фенотип sex-reversal, привел к обнаружению второго кластера генов MAGE, MAGE-B, которые расположены в локусе Xp21.3 [50]. Вся кодирующая белок последовательность нуклеотидов генов семейства MAGE-B расположена в одном последнем экзоне, а аминокислотная последовательность белков этого семейства совпадает на 50-68%. Промоторы и первые экзоны генов семейства MAGE-В различаются, что напоминает устройство генов семейства MAGE-A. Третий кластер, MAGE-C, был обнаружен в локусе Xq26-27 [51, 52]. Было установлено, что профиль экспрессии генов, принадлежащих к семействам MAGE-A, MAGE-B, MAGE-C, сходный. Три гена, составляющих неблизкородственный четвертый 25 кластер MAGE-D, как оказалось, экспрессируются во многих нормальных тканях [53-55]. Дополнительные семейства MAGE генов с таким повсеместным паттерном экспрессии, MAGE-E – MAGE-L [56], были обнаружены с помощью скрининга баз данных. При сравнении последовательностей всех MAGE белков был выявлен общий для всех MAGE белков домен, состоящий из 200 аминокислотных остатков, который был назван MHD (MAGE homology domain) [57]. Все остальные последовательности MAGE белков варьируют между семействами. Так как все семейства MAGE объединяет общий домен MHD, но они имеют и совершенно разный паттерн экспрессии, гены MAGE были разделены на два класса [58]. I класс включает в себя семейства MAGE-A, MAGE-B, MAGE-C, которые характеризуются экспрессией в зародышевых клетках и опухолях и считаются РТгенами. II класс включает в себя все остальные семейства MAGE-D – MAGE-L, и представителям этих семейств свойственна экспрессия во всех тканях организма, поэтому они не принадлежат к РТ-генам. 1.3.1.2. Экспрессия генов и антигенов семейства MAGE-A в нормальных тканях и в опухолях К тестикулярно-ограниченным РТ-генам относятся MAGE-A5, -A8, -A9, -A10, -A12. Все остальные РТ-гены семейства MAGE –A относятся к тестикулярноселективным. Если учитывать экспрессию соответствующих белков, то к РТ- антигенам, присутствующим только в иммунопривилегированных органах и плаценте, могут быть отнесены также MAGE-A1, -2, -A3, -A6 [49]. Белок MAGEA4 экспрессируется также в ткани вагины [59], белок MAGE-A11 – в эндометрии [60]. На уровне мРНК была обнаружена экспрессия MAGE-A2, -A3, -A4, -A6, -A10 в фетальных кератиноцитах и кератиноцитах взрослых [61]. Гены семейства MAGE-A часто экспрессируются в фетальных тканях: в фетальных семенниках – MAGE-A1 [44], -A4 [62]; яичнике – MAGE-A1 [44], -A3 [63], -A4 [64]; MAGE-A4 в фетальных надпочечниках [59]; MAGE-A1 в фетальном позвоночнике и нейронах [65], MAGE-A2 [66], -A6 [67] в зародышевых стволовых клетках. Ген MAGE-A1 экспрессируется в яичнике [68], поджелудочной железе [2], красном костном 26 мозге, мезенхимальных стволовых клетках [65]; мРНК MAGE-A4 была детектирована в мышцах [69]. Экспрессия генов и антигенов семейства MAGE-A в опухолях исследована наиболее полно по сравнению со всеми остальными РТ-генами и РТ-антигенами. Их экспрессия как на уровне мРНК, так и на уровне белка была детектирована в гематологических заболеваниях, меланомах, плоскоклеточном раке головы и шеи, злокачественных новообразованиях гортани, пищевода, желудка, легких, молочной железы, яичника, мочевого пузыря. Меньше исследована экспрессия MAGE-A генов и антигенов в опухолях кишечника и почки, саркомах. Результаты оценки экспрессии какого-либо MAGE-A антигена в определенном виде опухоли могут сильно варьироваться в разных исследованиях. С точки зрения разработки методов уточняющей диагностики опухолевых заболеваний, наиболее интересными являются исследования, в которых была обнаружена корреляция между клиникопатологическими характеристиками и экспрессией гена или антигена MAGE-A. Например, гены MAGE-A3, -A4 чаще экспрессируются в метастатической, чем в первичной меланоме кожи, экспрессия MAGE-A3 коррелирует с большей толщиной первичного очага, что является плохим прогностическим признаком [70]. MAGE-A4 чаще экспрессируется в изъязвленных меланомах, меланомах с толщиной 1.1-4 мм. Экспрессия MAGE-A4 ассоциируется с прогрессивной стадией заболевания [71]. В раке мочевого пузыря экспрессия MAGE-A4 коррелирует с прогрессией неинвазивного рака в рак с инвазией в мышечную ткань [72]. При исследовании колоректального рака была обнаружена ассоциация между экспрессией MAGE-A4 и эмболами сосудов, которые, в свою очередь, являются маркером метастазов [73]. При немелкоклеточном раке легких экспрессия MAGE-A4 ассоциировалась с меньшей выживаемостью при продвинутых стадиях (III+IV) [74]. Экспрессия MAGE-A3, A4, -A6, A12 в аспиратах красного костного мозга у пациентов с операбельным немелкоклеточным раком легкого без отдаленных метастазов является маркером плохого прогноза [75]. У пациентов с аденокарциномой легкого экспрессия MAGEA3 ассоциировалась с меньшей выживаемостью [76]. У пациентов с плоскоклеточным раком легких экспрессия антигенов MAGE-A3, MAGE-A4 коррелировала с наличием некроза [77]. 27 Таким образом, экспрессия MAGE-A генов и антигенов коррелирует с различными клиникопатологическими характеристиками, но практически всегда это факторы, связанные с неблагоприятным прогнозом 1.3.1.3. Иммунногенность раково-тестикулярных антигенов семейства MAGE-A Антигены семейства MAGE-A являются важной мишенью для разработки вакцин против опухолей. Для каждого из антигенов были идентифицированы антигенные пептиды. Вначале именно пептиды использовались в качестве иммуногенов при приготовлении вакцин. Однако в разных опухолях экспрессия различных членов семейства MAGE-A варьируется, поэтому были выделены эпитопы, общие для всех антигенов семейства MAGE-A. Поэтому вакцину можно использовать для широкого спектра опухолевых антигенов. Graff-Dubois S. et al. описали высокоаффинный гетероклитический пептид (p248V9), который распознавался цитотоксическими Т-лимфоцитами, в HLA-A*0201 трансгенных мышах [78]. Эти же CD8+ Т-клетки были способны распознавать два низкоаффинных пептида, имеющихся в MAGE-A2, -A3, -A4, -A6, -A10, and -A12 (p248G9) и MAGE-A1 (p248D9). Позднее в качестве иммуногенов стали использоваться рекомбинантные пептиды с различными иммуностимулирующими адъювантами, для того чтобы стимулировать формирование интегрированного (CD4+ и CD8+) иммунного ответа на большее число эпитопов. В настоящее время проходят испытания вакцины против немелкоклеточного рака легких, включающей в себя рекомбинантный MAGE-A3 белок и смесь адъювантов AS15 [79]. Фаза II испытаний этой вакцины проходила с участием пациентов с полной резекцией опухолевой массы немелкоклеточного рака легких в стадии I или IIB [80, 81]. Иммуностимуляторная смесь AS02B содержала собственный адъювант Glaxo Smith Klein, монофосфорил липид А с QS-21, сложной липидной смесью (лицензирована компанией Antigenics). Результаты этих испытаний были впечатляющими: у пациентов, прошедших курс инъекций вакцины MAGE-A3, рецидивы заболевания случались приблизительно в три раза реже, чем в группе пациентов, не получавших иммунотерапии. В связи с этим в 2007 году была начата самая крупная в истории активной иммунотерапии фаза III испытаний этой вакцины – MAGRIT [82]. В ней 28 участвуют 2270 пациентов из 400 центров, расположенных в 33 странах по всему миру (Европа, Северная и Южная Америка, Азия и Австралия), с немелкоклеточным раком легких IB, II или IIIA стадий. В этом испытании около половины пациентов получали химиотерапию. Изменился и состав адъюванта: в нее был добавлен CpG олигонуклеотид (агонист Toll-like рецептора 9, «Coley Pharmaceuticals Group»). В этом испытании будут оценены выживаемость без заболевания после завершения лечения и биомаркеры, с помощью которых можно предсказать возможность благоприятного ответа на MAGE-A3 вакцину. Эти испытания также являются прекрасной иллюстрацией того, что иммунотерапия наиболее эффективна у пациентов с минимальной остаточной болезнью. База данных клинических испытаний http://www.cancer.gov/clinicaltrials в настоящее время содержит информацию о большом числе испытаний вакцин, направленных на образование иммунного ответа против MAGE-A антигенов, они кратко освящены в обзоре [27]. Экспрессия MAGE-A антигенов наблюдается только в части опухолевых клеток. Использование вакцины для борьбы с такими опухолями может привести к селекции тех клеток, в которых не экспрессируются MAGE-A антигены. В многочисленных исследованиях на клеточных линиях различных опухолей было показано, что экспрессия MAGE-A антигенов стимулируется под действием деметилирующих агентов и ингибиторов деацетилаз. Результаты этих исследований инициировали проведение испытаний вакцин против MAGE-A антигенов в сочетании с деметилирующими агентами (в некоторых случаях и с ингибиторами деацетилаз). Например, в исследовании Goodyear O. et al. было оценено действие азацитидина и вальпроата натрия на иммунный ответ против MAGE-A антигенов у пациентов с миелоидной лейкемией и миелодисплазией [83]. Эпигенетическая терапия привела к тому, что у половины испытуемых сформировался CD8+ Т-клеточный ответ на MAGE-A антигены. В группе пациентов, развивших ответ на MAGE-A антигены (n=11), 8 достигли объективного клинического ответа, а 4 из них – полного ответа. Наличие MAGE-Aспецифического CD8+ Т-клеточного ответа значимо ассоциировалось с повышенной вероятностью достижения клинического ответа. В исследовании Cruz C.R. et al. в качестве деметилирующего агента использовался децитабин [84]. 29 Выделенные от пациентов с рецидивирующими Ходжкинскими лимфомами, ассоциированными с EBV (Epstein-Barr virus), Т-лимфоциты были иммунизированы синтетическими пептидами MAGE-A4, не рестрикцированными по каким-то отдельным HLA аллелям, а общими для многих аллелей. Затем эти лимфоциты вводились обратно пациентам. У пациентов, которые получали децитабин, противоопухолевый ответ был более выражен, чем у пациентов контрольной группы (без использования деметилирующего агента). Из приведенных исследований следует, что противоопухолевое действие РТантиген-специфической иммунотерапии может быть значительно усилено при комбинировании с эпигенетической терапией [85]. Наряду с развитием активной иммунотерапии совершенствуются и методы адоптивной иммунотерапии опухолей, экспрессирующих MAGE-A антигены, например, генная терапия, основанная на Т-клеточных рецепторах, против MAGEA и MAGE-C2 антигенов [86, 87]. Так как для генов и антигенов MAGE-A была выявлена ассоциация с важными прогностическими факторами, то они являются перспективными мишенями для разработки диагностических методов. А также на основании успешных испытаний вакцин их можно считать перспективной группой для развития иммунотерапевтических методов. 1.3.2. Раково-тестикулярные гены и антигены семейства BAGE 1.3.2.1. Номенклатура семейства BAGE Первый ген семейства BAGE был обнаружен с помощью клонирования эпитопов Т-лимфоцитов, распознававших антигены клеток линии меланомы MZ2MEL [88]. Ген BAGE-1a расположен в локусе p11.1 хромосомы 21. Затем были обнаружены другие гены, последовательность которых совпадала на 92-99% с последовательностью гена BAGE-1. Было выяснено, что они располагаются в юкстацентромерных участках (<1x106 п.н.) на хромосомах 13 и 21. На 9, 13, 18, 21 хромосомах были обнаружены нетранслируемые фрагменты последовательности гена BAGE [89]. Новые гены семейства BAGE получили названия BAGE2, BAGE3, BAGE5. При транскрипции гена BAGE-1 образуется 6 сплайс-вариантов a-f. Все 30 гены семейства BAGE экспрессировались только в семенниках и опухолях, то есть имели паттерн экспрессии типичных РТ-генов. Было исследовано происхождение генов BAGE [90]. ДНК фрагмент длиной 84 п.н. из филогенетического участка 7q36 был дуплицирован в юкстацентромерный участок или 13 или 21 хромосомы. Этот дуплицированный участок содержал фрагмент гена MLL3 (Mixed-Lineage Leukemia 3), который после юкстацентромерного перемещения сформировал генпредшественник BAGE. Ген-предшественник BAGE дал начало большому количеству независимых генов через последовательные циклы внутри- и межхромосомных дупликаций. Было выяснено, что гены BAGE находятся под селективным давлением, поэтому соответствующие белки должны иметь функцию. Однако пока функция белков BAGE неизвестна. 1.3.2.2. Экспрессия генов и антигенов семейства BAGE в нормальных тканях и в опухолях Наличие мРНК BAGE детектировалось в семенниках, но кроме того в плаценте, селезенке и яичнике [91], поэтому ген BAGE относится к группе тестикулярно-селективных РТ-генов. Антител к белку BAGE не существует, поэтому неизвестно, насколько транскрипция гена коррелирует с трансляцией. В метастатических меланомах BAGE экспрессировался чаще (15-26%), чем в первичных опухолях (8%) [88, 89]. При одновременном исследовании экспрессии генов BAGE2, BAGE3 и BAGE5 в меланоме оказалось, что они вместе экспрессируются чаще (35%), чем BAGE1 в одиночку [89]. мРНК экспрессия BAGE нечасто встречается в рабдомиосаркомах (6%) [92], плоскоклеточном раке головы и шеи (2%) [93], в опухолях слюнных желез [94]. В костном мозге пациентов с миеломой BAGE экспрессировался с частотой 15% (16/106) [95]. При исследовании пациентов разных стадий наличие мРНК BAGE было детектировано только в образцах от пациентов с третьей стадией миеломы – в 27% (7/26) [96] и в 33% (13/29%) [91]. В гепатоцеллюлярных карциномах экспрессия BAGE была обнаружена только в образцах с хорошей (1/10) и умеренной дифференциацией (6/20), всего в 21% образцов [97]. Не было выявлено корреляции экспрессии BAGE с клиникопатологическими характеристиками пациентов с гепатоцеллюлярной 31 карциномой, миеломой, рабдомиосаркомой, плоскоклеточным раком головы и шеи и меланомой. При исследовании асцитной жидкости у пациентов с раком яичника была зафиксирована высокая экспрессия BAGE – 63% (17/27) [98]. В самой ткани опухоли яичника BAGE экспрессировался гораздо реже: в первичных опухолях в 14,6% (6/41), в метастатических опухолях в 14,3% (1/7). При этом она была частой в серозных цистаденокарциномах яичника и ассоциировалась с асцитом у пациента [99]. Более выраженное прогностическое значение установлено для степени метилирования генов BAGE [100, 101]. Юкстацентромерные участки хромосом обычно сильно метилированы в нормальных клетках, а при канцерогенезе происходит их деметилирование. Оказалось, что этот процесс имеет место в участках около промоторов и на самих промоторах генов BAGE. В 98% опухолевых клеток эти участки были гипометилированы, что не всегда приводило к транскрипции гена [100]. При исследовании эпигенетического статуса локусов BAGE в образцах рака толстого кишечника было обнаружено, что CpG островки в юкстацентромерных локусах BAGE деметилированы в 81% [101]. Было показано, что степень метилированности локусов BAGE может быть эпигенетическим маркером рака толстой кишки. За пороговую степень деметилирования было принято 42%, то есть метилирование меньше этого значения считалось низким. При этих условиях специфичность метода была равна 85,7%; чувствительность – 93,3%; точность – 89,7%. Следовательно, на основании эпигенетического статуса локусов BAGE может быть разработан клинический тест для выявления рака толстой кишки. 1.3.2.3. Иммуногенность раково-тестикулярных антигенов семейства BAGE BAGE был идентифицирован с помощью клонирования эпитопов Т-клеток, то есть он способен распознаваться Т-лимфоцитами и вызывать развитие спонтанного клеточного ответа в пациентов с опухолевыми заболеваниями [88]. Однако не было сообщений о проведении вакцинации пациентов против BAGE [35]. Суммируя вышесказанное о генах и антигенах семейства BAGE, можно сказать, что эта тема изучена меньше, чем для других РТ-семейств. Анализ 32 экспрессии генов BAGE в тканях предраковых заболеваний также ранее не проводился, поэтому исследование паттерна их экспрессии актуально. 1.3.3. Раково-тестикулярные гены и антигены семейства GAGE 1.3.3.1. Номенклатура семейства GAGE Кластер генов GAGE расположен на X-хромосоме в локусе p11.23. Семейство GAGE состоит как минимум из 16 генов, которые представляют собой почти идеальные тандемные повторы, что обеспечивает очень высокую степень гомологии между членами семейства [67]. Это свидетельствует о том, что это семейство возникло совсем недавно. Для генов семейства сейчас существуют две номенклатуры. Первая была создана при открытии новых антигенов, представляемых в комплексе с молекулами HLA-Cw6 и HLA-A29 на клетках меланомы [102]. Они были названы GAGE1-6. Затем два гена, GAGE7B и GAGE8, были обнаружены при скрининге геномной библиотеки человека [103]. GAGE1 имеет вставку в 143 нуклеотида на 3’-конце ORF и, возможно, является самым древним геном этой группы. GAGE-2-8 отличаются единичными нуклеотидами, а следовательно, и аминокислотами. GAGE-7B отличается от GAGE-7 одним нуклеотидом снаружи от предполагаемой ORF. 1.3.3.2. Экспрессия генов и антигенов семейства GAGE в нормальных тканях и в опухолях Белки GAGE экспрессируются в зародышевых клетках семенников, в очень небольшом количестве в клетках мозга (и мозга плода), в части ооцитов в зародышевых и зрелых яичниках и матке [43, 44, 91, 103]. Кроме того, белки GAGE экспрессируются в клетках Сертоли и Лейдига во втором триместре беременности. В матке была обнаружена экспрессия мРНК GAGE [34]. GAGE часто экспрессируется в опухолях мозга (эпендимома - 93%, медуллобластома 18-64%, глиобластома – 65-78%) [104, 105]. Интересно отметить, что в образцах рецидивирующей миеломы GAGE экспрессировался гораздо чаще (в 71%), чем в образцах первично диагностированной миеломы (17%) [106]. Была 33 показана обратная корреляция между экспрессией генов семейства GAGE в образцах костного мозга пациентов с миеломой и общей выживаемостью [91]. И такая же тенденция наблюдалась между метастазирующими (36-41%) и первичными меланомами (13-29%) [102, 103]. В перитонеальной жидкости 8 из 44 больных (30%) с раком яичника была обнаружена экспрессия GAGE [98]. В самой опухолевой массе рака яичника экспрессия GAGE детектировалась в 26,8% (11/41) [99]. В образцах плоскоклеточного рака головы и шеи ген GAGE экспрессировался в 16% [93], а в плоскоклеточных карциномах гортани белок GAGE обнаруживался в 20,64% (13/63) [107]. В семиномах мРНК GAGE присутствовала в 6 из 6 образцов [102], но соответствующий белок детектировался только в 16% [108]. Экспрессия GAGE имеет прогностическую значимость для опухолей желудка, пищевода и мозга [109-111]. Так экспрессия GAGE коррелировала с плохим прогнозом для пациентов с плоскоклеточным раком пищевода и аденокарциномой [111]. В опухолях желудка экспрессия GAGE ассоциировалась с более высокой стадией и метастазами в лимфатические узлы [110]. Для пациентов с медуллобластомой обнаружение мРНК GAGE через 24 месяца после постановки диагноза было значимым указателем худшей выживаемости [109]. К сожалению, несмотря на первоначальные интересные результаты, в настоящее время работ, исследующих прогностическое значение GAGE, немного. Возможным ограничением использования белков GAGE в качестве мишеней иммунопрофилактики может быть гетерогенность экспрессии генов GAGE в пределах одной опухоли [43]. Возможно, эта проблема может быть преодолена путем использования деметилирующих агентов и ингибиторов деацетилаз. 1.3.3.3. Иммуногенность раково-тестикулярного антигена GAGE GAGE был идентифицирован с помощью клонирования эпитопов Т-клеток, то есть он способен распознаваться Т-лимфоцитами и вызывать развитие спонтанного клеточного ответа в пациентов с опухолевыми заболеваниями [102]. Однако, до настоящего времени, не было сообщений о проведении вакцинации пациентов против GAGE [35]. 34 Итак, экспрессия генов семейства GAGE коррелирует с плохими прогностическими факторами для многих видов опухолевых заболеваний, гены GAGE чаще экспрессируются в метастазах. Все это делает GAGE перспективной диагностической мишенью, но пока неизвестно, насколько продукты этих генов подходят для разработки методов иммунотерапии. 1.3.4. Раково-тестикулярные антиген и ген NY-ESO-1 1.3.4.1. Номенклатура семейства NY-ESO-1 Антиген NY-ESO-1 был открыт в 1997 году Chen Y.T. et al. в Нью-Йорке (отсюда первая часть названия антигена – New-York – NY), в образце рака пищевода (это нашло отражение в средней части названия антигена – esophageal cancer – ESO) с помощью метода SEREX [32]. Название гена, кодирующего NYESO-1, совпадает с названием антигена, как и у большинства РТ-генов, но, кроме того, его также называют CTAG1 (cancer/testis antigen 1). В семейство РТ-антигенов NY-ESO-1 помимо одноименного антигена также входит антиген LAGE-1. LAGE-1 (CTAG2) был открыт в 1998 году в клеточной линии меланомы с помощью метода RDA [33]. Оказалось, что последовательность генов, кодирующих NY-ESO-1 и LAGE-1, совпадает на 84%. При транскрипции гена LAGE-1 образуются два сплайс-варианта LAGE-1a и LAGE-1b. Оба гена расположены на Х-хромосоме в локусе p28. 1.3.4.2. Экспрессия гена и антигена NY-ESO-1 в нормальных тканях и в опухолях Антиген NY-ESO-1 обнаруживается с помощью иммуногистохимии в ранних сперматогониях экспрессируют и плаценте. антиген NY- Несперматогенные ESO-1 [112]. клетки Интересным семенников открытием не было обнаружение экспрессии антигена NY-ESO-1 в эпителиальных клетках мозгового вещества нормального тимуса [63, 113]. Больше ни в каких других зрелых тканях не было детектировано NY-ESO-1 антигена. При этом мРНК NY-ESO-1 наблюдалась не только в семенниках, плаценте и тимусе, но и в тканях печени и 35 поджелудочной железы [114]. Поэтому ген NY-ESO-1 можно отнести к семенникселективным генам [115]. Экспрессия NY-ESO-1 исследована в огромном количестве работ, поэтому, конечно, в рамках обзора литературы не имеет смысла приводить результаты всех исследований, большая часть которых представлена в базе данных РТ CTDatabase [35]. Но можно отметить, что для одного типа опухолей частота экспрессии NYESO-1 может сильно варьировать. Например, в миеломе от 7.3% до 36%, в плоскоклеточном раке головы и шеи от 6% до 28%, в гепатоцеллюлярной карциноме от 0% до 44%, в немелкоклеточном раке легких от 2-10% до 32%, в меланоме от 0% до 71%. В глиомах NY-ESO-1 экспрессируется редко (0-3%). В раке эпителия яичника мРНК NY-ESO-1 обнаруживается с частотой 10-30%. Наличие мРНК NY-ESO-1 и соответствующего белка было показано в 100% образцов миксоидных и круглоклеточных липосарком [116]. Экспрессия гена NY-ESO-1 может служить маркером высокой степени злокачественности при раке мочевого пузыря [117]. Это наблюдение получило подтверждение в работе Dyrskjot L. et al. Было показано, что наличие мРНК NYESO-1 коррелирует с более коротким периодом жизни без прогрессии (progressionfree survival) у пациентов с мускульно-неинвазивным раком мочевого пузыря [118]. При эпителиальном раке яичника NY-ESO-1 чаще экспрессируются при высокой стадии [119]. В нескольких исследованиях была показана связь экспрессии NYESO-1 с клиникопатологическими характеристиками рака легких. Например, при немелкоклеточном раке легкого экспрессия NY-ESO-1 и MAGE-A3 является маркером плохого исхода [76]. Исследование экспрессии РТ-антигенов семейств MAGE-A3, LAGE, GAGE и NY-ESO-1 у больных с раком легких рекомендуется при мужском поле, возрасте старше 60 лет, продвинутой стадии рака, статусе курильщика, большом размере опухоли (>3см). Это обусловлено тем, что экспрессия вышеуказанных РТ-генов коррелирует с наличием плевральной инвазии. Экспрессия NY-ESO-1 и MAGE-A3 была ассоциирована с меньшей выживаемостью при аденокарциноме легких [76], для NY-ESO-1 была показана корреляция с наличием метастазов [77]. В связи с показанной клинической значимостью анализ на экспрессию NY-ESO-1 и MAGE-A4 был включен в тестсистему EarlyCDT® для раннего обнаружения рака легких среди людей с высоким 36 риском развития этого заболевания [120]. При раке пищевода NY-ESO-1 чаще экспрессируется в хорошо и умеренно дифференцированных опухолях, и чем выше стадия рака, тем чаще регистрируется экспрессия NY-ESO-1 [121]. В гастроинтестинальных опухолях экспрессия белка NY-ESO-1 ассоциируется с прогрессией заболевания при лечении иматинибом [122]. При меланоме NY-ESO-1 значительно чаще экспрессируется в метастатической, чем в первичной злокачественной меланоме, его экспрессия коррелирует с большей толщиной первичного очага и большей частотой метастазирования и более высокой стадией, что является плохим прогностическим признаком [123]. Наличие Т-лимфоцитов, распознающих NY-ESO-1, у пациентов с меланомой с отдаленными метастазами является независимым прогностическим признаком выживаемости [124]. Таким образом, экспрессия NY-ESO-1 сильно варьирует, как среди разных типов опухолей, так и среди образцов одной нозологии. Характерно также, что частота экспрессии гена NY-ESO-1 может достигать больших значений, порядка 70%, но в среднем около 30%, что тоже выше, чем для большинства других наиболее исследованных РТ-генов. В настоящее время выявлены корреляции экспрессии гена NY-ESO-1 с важными клиникопатологическими характеристиками рака легких, что уже нашло применение в разработке диагностической тестсистемы. Также существенные ассоциации обнаружены для меланомы, рака мочевого пузыря. 1.3.4.3. Иммуногенность антигенов семейства NY-ESO-1 Функции NY-ESO-1 изучены слабо, а иммуногенным свойствам NY-ESO-1 посвящено большое количество работ. Это связано с тем, что NY-ESO-1 является самым иммуногенным РТ-антигеном. NY-ESO-1 обладает уникальными иммуногенными свойствами по сравнению с другими опухолевыми антигенами (в том числе и РТ-антигенами): иммунный ответ на NY-ESO-1 обычно проявляется как выработкой антител, так и формированием CD4+ и CD8+ NY-ESO-1специфичных Т-клеток [46, 125, 126]. 37 Опухоли, экспрессирующие NY-ESO-1, вызывают развитие спонтанного специфического иммунного ответа во время заболевания приблизительно у 50% больных [115, 127]. Частота обнаружения антител к NY-ESO-1 зависит от экспрессии гена в опухоли и может увеличиваться при увеличении стадии опухоли. Антитела к NY-ESO-1 были детектированы, в основном с помощью ELISA, у пациентов с раком головы и шеи, пищевода, желудка, поджелудочной железы, легких, молочной железы, яичника, простаты, колоректальной карциномой, Тклеточным лейкозом/лимфомой взрослых, неходжкинскими лимфомами, меланомой [35]. Например, у 30-40% пациентов с метастатической меланомой III-IV стадии вырабатывается спонтанный иммунный ответ на NY-ESO-1. У пациентов с метастатической меланомой в серии работ [47, 128, 129] была исследована взаимосвязь спонтанного гуморального иммунитета против NY-ESO-1 с клиническим ответом на введение антител (ипилимумаб) против CTLA-4. Было отмечено, что те пациенты, которые отвечали на лечение ипилимумабом, имели в сыворотке антитела против NY-ESO-1 (до или после лечения) [128, 129]. После лечения у этих пациентов детектировались также CD4+ и CD8+ NY-ESO-1специфичные Т-клетки. После лечения у некоторых ранее серонегативных по NYESO-1 пациентов также обнаруживались антитела к NY-ESO-1. В трех случаях пациенты были превакцинированы против NY-ESO-1, но развили слабый CD4+ и CD8+ Т-клеточный ответ, а также у них детектировались эффекторные CD8+ Тклетки памяти (CCR7(lo)CD45RA(lo)) [47]. После индукции ипилимумабом произошло усиление иммунного ответа на NY-ESO-1. Суммируя полученные результаты, авторы указывают, что наличие гуморального и CD8+ Т-клеточного иммунитета на NY-ESO-1 может служить предиктивным маркером клинического ответа на анти-CTLA-4 терапию. Пока неизвестно, насколько стимуляция иммунного ответа против NY-ESO-1 анти-CTLA-4 терапией повлияла на положительное течение заболевания. Но эти работы интересны тем, что наглядно показывают, что максимально эффективная стратегия иммунотерапии должна включать модуляторы иммуносупрессии, такие как анти-CTLA-4. Известно, что иммунный ответ на опухоли не обязательно предотвращает рост опухоли. Причин этому множество, они включают в себя и 38 внутренние механизмы Т-клеточной иммуносупрессии, и внешнюю опухольассоциированную иммуносупрессию Т-клеток. Внутренние механизмы Т- клеточной иммуносупрессии включают активацию различных ингибиторных молекул, таких как TIM-3, LAG-3, и PD-1 на Т-клетках [130-132]; к механизмам внешней иммуносупрессии Т-клеток относятся регуляторные Т-клетки, супрессорные клетки костномозгового происхождения, цитокины и хемокины [133]. Совместно с общей супрессией CD8+ Т-клеток в опухоли эти механизмы иммуносупрессии не позволяют проявиться противоопухолевому действию антиNY-ESO-1 иммунного ответа. По этим же причинам и индуцированный вакциной анти-NY-ESO-1 ответ очень редко приводит к элиминированию опухоли. На примере испытаний вакцины, состоящей из помеченного гистидином цельного рекомбинантного белка NY-ESO-1 с иммуностимулирующим адъювантом ISCOMATRIX™ (в его состав входят сапонины, холестерол, фосфолипиды), можно проследить, что эффективность иммунотерапии определяется во многом наличием или отсутствием иммуносупрессии у пациентов [125, 134]. Использование цельного белка позволяет индуцировать CD4+ и CD8+ иммунный ответ, избежать формирования опухолевых клеток, мутантных по эпитопам NY-ESO-1, и не ограничиваться применением вакцины только для пациентов с определенными молекулами HLA. Если в фазе I испытаний этой вакцины участвовали пациенты с меланомой после полной резекции опухоли (LUD99-008), то в фазе II испытаний участвовали пациенты с меланомой III/IV стадии (LUD2003-009). В испытании LUD99-008 вакцина стимулировала формирование CD4+ и CD8+ Т-клеточного ответа на новые эпитопы NY-ESO-1. У пациентов, вакцинированных NY-ESO-1 с ISCOMATRIX™, риск рецидивирования заболевания был значительно ниже (2/19), чем у пациентов, вакцинированных только NY-ESO-1 или плацебо (14/23) [125, 135, 136]. В испытании LUD2003-009 объективный ответ на вакцину наблюдался только у одного пациента из 27, Тклеточные ответы CD4+ были низкими, а CD8+ Т-клетки были специфичны к тем же эпитопам NY-ESO-1, что и до вакцинации. У пациентов с продвинутой меланомой количество циркулирующих Т-регуляторных клеток было намного выше, чем у пациентов с минимальной остаточной болезнью из первого испытания, то есть состояние иммуносупрессии может свести на нет противоопухолевое 39 действие даже очень эффективной вакцины. Также в испытаниях вакцины, состоящей из белка NY-ESO-1 с ISCOMATRIX™, была показана необходимость использования иммуностимулирующего адъюванта для формирования устойчивого иммунитета [137]. Было продемонстрировано, что у пациентов, которые сначала ответили на вакцину белок NY-ESO-1+ISCOMATRIX™, но затем рецидивировали, происходило иммуноредактирование анти-NY-ESO-1 иммунитета. Это было связано со сниженной экспрессией либо NY-ESO-1, либо HLA на опухолевых клетках. Из этого следует, что при использовании цельного NY-ESO-1 для иммунизации опухолевые клетки чаще ускользают от иммунитета не путем образования мутантных эпитопов опухоль-ассоциированного антигена, а путем прекращения его транскрипции и трансляции. Вакцинация пациентов CHP-NY-ESO-1 (cholesterol-bearing hydrophobized pullulan-NY-ESO-1), приводила к формированию сильного CD4+ и CD8+ Тклеточного ответа у большинства пациентов [138]. Было предложено скомбинировать такие вакцины, как CHP-NY-ESO-1 и NY-ESO-1+ISCOMATRIX с ипилимумабом для того, чтобы индуцировать интегрированный иммунный ответ на NY-ESO-1 [129]. В качестве иммуногенов используются также пептиды NY-ESO-1 с различными адъювантами. Использование антигенных пептидов имеет свои ограничения: необходимо учитывать аллели молекул главного комплекса гистосовместимости, по которым рестрикцированы выбранные эпитопы. Особенно эффективной оказалась вакцина, состоящая из пептида р157-165 с неполным адъювантом Фрейнда (Montanide® ISA-51) и синтетическими CpG 7909 ODN (deoxycytidyl-deoxyguanosin oligodeoxy-nucleotides) [126]. Из 9 пациентов с опухолевыми заболеваниями III-IV стадии, экспрессирующими NY-ESO-1, 4 развили CD8+ Т-клеточный ответ после двух вакцинаций, а 5 пациентов развили поздний, но стабильный ответ, который сохранялся в течение 4 месяцев после окончания вакцинации. Выживаемость пациентов, участвовавших в этом испытании, достигала 24 и 32+ месяцев. До этого проводились испытания вакцин на основе пептидов NY-ESO-1 и других адъювантов: отдельно Montanide ISA-51 [45], Montanide ISA-51 и CpG [46], имиквимода [139], Montanide ISA-51 и Picibanil OK-432 [140]. 40 Иммуногенные свойства NY-ESO-1 нашли свое применение и в разработке методов генной терапии опухолевых заболеваний. Например, для доставки ДНК, кодирующей ген NY-ESO-1, использовались вирусные и бактериальные векторы: вирус оспы кур [141], бактерия Salmonella typhimurium [142]. Также противоопухолевое действие NY-ESO-1 было оценено для генно-клеточной вакцины, приготовленной с использованием дендритных клеток, пульсированных NY-ESO-1 пептидами [143]. В нескольких исследованиях было показано, что NY-ESO-1 можно с успехом использовать для адоптивной иммунотерапии. В работе Hunder N.N. et al. у пациента с метастатической меланомой был выделен CD4+ Т-клеточный клон, специфичный к эпитопу NY-ESO-1, рестрикцированному по HLA-APB1*0401 [144]. Этот клон был размножен in vitro и снова введен в кровь того же пациента. У пациента произошло полное элиминирование метастазов в легких и лимфоузлах. Пациент оставался без признаков заболевания 2 года. В другом клиническом испытании принимали участие пациенты с метастатической меланомой и синовиальной саркомой, экспрессирующие NY-ESO-1, не отвечающие на стандартные методы лечения [145]. Пациенты предварительно проходили курс химиотерапии, сопоставимый с полной миелоаблативной подготовкой для аллогенной трансплантации стволовых клеток костного мозга. Затем вводились Тклетки с трансгенными Т-клеточными рецепторами, распознающими эпитопы NYESO-1, и высокие дозы ИЛ-2. На лечение ответили 45% пациентов с меланомой и 67% пациентов с саркомой. Регрессия опухолей наблюдалась у 5 из 6 пациентов с саркомой и 5 из 11 пациентов с меланомой. У одного пациента с саркомой частичный ответ длился 18 месяцев, а у двух пациентов с меланомой полная регрессия длилась минимум 20 месяцев. Эти успешные испытания свидетельствуют о том, что генная терапия, основанная на Т-клеточных рецепторах, против NY-ESO-1 представляет собой новый и эффективный подход для лечения пациентов с меланомой и синовиальной саркомой. Это показывает, что РТ-антиген NY-ESO-1 является действительно важным объектом интереса иммунологов всего мира. 41 На основании приведенных результатов исследований иммуногенности NYESO-1 можно заключить, что он обладает рядом свойств, характеризующих его как очень хорошую мишень. На этот антиген часто вырабатывается натуральный иммунный ответ, то есть NY-ESO-1 – сильный иммуноген, он способен индуцировать как выработку антител, так и формирование CD4+ и CD8+ NY-ESO1-специфичных Т-клеток. К этому добавляются качества, характерные для всех РТантигенов – специфическая экспрессия в опухолевых клетках. Однако высокая иммуногенность сопровождается высоким риском иммуноредактирования опухолевых клеток, что чаще всего проявляется в прекращении экспрессии этого белка. И выработка иммунного ответа на NY-ESO-1 возможна только в отсутствие выраженной иммуносупрессии, то есть подчиняется законам, общим для всех антигенов. Действительно впечатляющие и устойчивые результаты применения терапии против NY-ESO-1 могут быть получены, но для этого необходимо проводить иммунотерапию в составе комплексной терапии опухолевого заболевания и в периоды, когда иммуносупрессия менее выражена, например, в состоянии минимальной остаточной болезни. 1.4. Раково-тестикулярные гены и антигены при раке молочной железы Рак молочной железы является самым распространенным злокачественным новообразованием у женщин в Российской Федерации (57307 выявленных случаев в 2013 году), который приводит к смерти более 20 000 пациентов каждый год [146]. Развитие рецидивов и метастазирование РМЖ после первичного лечения представляет собой серьезную и нерешенную проблему [147]. Средняя выживаемость пациентов с метастатическим РМЖ может быть увеличена благодаря эффективным гормональным и химиотерапевтическим препаратам, а также комбинации химиотерапии с анти-HER2/neu антителами Trastuzumab, но метастатический РМЖ, в конце концов, приводит к смерти [148]. Одним из возможных подходов к профилактике метастазирования и рецидивов РМЖ является иммунотерапия. Лечение РМЖ с помощью терапии, не вызывающей 42 иммуносупрессии (гормональная терапия, герцептин), позволяет провести достаточно длительные курсы вакцинирования без опасения, что одновременное использование цитотоксических агентов может помешать развитию нормального иммунного ответа [149]. В настоящее время иммунотерапевтические курсы при РМЖ чаще используются при заболеваниях в продвинутой стадии и в основном направлены на антигены, экспрессирующиеся в нормальных тканях и с повышенной экспрессией мутированных форм в клетках опухоли [150]. В эту категорию включаются антигены, такие как MUC1, CEA, и углеводные рецепторы [151]. Иммунотерапия РМЖ, направленная на РТ-антигены, может быть более эффективной, чем на вышеперечисленные опухолевые антигены, так как к РТантигенам отсутствует толерантность. Кроме того, иммунный ответ может быть стимулирован эпигенетическими препаратами и анти-CTLA-4-терапией. Результаты анализа базы данных клинических испытаний www.clinicaltrial.gov показали, что до настоящего времени было проведено только одно испытание вакцины против MAGE-A12 с адъювантом Montanide ISA-51 с участием пациентов с РМЖ. Пациенты с РМЖ были включены также в одно испытание вакцины против NY-ESO-1 – CHP-NY-ESO-1 с иммуноадъювантом OK-432 [138]. В настоящее время идет испытание в фазе I/II вакцины против NY-ESO-1 – CDX-1401 в комбинации с Resiquimod и/или poly-ICLC (Hiltonol). Кроме того, идет набор пациентов, в частности с РМЖ, для участия в испытаниях вакцин против NY-ESO1 – IMF-001 (содержит CHP-NY-ESO-1) и DEC-205-NY-ESO-1 в комбинации с сиролимусом (рапамицином). Таким образом, иммунотерапия, направленная на РТантигены в РМЖ, находится в начальной стадии разработки. В рутинной клинической практике выбор лечебных воздействий основан на стандартных прогностических факторах (возраст, наступление менопаузы, размер опухоли, степень злокачественности, наличие рецепторов стероидных гормонов и HER2/neu, метастазов в локальных лимфатических узлах, мутация BRCA1 и 2 ((Breast Cancer, early onset)). Однако стандартные факторы не всегда способны предсказать течение и прогноз заболевания. Для некоторых РТ-генов и антигенов в результате многочисленных исследований было выявлено прогностическое значение, которое может быть использовано для уточняющей диагностики РМЖ. Например, была выявлена прямая корреляция между экспрессией NY-ESO-1 43 антигена и высокой степенью злокачественности [152], а экспрессия MAGE-C1 прямо коррелировала с высокой стадией заболевания [153]. При инвазивном раке протоков молочной железы экспрессия антигенов MAGE-A прямо коррелировала c инвазией лимфатических сосудов, некрозом внутри опухоли [154]. Тем не менее, для одного из белков семейства MAGE-A – MAGE-A4 была показана более низкая частота экспрессии в группе пациентов рака протоков молочной железы без региональных метастазов [155]. В этом исследовании белок MAGE-A4 детектировался значительно чаще у пациентов с большей продолжительностью жизни. Однако практически во всех других исследованиях, где оценивалось значение экспрессии РТ-антигенов с выживаемостью, зависимость была обратной. У пациентов с медуллярным РМЖ общая выживаемость была значительно ниже при экспрессии MAGE-A, MAGE-A1 или NY-ESO-1 [156]. В группе пациентов с MAGE-A11-негативными опухолями молочной железы общая выживаемость была выше, чем в группе с MAGE-A11-положительными опухолями [157]. Для MAGEA10 не было обнаружено корреляции с выживаемостью [157]. Экспрессия MAGEC1 также не имела прогностического значения [153]. Обобщая приведенные выше результаты, можно сделать вывод, что РТ-гены и РТ-антигены являются перспективными биомаркерами для РМЖ в целом, однако необходимо подтверждение полученных корреляций в многоцентровых рандомизированных контролируемых когортных исследованиях на большом количестве образцов. Особенно интересна выявленная значимая ассоциация экспрессии РТ-генов и РТ-антигенов с клиникопатологическими характеристиками не РМЖ в целом, а некоторых подгрупп РМЖ: негативных по эстрогеновому статусу, базальноподобных, «тройных негативных». Известно, что метилирование и конфигурация хроматина отвечают за эктопическую депрессию РТ-генов [38]. В свою очередь, деметилирование ДНК в клетках связано с потерей ими дифференцировки, что является очень характерным признаком опухолевых клеток. Поэтому можно предположить, что частота экспрессии РТ-генов будет выше в низкодифференцированных опухолях. В нескольких исследованиях РМЖ была доказана такая зависимость [154, 158]. В исследовании Grigoriadis A. et al. было обнаружено, что CT-X гены чаще 44 экспрессируются в подгруппе так называемых базальноподобных опухолей молочной железы [159]. Эти опухоли обычно имеют повышенную степень злокачественности, меньшую склонность к метастазированию в локальные лимфатические узлы и выраженную тенденцию к метастазированию в мозг и ассоциируются с очень плохим прогнозом [160, 161]. Более высокая частота экспрессии CT-X антигенов в подгруппе базальноподобных опухолей была подтверждена для MAGEA4, MAGEA10, MAGEA2B, MAGEA5, MAGEA6, MAGEA12, CTAG2, MAGEA1 и NY-ESO-1. Обычно базальноподобные опухоли молочной железы не имеют рецепторов к эстрогенам, прогестерону и не экспрессируют HER2 в избыточных количествах, поэтому они входят в группу тройных негативных опухолей, но эти две группы не идентичны друг другу [162]. В нескольких исследованиях было показано, что в опухолях молочной железы экспрессия РТ-генов и антигенов обратно коррелирует с наличием рецепторов гормонов и/или HER2/neu. Экспрессия гена и антигена NY-ESO-1 имела значимую связь с негативным по эстрогеновым рецепторам статусом опухоли в исследованиях Theurillat J.-P. et al. [152], Grigoriadis A. et al. [159], Sugita Y. et al. [163], Badovinac-Crnjevic T. et al. [164, 165], Hamaï A. et al. [166]. При исследовании MAGE-A антигенов тоже была выявлена обратная корреляция с наличием рецепторов эстрогенов [154]. Так экспрессия генов MAGE-A3 и MAGE-A6 ассоциировалась с ER-негативным статусом опухоли молочной железы [159]. После выявления экспрессии MAGE-A генов и антигенов в группе базальноподобных опухолей молочной железы и опухолях с негативным статусом по эстрогеновому рецептору наличие РТ-антигенов было целенаправленно проанализировано в группе тройных негативных опухолей. Так как на клетках этого типа отсутствуют рецепторы гормонов и HER2, на них слабо действует гормональная терапия и трастузумаб. Современные методы терапии включают применение антрациклинов, таксанов, соединений платины. В настоящее время идут испытания ингибиторов поли(АДФ-рибозо)полимеразы для терапии тройных негативных опухолей молочной железы. Несмотря на чувствительность к химиотерапевтическим агентам, тройные негативные опухоли ассоциируются с меньшей выживаемостью по сравнению с другими типами РМЖ. То есть для пациентов с тройными негативными карциномами терапевтические подходы 45 ограничены, поэтому требуется идентификация новых мишеней в этой группе опухолей молочной железы [167, 168]. В результате проведенных исследований по экспрессии РТ-генов и антигенов было выяснено, что они являются кандидатами для разработки иммунотерапии тройных негативных опухолей молочной железы [165, 169-172]. Например, антигены MAGE-A детектировались в 23-26% тройных негативных опухолей и лишь в 10% эстроген-положительных (P=0.07), а NY-ESO-1 антигены – в 16-18% и 4-2%, соответственно (P=0.05) [170-172]. Антиген MAGEA10 экспрессировался в 87,5% тройных негативных опухолей при том, что частота детекции MAGE-A10 в образцах РМЖ в целом была равна 64% [165]. Таким образом, в настоящее время появилась необходимость проведения клинических испытаний вакцины, направленной против РТ-антигенов (MAGE-A и NY-ESO-1), для лечения тройных негативных опухолей молочной железы, так как предполагается, что такая вакцина может стать для этой группы пациентов эффективным терапевтическим подходом. Экспрессия РТ-антигенов была исследована в BRCA-ассоциированных опухолях [173]. Эти опухоли тоже часто бывают негативными по статусу эстрогеновых, прогестероновых рецепторов и HER2, особенно в случаях инвазивной карциномы. В нормальной ткани молочной железы, полученной при профилактической мастэктомии у носителей мутации (n=7) экспрессии антигенов MAGE-A, MAGE-C1, MAGE-C2, NY-ESO-1 и GAGE не было детектировано с помощью иммуногистохимического метода. Исследованные РТ-антигены были обнаружены в 16 из 26 (61,5%) опухолей с мутациями генов BRCA. MAGE-A антигены экспрессировались в 13/26 (50%) опухолей, NY-ESO-1 – в 10/26 (38%). Три четверти опухолей с мутациями BRCA1 и половина опухолей с мутациями BRCA2 экспрессировали как минимум один из проанализированных РТ-антигенов. Кроме того, РТ-антигены часто выявляются в других опухолях, которые развиваются у носителей мутаций BRCA, таких как рак яичника и меланома [119, 123, 174]. Все это указывает на то, что необходимо изучить возможность использования вакцин, индуцирующих формирование иммунного ответа против РТ-антигенов, для лечения BRCA-ассоциированных опухолей и иммунопрофилактики в целях снижения риска развития рака у носителей мутаций BRCA1/2 [173] . 46 Еще одна группа пациентов с заболеваниями молочной железы, для которых потенциально может быть применена иммунопрофилактика, направленная против NY-ESO-1 антигена, – это пациенты с доброкачественными опухолями. В тканях доброкачественных новообразований молочной железы, собранных для гистологического подтверждения диагноза, была выявлена частая экспрессия NY-ESO-1 гена – 68% (21/31) [163]. Низкий уровень NY-ESO-1 мРНК был обнаружен в 18 из 25 фиброаденом, 2 из 4 фиброзно-кистозных мастопатий, 1 из 2 доброкачественных филлоидных фиброаденом. В одном случае фиброаденомы мРНК NY-ESO-1 составляла 8% от тестикулярного уровня мРНК NY-ESO-1 и был детектирован белок при Вестерн-блот анализе [163]. Эти результаты впечатляют, потому что частота экспрессии превышает частоту экспрессии гена в образцах РМЖ. Но пока данные об экспрессии NY-ESO-1 были получены только в одном исследовании. Кроме того, образцов, приходящихся на каждую нозологию, не хватает для того, чтобы делать какие-либо существенные выводы. Поскольку доброкачественные опухоли молочной железы распространены очень широко, в случае подтверждения этих результатов, встал бы вопрос о создании и применении вакцины против NY-ESO-1 для пациентов с такими новообразованиями. Следовательно, имеет смысл провести исследование экспрессии РТ-генов в образцах доброкачественных опухолей молочной железы для подтверждения или опровержения этих многообещающих результатов. Суммируя вышеизложенное, разработка и испытание вакцин против РТантигенов и диагностических методов, основанных на экспрессии РТ-генов и антигенов, являются актуальными. Это связано с обнаружением корреляции экспрессии РТ-генов и антигенов с принадлежностью к эстроген-негативным и тройным негативным опухолям, для которых терапевтические подходы ограничены. Кроме того, исследования РТ-генов и антигенов в основном ограничены семействами MAGE-A и NY-ESO-1. Поэтому анализ ассоциации экспрессии других РТ-генов в РМЖ с клиникопатологическими характеристиками необходим для идентификации новых, возможно более надежных, молекулярных маркеров РМЖ. Важно также отметить, что исследований экспрессии РТ-генов в образцах РМЖ в Российской Федерации не проводилось. 47 1.5. Раково-тестикулярные гены и антигены при лейкоплакии слизистой оболочки полости рта В настоящее время рак СОПР и губ занимает одиннадцатое место среди всех онкологических заболеваний в мире [17], а среди мужчин в Российской Федерации – 7-е место [135]. В 90% случаев рак СОПР и губ является плоскоклеточным [175]. Рак СОПР в 60,6 % случаев выявляется на III-IV стадии, что объясняет низкий уровень пятилетней выживаемости – 48,2% [146]. Между тем, выявление заболевания на I-II стадии увеличивает уровень пятилетней выживаемости до 82,4% [176]. Проведение своевременной надежной диагностики позволяет увеличить долю выявляемых на I-II стадиях больных плоскоклеточным раком СОПР. Лейкоплакия СОПР – хроническое заболевание, имеющее риск озлокачествления, клинически характеризуется нарушением ороговения слизистой оболочки. По Классификации опухолей головы и шеи ВОЗ (Всемирной организации здравоохранения) эритроплазией/эритроплакией 2005 года относится лейкоплакия к СОПР эпителиальным вместе с предраковым заболеваниям СОПР [175]. Термин «предраковые заболевания» предполагает, что все описанные под этим термином заболевания обязательно трансформируются в рак СОПР, но в действительности это не так. Поэтому Рабочей группой ВОЗ с 2005 года было рекомендовано использовать термин «потенциально злокачественные заболевания» [177]. Лейкоплакия – это наиболее распространенное и наиболее изученное предраковое заболевание СОПР [178]. В настоящее время в клинической практике отсутствует метод, позволяющий достоверно определить злокачественный потенциал каждой конкретной лейкоплакии и выбрать на основании этого стратегию лечения пациента. На данный момент единственным признанным ВОЗ прогностическим маркером риска злокачественной трансформации лейкоплакии является дисплазия эпителия [179, 180]. Показано, что лейкоплакии с тяжелой дисплазией имеют высокий риск трансформации в рак СОПР – 10%/год, лейкоплакии с легкой дисплазией имеют низкий риск – около 12%/год, без дисплазии – 0,2%/год [181-184]. Существует большая вариабельность в 48 оценке наличия степени дисплазии не только у разных гистологов, но и у одного и того же гистолога [185-187]. Кроме того, наличие дисплазии, а тем более слабой или умеренной степени, не означает обязательную трансформацию лейкоплакии в рак СОПР. В настоящее время в клинической практике отсутствуют объективные прогностические маркеры, позволяющие в каждом отдельном клиническом случае определить риск злокачественной трансформации лейкоплакии СОПР и выбрать терапевтический подход. По-прежнему актуальным остается вопрос своевременной дифференциальной диагностики предрака и рака. Известны случаи, когда в биопсии отдельной части образования признаки карциномы отсутствуют (до 10% случаев [188]), а при гистологическом исследовании ткани после хирургического иссечения обнаруживается рак [186, 189]. Одним из направлений поиска прогностических факторов риска злокачественной трансформации лейкоплакии СОПР является исследование молекулярных изменений в патологических очагах [6]. Выявлены биомаркеры, наличие которых увеличивает риск злокачественной трансформации лейкоплакии СОПР: анэуплоидия [190], потеря гетерозиготности в локусах 3p и/или 9p, экспрессия сурвивина, металлопротеиназы 9 [191] и подопланина [192]. Однако проведенных исследований не достаточно для введения приведенных выше молекулярных маркеров в клиническую практику, и поиск биомаркеров активно продолжается [179, 191]. Практически неизученной областью этого поиска является экспрессия РТ-генов и кодируемых ими антигенов. Недавно в литературе появились работы, посвященные изучению экспрессии РТ-генов и РТ-антигенов в лейкоплакии. Было подтверждено, что в образцах нормальной СОПР отсутствует экспрессия генов семейства MAGE-A, а в образцах плоскоклеточного рака СОПР MAGE-A гены экспрессируются с высокой частотой: мРНК одного из десяти MAGE-A генов обнаруживалась в 93% образцов рака [193]. Было предложено использовать анализ экспрессии РТ-генов семейства MAGE-A в образцах лейкоплакии в качестве метода ранней диагностики карциномы СОПР, например, у пациентов с раком СОПР в анамнезе и у пациентов с лейкоплакиями СОПР с неопределенным риском злокачественной трансформации [193, 194]. В образцах щеточной биопсии и инцизионной биопсии лейкоплакии с подозрением на рак СОПР была детектирована экспрессия генов MAGE-A3 и MAGE-A4 [194]. Ранее 49 экспрессия РТ-генов выявлялась только в образцах рака СОПР, поэтому лейкоплакия была полностью иссечена. По результатам гистологического исследования она оказалась ранней инвазивной карциномой. Возникло предположение, что экспрессия РТ-генов может служить маркером рака СОПР, дифференцирующим его от лейкоплакии. В результате дальнейших исследований было выяснено, что это не совсем так. При анализе экспрессии генов семейства MAGE-A в образцах одного пациента, собранных на разных стадиях прогрессии заболевания из лейкоплакии в плоскоклеточный рак, оказалось, что в фиброме с воспалительным инфильтратом и лейкоплакии с гиперплазией нет экспрессии MAGE-A генов, а на стадии лейкоплакии с тяжелой дисплазией появляется экспрессия генов MAGE-A3, -A4, A6, -A10 и -A12 [195]. В развившейся из лейкоплакии карциноме дополнительно экспрессировался ген MAGE-A1. Исследование экспрессии генов семейства MAGE-A для своевременной диагностики рецидивов рака СОПР было распространено и на образцы щеточной биопсии полости рта [196]. На уровне экспрессии белка с помощью иммуногистохимического метода MAGE-A антигены были обнаружены вначале только в лейкоплакиях с дисплазией (33%), а в лейкоплакиях без дисплазии их нет [197]. В результате ретроспективных исследований впоследствии было выявлено прогностическое значение экспрессии MAGE-A антигенов (MAGE-A1, MAGE-A3, -A4, -A6, -A10, -A12) для оценки риска трансформации лейкоплакии в плоскоклеточный рак СОПР [198, 199]. Из 24 лейкоплакий, прогрессировавших в плоскоклеточный рак СОПР, 11 экспрессировали хотя бы один MAGE-A антиген (46%). Экспрессия MAGE-A антигенов была обнаружена даже в лейкоплакии без дисплазии (42%), и эти лейкоплакии тоже трансформировались в рак. Таким образом, экспрессия MAGE-A антигенов указывает на высокий риск трансформации лейкоплакии СОПР в рак [198]. Итак, изучение экспрессии РТ-генов в потенциально злокачественных заболеваниях может дать основание для разработки диагностических методов и молекулярно-генетические предпосылки для исследования потенциала вакцин, содержащих РТ-антигены, для иммунотерапии и профилактики злокачественной трансформации. Совсем недавно получены данные о том, что РТ-антигены MAGE- 50 A можно использовать для оценки риска озлокачествления лейкоплакии СОПР. Однако, во-первых, это пока единичное исследование, а во-вторых, неизвестна экспрессия других РТ-генов в лейкоплакии СОПР. В Российской Федерации подобных исследований не проводилось. 51 2. Материалы и методы 2.1 Пациенты и биообразцы 2.1.1. Сбор биологического материала Образцы для анализа собирались в условиях хирургической операционной с информированного согласия пациентов. Иссекался патологический очаг в границах здоровых тканей. Диагноз подтверждался патогистологическим исследованием. 2.1.2. Пациенты с лейкоплакией и образцы слизистой оболочки полости рта Всего было собрано 15 образцов лейкоплакии СОПР и 15 образцов нормальной СОПР. Во всех образцах лейкоплакии, кроме одного (Код 14Л), отсутствовала дисплазия. Образцы 3Л, 5Л, 12Л, 13Л, 14Л были иссечены из веррукозных лейкоплакий, образец 10Л – из эрозивно-язвенной лейкоплакии. Остальные лейкоплакии были простыми. 2.1.3. Пациенты с плоскоклеточным раком слизистой оболочки полости рта и характеристика собранных образцов опухолей Было исследовано 16 образцов плоскоклеточного рака СОПР. Данные пациентов с плоскоклеточным раком СОПР приведены в Таблице 1. 52 Таблица 1 – Данные пациентов с плоскоклеточным раком СОПР. Код Возраст, Клинический диагноз образца пол 1Р 40, м. Плоскоклеточный рак СОПР с метастазами в л/у шеи, T4N1M0 ст. IV 2Р 61, м Плоскоклеточный рак языка, T1N0M0 ст. I 3Р 48, ж. Плоскоклеточный рак языка, Т2N0М0 ст. II 4Р 69, м. Плоскоклеточный рак СОПР, TisN0M0 5Р 54, ж. Плоскоклеточный рак СОПР с метастазами в л/у шеи, T4N1M0 ст. IV 6Р 63, м. Плоскоклеточный рак языка, Т1N0M0 ст. I, состояние после комбинированного лечения, метастазы в л/у шеи 7Р 47, м. Плоскоклеточный рак языка, T2N0M0 ст. II. 8Р 65, ж. Плоскоклеточный рак языка, состояние после нерадикальной операции 9Р 82, ж. Плоскоклеточный рак слизистой дна полости рта, T3N0M0 ст. III 10Р 59, ж. Плоскоклеточный рак языка, T1N0M0 ст. I 11Р 46, м. Плоскоклеточный рак дна полости рта, T2N0M0 ст. II 12Р 51, м. Плоскоклеточный рак слизистой оболочки верхней челюсти, состояние после неоднократного хирургического вмешательства 13Р 51, м. Плоскоклеточный рак ротоглотки, состояние после ХЛТ. 14Р 55, м. Плоскоклеточный рак ротоглотки с метастазами в л\у шеи, T3N1M0 ст. III 15Р 52, м. Плоскоклеточный рак языка, T2N0M0 ст. II 16Р 53, м. Плоскоклеточный рак ротоглотки, T3N1M0 ст. III 2.1.4. Пациенты с раком молочной железы и характеристика собранных образцов опухолей Был исследован 41 образец РМЖ. Данные пациентов с РМЖ приведены в Приложении А. У трёх пациентов были собраны парные образцы: 3.1, 4.1, 5.1 – образцы рака молочной железы; 3.2, 4.2, 5.2 – образцы нормальной ткани молочной железы, соответственно. 2.2. Стабилизация РНК в образцах Для немедленной хирургического стабилизации материала размером РНК не фрагменты более 5х5х5 биопсийного мм3 или погружали в стабилизирующий буфер «RNA Stabilization Reagent, RNAlater®» («Qiagen», США). 53 Пробирки с образцами выдерживались при 4-8 ˚С в течение 12-18 часов, затем образцы хранились при -20 ˚С согласно инструкции производителя. 2.3. Выделение тотальной РНК из стабилизированных образцов Тотальную РНК выделяли с помощью «RNeasy Protect Mini Kit» («Qiagen», США) согласно инструкции производителя. РНК элюировали 30-40 мкл воды. Концентрацию РНК измеряли с помощью спектрофотометра «Nanodrop8000» («Thermo Scientific», США). 2.4. Обработка РНК ДНКазой Для разрушения остатков ДНК в пробах РНК до постановки реакции обратной транскрипции образцы обрабатывались ДНКазой. Для этого использовалась ДНКаза, очищенная от РНКаз, «RQ1 RNase-Free DNase» («Promega», M610A). Все образцы РНК обрабатывались ДНКазой в соответствии с инструкцией производителя. 2.5. Реакция обратной транскрипции Для проведения обратной транскрипции (ОТ) использовали набор «RevertAid™ Revert Transcriptase M-MuLV» («Fermentas», Литва) согласно инструкции производителя. В одну реакционную пробу вносили 1-1,5 мкг РНК. В качестве олигонуклеотидных затравок использовали «Random Hexamer Primer» («Fermentas», Литва), а для ингибирования РНКаз – набор «RNasin® Ribonuclease Inhibitor» («Promega», США). В реакции использовалась вода, очищенная от нуклеаз «HyClone HyPure™ Molecular Biology Grade Water» («Thermo Scientific», США). Для каждого образца РНК проводили положительную и отрицательную реакцию ОТ. В положительную реакцию («ОТ+») добавлялся фермент обратная транскриптаза, а в отрицательную («ОТ-») вместо нее – вода, очищенная от 54 нуклеаз. Синтезированные первые цепи кДНК в реакционной смеси хранились при -70 ˚С. 2.6. Система контрольных образцов для исследования экспрессии раково-тестикулярных генов человека Клеточная линия меланомы человека MelKor была получена из опухолевого материала пациента с меланомой [200]. Было установлено, что эта клеточная линия экспрессирует все РТ-гены человека, планируемые для исследования в работе: MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, NY-ESO-1, гены семейств GAGE, BAGE. Из клеток этой линии была выделена тотальная РНК и очищена от ДНК с помощью методов, описанных в пп. 2.3, 2.4. Далее с РНК была синтезирована кДНК согласно протоколу 2.5. С помощью олигонуклеотидных праймеров к РТ-генам и гену глицеральдегидфосфатдегидрогеназы человека (GAPDH – glyceraldehydes-3-phosphate dehydrogenase), приведённых в Приложении Б, были амплифицированы кДНК этих генов. ПЦР-продукты были выделены из геля с помощью набора «MinElute Gel Extraction Kit» («Qiagen», США). Клонирование фрагментов ДНК в плазмидные векторы и анализ клонов проводились традиционными методами [201]. Для клонирования использовались плазмидные векторы pJET1. Для амплификации рекомбинантных плазмид использовался штамм E. coli XL10 Gold. Трансформация бактериальных клеток осуществлялась с использованием KCM-буфера [202]. Компетентные клетки получали согласно общепринятому протоколу [201]. Для трансформации к 100 мкл компетентных клеток добавляли 100 мкл смеси, состоящей из буфера KCM и 10 мкл лигированной смеси ДНК. Смесь клеток с ДНК 10 мин инкубировали на льду, после чего 20 Трансформированные минут клетки инкубировали высевали на при чашки комнатной с температуре. твёрдым агаром и соответствующим антибиотиком и растили при 37 ºС в течение ночи. Полученные колонии использовали для наращивания культур и выделения плазмидной ДНК. Препаративное выделение плазмидной ДНК осуществлялось при помощи набора «HiSpeed® Plasmid Midi Kit» («Qiagen», Германия). С помощью соответствующих 55 олигонуклеотидных праймеров амплифицировались фрагменты, кодирующие кДНК РТ-генов и гена GAPDH человека. ПЦР-фрагменты были выделены из геля, очищены. Соответствие последовательностей полученных ПЦР-фрагментов и кДНК РТ-генов и гена GAPDH человека проверялось с помощью секвенирования. Секвенирование пользования проводилось «ГЕНОМ» в ИМБ Межинститутском РАН Центре коллективного (http://www.genome-centre.narod.ru/), организованном при поддержке РФФИ. Концентрация двуцепочечной ДНК ПЦРфрагментов была измерена с помощью спектрофотометра «Nanodrop8000». Все ПЦР-фрагменты, кодирующие кДНК РТ-генов человека, были смешаны в одинаковой концентрации 1 мкг/мл и разводились в ДНК спермы лосося (50 нг/мкл) до концентрации 0.1 мкг/мл, и далее готовились десятикратные разведения в ДНК спермы лосося. С полученными разведениями ПЦР-фрагментов и соответствующими праймерами (Приложение Б) проводилась ПЦР согласно пп.2.7.1 и 2.7.2. Условия проведения ПЦР: 94 ºС в течение 2 минут, 26 циклов 94 ºС в течение 40 секунд, 55 ºС в течение 1 минуты и 72 ºС в течение 1 минуты, затем 72 ⁰C в течение 2 минут. Было выбрано разведение, которое при данных условиях ПЦР давало положительный сигнал, аналогичный по интенсивности сигналу, получаемому при проведении ПЦР с кДНК, синтезированной из РНК клеточной линии MelKor. Это разведение ПЦР-фрагментов в ДНК спермы лосося (50 нг/мкл) далее использовалось в качестве положительного контрольного образца 2. Аналогичным образом был приготовлен положительный контрольный образец 1 для исследования экспрессии гена GAPDH человека. Чувствительность метода составила от 102 копий матрицы (при 38 циклах амплификации) до 105 копий матрицы (при 26 циклах амплификации). 56 2.7. Полимеразная цепная реакция 2.7.1. Состав реакции 2.7.1.1. Состав реакционной смеси Для проведения ПЦР с кДНК образцов использовался стандартный набор для амплификации ДНК «Gene Pak® PCR MasterMix Core» («IsoGene Lab. Ltd.», Россия). Объем реакционной смеси был равен 20 мкл. В реакции использовалась вода, очищенная от нуклеаз «HyClone HyPure™ Molecular Biology Grade Water». Для приготовления реакционной смеси в пробирку вносили: ПЦР растворитель (PCR Diluent) 10 мкл Праймер 3’ (концентрация 50 нг/мкл) 1 мкл, Праймер 5’ (концентрация 50 нг/мкл) 1 мкл Вода, очищенная от нуклеаз 7 мкл кДНК 1 мкл 2.7.1.2. Праймеры Дизайн праймеров к РТ-генам человека проводили с помощью программ «Primer Premier 6.00» («PREMIER Biosoft International») и «Primer-BLAST» («NCBI»). Олигонуклеотиды для проведения ПЦР были синтезированы в НПФ «Литех» (Россия). Последовательности праймеров, использованных для амплификации кДНК РТ-генов и гена GAPDH человека, приведены в Приложении Б. 2.7.2. Условия проведения ПЦР Условия проведения реакции ПЦР для каждой пары праймеров приведены в Приложении Б. ПЦР проводили в амплификаторе «DNA Engine Dyad® Peltier Thermal Cycler» («BIO-RAD», США). 57 2.8. Порядок проведения ПЦР для исследованных образцов Одновременно с приготовлением реакционных смесей для ПЦР с продуктами ОТ образцов контрольным тканей готовились образцом, с реакционные отрицательным смеси с положительным контрольным образцом, соответствующих исследуемым генам. Например, при анализе наличия мРНК гена GAPDH в образцах ткани также проводилась ПЦР с положительным контрольным образцом 1; а при анализе наличия мРНК гена MAGE-A3 в образцах ткани также проводилась ПЦР с положительным контрольным образцом 2. При исследовании экспрессии РТ-генов человека в качестве отрицательного контрольного образца выступала реакционная смесь, в которую вместо матрицы добавлялся 1 мкл воды, очищенной от нуклеаз. Так как положительный контрольный образец 2 содержал смесь ПЦРфрагментов для каждого из анализируемых РТ-генов в одинаковой концентрации, его использовали в различных разведениях с учётом различного количества циклов амплификации для разных антигенов. При исследовании экспрессии РТ-генов MAGE-A3, MAGE-A4, MAGE-A10, BAGE – 1:100, при анализе экспрессии MAGEA12, NY-ESO-1 – 1:500, GAGE – 1:10. Для каждого образца качество синтезированной кДНК сначала оценивали по экспрессии гена GAPDH. Только в тех опытных образцах, в которых учёт результатов позволял сделать заключение о наличии экспрессии гена GAPDH, исследовалась экспрессия РТ-генов. Продукты ПЦР детектировались с помощью электрофореза в агарозном геле. 2.9. ДНК-электрофорез в агарозном геле Учёт результатов ПЦР проводили методом горизонтального электрофореза в 1,5% агарозном геле, содержащем трис-боратный буфер («AppliСhem», Германия) с бромистым этидием (0.015 мг на 100 мл геля). В качестве маркера молекулярного веса ДНК использовался «O’Gene Ruler 50 bp DNA Ladder» («Fermentas», Литва). 58 Электрофоретическое разделение продуктов амплификации проводили с напряженностью 4,6 В/см в течение 20-30 минут. 2.10. Регистрация результатов исследования Полученные результаты регистрировали с помощью гель-документирующей системы «Gel Doc XRS» («BIO-RAD», США) в ультрафиолетовом свете длиной волны 254 нм или 302 нм. Электрофореграммы обрабатывали с помощью программы «Quantity One» и «Adobe Photoshop CS5». 2.11. Учет результатов исследования Отрицательные контроли: «ОТ-» – в заданном диапазоне полосы отсутствуют. Появление каких-либо полос в отрицательных контролях свидетельствует о присутствии геномной ДНК или контаминации чужеродной ДНК. Положительный контроль: Детектируется одна полоса в заданном диапазоне, размер ожидаемого фрагмента указан в Приложении Б. Исследуемые образцы РНК: В «ОТ+» пробе – наличие одной полосы соответствующего для каждой пары праймеров размера (размеры ожидаемых фрагментов приведены в Приложении Б). В «ОТ-» пробе – отсутствие сигнала. Появление каких-либо полос в «ОТ-» пробе свидетельствует о присутствии геномной ДНК или контаминации чужеродной ДНК. При выполнении этих двух условий сигнал в «ОТ+» пробе можно интерпретировать как экспрессию исследуемого гена в данном образце. При использовании раствора праймеров к кДНК генов GAGE в «ОТ+» пробе образца может детектироваться наличие второго фрагмента, имеющего размер 59 401 п.н. Наличие этого фрагмента может свидетельствовать об экспрессии гена GAGE1 (CT4.1) в данном образце. При этом в «ОТ-» пробе фрагмент, имеющий такой же размер (401 п.н.), должен отсутствовать. При использовании раствора праймеров к кДНК генов BAGE в «ОТ-» пробе образца может детектироваться наличие второго и третьего фрагментов, имеющих размеры 256 и 328 п.н. Наличие фрагмента размером 328 п.н. может свидетельствовать об экспрессии гена BAGE1 (CT2.1), а фрагмента размером 256 п.н. – об экспрессии генов BAGE2 (CT2.2) и/или BAGE3 (CT2.3). При этом в «ОТ-» пробе фрагменты, имеющие такие же размеры (256, 328 п.н.), должны отсутствовать. 2.12. Анализ транскриптома клеточной линии MelP, входящей в состав генно-клеточной противоопухолевой вакцины «Аллоген» 2.12.1. Клеточная линия меланомы MelP Клеточная линия меланомы человека MelP была получена из опухолевого материала пациента с меланомой. Она была использована для создания генноклеточной противоопухолевой вакцины «Аллоген» [203]. Клетки культивировали в среде RPMI-1640 («HyClone», США) c добавлением 10 % эмбриональной бычьей сыворотки («HyClone», США), 2 мМ L-глутамина («HyClone», США), 100 ед/мл пенициллина («ОАО Синтез», Россия) и 100 мкг/мл стрептомицина («ОАО Биохимик», Россия) в условиях 7 % CO2, 95 % влажности и температуре 37 ºС в пластиковых матрасах («Corning Incorporated», США). 2,5*106 клеток высевали на чашки диаметром 10 см. Через 72 часа клетки подвергались лизису и дальнейшему выделению РНК. 2.12.2. Выделение тотальной РНК, оценка количества, качества, обработка ДНКазой Для лизиса клеток чашки вынимали из инкубатора, в течение 1 минуты с чашек отбирали питательную среду и незамедлительно лизировали клетки 60 буфером, входящим в состав набора «RNeasy Protect Mini Kit» («Qiagen», США). Далее следовали инструкции производителя. РНК элюировали 30-40 мкл воды. Концентрацию РНК измеряли с помощью спектрофотометра «Nanodrop8000». Для разрушения следов ДНК тотальную РНК обрабатывали ДНКазой «RQ1 RNase-Free DNase» согласно инструкции производителя. Качество тотальной РНК – RIN (RNA Integrity Number – показатель цельности РНК) определяли на приборе «Bioanalyzer» («Agilent», США), использующем электрофоретическое разделение образца на чипе «Agilent ®RNA Nano 6000 Kit» («Agilent», США), сопряжённое с детекцией флуоресценции. Библиотеки приготавливались из образцов тотальной РНК с RIN ≥7. 2.12.3. Выделение мРНК мРНК образца получали с помощью набора «Dynabeads®mRNA Purification Kit» («Life Technologies», США), согласно рекомендациям производителя. Проводили два раунда очистки мРНК. Количество РНК на этом и всех последующих этапах измеряли спектрофлуориметрически на приборе «Qubit» («Invitrogen», США) набором «Qubit ®RNA HS Assay Kit» («Molecular Probes», США). Отсутствие рРНК контролировали по результатам анализа образцов на приборе «Bioanalyzer» в сочетании с чипами «Agilent ®RNA Nano 6000 Kit». 2.12.4. Построение фрагментной библиотеки На построение фрагментных библиотек брали не меньше 125 нг мРНК. РНКбиблиотеки приготавливали с помощью набора «Ion Total RNA-Seq Kit v2» («Life Technologies», США) согласно инструкции производителя. Для этого мРНК фрагментировали ферментативно, распределение фрагментов РНК оценивали по результатам анализа на «Bioanalyzer» в сочетании с чипами «Agilent ®RNA Pico 6000 Kit» («Agilent», США). В среднем длина пика фрагментирования была равна 120 нуклеотидам (разброс 100-140 нуклеотидов). Далее фрагментированная РНК выпаривалась на вакуумном концентраторе до 3 мкл, в которых содержалось не менее 50 нг РНК. Для создания баркодированных библиотек использовали набор 61 «IonXpress ™RNA-Seq Barcode 01–16 Kit». Для амплификации кДНК проводили 14 циклов ПЦР. Концентрацию готовой РНК-библиотеки измеряли спектрофлуориметрически на приборе «Qubit» набором «Qubit ®DNA HS Assay Kit» («Molecular Probes», США). Распределение длин фрагментов РНК-библиотеки и молярность определяли при анализе на чипах «Agilent ®High Sensitivity DNA Kit» («Agilent», США). 2.12.5. Секвенирование РНК-библиотек Амплификацию и обогащение РНК-библиотек проводили с помощью набора «Ion PI ™Template OT2 200 Kit v2» («Life Technologies», США) согласно инструкции производителя. Так как планировалось проводить секвенирование двух библиотек на одном чипе, то перед приготовлением смеси для амплификации две библиотеки смешивались эквимолярно. Секвенировали РНК-библиотеки на приборе «Ion Proton» («Life Technologies», США). Для запуска использовали набор «Ion PI™ Sequencing 200 Kit v2» («Life Technologies», США) и чипы «Ion PI ™ Chip Kit v2» («Life Technologies», США). 2.12.6. Биоинформатическая обработка результатов секвенирования транскриптомов меланомы Количество прочтений для транскриптомных библиотек варьировалось от 45 млн. до 50,5 млн. Средняя длина прочтения 110 п.н. Результаты секвенирования были экспортированы из программного обеспечения «Torrent Server» в виде fastaq файлов. Дальнейший анализ производился с помощью программы «CLC Genomic Workbench» («Qiagen», США). Fastaq файлы для каждой библиотеки импортировались в программу, прочтения обрезались по длине (оставляли только прочтения ≥35 п.н.) и качеству (Q≥17). Далее проводили картирование с помощью пакета RNA-Seq, предоставляемого CLC. В качестве референсного генома использовали сборку hg19 (Genome Reference Consortium), и аннотацию по транскриптам, все референсные файлы загружались в программу с помощью прямых ссылок. Использовалось картирование только на генные регионы. После 62 получения результатов картирования, в частности значений относительного уровня экспрессии генов RPKM (reads per kilobase per million of reads – число прочтений на тысячу пар оснований экзона на миллион прочтений), файлы экспортировали из «CLC Genomic Workbench» в виде таблиц Microsoft Excel, и далее обработка результатов проводилась в «Microsoft Office Excel 2007» («Microsoft Corp.», США). 2.13. Статистическая обработка результатов анализа экспрессии генов Все вычисления проводились с помощью программы «GraphPad Prizm 6» («GraphPad Software Inc.», США). Экспрессия каждого гена оценивалась как качественный признак – «есть» или «нет». Для анализа качественных признаков был выбран двунаправленный критерий Фишера, так как учитывались следующие условия [204]: 1. Это когортное исследование (диагноз известен на момент анализа) 2. Сравниваемые образцы не были связаны между собой 3. Объем выборки небольшой (ожидаемые числа меньше 5 в некоторых группах). Ставилась нулевая гипотеза, что отсутствует ассоциация между распределением наличия/отсутствия экспрессии РТ-генов и типом ткани (опухолевая или нормальная (или предрак)). Значение p критерия Фишера показывает точную частоту, с которой данное распределение по группам обусловлено случайностью. Нулевая гипотеза отвергалась при значении p<0.05. Также вычислялось значение вероятности положительного исхода – odds ratio (OR), которое показывает насколько наличие/отсутствие экспрессии РТ-генов ассоциируется с принадлежностью (предраковой) ткани, и наоборот. образца к опухолевой/нормальной 63 3. Результаты и обсуждение 3.1. Разработка набора реагентов для молекулярногенетической диагностики экспрессии РТ-генов методом полимеразной цепной реакции Предпосылкой создания валидированного набора реагентов для определения экспрессии РТ-генов является необходимость диагностического сопровождения клинических испытаний генно-клеточных противоопухолевых вакцин, предназначенных для терапии и профилактики метастазирования меланомы и разработанных в ИБГ РАН. При рациональном выборе пациентов для участия в клинических испытаниях необходимо учитывать комплементарность профилей экспрессии опухолевых генов в вакцинах и в опухолевой ткани пациента. Желательно, чтобы в опухолевых клетках пациента и в клетках вакцины экспрессировались одни и те же гены, и, соответственно, антигены. При развитии иммунного ответа на антигены клетки вакцины, например, РТ-антигены, антигенспецифические клетки и антитела будут действовать перекрестно и на опухолевые клетки. Оценить профиль экспрессии РТ-генов в опухоли пациента можно с помощью полимеразной цепной реакции с продуктом обратной транскрипции и специфическими праймерами к РТ-генам. Подобное исследование при использовании в клинических испытаниях должно выполняться с помощью валидированной и разрешённой к применению на территории Российской Федерации тест-системы (ФЗ №323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", Правила государственной регистрации медицинских изделий, утвержденные постановлением Правительства РФ №1416 от 27.12.12 г.). Так как набор, отвечающий таким требованиям, отсутствовал, он был разработан и зарегистрирован в ходе данной диссертационной работы. 3.1.1.Выбор генов для набора реагентов При выборе генов был проведен литературный анализ информации о РТгенах, экспрессирующихся в меланомах, так как в состав генно-клеточных вакцин 64 входят клеточные линии меланом. Учитывалось, что РТ-антигены, кодирующиеся выбираемыми РТ-генами, могут вызывать развитие клеточного и/или гуморального ответа. В качестве генов-кандидатов также рассматривались РТ-гены, часто экспрессирующиеся во многих типах опухолей. Далее была исследована экспрессия выбранных РТ-генов (MAGE-A3, MAGE-A4, MAGE-A6 MAGE-A10, MAGE-A12, гены семейства BAGE, MAE-B1, MAGE-B2, гены семейства GAGE, NY-ESO-1, MAGE-C1) в клеточных линиях меланом, входящих в состав вакцин «Аллоген» и «Компливак». Результаты этого анализа приведены в Таблице 2. Было выяснено, что все выбранные гены экспрессируются в клеточных линиях вакцин и могут быть использованы для создания набора реагентов. Таблица 2 – Экспрессия РТ-генов в клеточных линиях вакцин «Аллоген» (клеточная линия MelP) и «Компливак» (клеточные линии 1, 2, 3), где «+» – экспрессия обнаружена, «-» – экспрессия не обнаружена. Название Клеточной линии Клеточная линия 1 Клеточная линия 2 Клеточная линия 3 MelP Название раково-тестикулярного гена MAGEA3 MAGEA4 MAGEA6 MAGEA10 MAGEA12 BAGE MAGEB1 MAGEB2 GAGE2, GAGE3, GAGE4 LAGE1a NY-ESO-1 + + + + + + + + + + + + + + + + + - + + - + + + + + + + - + + - - + - + - + - - + - - - При исследовании экспрессии РТ-генов в нормальной ткани слизистой оболочки полости рта было обнаружено, что в ней детектируется наличие мРНК генов MAGE-B1 и MAGE-B2 (см. Рисунок 1 и Рисунок 2). Согласно базе данных по раково-тестикулярным генам www.cta.lncc.br, экспрессия MAGE-B1 и MAGE-B2 должна отсутствовать в нормальных тканях. В связи с несоответствием результатов собственного анализа и литературных данных было решено исключить MAGE-B1 и MAGE-B2 из списка генов, подходящих для набора реагентов. 65 Рисунок 1 – Электрофореграмма продуктов ПЦР с использованием праймеров к гену MAGE-B1 и материала реакции RT: «1» – положительный контроль, «2» – отрицательный контроль, «6.1-14.2» - образцы слизистой ротовой полости, «RNA-RT» – контроль компонентов ОТ, «К-» – контроль компонентов ПЦР. 100bp – маркер молекулярного веса ДНК 100bp DNA Ladder. Рисунок 2 – Электрофореграмма продуктов ПЦР с использованием праймеров к гену MAGE-B2 и материала реакции RT«1» – положительный контроль, «2» – отрицательный контроль, «6.1-14.2» - образцы слизистой ротовой полости, «RNA-RT» – контроль компонентов ОТ, «К-» – контроль компонентов ПЦР. 100bp – маркер молекулярного веса ДНК 100bp DNA Ladder. 66 3.1.2. Исследование экспрессии раково-тестикулярных генов в клеточной линии Mel P с помощью полнотранскриптомного секвенирования. С помощью полнотранскриптомного секвенирования клеточной линии MelP, входящей в состав вакцины «Аллоген», была изучена представленность РТ-генов, выбранных для создания набора реагентов, среди всех известных РТ-генов. Исследование было проведено в трёх повторах, вычислено среднее значение относительного уровня экспрессии для каждого РТ-гена (RPKM). Данные по экспрессии РТ-генов, имеющих в среднем RPKM>1, а также уровни экспрессии генов «домашнего хозяйства» GAPDH и β-актина приведены в Приложении В. В результате обработки и анализа первичных данных было показано, что гены, выбранные для включения в состав набора реагентов, экспрессируются с наибольшей интенсивностью по отношению к большинству известных РТ-генов (Рисунок 3). Рисунок 3. Представленность транскриптов РТ-генов, выбранных для набора реактивов среди транскриптов всех РТ-генов, экспрессирующихся в клеточной линии MelP. 67 Таким образом, экспрессию генов, широко представленную в клетке, можно детектировать при выполнении небольшого количества циклов ПЦР (20-30). При детекции в агарозном геле сигнал наличия специфического ПЦР-продукта будет присутствовать в ожидаемом диапазоне длин ДНК-фрагментов, а «шумы» (неспецифическая амплификация) будут отсутствовать. 3.1.3. Подготовка документов для регистрационного досье «Набора реагентов для молекулярно-генетической диагностики экспрессии РТ-антигенов методом полимеразной цепной реакции (РТ-антиген)» Для того чтобы обеспечить производство набора реагентов были решены технические и технологические задачи, результаты отражены в разработанном лабораторном и опытно-промышленном регламентах (Рисунок 4а и 4б). Лабораторный и опытно-промышленный регламенты на производство набора были разработаны в соответствии с требованиями ОСТ 42-1-83 «Регламент производства медицинских иммунобиологических препаратов». В частности, в этих документах были решены вопросы характеристик конечного продукта и исходного сырья, обладающих минимальной лотовой вариабельностью. Разработана и апробирована технологическая схема производства. На неё наложена аппаратурная схема производства, подобрано оборудование, которое соответствует метрологическим требованиям. Решены важные задачи, связанные с обезвреживанием отходов производства. Разработаны стандартные операционные процедуры и производственные инструкции для всех этапов производства, для контроля качества, для входящего контроля сырья. Производство осуществляется с выполнением всех существующих требований к безопасности окружающей среды. Основные этапы производства: 1. Водоподготовка 2. Санитарная подготовка производства 3. Подготовка оборудования, материалов и сырья 4. Приготовление контрольных образцов 5. Розлив и укупорка реагентов набора и охране 68 6. Упаковка и маркировка Одним из ключевых документов, который необходим при регистрации, являются технические условия (Рисунок 4в). Это нормативный документ является основополагающим по контролю за качеством и валидацией, производимых наборов и анализов. В Технических соответствовать набор; условиях указаны приведены требования показатели, к которым комплектности, должен упаковке, маркировке, транспортировке, хранению, гарантии производителя. а) б) в) Рисунок 4 – Титульные листы нормативных документов, необходимых для регистрации «Набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)»: а) «Лабораторного регламента»; б) Опытнопромышленного регламента; в) «Технические условия». 69 В данном документе также определены требования к безопасности набора, правила приёмки и методы контроля качества выпускаемого товара. Каждая серия готового набора должна быть принята отделением биологического и технического контроля (ОБТК) предприятия-изготовителя после проведения всех этапов контроля качества. Этапы контроля качества продукции: 1. Визуальная оценка соответствия органолептических и физических свойств компонентов набора 2. Определение специфичности набора с помощью проведения ПЦР с контрольным образцом специфичности (КОС) 3. Определение чувствительности набора с помощью проведения ПЦР с контрольными образцами чувствительности 1 и 2 (КОЧ1 и КОЧ2). По результатам подготовки нормативных документов был установлен окончательный состав набора реактивов и правила его использования. 3.1.4. Состав набора реагентов В состав набора входят праймеры для исследования экспрессии раковотестикулярных генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, GAGE, NY-ESO-1, LAGE-1a, BAGE (Таблица 3). Данный набор содержит также праймеры к гену GAPDH, что даёт возможность проводить качественную оценку выделенной из исследуемых образцов РНК. Праймеры, входящие в данный набор, позволяют достоверно фиксировать наличие информационной РНК в анализируемом образце, кодирующей соответствующие антигены. По результатам экспериментальной части работы делается заключение об экспрессии конкретных опухолевых антигенов в клетках гистологического материала пациента, клеточных линиях и первичных культурах, полученных из опухолевых тканей пациентов. 70 Таблица 3 – Праймеры, входящие в состав «Набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)» Название гена GAPDH MAGE-A3 (ген CT1.3) MAGE-A4 (ген CT1.4) MAGE-A6 (ген CT1.6) MAGE-A10 (ген CT1.10) MAGE-A12 (ген CT1.12) GAGE (гены CT4.2-CT4.8) NY-ESO-1 (ген CT6.1) LAGE-1a (ген CT6.2a) BAGE (гены CT2.2, CT2.3) Обозначение праймеров в наборе Раствор праймеров 0 (GAP) Раствор праймеров 1 (МА3) Раствор праймеров 2 (МА4) Раствор праймеров 3 (МА6) Раствор праймеров 4 (МА10) Раствор праймеров 5 (МА12) Раствор праймеров 6 (GА) Раствор праймеров 7 (NY) Раствор праймеров 8 (LА) Раствор праймеров 9 (ВА) Особое место при разработке тест-системы уделялось выбору контролей (процесс приготовления контрольных образцов описан в главе 2.6). Сам метод ПЦР чувствителен к различным факторам, поэтому о правильности проведения исследований можно судить только при воспроизведении положительного и отрицательных контролей. В состав набора входят два положительных контрольных образца. Положительный контрольный образец 1 используется при проведении ПЦР с праймерами к гену GAPDH для оценки качества исследуемой РНК. Положительный контрольный образец 2 используется при проведении ПЦР с праймерами к РТ-генам. В качестве отрицательного контроля используется вода. Для визуализации результатов анализа применяется метод горизонтального электрофореза, разделяющего фрагменты ДНК в агарозном геле. В норме регистрируется отсутствие полос в заданном диапазоне относительно маркера молекулярного веса, а при онкологическом заболевании может регистрироваться одна (праймеры 1, 2, 3, 4, 5 и 7), две (праймеры 6 и 8) или три (праймеры 9) полосы в этом же диапазоне. 71 3.1.5. Валидация тест-системы 3.1.5.1. Технические испытания Специфичность и чувствительность положительных контрольных образцов 1 и 2, входящих в набор, проверялась в ходе трёх серий технических испытаний (Рисунок 5 и 6). Рисунок 5 – Электрофореграмма технических испытаний «Набора реагентов для молекулярно-генетической диагностике раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)», где «К+» – положительный контрольный образец 2, «К-» – отрицательный контрольный образец, «КОЧ1» – контрольный образец чувствительности 1, «КОЧ2» – контрольный образец чувствительности 2, «КОС» – контрольный образец специфичности, М – маркер молекулярного веса ДНК 72 Рисунок 6 – Электрофореграмма технических испытаний «Набора реагентов для молекулярно-генетической диагностике раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)», где «К+» – положительный контрольный образец 1, «К-» – отрицательный контрольный образец, «КОЧ1» – контрольный образец чувствительности 1, «КОЧ2» – контрольный образец чувствительности 2, «КОС» – контрольный образец специфичности, М – маркер молекулярного веса ДНК В ходе испытания каждой пары праймеров контролировалось наличие яркого сигнала положительного контрольного образца (K+) в диапазоне длин фрагментов, специфических для данного гена, контролировалось отсутствие сигнала в отрицательном контрольном образце и в контрольном образце специфичности (КОС). В контрольном образце чувствительности 1 (КОЧ1) должен детектироваться сигнал в диапазоне длин фрагментов, специфических для данного гена. В контрольном образце чувствительности 2 (КОЧ2) специфический сигнал может присутствовать или может отсутствовать, так как концентрация мишени в данном образце низкая, на нижней границе чувствительности. Чувствительность набора реагентов «РТ-антиген» составила 102 копий матрицы (при 38 циклах амплификации) до 105 копий матрицы (при 26 циклах амплификации). Все пары праймеров сработали в трех сериях испытаний с контрольными образцами, согласно приведенным выше требованиям. 3.1.5.2. Медицинские испытания После того, как три серии набора прошли все этапы контроля качества на контрольных образцах, были проведены медицинские испытания на биообразцах. В ходе данных испытаний контролировалась воспроизводимость результатов в 73 заявленных типах биологических образцов пациентов с подтвержденным диагнозом. Медицинские испытания включали 3 этапа, в ходе каждого из них тестировалась работа набора на разном типе биообразцов. На первом этапе испытаний участвовали биопсийные образцы злокачественных новообразований (РМЖ, плоскоклеточного рака СОПР) и клеточных линий меланомы. На втором этапе испытывали набор на образцах злокачественных опухолей (РМЖ, плоскоклеточного рака СОПР, меланома, аденокарциномы кишечника) и доброкачественных новообразованиях (полипах кишечника, лейкоплакии СОПР, доброкачественных опухолях молочной железы, невусах)), результаты приведены на Рисунках 7 и 8 соответственно. Экспрессия хотя бы одного РТ-гена была детектирована у 12 из 15 пациентов с диагнозом рак, и только у одного пациента из группы доброкачественных заболеваний (NY-ESO-1 у пациента с фиброаденомой молочной железы). Было подтверждено, что наличие экспрессии хотя бы одного из панели РТ-генов статистически достоверно ассоциируются с опухолевыми заболеваниями (p=0.0001, двунаправленный критерий Фишера). Рисунок 7 – Электрофореграмма результатов медицинских испытаний «Набора реагентов для молекулярно-генетической диагностики раковотестикулярных антигенов методом полимеразной цепной реакции (РТантиген)», где «K+» – положительный контроль, «К-» – отрицательный контроль, 1-4 – образцы РМЖ, 5-6 – образцы аденокарциномы прямой кишки, «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. 74 Рисунок 8 – Электрофореграмма результатов второго этапа медицинских испытаний «Набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТантиген)», где «K+» – положительный контроль, «К-» – отрицательный контроль, 7-12 – образцы меланом, 13-15 – образцы плоскоклеточного рака СОПР, 16 – образец фиброаденомы молочной железы, 17-19 – образцы полипов прямой кишки, 20-22 – невусы кожи, «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. В ходе третьего этапа медицинских испытаний тестировалась специфичность анализа экспрессии РТ-генов набором реагентов «РТ-антиген» в биопсийных образцах злокачественных образований (РМЖ, карциномы прямой кишки, меланомы, плоскоклеточный рак слизистой оболочки полости рта) с помощью капиллярного секвенирования Секвенирование проводилось в последовательностей Межинститутском ПЦР-фрагментов. Центре коллективного пользования «ГЕНОМ» ИМБ РАН (http://www.genome-centre.narod.ru/). Консенсусные последовательности всех ПЦР-фрагментов имели высокий уровень гомологии (от 93% до100%) с последовательностями кДНК РТ-генов. На основании данных результатов третий этап испытаний был успешно выполнен, а экспериментальная часть процесса регистрации набора реагентов закончена. 3.1.5.3. Получение регистрационного удостоверения После представления всех нормативных документов, проведения успешных технических и медицинских испытаний приказом № 10362-Пр/10 от 09 ноября 2010 года Федеральной службы по надзору в сфере здравоохранения и социального развития Российской Федерации было разрешено производство, продажа и применение изделия медицинского назначения «Набора реагентов для 75 молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)» на территории Российской Федерации (Регистрационное удостоверение № ФСР 2010/09180 от 09 ноября 2010 года) (Рисунок 9). Рисунок 9 – Фотография регистрационного удостоверения на «Набор реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)». Внешний вид «Набора реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТантиген)» отражен на Рисунке 10. 76 Рисунок 10 – Внешний вид «Набора реагентов для молекулярногенетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)». Таким образом, был получен валидированный набор реагентов, который можно использовать для воспроизводимых и контролируемых научных исследований РТ-генов, но, что самое главное, он необходим для использования в клинических испытаниях разработанных ранее противоопухолевых вакцин, так как в соответствии с современными требованиями к клиническим испытаниям, все тесты должны быть одобрены Федеральной службой по надзору в сфере здравоохранения и социального развития Российской Федерации (ФЗ №323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации"). 3.2. Результаты исследования экспрессии раково-тестикулярных генов в образцах рака молочной железы Рак молочной железы – гетерогенное заболевание. На основании стандартных биомаркеров не всегда удается определить наилучший метод лечения и предсказать течение болезни. Было показано, что экспрессия РТ-генов ассоциируется с принадлежностью к группе тройных негативных опухолей и более высокой злокачественностью [152, 156, 157, 159]. РТ-антигены могут стать мишенями, диагностика которых повысит точность прогноза, а иммунотерапия – 77 стать терапией выбора для пациентов с раком молочной железы и, что самое важное, для пациентов с «тройным негативным» раком. Поэтому разработка диагностических и иммунотерапевтических подходов с использованием РТ-генов и РТ-антигенов является актуальной темой. Ранее в ИБГ РАН были разработаны генно-клеточные противоопухолевые вакцины «Компливак», и «Аллоген», экспрессирующие набор РТ-антигенов [14, 25]. Перспективы её применения для лечения больных с РМЖ не ясны, так как исследования экспрессии РТ-генов в образцах РМЖ у российских пациенток до настоящего времени не проводились. В связи с этим задачей работы явилось изучение профиля экспрессии РТ-генов в опухолевых тканях молочной железы у российских пациенток и его сопоставление с набором РТ-генов в клеточных линиях вакцин «Аллоген» и «Компливак». 3.2.1. Исследование экспрессии раково-тестикулярных генов в образцах нормальной ткани молочной железы Вначале было проведено исследование экспрессии РТ-генов MAGE-A3, –A4, -A6, -A10, -A12, NY-ESO-1, LAGE-1a, GAGE2-GAGE8, BAGE2, BAGE3 в образцах нормальной ткани молочной железы. По литературным данным экспрессия выбранных РТ-генов в нормальной ткани молочной железы отсутствует. На Рисунке 11 представлены результаты исследования экспрессии РТ-генов в образцах нормальной ткани молочной железы от трёх пациентов. Во всех образцах нормальной ткани молочной железы сигнал об экспрессии GAPDH был положительным, что свидетельствовало о том, что выделенная РНК и синтезированная из неё кДНК были в достаточном количестве и качестве для проведения анализа экспрессии РТ-генов. Ни в одном из образцов нормальной ткани молочной железы не было детектировано экспрессии РТ-генов. Поэтому можно предполагать, что наша система позволяет избежать ложноположительных результатов. 78 Рисунок 11 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах нормальной ткани молочной железы, где «K+» – положительный контроль, «К-» – отрицательный контроль, «3.2», «4.2», «5.2» образцы нормальной ткани молочной железы, «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. 3.2.2. Исследование экспрессии раково-тестикулярных генов в образцах рака молочной железы После того, как мы убедились, что подобранные нами условия анализа позволяли адекватно оценивать экспрессию РТ-генов в образцах ткани молочной железы, были исследованы образцы РМЖ. На Рисунках 12, 13, 14, 15, 16 приведены результаты исследования экспрессии РТ-генов в образцах РМЖ. Специфичность ПЦР-продуктов была проверена с помощью капиллярного секвенирования по Сэнгеру. Результаты исследования экспрессии РТ-генов в образцах РМЖ суммированы в Таблице 4. 79 Рисунок 12 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах РМЖ, где «K+» – положительный контроль, «К-» – отрицательный контроль, «1.1»-«9.1» – образцы РМЖ «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. Рисунок 13 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах РМЖ, где «K+» – положительный контроль, «К-» – отрицательный контроль, «10.1»-«15.1» – образцы РМЖ «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. 80 Рисунок 14 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах РМЖ, где «K+» – положительный контроль, «К-» – отрицательный контроль, «16.1»-«23.1» – образцы РМЖ «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. Рисунок 15 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах РМЖ, где «K+» – положительный контроль, «К-» – отрицательный контроль, «24.1»-«33.1» – образцы РМЖ «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. 81 Рисунок 16 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах РМЖ, где «K+» – положительный контроль, «К-» – отрицательный контроль, «34.1»-«41.1» – образцы РМЖ «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. Таблица 4 – Частота экспрессии РТ-генов в образцах рака молочной железы. Название гена, экспрессия которого была исследована Количество Частота образцов, экспрессии гена экспрессирующих (всего 41 ген образец) Частота экспрессии гена по литературным данным MAGE-A3 7 17,1% 10-14[148, 158, 205] MAGE-A4 11 26,8% 4-13[148, 158] MAGE-A6 7 17,1% 15[158] MAGE-A10 5 12,2% 7,6[149] MAGE-A12 9 22,0% 9[158] GAGE2-GAGE8 NY-ESO-1 4 17 9,8% 41,5% 8-26[148, 205] 10,1-48[148, 149, 205, 206] LAGE-1a 2 4,9% 3,1-5,4[149, 206] BAGE2, BAGE3 2 4,9% 2-10 [149, 205] 82 В результате нашей работы были впервые получены данные о частоте экспрессии РТ-генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, GAGE2-GAGE8, BAGE2 и BAGE3, NY-ESO-1, LAGE1a в РМЖ населения Российской Федерации. Значения частоты экспрессии генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12 отличались от тех, что описаны в литературе [148, 149, 158, 205]. Значения частоты экспрессии генов NY-ESO-1, BAGE2, BAGE3, LAGE1a, GAGE2-GAGE8 были сходны с литературными данными [148, 149, 158, 205, 206]. 3.2.3. Сопоставление профиля экспрессии РТ-генов в образцах рака молочной железы с набором РТ-генов клеточных линий противоопухолевых вакцин «Компливак» и «Аллоген» Поливалентные вакцины, разработанные в ИБГ РАН, содержат набор опухолевых антигенов, и все из них экспрессировались в исследованных образцах рака молочной железы (Рисунок 17). Рисунок 17 – Сопоставление профиля экспрессии РТ-генов в образцах РМЖ и в клеточных линиях, входящих в состав вакцины «Компливак» и «Аллоген», на диаграммах отражена доля образцов, в которых профиль экспрессии РТ-генов комплементарен набору РТ-генов в соответствующей клеточной линии. 83 Анализ доли пациентов, которые имеют профиль экспрессии РТ-генов, перекрывающийся с каждой из клеточных линий вакцин, подтвердил важность комбинации нескольких клеточных линий в вакцине. Противоопухолевая вакцина «Аллоген» состоит только из клеточной линии MelP. Набор РТ-генов, экспрессирующихся в ней, пересекается с профилем экспрессии РТ-генов лишь у 56% потенциальных пациентов-участников. Противоопухолевая вакцина «Компливак» является поливалентной и содержит в своём составе клеточные линии 1, 2 и 3, поэтому ей можно охватить всех пациентов, потенциальных участников испытаний, которые имеют экспрессию хотя бы одного РТ-гена из панели набора реагентов «РТ-антиген». Всего экспрессия хотя бы одного из исследованных генов была детектирована в 27 из 41 образца (65,7%). Количество генов, экспрессировавшихся у каждого пациента, приведено в Рисунок 18. Рисунок 18 – Распределение пациентов по количеству РТ-генов из панели набора реактивов (экспрессия у каждого отдельного пациента). Таким образом, у 15 пациентов с РМЖ отсутствуют РТ-антигены, которые есть в клеточных линиях вакцин. Введение такому пациенту клеток вакцины, на которых экспрессируются РТ-антигены, вызвало бы формирование клеточного и 84 гуморального иммунного ответа против РТ-антигенов. Антигенспецифические клетки не смогли бы распознать и лизировать опухолевые клетки, так как на них отсутствуют РТ-антигены. В связи с этим, участие данных пациентов в клинических испытаниях противоопухолевых вакцин «Компливак» или «Аллоген» было бы малоэффективным и нецелесообразным. Наличие экспрессии РТ-генов из панели набора реагентов «РТ-антиген» обеспечивает перекрёст в антигенном профиле клеток вакцины и клеток опухоли пациента, а значит, увеличивается вероятность того, что антигенспецифические клетки будут эффективно воздействовать на клетки опухоли. Показанная в настоящей работе достаточно высокая частота экспрессии РТ-генов обусловливает целесообразность дальнейших исследований потенциала противоопухолевых вакцин, содержащих РТ-антигены, для иммунотерапии российских пациенток с различными клиническими формами РМЖ. В связи с этим также можно заключить, что есть все основания для применения набора реагентов «РТ-антиген» для отбора пациентов для иммунотерапии РМЖ на основании экспрессии РТ-генов. 3.3. Результаты исследования экспрессии раково-тестикулярных генов в образцах лейкоплакии и плоскоклеточного рака слизистой оболочки полости рта 3.3.1. Экспрессия раково-тестикулярных генов в образцах нормальной слизистой оболочке полости рта Лейкоплакия является предраковым заболеванием, которое развивается из нормальной ткани и, в свою очередь, может трансформироваться в рак. Поэтому для того, чтобы проверить объективность выбранного метода анализа экспрессии РТ-генов, было необходимо исследовать образцы нормальной СОПР и образцы плоскоклеточного рака СОПР. Согласно литературным данным, в нормальной слизистой интересовавшие нас РТ-гены не экспрессируются [207, 208], поэтому пробы нормальной СОПР пациентов с лейкоплакией выступали в качестве отрицательного контроля. В результате учёта ПЦР в контрольных образцах нормальной СОПР, экспрессия всех исследованных РТ-генов отсутствовала (Рисунок 19). Полученные результаты соответствуют данным литературы, поэтому 85 можно считать, что подобранные условия анализа экспрессии выбранных РТ-генов позволяют избежать ложноположительных результатов. Рисунок 19 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах нормальной СОПР, где «K+» – положительный контроль, «К-» – отрицательный контроль, «1Н»-«15Н» – образцы нормальной СОПР, «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. 3.3.2. Экспрессия раково-тестикулярных генов в образцах плоскоклеточного рака слизистой оболочки полости рта С помощью набора реагентов «РТ-антиген» была исследована экспрессия РТ генов MAGE-A3, –A4, -A6, -A10, -A12, GAGE2-GAGE8, NY-ESO-1, BAGE2 и BAGE3 в 16 образцах плоскоклеточного рака СОПР. В образцах плоскоклеточного рака СОПР была обнаружена экспрессия генов MAGE-A3 (в 10-ти образцах, 62,5%); MAGE-A4 (в 8-ми образцах, 50%); MAGE-A6 (в 9-ти образцах, 56,3%); MAGE-A10 (в 2-х образцах, 12,5%); MAGE-A12 (в 9-ти образцах, 56,3%); GAGE (в 2-х образцах, 12,5%); NY-ESO-1 (в 6-ти образцах, 37,5%) (Рисунок 20). Конкретные значения частоты экспрессии каждого гена в работах, посвящённых исследованию экспрессии РТ-генов в плоскоклеточном раке, варьируются. Однако можно выявить некоторые закономерности в экспрессии разных семейств РТ-генов: с наибольшей частотой экспрессируются РТ-гены семейства MAGE, а гены семейств GAGE, BAGE – с наименьшей [207-211]. Эти закономерности прослеживались и в наших результатах. Также общая доля плоскоклеточных карцином СОПР, в 86 которых была обнаружена экспрессия РТ-генов (87,5%), соответствует уровню, приведённому в работах других исследователей [207, 209]. Рисунок 20 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах плоскоклеточного рака СОПР, где «K+» – положительный контроль, «К-» – отрицательный контроль, «1Р»-«16Р» – образцы плоскоклеточного рака СОПР, «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. Частота экспрессии раково-тестикулярных генов MAGE-A10 и GAGE2GAGE8 низкая, поэтому вычисление ассоциации для данных генов нецелесообразно. Напротив, частота экспрессии генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12, NY-ESO-1 высокая, и наличие экспрессии хотя бы одного из данных генов достоверно ассоциировалось с плоскоклеточным раком полости рта (p=0.0002, p=0.0024, p=0.0008, p=0.0008, p=0.0177 соответственно; двунаправленный критерий Фишера). При наличии только экспрессии гена MAGE-A3 вероятность того, что образец ткани является опухолевым (OR), в 50,1 раз выше, чем при её отсутствии. Для наличия экспрессии только гена MAGE-A4 значение OR равно 33,0; для MAGE-A6 OR равно 39,27; для MAGE-A12 – также 39,27; а для NY-ESO-1 OR равно 19,2. А наличие экспрессии хотя бы одного из группы MAGE-A генов (-A3, -A4, -A6 или – A12) повышает вероятность того, что образец является опухолевой тканью в 179,8 раз. 87 3.3.3. Результаты исследования экспрессии раково-тестикулярных генов в образцах лейкоплакии слизистой оболочки полости рта После того, как мы убедились, что наша аналитическая система позволяет адекватно детектировать экспрессию РТ-генов в образцах рака и ее отсутствие в нормальной ткани, мы исследовали образцы предрака – лейкоплакии СОПР (Рисунок 21). Во всех образцах, кроме 13Л, экспрессия РТ-генов отсутствовала. В образце 13Л (веррукозной лейкоплакии без дисплазии) была обнаружена экспрессия РТгенов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12. Веррукозная лейкоплакия развивается из простой лейкоплакии и имеет более высокий риск трансформации в плоскоклеточный рак СОПР. Экспрессия РТ-генов в данном типе лейкоплакии отражает более выраженные молекулярные изменения, сопровождающие развитие веррукозной лейкоплакии. Экспрессия исследованных РТ-генов полностью отсутствовала в образцах лейкоплакии с низким риском злокачественной трансформации (образцы простых лейкоплакий 1Л, 2Л, 4Л, 6Л, 7Л, 8Л, 9Л, 11Л, 15Л). Рисунок 21 – Электрофореграммы результатов исследования экспрессии РТ-генов в образцах лейкоплакии СОПР, где «K+» – положительный контроль, «К-» – отрицательный контроль, «1Л»-«15Л» – образцы лейкоплакии СОПР «+» – положительная проба ОТ, «-» – отрицательная проба ОТ, «M» – маркер молекулярного веса ДНК. С помощью двунаправленного критерия Фишера была сравнена частота экспрессии РТ-генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12, NY-ESO-1 в плоскоклеточном раке СОПР и в лейкоплакии СОПР с низким риском 88 озлокачествления (9 образцов). Результаты анализа подтвердили, что отсутствие экспрессии данной панели РТ-генов достоверно ассоциировалось с принадлежностью образца к лейкоплакии с низким риском злокачественной трансформации (p<0.0001). Полученные результаты показывают возможность использования теста на экспрессию вышеперечисленных РТ-генов в качестве молекулярных маркеров плоскоклеточного рака СОПР у лиц с лейкоплакией. Это согласуется с данными Metzler P. Et al. [194] и Ries J. Et al. [193], которые предложили использовать анализ экспрессии РТ-генов семейства MAGE-A и NY-ESO-1 в образцах лейкоплакии в качестве метода ранней диагностики карциномы СОПР, например, у пациентов с раком СОПР в анамнезе и у пациентов с лейкоплакиями СОПР с неопределенным риском злокачественной трансформации. Наше исследование подтверждает целесообразность введения такого анализа в клиническую практику. На основании полученных результатов нельзя однозначно сказать, о каких молекулярных нарушениях может говорить экспрессия РТ-генов в предраковом заболевании. Лейкоплакия СОПР является проявлением нарушения процесса деления клеток – гиперплазией и/или дисплазией. Возможно, что повышенная активность камбиальных элементов эпителия приводит к экспрессии РТ-генов. Например, это подтверждается экспрессией гена MAGE-A1 в заживающей кожной ране [212]. Прослеживается тенденция, что чем больше клетки похожи на зародышевые, тем чаще в них экспрессируются РТ-гены. Это верно и для опухолевых клеток: чем они меньше дифференцированы, тем выше в них экспрессия РТ-генов. В многочисленных исследованиях показана ассоциация экспрессии РТ-генов с повышенной степенью злокачественности и худшим прогнозом [72, 76, 123, 213]. Все эти сведения являются теоретическими предпосылками того, что экспрессия РТ-генов в лейкоплакии могла бы быть прогностическим маркёром повышенного риска злокачественной трансформации в плоскоклеточный рак. Выяснить наличие прогностического значения экспрессии РТ-генов для оценки риска злокачественной трансформации лейкоплакии возможно только в результате объёмных лонгитудинальных исследований. Обнаруженная в данной работе экспрессия РТ-генов в лейкоплакии подтверждает уместность проведения таких исследований. На данном этапе выявление 89 экспрессии РТ-генов в лейкоплакии СОПР указывает на необходимость более частого клинического обследования конкретного пациента. 3.4. Теоретическое обобщение литературных данных для обоснования перспективных направлений исследований функций MAGE-A антигенов Исследование РТ-антигенов ведётся в основном в трёх направлениях: выявление диагностического значения экспрессии РТ-антигенов и генов в различных опухолях, разработка вакцин против РТ антигенов и исследование функций РТ-антигенов. Последнему направлению посвящено меньшее количество работ, поэтому сих пор функция РТ-антигенов во многом остаётся неизвестной. Результаты исследований функций РТ-антигенов могут позволить выяснить, нужны ли РТ-антигены для выживания опухолевых клеток, или опухолевые клетки могут ускользнуть от иммунной системы, перестав экспрессировать РТ-антигены, о протекании каких процессов говорит экспрессия РТ-антигенов, на какой механизм должна быть направлена терапия. Эти вопросы не могли остаться без внимания. Для разработки теоретических предпосылок дальнейших работ по изучению функций РТ-антигенов был проведён аналитический обзор. Были изучены статьи, посвящённые функциям РТ-антигенов семейств MAGE, GAGE, NY-ESO-1, то есть тех, которые экспериментально исследовались в рамках данной диссертации. Наиболее интересные результаты были получены относительно РТ-антигенов семейства MAGE. Это связано с тем, что для представителей семейства MAGE-A существует много работ, в которых для них были установлены непосредственные молекулярные взаимодействия, тогда как для членов других семейств РТ-антигенов таких работ очень мало. Хотя антигены MAGE были обнаружены раньше всех остальных РТантигенов, их функция до сих пор остаётся не до конца понятной и противоречивой. Все исследования, посвящённые определению функции антигенов MAGE, можно разделить на исследования, касающиеся одного антигена, и исследования, касающиеся антигенов MAGE I класса в целом. Необходимо иметь в 90 виду, что функция, установленная для целого класса антигенов MAGE, может противоречить функции, установленной для отдельных представителей MAGE. Одной из наиболее интересных работ по функциям MAGE-A антигенов является исследование, проведённое Laduron S. Et al. [214]. В этой работе было обнаружено, что партнёром MAGE-A1 является SKIP (Ski Interacting Protein). SKIP – это адапторный белок, который соединяет ДНК-связывающие белки с белками, активирующими или ингибирующими транскрипцию, в частности с белками сигнального пути Notch1. Взаимодействие MAGE-A1 с белком SKIP в сигнальном пути Notch1 проиллюстрировано на оригинальном рисунке (Рисунок 22). Сигнальный путь Notch1 начинается с рецептора Notch1 на поверхности клетки. После связывания Notch1 с лигандом (например, Delta-like) металлопротеиназа типа ADAM отщепляет внеклеточный домен Notch1. Далее ферментативный комплекс, содержащий γ-секретазу, отщепляет внутриклеточный домен (Notch Intracellular – Notch IC), который мигрирует в ядро. В отсутствие Notch1-IC CBF1 (C-promoter Binding Factor 1) ингибирует транскрипцию путем образования связи со SKIP и SMRT-корепрессорным комплексом (Silencing Mediator for Retinoid and Thyroid-hormone receptors), который содержит гистоновые деацетилазы HDAC. При появлении в ядре Notch-IC связывается с фактором связывания CBF1 и SKIP, заменяя репрессорный комплекс, и привлекает коактиваторный комплекс, состоящий из Mastermind (MAM) и HAT (Histone acetyltransferase) и других хроматин-модифицирующих белков. Все это приводит к активации транскрипции генов-мишеней Notch1 [215-220]. В работе Laduron S et al. Было выяснено, что MAGE-A1 репрессирует транскрипцию генов-мишеней NotchIC привлекая гистоновую деацетилазу HDAC1на транскрипционный комплекс. В общем, MAGE-A1, образуя связь со SKIP, ингибирует действие Notch1-IC. Также не исключена возможность того, что MAGE-A1 дестабилизирует связь Notch1-IC с коактиваторным комплексом. 91 Рисунок 22 – Схема Notch1-сигнального пути и взаимодействия MAGEA1 с адапторным белком SKIP (пояснения в тексте). На мышиной модели было показано, что конститутивная экспрессия Notch-IC в клетках Сертоли приводит к преждевременному выходу гоноцитов из митотического ареста, миграции в семенные канальцы и дифференциации раньше срока. Все это приводит к гибели гоноцитов уже ко второму дню после рождения [221]. Таким образом, физиологический смысл связывания MAGE-A1 со SKIP и репрессии транскрипции под действием Notch1-IC в сперматогониях, возможно, заключается в поддержании гоноцитов в недифференцированном состоянии в течение фетального развития. Из работы Laduron et al. Можно сделать два принципиальных вывода – MAGE-A1 взаимодействует со SKIP и может привлекать гистоновые деацетилазы. 92 В серии работ, продемонстрировано, андрогенов, выполненных что обеспечивает под руководством MAGE-A11 является возможность образования Wilson E., корегулятором связи было рецептора между ним и коактиваторами семейства SRC и транскрипционным регулятором р300 [222-225]. На основании результатов этой серии работ была создана иллюстрация обнаруженной функции MAGE-A11 (Рисунок 23). Рисунок 23 – Схема сигнального пути рецептора андрогенов и механизма его взаимодействия с MAGE-A11 (пояснения в тексте). В рецепторе андрогенов существуют домены: NTD (N-Terminal Domain), LBD (Ligand Binding Domain), DBD (DNA Binding Domain) и два сайта активации транскрипции – сайт AF1 и сайт AF2. В отсутствие агониста AR находится в цитоплазме и стабилизируется HSP (Heat Shock Protein), а через филамин-А связан 93 с актиновыми филаментами. Поступающий в клетку тестостерон под действием 5αредуктазы преобразуется в ДГТ (5α-дигидротестостерон). ДГТ связывается с доменом, связывающим лиганд. Это вызывает конформационные изменения, позволяющие взаимодействовать между собой участкам на NH2- и COOH-концах – N/C взаимодействие. Связывание с агонистом и последующее N/C взаимодействие стабилизирует рецептор андрогенов. В результате этого он перемещается в ядро, где образует гомодимеры. Через сайт AF1 рецептор андрогенов связывается с ARE (Androgene Responsive Elements). Это взаимодействие привлекает коактиваторные белки (например, p/CAF) и гистоновые ацетилтрансферазы (например, p300), что вызывает активацию транскрипции андроген-зависимых генов. При наличии в клетке андрогенов рецептор андрогенов и MAGE-A11 колокализуются в ядре. MAGE-A11 способен связаться с рецептором андрогенов, но эта связь кратковременная. Наличие MAGE-A11 снижает время связи рецептора андрогенов с лигандом, он может диссоциировать. В эти моменты N/C взаимодействие нарушается, и MAGE-A11 может связаться с мотивом FXXLF рецептора андрогенов и позволить присоединиться к сайту AF2 коактиваторам семейства SRC/p160. Присоединение MAGE-A11 и коактиваторов к рецептору андрогенов привлекает гистоновую ацетилрансферазу p300, которая способствует активации транскрипции андроген-зависимых генов в отсутствие ДГТ через сайт AF2. Рецептор андрогенов – это член подсемейства рецепторов стероидов семейства ядерных рецепторов. Под действием агонистов (дигидротестостерона) рецептор андрогенов (Androgen Receptor – AR) активирует транскрипцию андроген-зависимых генов через сайт AF1 (Activation Function 1). Также AR может быть активирован через сайт AF2 под действием коактиваторов из семейства SRC/p160. В норме активация AR под действием коактиваторов незначительна, но увеличивается при отсутствии андрогенов. Такое состояние может возникнуть в результате лечения карцином простаты путем уменьшения уровня андрогенов, то есть коактиваторы играют важную роль в работе рецептора андрогенов и вносят свой вклад в прогрессию и развитие рака простаты. Эти наблюдения привели к постулированию существования корегулятора AR, который открывает AF2 сайт для связывания коактиватора. 94 MAGE-A11 присоединяется специфически к участку на NH2-конце рецептора андрогенов, содержащему мотив FXXLF. При этом сайт AF2 остается доступным для связывания коактиваторов. Коактиваторы семейства SRC/p160 присоединяются к FXXLL сайта AF2. Одновременное присоединение MAGE-A11 и коактиваторов к рецептору андрогенов синергично усиливает его транскрипционную активность. MAGE-A11 использует для образования связи с рецептором андрогена высоко консервативный F-box (остатки 329-369) в MHD. Кроме того, MAGE-A11 взаимодействует с членом семейства SRC – TIF2 (Transcription Intermediary Factor 2), который увеличивает транскрипционную активность рецептора андрогенов через сайт AF2, а также с NH2-концевым мотивом FXXLF ацетилтрансферазы р300, то есть MAGE-A11 связывает рецептор андрогенов с р300 и с коактиваторами p160 (TIF2) [224, 225]. Таким образом, MAGE-A11 путем взаимодействия с рецептором андрогенов, его коактиваторами и транскрипционными факторами может значительно активировать транскрипцию андроген-респонсивных генов, тем самым поддерживая существование андроген-зависимых опухолей. Помимо рака простаты рецепторы андрогена обнаруживаются в 2% всех карцином молочной железы и в 10% так называемых тройных негативных опухолей [167]. Возможно, для лечения этой подгруппы опухолей помимо лекарств, направленных на рецептор андрогена, в качестве адъювантной терапии было бы разумно использовать и вакцины против MAGE-A антигенов. Работы, посвященные исследованию функций РТ-антигенов MAGE-A1 и MAGE-A11 легли в основу первой теоретической предпосылки о возможных функциях MAGE-A антигенов. Известно, что белок SKIP участвует не только в сигнальном пути Notch1 но также в сигнальных путях витамина D3, ретиноевой кислоты, эстрогенов, глюкокортикоидов и TGFβ. Было предположено, что MAGEA1 может взаимодействовать со SKIP в одном из перечисленных выше сигнальных путей. Рецептор витамина D3 (Vitamin D Receptor – VDR) также принадлежит к группе ядерных рецепторов и в его структуре также могут быть выделены домены: NTD, LBD, DBD и два сайта активации транскрипции – сайт AF1 и сайт AF2. В отсутствие агониста VDR находится в цитоплазме. Поступивший в клетку 1,25дигидроксихоликальциферол (кальцитриол) образует связь с LBD VDR. Это 95 вызывает N/C-взаимодействие, как и в AR. Далее VDR образует гетеродимер с ретиноид-Х-рецептором (A или B) (Retinoid-X-Receptor – RXR) и перемещается в ядро. В ядре комплекс VDR с RXR и кальцитриолом связывется с респонсивными элементами витамина D3 (Vitamin D Responsive Elements – VDRE). Это взаимодействие привлекает коактиваторные белки (например, p/CAF) и гистоновые ацетилтрансферазы (например, p300), что вызывает активацию транскрипции генов мишеней витамина D3. Этот процесс похож на активацию андроген-зависимых генов. Но отличие состоит в том, что в комплекс на VDRE привлекается еще белок SKIP [226-228]. Описанный сигнальный путь рецептора витамина D3 проиллюстрирован оригинальным рисунком (Рисунок 24). Рисунок 24 – Схема сигнального пути рецептора витамина D3 и механизма его предполагаемого взаимодействия с MAGE-A1 (пояснения в тексте). Итак, из работы Laduron S. Et al. Известно, что MAGE-A1 взаимодействует с белком SKIP. Если SKIP участвует в сигнальном пути рецептора витамина D3, то 96 высока вероятность, что MAGE-A1 будет взаимодействовать еще с какими-либо белками комплекса, собирающегося на VDRE. Из белков, которые привлекаются на VDRE взаимодействие с беками MAGE показано для коактиваторов семейства SRC/p160. Было проверено, есть ли в MAGE-A1 последовательность аминокислот, которая необходима MAGE-A11 для образования связи с TIF2. MAGE-A11 взаимодействует с TIF2 участком с мотивом 260 FPEIF264 [224]. Точно такой же мотив был обнаружен в аминокислотной последовательности белка MAGE-A1 – 140 FPEIF144, последовательность взята из [229]. Он находится MHD, как в MAGE- A11, так и в MAGE-A1. На основании этого вероятность взаимодействия MAGEA1 с TIF2 высока. MAGE-A11 взаимодействует с гистоновой ацетилазой p300, которая также рекрутируется на комплекс VDR. Было проверено, есть ли в MAGEA1 мотивы, которые MAGE-A11 использует для образования связи с p300. Таких мотивов в последовательности MAGE-A1 не было обнаружено. Это свидетельствует в пользу предположения, что при участии MAGE-A1 в сигнальном пути VDR будут привлекаться гистоновые деацетилазы (например, HDAC1), а не гистоновые ацетилазы. Гипотезу участия MAGE-A1 в сигнальном пути VDR можно сформулировать так: к генам-мишеням витамина D3 присоединяется гетеродимер VDR с RXR и кальцитриолом, на этом гетеродимере собирается комплекс коактиватора семейства SRC, адапторного белка SKIP, и MAGE-A1, который привлекает гистоновую деацетилазу HDAC1, что приводит к репрессии транскрипции VDRE (Рисунок 24). Вторая теоретическая предпосылка касается возможного участия MAGE-A1 в сигнальном пути рецептора андрогенов. На Рисунке 25 приведена схема взаимодействия MAGE-A11 с AR, коактиватором семейства SRC и гистоновой ацетилазой p300, составленная автором диссертационной работы на основе результатов работ, выполненных под руководством Wilson E. [222-225]. MAGE-A11 образует связь с коактиватором семейства SRC TIF2 через мотив FXXIF (260FPEIF264), который также обнаружен в MHD домене MAGE-A1 (140FPEIF144) (была использована референсная последовательность из базы данных National Center for Biotechnology Information NP_004979.3). MAGE-A11 выполняет роль корегулятора, позволяющего активировать транскрипцию андроген- зависимых генов в отсутствие андрогенов. MAGE-A1, привлекаясь в комплекс 97 транскрипционного фактора, наоборот, подавляет экспрессию соответствующих генов. Для того чтобы было возможно предполагать участие MAGE-A1 в сигнальном пути AR, необходимо, чтобы в MAGE-A1 был тот же мотив, которым MAGE-A11 взаимодействует с AR – MHD и в частности F-box. MHD – консервативный домен РТ-антигенов MAGE, поэтому остается проверить есть ли в MAGE-A1 F-box. Этот мотив представляет собой α-спиральную последовательность IPEEΨ3XΨ2X2ΨXΨX7Ψ2X6ΨX8Ψ2, похожую на F-box циклина F, где Ψ – гидрофобная аминокислота, X – любая аминокислота. Этот мотив обнаружен у всех членов семейства MAGE-A. F-box 329 MAGE-A11 имеет следующую последовательность: IPEEVMWEVLSIMGVYAGREHFLFGEPKRLLTQNWVQEKYL369 [223]. А в MAGE-A1 F-box имел последовательность: APEEEIWEELSVMEVYDGREHSAYGEPRKLLTQDLVQEKYL. Жирным и подчеркнутым шрифтом выделены консенсусные аминокислотные остатки F-box, а жирным шрифтом отмечены гидрофобные остатки. MAGE-A1 имеет высокую гомологию с F-box MAGE-A11. Таким образом, можно предположить, что MAGE-A1 участвует в сигнальном пути AR в качестве корегулятора и подавляет транскрипцию андроген ARE в отсутствие агонистов (Рисунок 25). Кроме того, недавно было показано взаимодействие SKIP с рецептором андрогенов, что увеличивает вероятность участия в транскрипционном комплексе на ARE MAGE-A1 [230]. 98 Рисунок 25 – Схема взаимодействия MAGE-A11 с рецептором андрогенов и схема предполагаемого взаимодействия MAGE-A1 с рецептором андрогенов. В данной главе освещены работы, на основании которых были выдвинуты идеи о возможных неизвестных функциях MAGE-A антигенов и направлениях дальнейших работ по изучению функций РТ-антигенов. Первая теоретическая предпосылка заключается в том, что MAGE-A1 через адаптерный белок SKIP может участвовать в сигнальном пути рецептора витамина D3 и, привлекая гистоновые деацетилазы, репрессировать транскрипцию генов-мишеней витамина D3. Вторая гипотеза касается потенциального участия MAGE-A1 в сигнальном пути рецептора андрогенов в качестве андроген-независимого корегулятора, который ингибирует транскрипцию ARE через привлечение гистоновых деацетилаз. В результате анализа функций РТ-антигенов, в частности MAGE-A, становится ясным, что они являются регуляторами транскрипции. Скорее всего, они играют критическую роль во время эмбрионального развития, участвуют в создании баланса дифференцировки и деления клеток. Нарушение баланса этих двух процессов является характерным признаком опухолевых клеток и находит отражение в индукции эктопической экспрессии РТ-генов, то есть РТ-антигены 99 поддерживают существование опухолевых клеток. В испытаниях опухолевых вакцин, направленных против РТ-антигенов, наблюдается возможность иммуноредактирования и селекции тех клеток, которые не экспрессируют РТ-гены и антигены, то есть функции РТ-антигенов могут быть скомпенсированы другими регуляторами. Можно заключить, что исследование функций РТ-генов может помочь определить те антигены, на которые должна быть направлена терапия в конкретном заболевании, разработать таргетные препараты. Такая терапия может быть эффективной при условии проведения ее в составе комплексной терапии опухолевого заболевания. 100 4. Заключение Раково-тестикулярными генами называются гены, которые экспрессируются зародышевыми клетками человека и не экспрессируются в соматических зрелых тканях, но аберрантно активируются в различных злокачественных образованиях. Их продукты, РТ-антигены, являются иммуногенными у больных раком и вызывают развитие гуморального и клеточного ответа. Так как экспрессия РТ генов в нормальных тканях ограничена, а семенники являются иммунопривилегированным органом, то РТ-антигены могут рассматриваться как биомаркеры и перспективные мишени для иммунотерапии. Рак молочной железы является самым распространённым злокачественным новообразованием у женщин в Российской Федерации. Несмотря на достижения диагностики и терапии, рецидивирование РМЖ остается актуальной проблемой [147]. Рациональным подходом к снижению частоты рецидивов РМЖ после первичного лечения является иммунотерапия. Разработка и испытание вакцин против РТ-антигенов, подходящих к применению при РМЖ, особенно актуальна в связи с обнаружением корреляции их экспрессии с принадлежностью опухоли к подгруппе «тройных негативных» (опухоли, на клетках которых отсутствуют рецепторы эстрогена, прогестерона и отсутствует повышенная экспрессия HER2/neu), наиболее неблагоприятных из-за ограниченности выбора вариантов лечения и плохого прогноза [171]. В ИБГ РАН были разработаны генно-клеточные противоопухолевые вакцины «Аллоген» и «Компливак», содержащие в себе клеточные линии, которые экспрессируют РТ-гены. Перспективы её применения для пациентов с РМЖ неизвестны, так как исследования экспрессии РТ-генов у пациенток Российской Федерации ранее не проводились. Возможность использования РТ-содержащих вакцин в значительной степени определяется частотой экспрессии РТ-генов опухолевыми тканями. В рамках диссертации была впервые в Российской Федерации исследована частота экспрессии РТ-генов в образцах рака молочной железы. Показано, что профиль экспрессии раково-тестикулярных генов в образцах рака молочной железы (MAGE-A3 (17,1%), MAGE-A4 (20,1%), MAGE-A6 (14,6%), MAGE-A10 (8,5%), MAGE-A12 (15,9%), NY-ESO-1 (31,7%), BAGE2 и BAGE3 (4,8%) , LAGE1a 101 (3,6%), GAGE2-GAGE8 (7,3%)) комплиментарен набору РТ-генов, экспрессирующихся в клеточных линиях генно-клеточных противоопухолевых вакцин «Аллоген» и «Компливак». Таким образом, была теоретически обоснована возможность применения вакцин «Компливак» и «Аллоген» для лечения пациентов с раком молочной железы. В ходе диссертационной работы был разработан и зарегистрирован в Федеральной службе по надзору в сфере здравоохранения и социального развития Российской Федерации «Набор реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)», который может быть использован для отбора пациентов при включении в клинические испытания вакцин «Аллоген» и «Компливак». Предраковые заболевания ротовой полости характеризуются высокой вероятностью трансформации в плоскоклеточный рак. В настоящее время в клинической практике отсутствуют объективные прогностические маркеры, позволяющие в каждом отдельном клиническом случае определить риск злокачественной трансформации лейкоплакии СОПР и выбрать на основе этих данных стратегию лечения. Кроме того, по-прежнему актуален вопрос своевременной дифференциальной диагностики предрака и рака. С целью поиска молекулярных маркёров повышенного риска злокачественной трансформации лейкоплакии СОПР с помощью разработанного в ходе диссертационной работы набора реактивов «РТ-антиген» была впервые в Российской Федерации изучена экспрессия раково-тестикулярных генов в образцах нормальной ткани, плоскоклеточного рака и лейкоплакии СОПР. Было выяснено, что в нормальной ткани и в группе лейкоплакий СОПР с низким риском злокачественной трансформации не экспрессируются раково-тестикулярные гены MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12 и NY-ESO-1, GAGE2-GAGE8, BAGE2 и BAGE3. При этом в 87,5% образцов плоскоклеточного рака СОПР экспрессировался хотя один из вышеперечисленных генов. Экспрессия MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A12, NY-ESO-1 достоверно ассоциировалась с плоскоклеточным раком СОПР. Отсутствие экспрессии генов MAGE-A3, MAGEA4, MAGE-A6, MAGE-A12, NY-ESO-1 в образце слизистой оболочки полости рта достоверно указывало на то, что исследуемый образец является либо нормальной 102 тканью, либо лейкоплакией с низким риском злокачественной трансформации (p<0.0001). Полученные результаты позволяют рассматривать РТ-гены в качестве молекулярных маркеров подтверждающей плоскоклеточного дифференциальной рака диагностики СОПР при нормальной проведении ткани и лейкоплакии СОПР от плоскоклеточного рака СОПР. Для ее проведения может быть использован разработанный набор «РТ-антиген». В одном образце лейкоплакии из группы с высоким риском злокачественной трансформации была обнаружена экспрессия генов MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12. Возможно, экспрессия этих генов указывает на повышенный риск злокачественной трансформации лейкоплакии в плоскоклеточный рак СОПР. На данном этапе при выявлении экспрессии РТ- генов в лейкоплакии СОПР рекомендуется более частое клиническое обследование конкретного пациента. Для выяснения прогностического значения экспрессии раково-тестикулярных генов необходимы лонгитудинальные исследования. Так как ни один вид активного лечения лейкоплакии СОПР не способен предотвратить рецидивирование или малигнизацию, становится целесообразным изучение возможности применения иммунотерапевтических подходов для профилактики рецидивов и злокачественной трансформации лейкоплакии. В качестве одного из таких подходов можно рассматривать генно-клеточные противоопухолевые вакцины «Аллоген» и «Копливак», содержащие в своем составе РТ-антигены. Таким образом, результаты представленной диссертационной работы привели к созданию валидированной тест-системы для определения экспрессии РТ-генов, позволили предложить новый метод диагностики лейкоплакии СОПР и плоскоклеточного рак СОПР, а также вплотную приблизиться к проведению клинических испытаний новых вариантов генно-клеточных вакцин, в том числе и для нового спектра гистотипов опухолей. 103 5. Выводы 1. Разработан, валидирован и зарегистрирован в Федеральной службе по надзору в сфере здравоохранения и социального развития «Набор реагентов для молекулярно-генетической диагностики раково-тестикулярных антигенов методом полимеразной цепной реакции (РТ-антиген)». 2. Показана комплементарность спектра экспрессии РТ-генов в образцах рака молочной железы противоопухолевых возможным и в вакцин рациональную клеточных линиях, «Компливак» селекцию и входящих «Аллоген», пациентов при в состав что делает включении в клинические испытания только носителей указанных антигенов. 3. Частоты экспрессии РТ-генов MAGE-A3, MAGE-A4, MAGE-A6, MAGEA12, NY-ESO-1 в нормальной ткани и плоскоклеточном раке слизистой оболочки полости рта достоверно различались, и наличие экспрессии хотя бы одного из этих РТ-генов ассоциировалось с плоскоклеточным раком слизистой оболочки полости рта. 4. Отсутствие экспрессии РТ-генов MAGE-A3, MAGE-A4, MAGE-A6, MAGEA12, NY-ESO-1 в образце лейкоплакии слизистой оболочки полости рта статистически значимо ассоциировалось с принадлежностью к форме с низким риском злокачественной трансформации. 104 6. Список сокращений ВОЗ Всемирная организация здравоохранения ДГТ 5α-дигидротестостерон ДНК дезоксирибонуклеиновая кислота кДНК комплиментарная дезоксирибонуклеиновая кислота мРНК матричная рибонуклеиновая кислота ОТ обратная транскрипция ПЦР полимеразная цепная реакция РТ раково-тестикулярный РМЖ рак молочной железы СОПР слизистая оболочка ротовой полости AF1 Activation Function 1 (активации функции 1) APC Adenomatous Polyposis Coli (аденоматозный полипоз толстой кишки) AR Androgen Receptor (рецептор андрогена) ARE Androgene-Responsive Elements (андроген-отвечающие элементы) BORIS Brother of the Regulator of Imprinted Sites (брат регулятора сайтов импринтинга) BRCA1/2 Breast Cancer, early onset1/2 (белок раннего развития рака молочной железы 1 или 2) CBF1 C-promoter Binding Factor 1 (фактор связывания С-промотора 1) CD Cluster of Differentiation (кластер дифференцировки) CEA Carcinoembryonic antigen (раково-эмбриональный антиген) CHP-NYESO-1 Сholesterol-bearing Hydrophobized Pullulan-NY-ESO-1 (гидрофобизированный пуллулан, нагруженный холестеролом и сшитый с белком NY-ESO-1) CTCF CCCTC-binding factor (CCCTC-связывающий фактор) CTAG1 Cancer/testis antigen 1 (LAGE-1a) (раково-тестикулярный антиген 1) CTLA-4 Cytotoxic T-Lymphocyte Antigen 4(антиген цитотоксических лимфоцитов 4) DBD DNA binding Domain (ДНК-связывающий домен) EBV Epshtein-Barr Virus (вирус Эпштейн-Барра) ELISA Enzyme-linked immunosorbent assay (иммуноферментный анализ – ИФА) GAPDH Glyceraldehyde 3-phosphate dehydrogenase (НАД-зависимая 105 глицеральдегид-3-фосфат дегидрогеназа) HAT Histone acetyltransferase (ацетилтрансфераза гистонов) HER2/neu Human Epidermal Growth Factor Receptor 2 (рецептор фактора роста эпидермиса 2) HSP Heat Shock Protein (белок теплового шока), IFNγ Interferon γ (интерферон γ) KAP1 Krüppel-associated protein (белок, ассоциированный с геном Krüppel) LAG-3 Lymphocyte-activation gene 3 (белок, кодирующий ген активации лимфоцитов 3) LBD Ligand Binding Domain (лиганд-связывающий домен), MAGE Melanoma Associated Gene (ген, ассоциированный с меланомой) MAM Mastermind (белок Mastermind) MHC Major Histocompatibility Complex (главный комплекс гистосовместимости) MHD MAGE homology domain (домен гомологичности MAGE) MLL3 Mixed-Lineage Leukemia 3 (белок лейкемии смешанного происхождения 3) MUC1 Mucin 1, cell surface associated (муцин 1, ассоциированный с поверхностью клетки) M-MuLV Moloney Murine Leukemia Virus (вирус лейкемии мышей Молони) Notch-IC Intracellular Notch (внутриклеточный Notch) NTD N-Terminal Domain (N-концевой домен ) ODN Deoxycytidyl-Deoxyguanosin Oligodeoxynucleotides (дезоксицитидилдезоксигуанозин олигодезоксинуклеотидами) PD-1 Programmed Death 1 (белок программированной смерти 1) RAS Rat sarcoma (ген, кодирующий ГТФазу, участвующую в проведении сигнала от рецептора внутрь клетки ) RDA Representational Difference Analysis (анализ репрезентативной разницы) RPKM reads per kilobase per million of reads (число прочтений на тысячу пар оснований экзона на миллион прочтений) SAGE Serial Analysis of Gene Expression (серийный анализ экспрессии генов) SEREX Serological Expression Cloning (клонирование опухолевых антигенов, распознающихся антителами сывороток больных опухолевыми заболеваниями) SKIP Ski Interacting Protein (белок, взаимодействующий со Ski) 106 SMRT Silencing Mediator for Retinoid and Thyroid-hormone receptors (медиатор сайленсинга рецепторов ретиноидный и тиреоидных гормонов) SSX Synovial Sarcoma X (ген синовиальной саркомы X – CT5) TGF-β Transforming growth factor β (трансформирующий фактор β) TIF2 Transcription Intermediary Factor 2 (фактор, опосредующий транскрипцию, 2) TIM-3 Hepatitis A virus cellular receptor 2 (клеточный рецептор вируса гепатита А 2) Tripartite motif-containing 28 (белок, содержащий тройной мотив, 28) TRIM28 107 7. Список литературы 1. Hofmann O., Caballero O.L., Stevenson B.J., Chen Y.T., Cohen T., Chua R., Maher C.A., Panji S., Schaefer U., Kruger A., Lehvaslaiho M., Carninci P., Hayashizaki Y., Jongeneel C.V., Simpson A.J., Old L.J., Hide W. Genome-wide analysis of cancer/testis gene expression // Proc. Nat. Acad. Sci. USA. – 2008. – 105. – № 51. – P: 20422-7. 2. Scanlan M.J., Simpson A.J., Old L.J. The cancer/testis genes: review, standardization, and commentary // Cancer Immun. – 2004. – 4. – №. – P: 1. 3. Hanahan D., Weinberg R.A. Hallmarks of Cancer: The Next Generation // Cell. – 2011. – 144. – № 5. – P: 646-674. 4. Blankenstein T. The role of tumor stroma in the interaction between tumor and immune system // Curr Opin Immunol. – 2005. – 17. – №. – P: 180-6. 5. Staveley-O'Carroll K., Sotomayor E., Montgomery J., Borrello I., Hwang L., Fein S., Pardoll D., Levitsky H. Induction of antigen-specific T cell anergy: An early event in the course of tumor progression // Proc. Natl. Acad. Sci. USA –1998 – 95. – №. – P: 1178-1183. 6. Бережной А.Е., Гнучев Н.В., Георгиев Г.П., Козлов А.М., Ларин С.С. Молекулярные механизмы взаимодействия опухоли и иммунной системы // Вопр. Онкологии. – 2008. – 54. – № 6. – P: 669-683. 7. Закеева И.Р., Бережной А.Е., Гнучев Н.В., Георгиев Г.П., Ларин С.С. Ингибиторные рецепторы лимфоцитов и их роль в противоопухолевом иммунитете // Вопр. онкол. – 2007. – 53. – № 2. – P: 140-9. 8. Бережной А.Е., Чернышева А.Д., Закеева И.Р., Данилова А.Б., Данилов А.О., Моисеенко В.М., Geraghty D., Гнучев Н.В., Георгиев Г.П., Кибардин А.В., Ларин C.C. Индукция экспрессии молекулы HLA-E на поверхности опухолевых клеток интерфероном-гамма приводит к защите опухолевых клеток от цитотоксического действия лимфоцитов // Вопр. Онкологии. – 2009. – 55. – № 2. – P: 224-9. 9. Larin S.S., Georgiev G.P., Kiselev S.L. Gene transfer approaches in cancer immunotherapy // Gene Ther. – 2004. – 11 Suppl 1. – №. – P: S18-25. 10. Soiffer R., Lynch T., Mihm M., Jung K., Rhuda C., Schmollinger J.C., Hodi F.S., Liebster L., Lam P., Mentzer S., Singer S., Tanabe K.K. Vaccination with irradiated autologous melanoma cells engineered to secrete human granulocyte-macrophage colony-stimulating factor generates potent antitumor immunity in patients with metastatic melanoma // Proc. Nat. Acad. Sci. USA. – 1998. – 95. – №. – P: 131416. 11. Soiffer R., Hodi S., Haluska F., Jung K., Gillessen S. Vaccination With Irradiated, Autologous Melanoma Cells Engineered to Secrete Granulocyte-Macrophage Colony-Stimulating Factor by Adenoviral-Mediated Gene Transfer Augments Antitumor Immunity in Patients With Metastatic Melanoma // J Clin Oncol. – 2003. – 21. – №. – P: 3343-3350. 12. Mikhaylova I.N., Lukashina M.I., Baryshnikov A.I., Morozova L.F., Burova O.S., Palkina T.N., Kozlov A.M., Golubeva V.A., Cheremushkin E.A., Doroshenko M.B., Demidov L.V., Kiselev S.L., Larin S.S., Georgiev G.P. Melanoma cell lines 108 13. 14. 15. 16. 17. 18. 19. 20. as the basis for antitumor vaccine preparation // Vestn Ross Akad Med Nauk. – 2005. – 7. – №. – P: 37-40. Данилов А.О., Ларин С.С., Данилова А.Б., Моисеенко В.М., Балдуева И.А., Киселев С.Л., Туркевич Е.А., Барчук А.С., Анисимов В.В., Гафтов Г.И., Кочнев В.А., Hanson K.P. Усовершенствование метода приготовления аутологичных модифицированных противоопухолевых вакцин для активной специфической иммунотерапии больных диссеминированными солидными опухолями // Вопр. онкол. – 2004. – 50. – № 2. – P: 219-227. Бережной А.Е., Сапрыкина Н.С., Барышников А.Ю., Ларин С.С., Козлов А.М. Изучение противоопухолевой активности вакцин на основе генетически модифицированных опухолевых клеток, секретирующих ГМ-КСФ // Российский биотерапевтический журнал. – 2006. – 5. – № 4. – P: 47-53. Moiseyenko V.M., Danilov A.O., Baldueva I.A., Danilova A.B., Tyukavina N.V., Larin S.S., Kiselev S.L., Orlova R.V., Anisimov V.V., Semenova A.I., Shchekina L.A., Gafton G.I., Kochnev V.A., Barchuk A.S., Kanaev S.V., Hanson K.P., Georgiev G.P. Phase I/II trial of gene therapy with autologous tumor cells modified with tag7/PGRP-S gene in patients with disseminated solid tumors: miscellaneous tumors // Ann Oncol. – 2005. – 16. – № 1. – P: 162-8. Моисеенко В.М., Данилов А.О., Балдуева И.А., Данилова А.Б., Тюкавина Н.В., Орлова Р.В., Семенова А.И., Туркевич Е.А., Шекина Л.А., Анисимов В.В., Гафтов Г.И., Кочнев В.А., Барчук А.С., Канаев С.В., Hanson K.P., Ларин С.С., Георгиев Г.П., Киселев С.Л. I-II фаза клинической оценки эффективности генотерапии на основе аутологичных опухолевых клеток, модифицированных геном tag7 у больных диссеминированными солидными опухолями // Вопр. Онкол. – 2004. – 50. – № 3. – P: 299-303. Ferlay J., Soerjomataram I., Ervik M., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F., GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Available from: http://globocan.iarc.fr, accessed on 08/03/2015. , 2013, International Agency for Research on Cancer Lyon, France. Garland S.M., Hernandez-Avila M., Wheeler C.M., Perez G., Harper D.M., Leodolter S., Tang G.W., Ferris D.G., Steben M., Bryan J., Taddeo F.J., Railkar R., Esser M.T., Sings H.L., Nelson M., Boslego J., Sattler C., Barr E., Koutsky L.A., Investigators F.U.t.U.R.E.E.D.F.I. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases // N Engl J Med. – 2007. – 356. – № 19. – P: 1928-43. Muñoz N., Manalastas R.J., Pitisuttithum P., Tresukosol D., Monsonego J., Ault K., Clavel C., Luna J., Myers E., Hood S., Bautista O., Bryan J., Taddeo F.J., Esser M.T., Vuocolo S., Haupt R.M., Barr E., Saah A. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years: a randomised, double-blind trial // Lancet. – 2009. – 373. – № 9679. – P: 1949-57. Giuliano A.R., Palefsky J.M., Goldstone S., Moreira E.D.J., Penny M.E., Aranda C., Vardas E., Moi H., Jessen H., Hillman R., Chang Y.H., Ferris D., Rouleau D., Bryan J., Marshall J.B., Vuocolo S., Barr E., Radley D., Haupt R.M., Guris D. Efficacy of quadrivalent HPV vaccine against HPV Infection and disease in males // N Engl J Med. – 2011. – 364. – № 5. – P: 401-11. 109 21. Ogden G., Lewthwaite R., Shepherd S.D. Early detection of oral cancer: how do I ensure I don't miss a tumour? // Dent Update. – 2013. – 40. – № 6. – P: 462-5. 22. Messadi D.V. Diagnostic aids for detection of oral precancerous conditions // Int J Oral Sci. – 2014. – 5. – № 2. – P: 59-65. 23. Dranoff G., Jaffee E., Lazenby A., Golumbek P., Levitsky H., Brose K., Jackson V., Hamada H., Pardoll D., Mulligan R.C. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent, specific, and long-lasting anti-tumor immunity // Proc. Natl. Acad. Sci. USA. – 1993. – 90. – №. – P: 3539-3543. 24. Кустикова О.С., Киселев С.Л., Бородулина О.Р., Сенин В.М., Афанасьева А.В., Кабишев А.А. Клоинрование гена tag(7), экспрессирующегося в метастазирующих опухолях мыши // Генетика. – 1996. – 32. – № 5. – P: 621628. 25. Larin S.S., Korobko E.V., Kustikova O.S., Borodulina O.R., Raikhlin N.T., Brisgalov I.P., Georgiev G.P., Kiselev S.L. Immunotherapy with autologous tumor cells engineered to secrete Tag7/PGRP, an innate immunity recognition molecule // J Gene Med. – 2004. – 6. – № 7. – P: 798-808. 26. Михайлова И.Н., Демидов Л.В., Барышников А.Ю., Бурова О.С., Харкевич Г.Ю., Палкина Т.Н., Козлов А.М., Морозова Л.Ф., Вайнсон А.А., Кадагидзе З.Г., Заботина Т.Н., Буркова А.А., Дорошенко М.Б., Хатырев С.А., Носов Д.А., Тюляндин С.А., Гарин А.М., Киселев С.Л., Ларин С.С., Георгиев Г.П. Клинические испытания аутологичной вакцины на основе опухолевых клеток, модифицированных геном tag7 // Сибирский Онкологический Журнал. – 2005. – 1. – № 13. – P: 23-27. 27. Meek D.W., Marcar L. MAGE-A antigens as targets in tumour therapy // Cancer Lett. – 2012. – 324. – № 2. – P: 126-32. 28. Sang M., Lian Y., Zhou X., Shan B. MAGE-A family: attractive targets for cancer immunotherapy // Vaccine. – 2011. – 29. – № 47. – P: 8496-500. 29. Caballero O.L., Chen Y.T. Cancer/testis (CT) antigens: potential targets for immunotherapy // Cancer Sci. – 2009. – 100. – № 11. – P: 2014-21. 30. van der Bruggen P., Traversari C., Chomez P., Lurquin C., De Plaen E., Van den Eynde B., Knuth A., Boon T. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma // Science. – 1991. – 254. – № 5038. – P: 16437. 31. Sahin U., Tureci O., Schmitt H., Cochlovius B., Johannes T., Schmits R., Stenner F., Luo G., Schobert I., Pfreundschuh M. Human neoplasms elicit multiple specific immune responses in the autologous host // Proc. Nat. Acad. Sci. USA. – 1995. – 92. – № 25. – P: 11810-3. 32. Chen Y.T., Scanlan M.J., Sahin U., Tureci O., Gure A.O., Tsang S., Williamson B., Stockert E., Pfreundschuh M., Old L.J. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening // Proc. Nat. Acad. Sci. USA. – 1997. – 94. – № 5. – P: 1914-8. 33. Lethe B., Lucas S., Michaux L., De Smet C., Godelaine D., Serrano A., De Plaen E., Boon T. LAGE-1, a new gene with tumor specificity // Int J Cancer. – 1998. – 76. – № 6. – P: 903-8. 34. Chen Y.T., Gure A.O., Tsang S., Stockert E., Jager E., Knuth A., Old L.J. Identification of multiple cancer/testis antigens by allogeneic antibody screening of 110 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. a melanoma cell line library // Proc. Nat. Acad. Sci. USA. – 1998. – 95. – № 12. – P: 6919-23. Almeida L.G., Sakabe N.J., deOliveira A.R., Silva M.C., Mundstein A.S., Cohen T., Chen Y.T., Chua R., Gurung S., Gnjatic S., Jungbluth A.A., Caballero O.L., Bairoch A., Kiesler E., White S.L., Simpson A.J., Old L.J., Camargo A.A., Vasconcelos A.T. CTdatabase: a knowledge-base of high-throughput and curated data on cancer-testis antigens // Nucleic Acids Res. – 2009. – 37. – № Database issue. – P: D816-9. Shichijo S., Yamada A., Sagawa K., Iwamoto O., Sakata M., Nagai K., Itoh K. Induction of MAGE genes in lymphoid cells by the demethylating agent 5-aza-2'deoxycytidine // Jpn J Cancer Res. – 1996. – 87. – № 7. – P: 751-6. Gjerstorff M., Burns J.S., Nielsen O., Kassem M., Ditzel H. Epigenetic modulation of cancer-germline antigen gene expression in tumorigenic human mesenchymal stem cells: implications for cancer therapy // Am J Pathol. – 2009. – 175. – № 1. – P: 314-23. De Smet C., De Backer O., Faraoni I., Lurquin C., Brasseur F., Boon T. The activation of human gene MAGE-1 in tumor cells is correlated with genome-wide demethylation // Proc. Nat. Acad. Sci. USA. – 1996. – 93. – № 14. – P: 7149-53. Vatolin S., Abdullaev Z., Pack S.D., Flanagan P.T., Custer M., Loukinov D.I., Pugacheva E., Hong J.A., Morse H., 3rd, Schrump D.S., Risinger J.I., Barrett J.C., Lobanenkov V.V. Conditional expression of the CTCF-paralogous transcriptional factor BORIS in normal cells results in demethylation and derepression of MAGEA1 and reactivation of other cancer-testis genes // Cancer research. – 2005. – 65. – № 17. – P: 7751-62. Akers S.N., Odunsi K., Karpf A.R. Regulation of cancer germline antigen gene expression: implications for cancer immunotherapy // Future Oncol. – 2010. – 6. – № 5. – P: 717-32. Yawata T., Nakai E., Park K.C., Chihara T., Kumazawa A., Toyonaga S., Masahira T., Nakabayashi H., Kaji T., Shimizu K. Enhanced expression of cancer testis antigen genes in glioma stem cells // Mol Carcinog. – 2010. – 49. – № 6. – P: 53244. Yang B., Wu J., Maddodi N., Ma Y., Setaluri V., Longley B.J. Epigenetic control of MAGE gene expression by the KIT tyrosine kinase // J Invest Dermatol. – 2007. – 127. – № 9. – P: 2123-8. Gjerstorff M.F., Johansen L.E., Nielsen O., Kock K., Ditzel H.J. Restriction of GAGE protein expression to subpopulations of cancer cells is independent of genotype and may limit the use of GAGE proteins as targets for cancer immunotherapy // British journal of cancer. – 2006. – 94. – № 12. – P: 1864-73. Gjerstorff M.F., Kock K., Nielsen O., Ditzel H.J. MAGE-A1, GAGE and NY-ESO1 cancer/testis antigen expression during human gonadal development // Hum Reprod. – 2007. – 22. – № 4. – P: 953-60. Diefenbach C.S., Gnjatic S., Sabbatini P., Aghajanian C., Hensley M.L., Spriggs D.R., Iasonos A., Lee H., Dupont B., Pezzulli S., Jungbluth A.A., Old L.J., Dupont J. Safety and immunogenicity study of NY-ESO-1b peptide and montanide ISA-51 vaccination of patients with epithelial ovarian cancer in high-risk first remission // Clin Cancer Res. – 2008. – 14. – № 9. – P: 2740-8. 111 46. Valmori D., Souleimanian N.E., Tosello V., Bhardwaj N., Adams S., O'Neill D., Pavlick A., Escalon J.B., Cruz C.M., Angiulli A., Angiulli F., Mears G., Vogel S.M., Pan L., Jungbluth A.A., Hoffmann E.W., Venhaus R., Ritter G., Old L.J., Ayyoub M. Vaccination with NY-ESO-1 protein and CpG in Montanide induces integrated antibody/Th1 responses and CD8 T cells through cross-priming // Proc. Nat. Acad. Sci. USA. – 2007. – 104. – № 21. – P: 8947-52. 47. Yuan J., Ginsberg B., Page D., Li Y., Rasalan T., Gallardo H.F., Xu Y., Adams S., Bhardwaj N., Busam K., Old L.J., Allison J.P., Jungbluth A., Wolchok J.D. CTLA4 blockade increases antigen-specific CD8(+) T cells in prevaccinated patients with melanoma: three cases // Cancer Immunol Immunother. – 2011. – 60. – № 8. – P: 1137-46. 48. Bhatia N., Yang B., Xiao T.Z., Peters N., Hoffmann M.F., Longley B.J. Identification of novel small molecules that inhibit protein-protein interactions between MAGE and KAP-1 // Arch Biochem Biophys. – 2011. – 508. – № 2. – P: 217-21. 49. De Plaen E., Arden K., Traversari C., Gaforio J.J., Szikora J.P., De Smet C., Brasseur F., van der Bruggen P., Lethe B., Lurquin C., et al. Structure, chromosomal localization, and expression of 12 genes of the MAGE family // Immunogenetics. – 1994. – 40. – № 5. – P: 360-9. 50. Lurquin C., De Smet C., Brasseur F., Muscatelli F., Martelange V., De Plaen E., Brasseur R., Monaco A.P., Boon T. Two members of the human MAGEB gene family located in Xp21.3 are expressed in tumors of various histological origins // Genomics. – 1997. – 46. – № 3. – P: 397-408. 51. Lucas S., De Smet C., Arden K.C., Viars C.S., Lethe B., Lurquin C., Boon T. Identification of a new MAGE gene with tumor-specific expression by representational difference analysis // Cancer research. – 1998. – 58. – № 4. – P: 743-52. 52. Gure A.O., Stockert E., Arden K.C., Boyer A.D., Viars C.S., Scanlan M.J., Old L.J., Chen Y.T. CT10: a new cancer-testis (CT) antigen homologous to CT7 and the MAGE family, identified by representational-difference analysis // Int J Cancer. – 2000. – 85. – № 5. – P: 726-32. 53. Lucas S., Brasseur F., Boon T. A new MAGE gene with ubiquitous expression does not code for known MAGE antigens recognized by T cells // Cancer research. – 1999. – 59. – № 16. – P: 4100-3. 54. Salehi A.H., Roux P.P., Kubu C.J., Zeindler C., Bhakar A., Tannis L.L., Verdi J.M., Barker P.A. NRAGE, a novel MAGE protein, interacts with the p75 neurotrophin receptor and facilitates nerve growth factor-dependent apoptosis // Neuron. – 2000. – 27. – № 2. – P: 279-88. 55. Saburi S., Nadano D., Akama T.O., Hirama K., Yamanouchi K., Naito K., Tojo H., Tachi C., Fukuda M.N. The trophinin gene encodes a novel group of MAGE proteins, magphinins, and regulates cell proliferation during gametogenesis in the mouse // The Journal of biological chemistry. – 2001. – 276. – № 52. – P: 4937889. 56. Boccaccio I., Glatt-Deeley H., Watrin F., Roeckel N., Lalande M., Muscatelli F. The human MAGEL2 gene and its mouse homologue are paternally expressed and mapped to the Prader-Willi region // Hum Mol Genet. – 1999. – 8. – № 13. – P: 2497-505. 112 57. Chomez P., De Backer O., Bertrand M., De Plaen E., Boon T., Lucas S. An overview of the MAGE gene family with the identification of all human members of the family // Cancer research. – 2001. – 61. – № 14. – P: 5544-51. 58. Simpson A.J., Caballero O.L., Jungbluth A., Chen Y.T., Old L.J. Cancer/testis antigens, gametogenesis and cancer // Nature reviews. Cancer. – 2005. – 5. – № 8. – P: 615-25. 59. Bolli M., Kocher T., Adamina M., Guller U., Dalquen P., Haas P., Mirlacher M., Gambazzi F., Harder F., Heberer M., Sauter G., Spagnoli G.C. Tissue microarray evaluation of Melanoma antigen E (MAGE) tumor-associated antigen expression: potential indications for specific immunotherapy and prognostic relevance in squamous cell lung carcinoma // Ann Surg. – 2002. – 236. – № 6. – P: 785-93; discussion 793. 60. Bai S., Grossman G., Yuan L., Lessey B.A., French F.S., Young S.L., Wilson E.M. Hormone control and expression of androgen receptor coregulator MAGE-11 in human endometrium during the window of receptivity to embryo implantation // Mol Hum Reprod. – 2008. – 14. – № 2. – P: 107-16. 61. Muller-Richter U.D., Dowejko A., Zhou W., Reichert T.E., Driemel O. Different expression of MAGE-A-antigens in foetal and adult keratinocyte cell lines // Oral Oncol. – 2008. – 44. – № 7. – P: 628-33. 62. Pauls K., Schorle H., Jeske W., Brehm R., Steger K., Wernert N., Buttner R., Zhou H. Spatial expression of germ cell markers during maturation of human fetal male gonads: an immunohistochemical study // Hum Reprod. – 2006. – 21. – № 2. – P: 397-404. 63. Nelson P.T., Zhang P.J., Spagnoli G.C., Tomaszewski J.E., Pasha T.L., Frosina D., Caballero O.L., Simpson A.J., Old L.J., Jungbluth A.A. Cancer/testis (CT) antigens are expressed in fetal ovary // Cancer Immun. – 2007. – 7. – №. – P: 1. 64. Hoei-Hansen C.E., Kraggerud S.M., Abeler V.M., Kaern J., Rajpert-De Meyts E., Lothe R.A. Ovarian dysgerminomas are characterised by frequent KIT mutations and abundant expression of pluripotency markers // Mol Cancer. – 2007. – 6. – №. – P: 12. 65. Gjerstorff M.F., Harkness L., Kassem M., Frandsen U., Nielsen O., Lutterodt M., Mollgard K., Ditzel H.J. Distinct GAGE and MAGE-A expression during early human development indicate specific roles in lineage differentiation // Hum Reprod. – 2008. – 23. – № 10. – P: 2194-201. 66. Kim C.G., Lee J.J., Jung D.Y., Jeon J., Heo H.S., Kang H.C., Shin J.H., Cho Y.S., Cha K.J., Do B.R., Kim K.S., Kim H.S. Profiling of differentially expressed genes in human stem cells by cDNA microarray // Mol Cells. – 2006. – 21. – № 3. – P: 343-55. 67. Gjerstorff M.F., Ditzel H.J. An overview of the GAGE cancer/testis antigen family with the inclusion of newly identified members // Tissue Antigens. – 2008. – 71. – № 3. – P: 187-92. 68. Gillespie A.M., Rodgers S., Wilson A.P., Tidy J., Rees R.C., Coleman R.E., Murray A.K. MAGE, BAGE and GAGE: tumour antigen expression in benign and malignant ovarian tissue // British journal of cancer. – 1998. – 78. – № 6. – P: 81621. 113 69. Joyner D.E., Damron T.A., Aboulafia A., Bokor W., Bastar J.D., Randall R.L. Heterogeneous expression of melanoma antigen (hMAGE) mRNA in mesenchymal neoplasia // Tissue Antigens. – 2006. – 68. – № 1. – P: 19-27. 70. Brasseur F., Rimoldi D., Lienard D., Lethe B., Carrel S., Arienti F., Suter L., Vanwijck R., Bourlond A., Humblet Y., et al. Expression of MAGE genes in primary and metastatic cutaneous melanoma // Int J Cancer. – 1995. – 63. – № 3. – P: 375-80. 71. Barrow C., Browning J., MacGregor D., Davis I.D., Sturrock S., Jungbluth A.A., Cebon J. Tumor antigen expression in melanoma varies according to antigen and stage // Clin Cancer Res. – 2006. – 12. – № 3 Pt 1. – P: 764-71. 72. Bergeron A., Picard V., LaRue H., Harel F., Hovington H., Lacombe L., Fradet Y. High frequency of MAGE-A4 and MAGE-A9 expression in high-risk bladder cancer // Int J Cancer. – 2009. – 125. – № 6. – P: 1365-71. 73. Li M., Yuan Y.H., Han Y., Liu Y.X., Yan L., Wang Y., Gu J. Expression profile of cancer-testis genes in 121 human colorectal cancer tissue and adjacent normal tissue // Clin Cancer Res. – 2005. – 11. – № 5. – P: 1809-14. 74. Yoshida N., Abe H., Ohkuri T., Wakita D., Sato M., Noguchi D., Miyamoto M., Morikawa T., Kondo S., Ikeda H., Nishimura T. Expression of the MAGE-A4 and NY-ESO-1 cancer-testis antigens and T cell infiltration in non-small cell lung carcinoma and their prognostic significance // Int J Oncol. – 2006. – 28. – № 5. – P: 1089-98. 75. Sienel W., Mecklenburg I., Dango S., Ehrhardt P., Kirschbaum A., Passlick B., Pantel K. Detection of MAGE-A transcripts in bone marrow is an independent prognostic factor in operable non-small-cell lung cancer // Clin Cancer Res. – 2007. – 13. – № 13. – P: 3840-7. 76. Gure A.O., Chua R., Williamson B., Gonen M., Ferrera C.A., Gnjatic S., Ritter G., Simpson A.J., Chen Y.T., Old L.J., Altorki N.K. Cancer-testis genes are coordinately expressed and are markers of poor outcome in non-small cell lung cancer // Clin Cancer Res. – 2005. – 11. – № 22. – P: 8055-62. 77. Grah J., Samija M., Juretic A., Sarcevic B., Sobat H. Immunohystochemical expression of cancer/testis antigens (MAGE-A3/4, NY-ESO-1) in non-small cell lung cancer: the relationship with clinical-pathological features // Coll Antropol. – 2008. – 32. – № 3. – P: 731-6. 78. Graff-Dubois S., Faure O., Gross D.A., Alves P., Scardino A., Chouaib S., Lemonnier F.A., Kosmatopoulos K. Generation of CTL recognizing an HLAA*0201-restricted epitope shared by MAGE-A1, -A2, -A3, -A4, -A6, -A10, and A12 tumor antigens: implication in a broad-spectrum tumor immunotherapy // J Immunol. – 2002. – 169. – № 1. – P: 575-80. 79. Goldman B., DeFrancesco L. The cancer vaccine roller coaster // Nat Biotechnol. – 2009. – 27. – № 2. – P: 129-39. 80. Brichard V.G., Lejeune D. GSK's antigen-specific cancer immunotherapy programme: pilot results leading to Phase III clinical development // Vaccine. – 2007. – 25 Suppl 2. – №. – P: B61-71. 81. Brichard V.G., Lejeune D. Cancer immunotherapy targeting tumour-specific antigens: towards a new therapy for minimal residual disease // Expert Opin Biol Ther. – 2008. – 8. – № 7. – P: 951-68. 114 82. Tyagi P., Mirakhur B. MAGRIT: the largest-ever phase III lung cancer trial aims to establish a novel tumor-specific approach to therapy // Clin Lung Cancer. – 2009. – 10. – № 5. – P: 371-4. 83. Goodyear O., Agathanggelou A., Novitzky-Basso I., Siddique S., McSkeane T., Ryan G., Vyas P., Cavenagh J., Stankovic T., Moss P., Craddock C. Induction of a CD8+ T-cell response to the MAGE cancer testis antigen by combined treatment with azacitidine and sodium valproate in patients with acute myeloid leukemia and myelodysplasia // Blood. – 2010. – 116. – № 11. – P: 1908-18. 84. Cruz C.R., Gerdemann U., Leen A.M., Shafer J.A., Ku S., Tzou B., Horton T.M., Sheehan A., Copeland A., Younes A., Rooney C.M., Heslop H.E., Bollard C.M. Improving T-cell therapy for relapsed EBV-negative Hodgkin lymphoma by targeting upregulated MAGE-A4 // Clin Cancer Res. – 2011. – 17. – № 22. – P: 7058-66. 85. Rezvani K. MAGE: the spell is broken // Clin Cancer Res. – 2011. – 17. – № 22. – P: 6955-7. 86. Shirakura Y., Mizuno Y., Wang L., Imai N., Amaike C., Sato E., Ito M., Nukaya I., Mineno J., Takesako K., Ikeda H., Shiku H. T-cell receptor gene therapy targeting melanoma-associated antigen-A4 inhibits human tumor growth in non-obese diabetic/SCID/gammacnull mice // Cancer Sci. – 2012. – 103. – № 1. – P: 17-25. 87. Straetemans T., van Brakel M., van Steenbergen S., Broertjes M., Drexhage J., Hegmans J., Lambrecht B.N., Lamers C., van Der Bruggen P., Coulie P.G., Debets R. TCR gene transfer: MAGE-C2/HLA-A2 and MAGE-A3/HLA-DP4 epitopes as melanoma-specific immune targets // Clin Dev Immunol. – 2012. – 2012. – №. – P: 586314. 88. Boel P., Wildmann C., Sensi M.L., Brasseur R., Renauld J.C., Coulie P., Boon T., van der Bruggen P. BAGE: a new gene encoding an antigen recognized on human melanomas by cytolytic T lymphocytes // Immunity. – 1995. – 2. – № 2. – P: 16775. 89. Ruault M., van der Bruggen P., Brun M.E., Boyle S., Roizes G., De Sario A. New BAGE (B melanoma antigen) genes mapping to the juxtacentromeric regions of human chromosomes 13 and 21 have a cancer/testis expression profile // Eur J Hum Genet. – 2002. – 10. – № 12. – P: 833-40. 90. Ruault M., Ventura M., Galtier N., Brun M.E., Archidiacono N., Roizes G., De Sario A. BAGE genes generated by juxtacentromeric reshuffling in the Hominidae lineage are under selective pressure // Genomics. – 2003. – 81. – № 4. – P: 391-9. 91. Andrade V.C., Vettore A.L., Felix R.S., Almeida M.S., Carvalho F., Oliveira J.S., Chauffaille M.L., Andriolo A., Caballero O.L., Zago M.A., Colleoni G.W. Prognostic impact of cancer/testis antigen expression in advanced stage multiple myeloma patients // Cancer Immun. – 2008. – 8. – №. – P: 2. 92. Dalerba P., Frascella E., Macino B., Mandruzzato S., Zambon A., Rosolen A., Carli M., Ninfo V., Zanovello P. MAGE, BAGE and GAGE gene expression in human rhabdomyosarcomas // Int J Cancer. – 2001. – 93. – № 1. – P: 85-90. 93. Cuffel C., Rivals J.P., Zaugg Y., Salvi S., Seelentag W., Speiser D.E., Lienard D., Monnier P., Romero P., Bron L., Rimoldi D. Pattern and clinical significance of cancer-testis gene expression in head and neck squamous cell carcinoma // Int J Cancer. – 2011. – 128. – № 11. – P: 2625-34. 115 94. Nagel H., Laskawi R., Eiffert H., Schlott T. Analysis of the tumour suppressor genes, FHIT and WT-1, and the tumour rejection genes, BAGE, GAGE-1/2, HAGE, MAGE-1, and MAGE-3, in benign and malignant neoplasms of the salivary glands // Mol Pathol. – 2003. – 56. – № 4. – P: 226-31. 95. Atanackovic D., Arfsten J., Cao Y., Gnjatic S., Schnieders F., Bartels K., Schilling G., Faltz C., Wolschke C., Dierlamm J., Ritter G., Eiermann T., Hossfeld D.K., Zander A.R., Jungbluth A.A., Old L.J., Bokemeyer C., Kroger N. Cancer-testis antigens are commonly expressed in multiple myeloma and induce systemic immunity following allogeneic stem cell transplantation // Blood. – 2007. – 109. – № 3. – P: 1103-12. 96. van Baren N., Brasseur F., Godelaine D., Hames G., Ferrant A., Lehmann F., Andre M., Ravoet C., Doyen C., Spagnoli G.C., Bakkus M., Thielemans K., Boon T. Genes encoding tumor-specific antigens are expressed in human myeloma cells // Blood. – 1999. – 94. – № 4. – P: 1156-64. 97. Kobayashi Y., Higashi T., Nouso K., Nakatsukasa H., Ishizaki M., Kaneyoshi T., Toshikuni N., Kariyama K., Nakayama E., Tsuji T. Expression of MAGE, GAGE and BAGE genes in human liver diseases: utility as molecular markers for hepatocellular carcinoma // J Hepatol. – 2000. – 32. – № 4. – P: 612-7. 98. Hofmann M., Ruschenburg I. mRNA detection of tumor-rejection genes BAGE, GAGE, and MAGE in peritoneal fluid from patients with ovarian carcinoma as a potential diagnostic tool // Cancer. – 2002. – 96. – № 3. – P: 187-93. 99. Zhang S., Zhou X., Yu H., Yu Y. Expression of tumor-specific antigen MAGE, GAGE and BAGE in ovarian cancer tissues and cell lines // BMC cancer. – 2010. – 10. – №. – P: 163. 100. Grunau C., Sanchez C., Ehrlich M., van der Bruggen P., Hindermann W., Rodriguez C., Krieger S., Dubeau L., Fiala E., De Sario A. Frequent DNA hypomethylation of human juxtacentromeric BAGE loci in cancer // Genes, chromosomes & cancer. – 2005. – 43. – № 1. – P: 11-24. 101. Grunau C., Brun M.E., Rivals I., Selves J., Hindermann W., Favre-Mercuret M., Granier G., De Sario A. BAGE hypomethylation, a new epigenetic biomarker for colon cancer detection // Cancer Epidemiol Biomarkers Prev. – 2008. – 17. – № 6. – P: 1374-9. 102. Van den Eynde B., Peeters O., De Backer O., Gaugler B., Lucas S., Boon T. A new family of genes coding for an antigen recognized by autologous cytolytic T lymphocytes on a human melanoma // J Exp Med. – 1995. – 182. – № 3. – P: 68998. 103. De Backer O., Arden K.C., Boretti M., Vantomme V., De Smet C., Czekay S., Viars C.S., De Plaen E., Brasseur F., Chomez P., Van den Eynde B., Boon T., van der Bruggen P. Characterization of the GAGE genes that are expressed in various human cancers and in normal testis // Cancer Res. – 1999. – 59. – № 13. – P: 315765. 104. Scarcella D.L., Chow C.W., Gonzales M.F., Economou C., Brasseur F., Ashley D.M. Expression of MAGE and GAGE in high-grade brain tumors: a potential target for specific immunotherapy and diagnostic markers // Clin Cancer Res. – 1999. – 5. – № 2. – P: 335-41. 105. Kasuga C., Nakahara Y., Ueda S., Hawkins C., Taylor M.D., Smith C.A., Rutka J.T. Expression of MAGE and GAGE genes in medulloblastoma and modulation of 116 106. 107. 108. 109. 110. 111. 112. 113. 114. 115. 116. 117. resistance to chemotherapy. Laboratory investigation // J Neurosurg Pediatr. – 2008. – 1. – № 4. – P: 305-13. van Duin M., Broyl A., de Knegt Y., Goldschmidt H., Richardson P.G., Hop W.C., van der Holt B., Joseph-Pietras D., Mulligan G., Neuwirth R., Sahota S.S., Sonneveld P. Cancer testis antigens in newly diagnosed and relapse multiple myeloma: prognostic markers and potential targets for immunotherapy // Haematologica. – 2011. – 96. – № 11. – P: 1662-9. Figueiredo D.L., Mamede R.C., Spagnoli G.C., Silva W.A., Jr., Zago M., Neder L., Jungbluth A.A., Saggioro F.P. High expression of cancer testis antigens MAGE-A, MAGE-C1/CT7, MAGE-C2/CT10, NY-ESO-1, and gage in advanced squamous cell carcinoma of the larynx // Head Neck. – 2011. – 33. – № 5. – P: 702-7. Chen Y.T., Chiu R., Lee P., Beneck D., Jin B., Old L.J. Chromosome X-encoded cancer/testis antigens show distinctive expression patterns in developing gonads and in testicular seminoma // Hum Reprod. – 2011. – 26. – № 12. – P: 3232-43. Cheung I.Y., Chi S.N., Cheung N.K. Prognostic significance of GAGE detection in bone marrows on survival of patients with metastatic neuroblastoma // Med Pediatr Oncol. – 2000. – 35. – № 6. – P: 632-4. Kong U., Koo J., Choi K., Park J., Chang H. The expression of GAGE gene can predict aggressive biologic behavior of intestinal type of stomach cancer // Hepatogastroenterology. – 2004. – 51. – № 59. – P: 1519-23. Zambon A., Mandruzzato S., Parenti A., Macino B., Dalerba P., Ruol A., Merigliano S., Zaninotto G., Zanovello P. MAGE, BAGE, and GAGE gene expression in patients with esophageal squamous cell carcinoma and adenocarcinoma of the gastric cardia // Cancer. – 2001. – 91. – № 10. – P: 1882-8. Jungbluth A.A., Chen Y.T., Stockert E., Busam K.J., Kolb D., Iversen K., Coplan K., Williamson B., Altorki N., Old L.J. Immunohistochemical analysis of NY-ESO1 antigen expression in normal and malignant human tissues // Int J Cancer. – 2001. – 92. – № 6. – P: 856-60. Gotter J., Brors B., Hergenhahn M., Kyewski B. Medullary epithelial cells of the human thymus express a highly diverse selection of tissue-specific genes colocalized in chromosomal clusters // J Exp Med. – 2004. – 199. – № 2. – P: 15566. Sato S., Noguchi Y., Wada H., Fujita S., Nakamura S., Tanaka R., Nakada T., Hasegawa K., Nakagawa K., Koizumi F., Ono T., Nouso K., Jungbluth A., Chen Y.T., Old L.J., Shiratori Y., Nakayama E. Quantitative real-time RT-PCR analysis of NY-ESO-1 and LAGE-1a mRNA expression in normal tissues and tumors, and correlation of the protein expression with the mRNA copy number // Int J Oncol. – 2005. – 26. – № 1. – P: 57-63. Gnjatic S., Nishikawa H., Jungbluth A.A., Gure A.O., Ritter G., Jager E., Knuth A., Chen Y.T., Old L.J. NY-ESO-1: review of an immunogenic tumor antigen // Adv Cancer Res. – 2006. – 95. – №. – P: 1-30. Hemminger J.A., Ewart Toland A., Scharschmidt T.J., Mayerson J.L., Kraybill W.G., Guttridge D.C., Iwenofu O.H. The cancer-testis antigen NY-ESO-1 is highly expressed in myxoid and round cell subset of liposarcomas // Mod Pathol. – 2012. – №. – P. Sharma P., Gnjatic S., Jungbluth A.A., Williamson B., Herr H., Stockert E., Dalbagni G., Donat S.M., Reuter V.E., Santiago D., Chen Y.T., Bajorin D.F., Old 117 118. 119. 120. 121. 122. 123. 124. 125. 126. L.J. Frequency of NY-ESO-1 and LAGE-1 expression in bladder cancer and evidence of a new NY-ESO-1 T-cell epitope in a patient with bladder cancer // Cancer Immun. – 2003. – 3. – №. – P: 19. Dyrskjot L., Zieger K., Kissow Lildal T., Reinert T., Gruselle O., Coche T., Borre M., Orntoft T.F. Expression of MAGE-A3, NY-ESO-1, LAGE-1 and PRAME in urothelial carcinoma // British journal of cancer. – 2012. – 107. – № 1. – P: 116-22. Odunsi K., Jungbluth A.A., Stockert E., Qian F., Gnjatic S., Tammela J., Intengan M., Beck A., Keitz B., Santiago D., Williamson B., Scanlan M.J., Ritter G., Chen Y.T., Driscoll D., Sood A., Lele S., Old L.J. NY-ESO-1 and LAGE-1 cancer-testis antigens are potential targets for immunotherapy in epithelial ovarian cancer // Cancer research. – 2003. – 63. – № 18. – P: 6076-83. Chapman C.J., Healey G.F., Murray A., Boyle P., Robertson C., Peek L.J., Allen J., Thorpe A.J., Hamilton-Fairley G., Parsy-Kowalska C.B., Macdonald I.K., Jewell W., Maddison P., Robertson J.F. EarlyCDT(R)-Lung test: improved clinical utility through additional autoantibody assays // Tumour Biol. – 2012. – 33. – № 5. – P: 1319-26. Fujita S., Wada H., Jungbluth A.A., Sato S., Nakata T., Noguchi Y., Doki Y., Yasui M., Sugita Y., Yasuda T., Yano M., Ono T., Chen Y.T., Higashiyama M., Gnjatic S., Old L.J., Nakayama E., Monden M. NY-ESO-1 expression and immunogenicity in esophageal cancer // Clin Cancer Res. – 2004. – 10. – № 19. – P: 6551-8. Perez D., Hauswirth F., Jager D., Metzger U., Samartzis E.P., Went P., Jungbluth A. Protein expression of cancer testis antigens predicts tumor recurrence and treatment response to imatinib in gastrointestinal stromal tumors // Int J Cancer. – 2011. – 128. – № 12. – P: 2947-52. Velazquez E.F., Jungbluth A.A., Yancovitz M., Gnjatic S., Adams S., O'Neill D., Zavilevich K., Albukh T., Christos P., Mazumdar M., Pavlick A., Polsky D., Shapiro R., Berman R., Spira J., Busam K., Osman I., Bhardwaj N. Expression of the cancer/testis antigen NY-ESO-1 in primary and metastatic malignant melanoma (MM)--correlation with prognostic factors // Cancer Immun. – 2007. – 7. – №. – P: 11. Weide B., Zelba H., Derhovanessian E., Pflugfelder A., Eigentler T.K., Di Giacomo A.M., Maio M., Aarntzen E.H., de Vries I.J., Sucker A., Schadendorf D., Buttner P., Garbe C., Pawelec G. Functional T cells targeting NY-ESO-1 or Melan-A are predictive for survival of patients with distant melanoma metastasis // J Clin Oncol. – 2012. – 30. – № 15. – P: 1835-41. Davis I.D., Chen W., Jackson H., Parente P., Shackleton M., Hopkins W., Chen Q., Dimopoulos N., Luke T., Murphy R., Scott A.M., Maraskovsky E., McArthur G., MacGregor D., Sturrock S., Tai T.Y., Green S., Cuthbertson A., Maher D., Miloradovic L., Mitchell S.V., Ritter G., Jungbluth A.A., Chen Y.T., Gnjatic S., Hoffman E.W., Old L.J., Cebon J.S. Recombinant NY-ESO-1 protein with ISCOMATRIX adjuvant induces broad integrated antibody and CD4(+) and CD8(+) T cell responses in humans // Proc. Nat. Acad. Sci. USA. – 2004. – 101. – № 29. – P: 10697-702. Karbach J., Gnjatic S., Bender A., Neumann A., Weidmann E., Yuan J., Ferrara C.A., Hoffmann E., Old L.J., Altorki N.K., Jager E. Tumor-reactive CD8+ T-cell responses after vaccination with NY-ESO-1 peptide, CpG 7909 and Montanide ISA-51: association with survival // Int J Cancer. – 2010. – 126. – № 4. – P: 909-18. 118 127. Stockert E., Jager E., Chen Y.T., Scanlan M.J., Gout I., Karbach J., Arand M., Knuth A., Old L.J. A survey of the humoral immune response of cancer patients to a panel of human tumor antigens // J Exp Med. – 1998. – 187. – № 8. – P: 1349-54. 128. Yuan J., Adamow M., Ginsberg B.A., Rasalan T.S., Ritter E., Gallardo H.F., Xu Y., Pogoriler E., Terzulli S.L., Kuk D., Panageas K.S., Ritter G., Sznol M., Halaban R., Jungbluth A.A., Allison J.P., Old L.J., Wolchok J.D., Gnjatic S. Integrated NYESO-1 antibody and CD8+ T-cell responses correlate with clinical benefit in advanced melanoma patients treated with ipilimumab // Proc. Nat. Acad. Sci. USA. – 2011. – 108. – № 40. – P: 16723-8. 129. Yuan J., Gnjatic S., Li H., Powel S., Gallardo H.F., Ritter E., Ku G.Y., Jungbluth A.A., Segal N.H., Rasalan T.S., Manukian G., Xu Y., Roman R.A., Terzulli S.L., Heywood M., Pogoriler E., Ritter G., Old L.J., Allison J.P., Wolchok J.D. CTLA-4 blockade enhances polyfunctional NY-ESO-1 specific T cell responses in metastatic melanoma patients with clinical benefit // Proc. Nat. Acad. Sci. USA. – 2008. – 105. – № 51. – P: 20410-5. 130. Fourcade J., Kudela P., Sun Z., Shen H., Land S.R., Lenzner D., Guillaume P., Luescher I.F., Sander C., Ferrone S., Kirkwood J.M., Zarour H.M. PD-1 is a regulator of NY-ESO-1-specific CD8+ T cell expansion in melanoma patients // J Immunol. – 2009. – 182. – № 9. – P: 5240-9. 131. Fourcade J., Sun Z., Benallaoua M., Guillaume P., Luescher I.F., Sander C., Kirkwood J.M., Kuchroo V., Zarour H.M. Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+ T cell dysfunction in melanoma patients // J Exp Med. – 2010. – 207. – № 10. – P: 2175-86. 132. Matsuzaki J., Gnjatic S., Mhawech-Fauceglia P., Beck A., Miller A., Tsuji T., Eppolito C., Qian F., Lele S., Shrikant P., Old L.J., Odunsi K. Tumor-infiltrating NY-ESO-1-specific CD8+ T cells are negatively regulated by LAG-3 and PD-1 in human ovarian cancer // Proc. Nat. Acad. Sci. USA. – 2010. – 107. – № 17. – P: 7875-80. 133. Gabrilovich D.I., Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system // Nature reviews. Immunology. – 2009. – 9. – № 3. – P: 162-74. 134. Nicholaou T., Ebert L.M., Davis I.D., McArthur G.A., Jackson H., Dimopoulos N., Tan B., Maraskovsky E., Miloradovic L., Hopkins W., Pan L., Venhaus R., Hoffman E.W., Chen W., Cebon J. Regulatory T-cell-mediated attenuation of T-cell responses to the NY-ESO-1 ISCOMATRIX vaccine in patients with advanced malignant melanoma // Clin Cancer Res. – 2009. – 15. – № 6. – P: 2166-73. 135. Chen Q., Jackson H., Parente P., Luke T., Rizkalla M., Tai T.Y., Zhu H.C., Mifsud N.A., Dimopoulos N., Masterman K.A., Hopkins W., Goldie H., Maraskovsky E., Green S., Miloradovic L., McCluskey J., Old L.J., Davis I.D., Cebon J., Chen W. Immunodominant CD4+ responses identified in a patient vaccinated with fulllength NY-ESO-1 formulated with ISCOMATRIX adjuvant // Proc. Nat. Acad. Sci. USA. – 2004. – 101. – № 25. – P: 9363-8. 136. Mischo A., Bubel N., Cebon J.S., Samaras P., Petrausch U., Stenner-Liewen F., Schaefer N.G., Kubuschok B., Renner C., Wadle A. Recombinant NY-ESO-1 protein with ISCOMATRIX adjuvant induces broad antibody responses in humans, a RAYS-based analysis // Int J Oncol. – 2011. – 39. – № 1. – P: 287-94. 137. Nicholaou T., Chen W., Davis I.D., Jackson H.M., Dimopoulos N., Barrow C., Browning J., Macgregor D., Williams D., Hopkins W., Maraskovsky E., Venhaus 119 138. 139. 140. 141. 142. 143. 144. 145. R., Pan L., Hoffman E.W., Old L.J., Cebon J. Immunoediting and persistence of antigen-specific immunity in patients who have previously been vaccinated with NY-ESO-1 protein formulated in ISCOMATRIX // Cancer Immunol Immunother. – 2011. – 60. – № 11. – P: 1625-37. Aoki M., Ueda S., Nishikawa H., Kitano S., Hirayama M., Ikeda H., Toyoda H., Tanaka K., Kanai M., Takabayashi A., Imai H., Shiraishi T., Sato E., Wada H., Nakayama E., Takei Y., Katayama N., Shiku H., Kageyama S. Antibody responses against NY-ESO-1 and HER2 antigens in patients vaccinated with combinations of cholesteryl pullulan (CHP)-NY-ESO-1 and CHP-HER2 with OK-432 // Vaccine. – 2009. – 27. – № 49. – P: 6854-61. Shackleton M., Davis I.D., Hopkins W., Jackson H., Dimopoulos N., Tai T., Chen Q., Parente P., Jefford M., Masterman K.A., Caron D., Chen W., Maraskovsky E., Cebon J. The impact of imiquimod, a Toll-like receptor-7 ligand (TLR7L), on the immunogenicity of melanoma peptide vaccination with adjuvant Flt3 ligand // Cancer Immun. – 2004. – 4. – №. – P: 9. Kakimi K., Isobe M., Uenaka A., Wada H., Sato E., Doki Y., Nakajima J., Seto Y., Yamatsuji T., Naomoto Y., Shiraishi K., Takigawa N., Kiura K., Tsuji K., Iwatsuki K., Oka M., Pan L., Hoffman E.W., Old L.J., Nakayama E. A phase I study of vaccination with NY-ESO-1f peptide mixed with Picibanil OK-432 and Montanide ISA-51 in patients with cancers expressing the NY-ESO-1 antigen // Int J Cancer. – 2011. – 129. – № 12. – P: 2836-46. Jager E., Karbach J., Gnjatic S., Neumann A., Bender A., Valmori D., Ayyoub M., Ritter E., Ritter G., Jager D., Panicali D., Hoffman E., Pan L., Oettgen H., Old L.J., Knuth A. Recombinant vaccinia/fowlpox NY-ESO-1 vaccines induce both humoral and cellular NY-ESO-1-specific immune responses in cancer patients // Proc. Nat. Acad. Sci. USA. – 2006. – 103. – № 39. – P: 14453-8. Nishikawa H., Sato E., Briones G., Chen L.M., Matsuo M., Nagata Y., Ritter G., Jager E., Nomura H., Kondo S., Tawara I., Kato T., Shiku H., Old L.J., Galan J.E., Gnjatic S. In vivo antigen delivery by a Salmonella typhimurium type III secretion system for therapeutic cancer vaccines // J Clin Invest. – 2006. – 116. – № 7. – P: 1946-54. Davis I.D., Chen Q., Morris L., Quirk J., Stanley M., Tavarnesi M.L., Parente P., Cavicchiolo T., Hopkins W., Jackson H., Dimopoulos N., Tai T.Y., MacGregor D., Browning J., Svobodova S., Caron D., Maraskovsky E., Old L.J., Chen W., Cebon J. Blood dendritic cells generated with Flt3 ligand and CD40 ligand prime CD8+ T cells efficiently in cancer patients // J Immunother. – 2006. – 29. – № 5. – P: 499511. Hunder N.N., Wallen H., Cao J., Hendricks D.W., Reilly J.Z., Rodmyre R., Jungbluth A., Gnjatic S., Thompson J.A., Yee C. Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1 // N Engl J Med. – 2008. – 358. – № 25. – P: 2698-703. Robbins P.F., Morgan R.A., Feldman S.A., Yang J.C., Sherry R.M., Dudley M.E., Wunderlich J.R., Nahvi A.V., Helman L.J., Mackall C.L., Kammula U.S., Hughes M.S., Restifo N.P., Raffeld M., Lee C.C., Levy C.L., Li Y.F., El-Gamil M., Schwarz S.L., Laurencot C., Rosenberg S.A. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered 120 146. 147. 148. 149. 150. 151. 152. 153. 154. 155. 156. 157. 158. lymphocytes reactive with NY-ESO-1 // J Clin Oncol. – 2011. – 29. – № 7. – P: 917-24. Каприн А.Д., Старинский В.В., Петрова Г.В., Состояние онкологической помощи населению России в 2013 году.2014, М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздравсоцразвития России. Ahmad A. Pathways to breast cancer recurrence // ISRN Oncol. – 2013. – 2013. – №. – P: 290568. Mischo A., Kubuschok B., Ertan K., Preuss K.D., Romeike B., Regitz E., Schormann C., de Bruijn D., Wadle A., Neumann F., Schmidt W., Renner C., Pfreundschuh M. Prospective study on the expression of cancer testis genes and antibody responses in 100 consecutive patients with primary breast cancer // Int J Cancer. – 2006. – 118. – № 3. – P: 696-703. Taylor M., Bolton L.M., Johnson P., Elliott T., Murray N. Breast cancer is a promising target for vaccination using cancer-testis antigens known to elicit immune responses // Breast Cancer Res. – 2007. – 9. – № 4. – P: R46. Curigliano G., Locatelli M., Fumagalli L., Goldhirsch A. Immunizing against breast cancer: a new swing for an old sword // Breast. – 2009. – 18 Suppl 3. – №. – P: S51-4. Herold C.I., Blackwell K.L. Aromatase inhibitors for breast cancer: proven efficacy across the spectrum of disease // Clin Breast Cancer. – 2008. – 8. – № 1. – P: 50-64. Theurillat J.P., Ingold F., Frei C., Zippelius A., Varga Z., Seifert B., Chen Y.T., Jager D., Knuth A., Moch H. NY-ESO-1 protein expression in primary breast carcinoma and metastases: correlation with CD8+ T-cell and CD79a+ plasmacytic/B-cell infiltration // Int J Cancer. – 2007. – 120. – № 11. – P: 2411-7. Kruger S., Ola V., Feller A.C., Fischer D., Friedrich M. Expression of cancer-testis antigen CT7 (MAGE-C1) in breast cancer: an immunohistochemical study with emphasis on prognostic utility // Pathol Oncol Res. – 2007. – 13. – № 2. – P: 91-6. Kavalar R., Sarcevic B., Spagnoli G.C., Separovic V., Samija M., Terracciano L., Heberer M., Juretic A. Expression of MAGE tumour-associated antigens is inversely correlated with tumour differentiation in invasive ductal breast cancers: an immunohistochemical study // Virchows Arch. – 2001. – 439. – № 2. – P: 127-31. Bandic D., Juretic A., Sarcevic B., Separovic V., Kujundzic-Tiljak M., Hudolin T., Spagnoli G.C., Covic D., Samija M. Expression and possible prognostic role of MAGE-A4, NY-ESO-1, and HER-2 antigens in women with relapsing invasive ductal breast cancer: retrospective immunohistochemical study // Croat Med J. – 2006. – 47. – № 1. – P: 32-41. Matkovic B., Juretic A., Spagnoli G.C., Separovic V., Gamulin M., Separovic R., Saric N., Basic-Koretic M., Novosel I., Kruslin B. Expression of MAGE-A and NY-ESO-1 cancer/testis antigens in medullary breast cancer: retrospective immunohistochemical study // Croat Med J. – 2011. – 52. – № 2. – P: 171-7. Lian Y., Sang M., Ding C., Zhou X., Fan X., Xu Y., Lu W., Shan B. Expressions of MAGE-A10 and MAGE-A11 in breast cancers and their prognostic significance: a retrospective clinical study // J Cancer Res Clin Oncol. – 2012. – 138. – № 3. – P: 519-27. Otte M., Zafrakas M., Riethdorf L., Pichlmeier U., Loning T., Janicke F., Pantel K. MAGE-A gene expression pattern in primary breast cancer // Cancer research. – 2001. – 61. – № 18. – P: 6682-7. 121 159. Grigoriadis A., Caballero O.L., Hoek K.S., da Silva L., Chen Y.T., Shin S.J., Jungbluth A.A., Miller L.D., Clouston D., Cebon J., Old L.J., Lakhani S.R., Simpson A.J., Neville A.M. CT-X antigen expression in human breast cancer // Proc. Nat. Acad. Sci. USA. – 2009. – 106. – № 32. – P: 13493-8. 160. Perou C.M., Sorlie T., Eisen M.B., van de Rijn M., Jeffrey S.S., Rees C.A., Pollack J.R., Ross D.T., Johnsen H., Akslen L.A., Fluge O., Pergamenschikov A., Williams C., Zhu S.X., Lonning P.E., Borresen-Dale A.L., Brown P.O., Botstein D. Molecular portraits of human breast tumours // Nature. – 2000. – 406. – № 6797. – P: 747-52. 161. Pazaiti A., Fentiman I.S. Basal phenotype breast cancer: implications for treatment and prognosis // Womens Health (Lond Engl). – 2011. – 7. – № 2. – P: 181-202. 162. Brouckaert O., Wildiers H., Floris G., Neven P. Update on triple-negative breast cancer: prognosis and management strategies // Int J Womens Health. – 2012. – 4. – №. – P: 511-20. 163. Sugita Y., Wada H., Fujita S., Nakata T., Sato S., Noguchi Y., Jungbluth A.A., Yamaguchi M., Chen Y.T., Stockert E., Gnjatic S., Williamson B., Scanlan M.J., Ono T., Sakita I., Yasui M., Miyoshi Y., Tamaki Y., Matsuura N., Noguchi S., Old L.J., Nakayama E., Monden M. NY-ESO-1 expression and immunogenicity in malignant and benign breast tumors // Cancer research. – 2004. – 64. – № 6. – P: 2199-204. 164. Badovinac-Crnjevic T., Spagnoli G., Juretic A., Jakic-Razumovic J., Podolski P., Saric N. Erratum to: High expression of MAGE-A10 cancer-testis antigen in triplenegative breast cancer // Med Oncol. – 2012. – №. – P. 165. Tanja B.C., Giulio S., Antonio J., Jasminka J.R., Paula P., Nera High expression of MAGE-A10 cancer-testis antigen in triple-negative breast cancer // Med Oncol. – 2012. – 29. – № 3. – P: 1586-91. 166. Hamai A., Duperrier-Amouriaux K., Pignon P., Raimbaud I., Memeo L., Colarossi C., Canzonieri V., Perin T., Classe J.M., Campone M., Jezequel P., Campion L., Ayyoub M., Valmori D. Antibody responses to NY-ESO-1 in primary breast cancer identify a subtype target for immunotherapy // PLoS One. – 2011. – 6. – № 6. – P: e21129. 167. Hudis C.A., Gianni L. Triple-negative breast cancer: an unmet medical need // Oncologist. – 2011. – 16 Suppl 1. – №. – P: 1-11. 168. Venkitaraman R. Triple-negative/basal-like breast cancer: clinical, pathologic and molecular features // Expert Rev Anticancer Ther. – 2010. – 10. – № 2. – P: 199207. 169. Karn T., Pusztai L., Ruckhaberle E., Liedtke C., Muller V., Schmidt M., Metzler D., Wang J., Coombes K.R., Gatje R., Hanker L., Solbach C., Ahr A., Holtrich U., Rody A., Kaufmann M. Melanoma antigen family A identified by the bimodality index defines a subset of triple negative breast cancers as candidates for immune response augmentation // Eur J Cancer. – 2012. – 48. – № 1. – P: 12-23. 170. Curigliano G., Viale G., Ghioni M., Jungbluth A.A., Bagnardi V., Spagnoli G.C., Neville A.M., Nole F., Rotmensz N., Goldhirsch A. Cancer-testis antigen expression in triple-negative breast cancer // Ann Oncol. – 2011. – 22. – № 1. – P: 98-103. 171. Ademuyiwa F.O., Bshara W., Attwood K., Morrison C., Edge S.B., Ambrosone C.B., O'Connor T.L., Levine E.G., Miliotto A., Ritter E., Ritter G., Gnjatic S., 122 172. 173. 174. 175. 176. 177. 178. 179. 180. 181. 182. Odunsi K. NY-ESO-1 cancer testis antigen demonstrates high immunogenicity in triple negative breast cancer // PLoS One. – 2012. – 7. – № 6. – P: e38783. Hamai A., Memeo L., Colarossi C., Canzonieri V., Perin T., Ayyoub M., Valmori D. Expression of MAGE-A antigens is frequent in triple-negative breast cancers but does not correlate with that of basal-like markers // Ann Oncol. – 2011. – 22. – № 4. – P: 986-7. Adams S., Greeder L., Reich E., Shao Y., Fosina D., Hanson N., Tassello J., Singh B., Spagnoli G.C., Demaria S., Jungbluth A.A. Expression of cancer testis antigens in human BRCA-associated breast cancers: potential targets for immunoprevention? // Cancer Immunol Immunother. – 2011. – 60. – № 7. – P: 999-1007. Odunsi K., Matsuzaki J., Karbach J., Neumann A., Mhawech-Fauceglia P., Miller A., Beck A., Morrison C.D., Ritter G., Godoy H., Lele S., duPont N., Edwards R., Shrikant P., Old L.J., Gnjatic S., Jager E. Efficacy of vaccination with recombinant vaccinia and fowlpox vectors expressing NY-ESO-1 antigen in ovarian cancer and melanoma patients // Proc. Nat. Acad. Sci. USA. – 2012. – 109. – № 15. – P: 5797802. Barnes L., Eveson J.W., Reichart P., Sidransky D., World Health Organization Classification of tumours. Pathology and Genetics of Head and Neck Tumours.2005, Lyon: IARC Press. Howlader N., Noone A.M., Krapcho M., Neyman N., Aminou R., Altekruse S.F., Kosary C.L., Ruhl J., Tatalovich Z., Cho H., Mariotto A., Eisner M.P., Lewis D.R., Chen H.S., Feuer E.J., Cronin K.A., SEER Cancer Statistics Review, 1975-2009 (Vintage 2009 Populations), based on November 2011 SEER data submission, posted to the SEER web site, April 2012. http://seer.cancer.gov/csr/1975_2009_pops09/, 2012, National Cancer Institute Bethesda, MD. Warnakulasuriya S., Johnson N.W., van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa // J Oral Pathol Med. – 2007. – 36. – № 10. – P: 575-80. Reibel J. Prognosis of oral pre-malignant lesions: significance of clinical, histopathological, and molecular biological characteristics // Crit Rev Oral Biol Med. – 2003. – 14. – № 1. – P: 47-62. Warnakulasuriya S., Reibel J., Bouquot J., Dabelsteen E. Oral epithelial dysplasia classification systems: predictive value, utility, weaknesses and scope for improvement // J Oral Pathol Med. – 2008. – 37. – № 3. – P: 127-33. Warnakulasuriya S., Kovacevic T., Madden P., Coupland V.H., Sperandio M., Odell E., Moller H. Factors predicting malignant transformation in oral potentially malignant disorders among patients accrued over a 10-year period in South East England // J Oral Pathol Med. – 2011. – №. – P. Hsue S.S., Wang W.C., Chen C.H., Lin C.C., Chen Y.K., Lin L.M. Malignant transformation in 1458 patients with potentially malignant oral mucosal disorders: a follow-up study based in a Taiwanese hospital // J Oral Pathol Med. – 2007. – 36. – № 1. – P: 25-9. Cowan C.G., Gregg T.A., Napier S.S., McKenna S.M., Kee F. Potentially malignant oral lesions in northern Ireland: a 20-year population-based perspective of malignant transformation // Oral Dis. – 2001. – 7. – № 1. – P: 18-24. 123 183. Liu W., Wang Y.F., Zhou H.W., Shi P., Zhou Z.T., Tang G.Y. Malignant transformation of oral leukoplakia: a retrospective cohort study of 218 Chinese patients // BMC cancer. – 2010. – 10. – №. – P: 685. 184. Liu W., Bao Z.X., Shi L.J., Tang G.Y., Zhou Z.T. Malignant transformation of oral epithelial dysplasia: clinicopathological risk factors and outcome analysis in a retrospective cohort of 138 cases // Histopathology. – 2011. – 59. – № 4. – P: 73340. 185. Kujan O., Khattab A., Oliver R.J., Roberts S.A., Thakker N., Sloan P. Why oral histopathology suffers inter-observer variability on grading oral epithelial dysplasia: an attempt to understand the sources of variation // Oral Oncol. – 2007. – 43. – № 3. – P: 224-31. 186. Lee J.J., Hung H.C., Cheng S.J., Chiang C.P., Liu B.Y., Yu C.H., Jeng J.H., Chang H.H., Kok S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions // Oral Surg Oral Med Oral Pathol Oral Radiol Endod. – 2007. – 104. – № 2. – P: 217-25. 187. Fischer D.J., Epstein J.B., Morton T.H., Schwartz S.M. Interobserver reliability in the histopathologic diagnosis of oral pre-malignant and malignant lesions // J Oral Pathol Med. – 2004. – 33. – № 2. – P: 65-70. 188. Holmstrup P., Vedtofte P., Reibel J., Stoltze K. Oral premalignant lesions: is a biopsy reliable? // J Oral Pathol Med. – 2007. – 36. – № 5. – P: 262-6. 189. Scully C. Challenges in predicting which oral mucosal potentially malignant disease will progress to neoplasia. // Oral Dis. – 2014. – 20. – № 1. – P: 1-5. 190. Sperandio M., Brown A.L., Lock C., Morgan P.R., Coupland V.H., Madden P.B., Warnakulasuriya S., Møller H., Odell E.W. Predictive value of dysplasia grading and DNA ploidy in malignant transformation of oral potentially malignant disorders. // Cancer Prev Res (Phila). – 2013. – 6. – № 8. – P: 822-31. 191. Smith J., Rattay T., McConkey C., Helliwell T., Mehanna H. Biomarkers in dysplasia of the oral cavity: a systematic review // Oral Oncol. – 2009. – 45. – № 8. – P: 647-53. 192. Kawaguchi H., El-Naggar A.K., Papadimitrakopoulou V., Ren H., Fan Y.H., Feng L., Lee J.J., Kim E., Hong W.K., Lippman S.M., Mao L. Podoplanin: a novel marker for oral cancer risk in patients with oral premalignancy // J Clin Oncology. – 2008. – 26. – № 3. – P: 354-60. 193. Ries J., Mollaoglu N., Toyoshima T., Vairaktaris E., Neukam F.W., Ponader S., Nkenke E. A novel multiple-marker method for the early diagnosis of oral squamous cell carcinoma // Dis Markers. – 2009. – 27. – № 2. – P: 75-84. 194. Metzler P., Mollaoglu N., Schwarz S., Neukam F.W., Nkenke E., Ries J. MAGE-A as a novel approach in the diagnostic accuracy of oral squamous cell cancer: a case report // Head Neck Oncol. – 2009. – 1. – №. – P: 39. 195. Ries J., Ponader S., Mollaoglu N., Vairaktaris E., Neukam F.W., Nkenke E. Early findings of a novel established molecular diagnostic technique for the prediction of malignant transformation in leukoplakia // Mol Med Report. – 2009. – 2. – № 6. – P: 947-52. 196. Mollaoglu N., Metzler P., Zenk J., Nkenke E., Neukam F.W., Ries J. Prediction of recurrence using exfoliative cytology and melanoma-associated antigen-A mRNA analysis following wide excision of oral squamous cell carcinoma: short report // Cytopathology. – 2011. – 22. – № 6. – P: 387-91. 124 197. Krauss E., Rauthe S., Gattenlohner S., Reuther T., Kochel M., Kriegebaum U., Kubler A.C., Muller-Richter U.D. MAGE-A antigens in lesions of the oral mucosa // Clin Oral Investig. – 2011. – 15. – № 3. – P: 315-20. 198. Ries J., Agaimy A., Vairaktaris E., Gorecki P., Neukam F.W., Strassburg L.H., Nkenke E. Detection of MAGE-A expression predicts malignant transformation of oral leukoplakia // Cancer Invest. – 2012. – 30. – № 7. – P: 495-502. 199. Ries J., Agaimy A., Vairaktaris E., Kwon Y., Neukam F.W., Strassburg L.H., Nkenke E. Evaluation of MAGE-A expression and grade of dysplasia for predicting malignant progression of oral leukoplakia // Int J Oncol. – 2012. – 41. – № 3. – P: 1085-93. 200. Михайлова И.Н., Барышников А.Ю., Морозова Л.Ф., Бурова О.С., Демидов Л.В., Козлов А.М., Ларин С.С., Георгиев Г.П., Ворожцов Г.Н., Гнучев Н.В., Приоритет изобретения 22.04.2005. Клеточная линия меланомы человека mel Kor, используемая для получения противоопухолевых вакцин. , Патент RU 2387578. 201. Sambrook J., Fritsch E.F., Maniatis T., Molecular cloning. 2nd ed.1989, Ann Arbor, MI: Cold Spring Harbor Laboratory Press. 202. KCM buffer (5X) Recipe., 2008., Cold Spring Harbor Protocols 2008(9). 203. Михайлова И.Н., Барышников А.Ю., Морозова Л.Ф., Бурова О.С., Демидов Л.В., Палкина Т.Н., Козлов А.М., Ларин С.С., Георгиев Г.П., Ворожцов Г.Н., Гнучев Н.В., Приоритет изобретения от 22.04.2005. Клеточная линия меланомы человека mel P, используемая для получения противоопухолевых вакцин, Патент RU 2287575. . 204. Гланц С., Медико-биологическая статистика1998, М.: Практика. 459. 205. Sahin U., Tureci O., Chen Y.T., Seitz G., Villena-Heinsen C., Old L.J., Pfreundschuh M. Expression of multiple cancer/testis (CT) antigens in breast cancer and melanoma: basis for polyvalent CT vaccine strategies // Int J Cancer. – 1998. – 78. – № 3. – P: 387-9. 206. Mashino K., Sadanaga N., Tanaka F., Yamaguchi H., Nagashima H., Inoue H., Sugimachi K., Mori M. Expression of multiple cancer-testis antigen genes in gastrointestinal and breast carcinomas // British journal of cancer. – 2001. – 85. – № 5. – P: 713-20. 207. Ries J., Vairaktaris E., Mollaoglu N., Wiltfang J., Neukam F.W., Nkenke E. Expression of melanoma-associated antigens in oral squamous cell carcinoma // J Oral Pathol Med. – 2008. – 37. – № 2. – P: 88-93. 208. Ries J., Mollaoglu N., Vairaktaris E., Neukam F.W., Nkenke E. Diagnostic and therapeutic relevance of NY-ESO-1 expression in oral squamous cell carcinoma // Anticancer Res. – 2009. – 29. – № 12. – P: 5125-30. 209. Atanackovic D., Blum I., Cao Y., Wenzel S., Bartels K., Faltz C., Hossfeld D.K., Hegewisch-Becker S., Bokemeyer C., Leuwer R. Expression of cancer-testis antigens as possible targets for antigen-specific immunotherapy in head and neck squamous cell carcinoma // Cancer Biol Ther. – 2006. – 5. – № 9. – P: 1218-25. 210. Figueiredo D.L., Mamede R.C., Proto-Siqueira R., Neder L., Silva W.A., Jr., Zago M.A. Expression of cancer testis antigens in head and neck squamous cell carcinomas // Head Neck. – 2006. – 28. – № 7. – P: 614-9. 125 211. Kienstra M.A., Neel H.B., Strome S.E., Roche P. Identification of NY-ESO-1, MAGE-1, and MAGE-3 in head and neck squamous cell carcinoma // Head Neck. – 2003. – 25. – № 6. – P: 457-63. 212. Becker J.C., Gillitzer R., Brocker E.B. A member of the melanoma antigenencoding gene (MAGE) family is expressed in human skin during wound healing // Int J Cancer. – 1994. – 58. – № 3. – P: 346-8. 213. Muller-Richter U.D., Dowejko A., Peters S., Rauthe S., Reuther T., Gattenlohner S., Reichert T.E., Driemel O., Kubler A.C. MAGE-A antigens in patients with primary oral squamous cell carcinoma // Clin Oral Investig. – 2010. – 14. – № 3. – P: 291-6. 214. Laduron S., Deplus R., Zhou S., Kholmanskikh O., Godelaine D., De Smet C., Hayward S.D., Fuks F., Boon T., De Plaen E. MAGE-A1 interacts with adaptor SKIP and the deacetylase HDAC1 to repress transcription // Nucleic Acids Res. – 2004. – 32. – № 14. – P: 4340-50. 215. Kopan R., Ilagan M.X. The canonical Notch signaling pathway: unfolding the activation mechanism // Cell. – 2009. – 137. – № 2. – P: 216-33. 216. Wallberg A.E., Pedersen K., Lendahl U., Roeder R.G. p300 and PCAF act cooperatively to mediate transcriptional activation from chromatin templates by notch intracellular domains in vitro // Mol Cell Biol. – 2002. – 22. – № 22. – P: 7812-9. 217. Lai E.C. Keeping a good pathway down: transcriptional repression of Notch pathway target genes by CSL proteins // EMBO Rep. – 2002. – 3. – № 9. – P: 8405. 218. Kovall R.A. Structures of CSL, Notch and Mastermind proteins: piecing together an active transcription complex // Curr Opin Struct Biol. – 2007. – 17. – № 1. – P: 11727. 219. Zhou S., Fujimuro M., Hsieh J.J., Chen L., Miyamoto A., Weinmaster G., Hayward S.D. SKIP, a CBF1-associated protein, interacts with the ankyrin repeat domain of NotchIC To facilitate NotchIC function // Mol Cell Biol. – 2000. – 20. – № 7. – P: 2400-10. 220. Borggrefe T., Oswald F. The Notch signaling pathway: transcriptional regulation at Notch target genes // Cell Mol Life Sci. – 2009. – 66. – № 10. – P: 1631-46. 221. Garcia T.X., DeFalco T., Capel B., Hofmann M.C. Constitutive activation of NOTCH1 signaling in Sertoli cells causes gonocyte exit from quiescence // Dev Biol. – 2013. – 377. – № 1. – P: 188-201. 222. Bai S., He B., Wilson E.M. Melanoma antigen gene protein MAGE-11 regulates androgen receptor function by modulating the interdomain interaction // Mol Cell Biol. – 2005. – 25. – № 4. – P: 1238-57. 223. Bai S., Wilson E.M. Epidermal-growth-factor-dependent phosphorylation and ubiquitinylation of MAGE-11 regulates its interaction with the androgen receptor // Mol Cell Biol. – 2008. – 28. – № 6. – P: 1947-63. 224. Askew E.B., Bai S., Hnat A.T., Minges J.T., Wilson E.M. Melanoma antigen gene protein-A11 (MAGE-11) F-box links the androgen receptor NH2-terminal transactivation domain to p160 coactivators // J Biol Chem. – 2009. – 284. – № 50. – P: 34793-808. 225. Askew E.B., Bai S., Blackwelder A.J., Wilson E.M. Transcriptional synergy between melanoma antigen gene protein-A11 (MAGE-11) and p300 in androgen receptor signaling // J Biol Chem. – 2010. – 285. – № 28. – P: 21824-36. 126 226. Leong G.M., Subramaniam N., Issa L.L., Barry J.B., Kino T., Driggers P.H., Hayman M.J., Eisman J.A., Gardiner E.M. Ski-interacting protein, a bifunctional nuclear receptor coregulator that interacts with N-CoR/SMRT and p300 // Biochem Biophys Res Commun. – 2004. – 315. – № 4. – P: 1070-6. 227. Zhang C., Baudino T.A., Dowd D.R., Tokumaru H., Wang W., MacDonald P.N. Ternary complexes and cooperative interplay between NCoA-62/Ski-interacting protein and steroid receptor coactivators in vitamin D receptor-mediated transcription // J Biol Chem. – 2001. – 276. – № 44. – P: 40614-20. 228. Rachez C., Freedman L.P. Mechanisms of gene regulation by vitamin D(3) receptor: a network of coactivator interactions // Gene. – 2000. – 246. – № 1-2. – P: 9-21. 229. Celis E., Fikes J., Wentworth P., Sidney J., Southwood S., Maewal A., Del Guercio M.F., Sette A., Livingston B. Identification of potential CTL epitopes of tumorassociated antigen MAGE-1 for five common HLA-A alleles // Mol Immunol. – 1994. – 31. – № 18. – P: 1423-30. 230. Abankwa D., Millard S.M., Martel N., Choong C.S., Yang M., Butler L.M., Buchanan G., Tilley W.D., Ueki N., Hayman M.J., Leong G.M. Ski-interacting protein (SKIP) interacts with androgen receptor in the nucleus and modulates androgen-dependent transcription // BMC Biochem. – 2013. – 14. – №. – P: 10. 127 Приложение А. Таблица А.1. – Данные пациентов с раком молочной железы Пол, год рождения Клинический диагноз ж., 1964 Карцинома молочной железы, Т2N0M0 ст. 2A 2.1 ж., 1954 Инфильтрующая протоковая карцинома, T2N1M0 ст. 3 Адъювантная ПХТ (4курса) и гормонотерапия в 2 л/у mts Эр+++ ПР+++ 3.1 ж., 1965 Инфильтрующая протоковая карцинома, T2N0M0 ст. 3 Адъювантная ПХТ (4курса) и гормонотерапия в л/у mts нет Эр+++ ПР+++ Отрицательно ж., 1952 Инфильтрующая протоковая крацинома T2N1M0 ст. 3 Адъювантная ПХТ (4курса) и гормонотерапия и лучевая терапия в 2 л/у mts Эр- ПР+++ Отрицательно 5.1 ж., 1938 Инфильтрующая протоковая карцинома T2N0M0 ст.3 Адъювантная ПХТ (4курса) и гормонотерапия в 2 л/у mts Эр- Пр+++ Отрицательно 6.1 ж., 1961 7.1 ж., 1961 Адъювантная ПХТ (4 курса) и гормонотерапия в 2 л/у mts Эр+++ Пр+++ Отрицательно 8.1 ж., 1952 в 3 л/у mts Эр+ ПР+++ Отрицательно Код образца 1.1 4.1 9.1 ж., 1949 10.1 ж. 11.1 ж. Карцинома молочной железы, T4N2Mx Инфильтрующая протоковая карцинома T2N1M0 ст.3 Инфильтрующая протоковая крацинома T2N1M0 ст. 3 Карцинома молочной железы, T3N2Mx Карцинома молочной железы Карцинома молочной железы Терапия Метастазы (mts) в л/у Рецепторы эстрогена Рецепторы прогестерона Рецепторы HER2/n eu 128 Таблица А.1. (Продолжение). Код образ -ца Пол, год рожден ия 12.1 ж. 13.1 ж. 14.1 1926 15.1 ж. 16.1 ж. 17.1 ж. 18.1 ж. 19.1 ж. 20.1 ж. 21.1 ж. 22.1 ж., 1967 23.1 ж., 1962 24.1 ж., 1937 25.1 ж., 1927 26.1 ж., 1931 27.1 ж., 1934 Клинический диагноз Карцинома молочной железы Карцинома молочной железы Инфильтрующая протоковая карцинома T2N0M0 ст.3 Карцинома молочной железы, Т2NхM2 Карцинома молочной железы Терапия Метастазы (mts) в л/у Рецепторы эстрогена Рецепторы прогестерона Рецепторы HER2/n eu Адъювантная ПХТ (4 курса) в 2 л/у mts нет Эр++ Пр+++ Отрицательно Карцинома молочной железы Карцинома молочной железы Карцинома молочной железы Карцинома молочной железы Карцинома молочной железы Инфильтрующая протоковая карцинома T2N0M0 ст.3 Инфильтрующая протоковая карцинома T2N0M0 ст.3 Инфильтрующая протоковая крцинома T2N0M0, ст.2-3 Скирр T4N1Mx ст.2 с инвазией в кожу Инфильтрующая протоковая карцинома T2N1M0 ст.2 Скирр T3N0M0 ст.2 Адъювантная ПХТ (4 курса) и гормонотерапия Адъювантная ПХТ (4 курса) и гормонотерапия Тамоксифен в 2 л/у mts нет Эр- Пр- Отрицательно в л/у mts нет Эр- Пр- Отрицательно Отрицательно в л/у mts нет Эр+++ ПР+++ в 1 из 5 л/у mts Эр+++ Пр+ Эр- Пр++++ Нет Тамоксифен Адъювантная ПХТ HER2/ne u++ Отрицательно 129 Таблица А.1. (Продолжение). Код Пол, год образрождения ца 28.1 ж., 1931 29.1 ж., 1956 30.1 ж., 1932 31.1 ж., 1951 32.1 ж., 1978 33.1 ж. 34.1 ж. 35.1 ж., 1939 36.1 ж. 37.1 ж, 1964 38.1 ж. 39.1 ж.,1938 40.1 ж. 41.1 ж., 1938 Клинический диагноз Инфильтрующая протоковая карцинома T1N0M0 ст.2 Инфильтрующая протоковая карцинома T2N0M0 ст.2 Инфильтрующая протоковая карцинома T2N0M0 ст.3 Инфильтрующая протоковая карцинома T2N0M0 ст.3 Инфильтрующая протоковая карцинома T1N0M0 ст.1 Карцинома молочной железы Карцинома молочной железы Инфильтрующая протоковая карцинома T2N1M0 ст. 3 Карцинома молочной железы Карцинома молочной железы Карцинома молочной железы Инфильтрующая протоковая карцинома T2N0M0 ст. 3 Карцинома молочной железы Инфильтрующая протоковая карцинома T2N0M0 ст.2 Терапия Метастазы (mts) в л/у Тамоксифен в л/у mts нет Эр+++ Пр++ Отрицательно Адъювантная ПХТ в 1 из 5 л/у mts Эр+ Пр+ Отрицательно Гормонотерапия (тамоксифен) в 1 л/у mts нет Эр+++ Пр+++ Отрицательно Адъювантная ПХТ 6 курсов в 4 л/у mts нет Адъювантная ПХТ (4 курса) и гормонотерапия в 4 л/у mts нет Эр+++ Пр+++ Отрицательно в л/у mts нет Эр- Пр- Отрицательно в л/у mts нет Эр++ Пр++ Отрицательно в л/у mts нет Эр+ Пр+ Отрицательно Адъювантная ПХТ (5 курсов) и гормонотерапия Рецепторы эстрогена Рецепторы прогестерона Рецепторы HER2/neu 130 Приложение Б Таблица Б.1. – Перечень олигонуклеотидных праймеров, использованных в работе, и условий проведения полимеразной цепной реакции. Название гена MAGE-A3 (CT1.3) MAGE-A4 (CT1.4) MAGE-A6 (CT1.6) MAGEA10 Последовательности олигонуклеотидных праймеров 5’-ACAATCAGATCATGCCCAAGG-3’ 5’-TCCTCCACTGATCTTTACCAT-3’ 5’-CTGATAATCGTCCTGGGCACA-3’ 5’-CTTGCATTGACCCTGACCAC-3’ 5’-AAGACAGGCTTCCTGATAATCA-3 5’-TCCTCCACTGATCTTTACCAT-3’ 5’-GCATTCTCATACTTATCCTAAG-3’ 5’-AGTGGGAAGGATCTTGGATCA-3’ (CT1.10) MAGEA12 5’-CTCCTGATAATCGTCCTGGC-3’ 5’-GTCCTCCACTGATCTTTAGCAA-3 (CT1.12) BAGE2 (CT2.2, CT2.3) 5’-GCTGGAGCAGTAAGATGGC-3’ 5’-GATAGTGCCTCCAAAGTGCT-3’ GAGE (CT4.2CT4.8) 5’-CAGCAACTCAACGTCAGGATC-3’ 5’-CAACATAGGAGCAGCCTGCA-3 NY-ESO-1 (CT6.1) 5’-TGCTTGAGTTCTACCTCGCC-3’ 5’-CTGCGTGATCCACATCAACA-3’ Условия проведения ПЦР 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 37 55°С 1 минута циклов 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 30 55°С 1 минута циклов 72°С 1 минута 72°С 2 минуты – 1 цикл 94°С 2 минуты – 1 цикл 94°С 40 секунд 34 55°С 1 минута цикла 72°С 1 минута 72°С 2 минуты – 1 цикл Размер амплифицируемого участка (п.н.) 314 284 297 310 289 198 258 233 131 GAPDH 5’-GATGGTTGATGGGGATTTCCATT-3’ 5’-TGACTCCTACCTTCACCTTTC-3’ 94°С 2 минуты – 1 цикл 94°С 40 секунд 26 55°С 1 минута циклов 72°С 1 минута 72°С 2 минуты – 1 цикл 250 132 Приложение В Таблица В.1. – Экспрессия РТ-генов и генов «домашнего хозяйства» в клеточной линии MelP на основании данных полнотранскриптомного секвенирования. (зеленым цветом выделены гены «домашнего хозяйства», синим – РТ-гены, имеющие известную функцию в клетке, красным – РТ-гены, входящие в набор реагентов). Название гена Число аннотированных транскриптов ACTB GAPDH PRAME MAGEA6 CSAG1 MAGEA3 MCAK SYCE1 IMP-3 MAGE-A2B CSAG2 PBK DCAF12 RQCD1 DSCR8 SPAG9 KIAA0100 MAGEA2 LEMD1 MAGEA12 ODF2 SSX2b CEP55 IGSF11 SSX2 CT45A5 SAGE1 ROPN1 OIP5 TTK ATAD2 CT45A4 AKAP3 CEP290 CABYR CTAGE5 13 10 16 3 4 3 10 5 17 11 2 4 5 9 2 21 16 7 8 3 21 3 3 10 3 3 4 10 2 10 8 4 13 8 15 14 Повтор 1 Длина гена 3256 2975 3778 1863 1092 2216 3658 2934 8511 2415 1083 2165 4390 5292 1083 11948 9235 2228 1063 1943 6342 1540 3271 4883 1536 1391 3092 4395 1236 4579 7118 1805 8809 10386 3195 6108 Повтор 2 Повтор 3 Число уникальных ридов Число тотальное ридов Число уникальных ридов Число тотальное ридов Число уникальных ридов Число тотальное ридов 39100 44733 10305 1172 751 861 487 432 445 15 3 193 230 681 4 1368 713 3 167 28 454 0 244 357 0 15 111 121 54 159 276 9 591 162 36 5 41010 86352 10306 2131 769 1470 805 630 518 621 349 359 878 682 445 1383 1199 166 231 114 484 72 244 363 77 60 114 181 61 159 281 40 592 196 44 99 58326 196986 16988 2336 1335 1513 1314 1017 1280 9 0 431 327 1543 3 1644 800 6 310 50 820 1 431 239 1 53 220 299 70 278 494 53 0 180 61 11 59468 312662 16988 3550 1352 2213 2098 1524 1335 793 221 841 970 1544 3 1663 1428 627 428 196 848 135 435 246 126 166 223 413 76 278 498 189 2 216 93 136 50631 168559 29697 3643 1853 2806 1379 1101 1865 14 1 421 490 1935 0 4143 1518 4 331 189 1630 5 422 817 1 24 478 233 139 410 415 66 0 534 123 19 51956 532505 29698 5159 1874 3769 1943 1607 1952 1429 529 820 1732 1935 0 4179 2443 498 522 679 1687 441 433 824 159 62 479 288 154 411 419 189 1 666 178 259 133 Таблица В.1. (Продолжение) Среднее Название гена значение RPKM ACTB GAPDH PRAME MAGEA6 CSAG1 MAGEA3 MCAK SYCE1 IMP-3 MAGEA2B CSAG2 PBK DCAF12 RQCD1 DSCR8 SPAG9 KIAA0100 MAGEA2 LEMD1 MAGEA12 ODF2 SSX2b CEP55 IGSF11 SSX2 CT45A5 SAGE1 ROPN1 OIP5 TTK ATAD2 CT45A4 AKAP3 CEP290 CABYR CTAGE5 818,043 4461,153 231,614 91,824 57,272 52,720 20,371 19,494 18,431 18,344 16,385 14,931 13,137 11,972 10,597 8,882 8,789 8,782 8,297 6,927 6,556 5,569 5,260 4,251 3,691 3,631 3,613 3,373 2,975 2,843 2,663 1,823 1,737 1,296 1,142 1,121 Повтор 1 RPKM 1023,39 2360,59 220,88 92,01 56,65 53,88 17,27 16,87 4,37 20,52 24,65 13,46 16,15 10,41 31,79 9,10 10,47 5,84 7,12 4,73 5,61 3,70 5,82 5,62 3,97 3,51 2,71 3,31 3,42 2,67 3,01 1,17 5,17 1,31 0,84 1,19 Повтор 2 RPKM 921,86 5309,52 225,73 95,55 61,70 50,18 27,74 24,94 26,50 16,05 9,94 19,33 10,97 14,17 0,00 6,70 7,69 13,68 8,37 5,02 6,30 4,30 6,26 2,10 3,98 5,96 3,60 4,73 2,66 3,05 3,24 3,36 0,03 0,87 1,11 0,97 Повтор 3 RPKM 508,88 5713,35 248,22 87,92 53,48 54,10 16,10 16,67 24,42 18,46 14,56 12,00 12,29 11,33 0,00 10,86 8,21 6,82 9,40 11,03 7,76 8,71 3,70 5,04 3,12 1,42 4,53 2,08 2,84 2,82 1,74 0,94 0,01 1,71 1,48 1,21