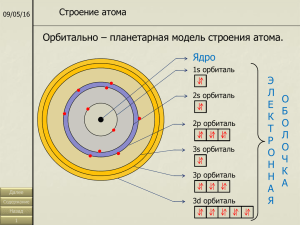
Тесты по теме «Строение атома и периодическая система
реклама

Тесты по теме «Строение атома и периодическая система элементов». 1.Какие элементарные частицы входят в состав ядра атома? 1) протоны и электроны 2) нейтроны и электроны 3) протоны и нейтроны 4) протоны, нейтроны, электроны 2.Какой частице соответствует электронная формула 1S22S22P6? 1) C+4 2) N+5 3) N-3 4) O 3.Какой из приведенных атомов может проявлять степень окисления «-2» в соединениях? 1) Mg 2) F 3) B 4) C 4.Укажите соединение в котором степень окисления каждого атома совпадает с его валентностью (по абсолютной величине)? 1) CaC2 2) HNO3 3) H2O2 4) H3PO4 5.Число нейтронов в атоме 39K равно числу нейтронов в атоме? 1) 39Ar 2) 40Ca 3) 35Cl 4) 40Ar 6.Основные свойства усиливаются в ряду 1) NaOH – Mg(OH)2 - AI(OH)3 2) LiOH – NaOH – KOH 3) Ba(OH)2 – Sr(OH)2 – Ca(OH)2 4) Al(OH)3 – Mg(OH)2 – Be(OH)2 7.Степень окисления «-3» азот проявляет в соединении 1) N2O3 2) HNO3 3) NF3 4) NH4Cl 8. Наиболее выраженными металлическими свойствами обладает 1) Rb 2) Sr 3) Ca 4) K 9. В ряду Н2О - H2S происходит уменьшение 1) кислотных свойств 2) длины связи 3) степени окисления центрального атома 4) температуры кипения 10. 16 электронов содержит частица 1) Cl2) S23) O 4) S 11. Степень окисления «+3» хром проявляет в соединениях 1) CrO3 2) K2CrO4 3)KCrO2 4)Cr(OH)2 12. Наибольший потенциал ионизации у атома 1) Ga 2) Al 3) Si 4) C 13. В ряду Be – Mg – Ca – Sr происходит 1) ослабление металлических свойств 2) увеличение электроотрицательности 3) уменьшение числа валентных электронов 4) уменьшение силы притяжения валентных электронов к ядру 14. Сколько холостых электронов может содержать атом хлора в возбужденном состоянии? 1) 3, 5 2) 1, 3, 5 3) 3, 5, 7, 4)1, 2, 3 15. Число электронов внешнего энергетического уровня для атома титана равно: 1) 2 2) 4 3) 3 4) 8 16. Длина связи увеличивается в ряду: 1) H2O – H2S – H2Se 2) HBr – HCl – HY 3) NH3 – H2O – HF 4) H2Se – H2S – HCl 17. Притяжение электронов внешнего уровня к ядру ослабевает в ряду: 1) Al – Mg – Ca 2) Al – Si – C 3) Na – Mg – Be 4) Se – S – Cl 18. Что общего между атомами хлора и марганца: 1) номер периода в периодической системе 2) номер группы и подгруппы в периодической системе 3) одинаковые свойства 4) одинаковое число валентных электронов 19. У кокого из атомов валентные электроны характеризуются следующим набором квантовых чисел: n=3 l=0 ml = 0 ms = + 1/2 n=3 l=0 ml = 0 ms = - 1/2 n=3 l=1 ml = -1 ms = + 1/2 1) Se 2) Al 3) Ga 4) Si 20. Какой из указанных элементов проявляет степень окисления в соединениях только «+1»? 1) Cl 2) H 3) Li 4) B 21. Что является главной характеристикой атома? 1) 2) 3) 4) атомная масса число электронов на внешнем уровне заряд ядра общее число электронов 22. Как охарактеризовать элемент с электронной формулой: 1S22S22P63S23P63d54S1 1) S – элемент, металл, I - группа А, 4 период 2) d – элемент, металл VI – группа B, 4 период 3) d – элемент, неметалл VI – группа B, 4 период 4) d – элемент, металл V – группа B, 4 период 23. С увеличением порядкового номера элемента в периоде потенциал ионизации и сродство к электрону соответственно: 1) уменьшается, уменьшается 2) уменьшается, увеличивается 3) увеличивается, увеличивается 4) увеличивается, уменьшается 24. Какова максимальная и минимальная степени окисления селена в соединениях 1) +6,+2 2) +6,-2 3) +2,-2 4) +4,-2 25. В каких реакциях изменяется заряд ядра атома? 1) в окислительно- восстановительных реакциях 2) в ядерных реакциях 3) в реакциях обмена 4) в цепных реакциях 26 .Используя правило Клечковского, покажите в какой последовательности заполняются следующие орбитали электронами: 4P 4d 5P 5S 6S 1) 4P 4d 5S 5P 6S 2) 4P 5S 4d 5P 6S 3) 4P 4d 5S 6S 5P 4) 4P 5S 5P 4d 6S 27. Для какого атома валентные электроны в возбужденном состоянии характеризуется следующим набором квантовых чисел n=2 l=0 ml = 0 ms = + 1/2 n=2 l=1 ml = -1 ms = + 1/2 1) B 2) Be 3) Mg 4) C 28. расположите следующие элементы (даны окончания электронных формул) в порядке возрастания электроотрицательности: …3S23P4…3S23P3…2S22P5…2S22P4 1) 2) 3) 4) 3S23P4,3S23P3 ,2S22P4,2S22P5 3S23P3 ,3S23P4, 2S22P4,2S22P5 3S23P3 , 2S22P4,3S23P4,2S22P5 2S22P4, 2S22P5 ,3S23P3,3S23P4 29. Число валентных электронов одинаково для атомов 1) V, Se 2) Gr, Se 3) P, Ti 30. Основные степени окисления для элементов группы VIII B (группа триад) 1) +2, +8 2) +1, +2 3) +2, +3 4) Ti, V 4) +2, +6 31. «Проскок» электрона наблюдается у следующего элемента 1) Zn 2) Sr 3) Ag 32. Степень окисления хрома увеличивается в ряду соединений: 4) Mn 1) KCrO2, CrCl2, K[Cr(OH)4] 2) Cr2O3, Cr(NO3)2, K2CrO4 3) CrSO4, KCrO2, K2Cr2O7 4) Cr(OH)2, Cr2(SO4)3, Cr2O3 33. Число валентных электронов возрастает в ряду следующих элементов: 1) Ca, K, Ga, V 2) Mg, Ti, Cr, Br 3) N, Si, O, F 4) P, Cr, S, Cl 34. Какова степень окисления кислорода в соединениях следующего ряда: K2O, Na2O2, KO2, BaO2 1) -2, -2, -1, -1 2) -2, -1, -1, -2 3) -2, -1, -1/2, -1/2 4) -2, -1, -1/2, -1 35. Металл – это элемент у которого: 1) 2) 3) на внешней орбитали не менее 4 электронов на внешнем электронном уровне более 4 электронов на внешнем энергетическом уровне от 1до 4 электронов, за исключением H, He, B, C, Si 4) на внешнем энергетическом уровне от 1 до 3 электронов 36. 18 электронов содержит частица 1) S+4 2) Cl+ 3) P-3 4) S0 37.Какой элемент проявляет только две степени окисления в сложных соединениях 1) Na 2) O 3) F 4) H 38. Почему Cl и Mn стоят в одной (VII) группе периодической системы 1) одинаково строение электронных оболочек 2) являются химическими аналогами 3) имеют семь валентных электронов 4) имеют одинаковое число электронов на внешнем уровне 39. Какой из инертных газов образует больше всего химических соединений 1) He 2) Ne 3) Ar 40. Какой частице соответствует концовка электронной формулы: 4d55S1 1) Rb 2) Nb 3) Mo 41. Какое утверждение верно с точки зрения квантовой механики 1) 2) 3) 4) 4) Xe 4) Mo+2 электрон – это частица, движущаяся по определенной орбите электрон в атоме можно представить в виде волны Электрон обладает свойствами частицы и волны одновременно электрон – это как спутник, вращающийся вокруг планеты 42. Реальное поведение электрона в квантовой механике описывается уравнением: 1) Бора 2) Эйнштейна 3) Шредингера 43. Любая атомная орбиталь характеризуется набором 1) 2) 3) 4) четырех квантовых чисел трех квантовых чисел двух квантовых чисел одним квантовым числом 4) Гейзенберга 44. Какая орбиталь характеризуется набором me= -1, 0, +1 1) S – орбиталь 2) P – орбиталь 3) d – орбиталь 4) f – орбиталь 45.Почему d – элементы появляются только в четвертом периоде периодической системы? 1) потому что после 3Р орбитали заполняется 3d орбиталь 2) потому что после 4S орбитали заполняется 4d орбиталь 3) потому что 3d орбиталь заполняется после 4S орбитали 4) потому что d – орбиталь появляется в 3 уровне 46. Энергетический уровень - это совокупность энергетических состояний электрона в атоме, характеризующихся одним и тем же значением 1) орбитального квантового числа 2) главного квантовые числа 3) магнитного квантового числа 4) спинового квантового числа 47. Правило Хунда утверждает, что при заполнении АО одной энергии, общее число электронов с одинаковыми спинами должно быть: 1) минимальным 2) максимальным 3) равно нулю 4) равным единице 48. В многоэлектронных атомах заполнение орбиталей электронами не произвольное, а в строгом соответствии с: 1) принципом Паули 2) правилам Хунда 3) принципом минимума энергии, принципом Паули, правилом Хунда 4) правилами Клечковского 49. Положение электрона в атоме водорода 1) 2) 3) 4) можно определить с высокой точностью можно определить исходя из радиуса атома можно рассчитать вероятность нахождения электрона в атомном пространстве нельзя определить, так как электрон представляет собой отрицательно заряженное облако 50. По электронной формуле элемента можно 1) 2) определить период и группу для элемента дать полную характеристику элемента и описать свойства элемента и свойства его оксидов и гидроксидов 3) определить металл это или неметалл 4) определить максимальную степень окисления элемента в соединениях. 51. В атоме хлора число полностью завершенных энергетических подуровней равно: 1) 5 2) 2 3) 3 4) 4 52. Аллотропные модификации указаны в наборе: 1) сталь, чугун 2) сера, селен 3) водород, дейтерий 4) озон, кислород 53. Элемент, для которого существует только одно простое вещество,- это 1) Р 2) О 3) Br 4) C 54. В ионе Al+3 число полностью заполненных энергетических подуровней равно 1) 5 2) 2 3) 3 4) 4