030104-15-1234-биохимия о.ф.
реклама
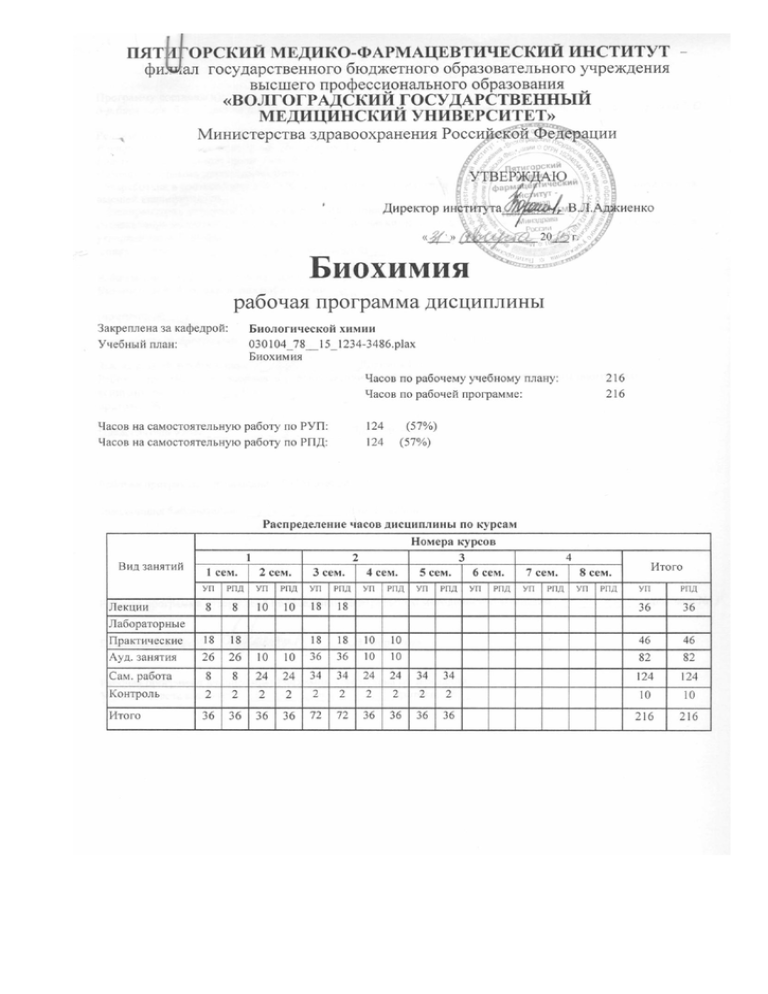
УП: 030104_78-12-123-3486.plax стр. 4 1 Цели и задачи дисциплины 1.1 Цель биологической химии, как науки о живой материи, состоит в исследовании и выявлении закономерностей химических процессов жизнедеятельности, распределения, состава, структуры, функции, свойств и превращений веществ, присущих живым организмам, связи этих превращений с деятельностью клеточных структур, органелл, клеток, тканей и органов, целостных организмов, их сообществ и всей биосферы. 1.2 Задачами дисциплины являются: - изучение структуры и свойств биополимеров; - изучение обмена веществ и энергии в живых системах; - проблемы хранения и реализации генетической информации; - изучение взаимосвязи и регуляции процессов обмена веществ в организме; - изучение метаболизма лекарственных соединений; - исследования в области биохимии атеросклероза; - изучение роли активированных кислородных метаболитов в биологических системах. 2 Требования к уровню освоения содержания дисциплины 2.1 Место дисциплины в структуре ОП: 2.1.1 Специальная дисиплина «Биохимия» изучается в течение первого, второго, третьего, четвѐртого и пятого годов обучения в аспирантуре, относится к блоку обязательных дисциплин. 2.1.2 На послевузовском этапе изучение дисциплины «Биохимия» рассматривается как средство интеграции образования и науки в различные отрасли научной деятельности и совершенствование уровня теоретических и практических знаний, навыков и умений в области биологических наук. Биохимия является базисной наукой для формирования научного мировоззрения и профессиональной деятельности выпускника аспирантуры. 2.2 В результате освоения программы аспир антуры обучающегося (аспиранта ) должны быть сформированы 2.2.2 Общепрофессиональные компетенции (ОПК): способностью самостоятельно осуществлять научно-исследовательскую деятельность в соответствующей профессиональной области с использованием современных методов исследования и информационнокоммуникационных технологий (ОПК-1) 2.2.3 Профессиональные компетенции (ПК): Способность и готовность к проведению биохимического исследования биологических жидкостей и объектов в сырье растительного и животного происхождения; воспроизведению экспериментальных моделей некоторых заболеваний и патологических процессов с целью изучения биохимических механизмов развития патологических процессов Аудиторные занятия (всего) В том числе: Лекции (Л) Практические занятия (ПР) Самостоятельная работа (всего) Вид промежуточной аттестации: Контроль Кандидатский экзамен по специальности Общая трудоѐмкость часы Зачѐтные единицы 82 26 10 36 36 8 10 18 46 18 124 8 10 216 10 18 10 24 34 24 34 2 2 2 2 2 36 36 72 36 36 1 6 1 1 2 1 9 сем 4 8 сем 7 сем 6 сем 5 сем 4 сем 3 сем 2 сем 1 сем 3. Объѐм дисциплины и виды учебной работы Всего Год обучения аспиранта часов Вид учебной работы 1 2 3 4 Содержание дисциплины Блок Наименование дисциплины и ее основные разделы ОД.А.СД Биохимия 1.Предмет и задачи биологической химии Предмет и задачи биологической химии. Связь биологической хи-мии с сопредельными дисциплинами - биофизикой, биоорганиче-ской химией, цитологией, микробиологией, генетикой, физиологией. Место биохимии в системе наук, связанных с физико-химической биологией. Направления и перспективы развития биохимии. Роль структурной организации клетки в явлениях жизни. Компар-тментация веществ и процессов в клетке. Значение обмена веществ (катаболизм и анаболизм) в явлениях жизни. Принципы регуляции процессов обмена веществ в клетке. Генетическая ин-формация и ее значение. Академики А.Н.Бах, А.И.Опарин, B.C.Гулевич, А.В.Палладин, А.Н.Белозерский, В.А.Энгельгардт, А.Е.Браунштейн, С.Е.Северин и их роль в создании отечественной школы биохимиков. Развитие биохимии и ее связи с практикой: микробиологией, биотехнологи-ей, медициной. Важнейшие журналы, справочные и обзорные из-дания по биохимии. Понятие о биоинформатике. Общая характе-ристика веществ, входящих в состав организмов, их роль и значе-ние. Роль минеральных элементов, белков, липидов, углеводов, витаминов в обмене веществ и в питании человека и животных. Калорийность и усвояемость пищевых продуктов. Незаменимые факторы питания. 2.Физико-химические ос-новы биохимии методы, применяемые в биохимии: спектрофотометрия, флуорометрия, хроматография, калориметрия, электрофорез. Основы химической кинетики: молекулярность и порядок реакции; константы скоростей химических реакций и факторы, влияющие на скорости и равновесия реакций. Гомогенный и гетерогенный катализ. 3.Природные аминокислоты.Природные углеводы и их производные. Пуриновые и пиримидиновые основания. Витамины, коферменты и другие биологически активные соединения. Природные аминокислоты. Различные способы классификации аминокислот. Общие и специфические реакции функциональных групп аминокислот. Ионизация аминокислот. Глютатион и его значение в обмене веществ. Аминокислоты как составные части белков. Физические и химические свойства протеиногенных аминокислот. Селеноцистеин. Непротеиногенные кислоты. Незаменимые аминокислоты. Полипептиды. Природные углеводы и их производные. Классификация углево-дов. Наиболее широко распространенные в природе гексозы и пентозы и их свойства. Взаимопревращения моносахаридов. Гликозиды, амино-, фосфо- и сульфосахариды. Дезоксисахара. Липофильные Физико-химическая характеристика воды как универсального рас-творителя в биологических системах. Вода и ее роль в живых ор-ганизмах. Основные понятия электрохимии водных растворов. Водородный показатель (рН), буферные растворы. Основные физико-химические соединения и классификация липидов. Жирные кислоты. Изомерия и структура ненасыщенных жирных кислот. Полиненасыщенные жирные кислоты. Нейтральные жиры и их свойства. Фосфолипиды. Гликолипиды и сульфолипиды. Стерины, холестерин, желчные кислоты. Диольные липиды. Полярность молекулы фосфатидов. Участие фосфатидов и других липидов в построении биологических мембран. Терпеноиды и каротиноиды. Пуриновые и пиримидиновые основания. Нуклеозиды и нуклеотиды. Циклические нуклеотиды. Минорные пуриновые и пиримидиновые основания. Комплексообразующие свойства нуклеотидов. Витамины, коферменты и другие биологически активные соединения. Роль витаминов в питании животных и человека. Витамины как компоненты ферментов. Жирорастворимые витамины. Витамин А. Каротиноиды и их значение как провитаминов А. Витамин Д и его образование. Витамин Е. Витамин К. Нафтохиноны и убихинон. Водорастворимые витамины. Витамин В1. Каталитические функции тиаминпирофосфата. Витамины В2 и PP. Участие витаминов В2 и РР в построении коферментов аэробных и анаэробных дегидрогеназ. Витамин В6 и его каталитические функции. Панто-теновая кислота. Липоевая кислота. Витамин В12. Фолиевая кисло-та и дигидроптеридин. Другие витамины и витаминоподобные вещества комплекса В. Витамин С. Ферментативное окисление аскорбиновой кислоты. Биофлавоноиды, рутин. Витамины антиоксиданты. Витамины - прокоферменты. Витамины - прогормоны. Прочие известные в настоящее время витамины. Антивитамины. Динуклеотидные коферменты. Нуклеотиды как коферменты. Простагландины как производные полиненасыщенных жирных кислот. Биогенные амины. Ацетилхолин. Железопорфирины. Хлорофилл и другие растительные пигменты. Минеральный состав клеток. Микроэлементы. Методы аналитической бионеорганической хи-мии. Всего часов 216 4.Структура и свойства биополимеров Специфическая роль белковых веществ в явлениях жизни. Пептидная связь, ее свойства и влияние на конформацию полипептидов. Теория строения белковой молекулы. Ковалентные и нековалентные связи в белках. Работы А.Я. Даниловского, Э.Фишера, Ф. Сенгера, Л. Полинга. Первичная, вторичная, третичная и четвертичная структура белков. Упорядоченные и неупорядоченные вторичные структуры. Супервторичные структуры. Примеры. Соотношение между первичной структурой и структурами более высокого порядка в белковой молекуле. Амфипатия полипептидных цепей. Динамичность структуры белка. Величина и форма белковых молекул. Конформационная динамика белковой молекулы. Денатурация белков и полипептидов. Фолдинг и рефолдинг. Шапероны. Прионы. Комплексы белков с низкомолекулярными соединениями, белоклигандные взаимоотношения. Сольватация белков. Кристаллические белки. Олигомерные комплексы белков. Классификация белков. Простые и сложные белки. Гомологичные белки и гомологичные последовательности аминокислот в поли-пептидах. Семейства и суперсемейства белков. Протеомика. Взаи-модействие белков и малых лигандов. Олиго- и полисахариды. Дисахариды и трисахариды. Крах-мал и гликоген, клетчатка и гемицеллюлозы, их структура и свой-ства. Гетерополисахариды, гликозаминогликаны. Протеогликаны. Методы изучения первичной, вторичной и более высоких уровней структурной организации полисахаридов, гликопротеинов и про-теогликанов. Полиморфизм амфифильных соединений в водных раство-рах (мицеллы, эмульсии, ламеллы, бислойные структуры). Модели строения биологических мембран. Липосомы; методы их получения и изучения. Фазовые переходы в агрегатах амфифильных со-единений. Проницаемость биологических мембран. Типы нуклеиновых кислот. Роль нуклеиновых кислот в жи-вом организме. Полинуклеотиды. Структура ДНК. Принцип ком-плементарности азотистых оснований. Минорные основания. А-, В-, С-, Т- и Z-формы ДНК. Суперспирализация ДНК. Структура и функционирование хроматина. ДНК хлоропластов и митохондрий. Особенности строения дезоксирибонуклеиновой кислоты. Роль ДНК как носителя наследственной информации в клетке. Структура рибонуклеиновых кислот. Типы РНК: ядерная, рибосомная, транспортная, м-РНК. Взаимодействие белков и нуклеиновых кислот. Генная инженерия. Генотерапия. Понятие о геномике. 5.Обмен веществ и энергии в живых системах Биологические объекты как стационарные системы. Ката-болические и анаболические процессы. Единство основных мета-болических путей во всех живых системах. Ферментативный катализ, белки-ферменты. Основные по-ложения теории ферментативного катализа. Энергия активации ферментативных реакций. Образование промежуточного комплек-са «фермент-субстрат», доказательства его образования. Понятие об активном центре фермента. Теория индуцированного активного центра. Кинетика ферментативного катализа. Обратимость действия ферментов. Стационарное приближение при рассмотрении ферментативных реакций. Начальная скорость ферментативной реакции и метод ее определения. Уравнение МихаэлисаБриггса-Холдейна. Константа Михаэлиса и методы ее нахождения. Единицы активности ферментов. Стандартная единица, удельная и молекулярная активность. Активность и числа оборотов фермента. Двухкомпонентные и однокомпонентные ферменты. Динамичность структуры и ферментативный катализ. Химические механизмы ферментативного катализа (сериновые протеазы, пиридоксалевый катализ, карбоангидраза, рибонуклеаза и др.). Кофакторы в ферментативном катализе. Простетические группы и коферменты. Химическая природа коферментов. Коферменты алифатического, ароматического и гетероциклического ряда. Витамины как предшественники коферментов. Значение металлов для действия ферментов. Негеминовые железопротеиды. Влияние физических и химических факторов на активность ферментов. Действие темпе-ратуры и концентрации водородных ионов. Специфические активаторы и ингибиторы ферментативных процессов. Механизм ин-гибирования ферментов. Обратимое и необратимое, конкурентное и неконкурентное ингибирование. Изостерические и аллостериче-ские лиганды-регуляторы. Кооперативность в ферментативном катализе. Фермент как молекулярная машина. Модели кооператив-ного функционирования ферментов. Локализация ферментов в клетке. Специфичность ферментов. Классификация ферментов и ее принципы. Оксидоредуктазы, важнейшие представители. Трансферазы, важнейшие представители. Гидролазы, распространенные в природе, важнейшие представители. Значение их в пищевой технологии. Лиазы, важнейшие представители. Лигазы, важнейшие представители. Регуляция активности и синтез ферментов. Аллостерические ферменты. Теория индуцированного синтеза ферментов Жакоба и Моно. Множественные формы ферментов, изоферменты. Мультиферментные системы. Пируватдегидрогеназа. Им-мобилизованные ферменты. Использование ферментов в биотех-нологии и медицине. Энзимотерапия. Понятие об абзимах. Рибо-зимы. Основные понятия биоэнергетики. АТФ - универсальный источник энергии в биологических системах. Энергетическое со-пряжение. Фосфорильный потенциал клетки. Нуклеозид ди- и трифосфаткиназы. Аденилаткиназная и креатинкиназная реакции. Терминальное окисление. Механизмы активации кислоро-да. Оксидазы. Коферменты окислительно-восстановительных ре-акций (НАД+/НАДН, НАДФ+/НАДФН, ФМН/ФМН-Н2, ФАД/ФАД-Н2). Электрон-трансферазные реакции. Убихинон, же-лезо-серные белки и цитохромы как компоненты дыхательной це-пи. Локализация окислительных процессов в клетке. Митохондрии и их роль как биоэнергетических машин. Локализация электрон-трансфераз в биологических мембранах. Структура дыхательной цепи. Хемиосмотическая теория сопряжения окислительного фосфорилирования и тканевого дыхания. DmH и его значение. Циклический векторный перенос протона. Биологические генераторы разно¬сти электрохимических потенциалов ионов. Электрохимическое сопряжение в мембранах и окислительное фосфорилирование, синтез АТФ. Механизмы окислительного фосфорилирования. Разобщители и ионофоры. Механизмы разобщения окислительного фосфорилирования и тканевого дыхания. АТФазы их строение и функция. Эффективность аккумуляции энергии, сопряженной с переносом электронов. Альтернативные функции биологического окисления. Термогенез. Биохимия пищеварения. Органная специфичность пищева-рительных протеаз, липаз, гликозидаз. Распад белков, липидов и углеводов в процессе пищеварения. Роль желчных кислот в метаболизме липофильных соединений. Пристеночное пищеварение в кишечнике. Транспорт метаболитов через биологические мембра-ны. Понятие об активном транспорте, секреции, пиноцитозе. Углеводы и их ферментативные превращения. Фосфорные эфиры сахаров и роль фосфорной кислоты в процессах превраще-ния углеводов в организме. Ферменты, катализирующие взаимопревращения сахаров и образование фосфорных эфиров. Продукты окисления и восстановления моносахаридов. Роль многоатомных спиртов в углеводном обмене. Гликозиды и дубильные вещества, их свойства, ферментативные превращения и роль в пищевой промышленности. Ферменты, гидролизующие олигосахариды. Нуклеозиддифосфатсахара и их роль в биосинтезе олигосахаридов и полисахаридов. Гликозилтрансферазы. Амилазы. Распространение в природе и характеристика отдельных амилаз. Роль амилаз в промышленности и пищеварении. Взаимопревращения крахмала и сахарозы в растениях. Биосинтез крахмала и гликогена. Полифруктозиды, клетчатка и гемицеллюлозы, их свойства, ферментативные превращения и роль в пищевой промышленности. Гетерополисахариды, гликозаминогликаны, их синтез и участие в построении соединительной ткани. Общая характеристика процессов распада углеводов. Гликолиз и гликогенолиз как метаболическая система. Взаимосвязь процессов гликолиза, брожения и дыхания. Спирто-вое, молочнокислое, маслянокислое брожение. Работы Л.Пастера. Значение работы Э. Бухнера. Основные и побочные продукты брожения. Химизм анаэробного и аэробного распада углеводов. Структура и механизм действия отдельных ферментов гликолиза и гликогенолиза. Энергетическая эффективность гликолиза, глико-генолиза и брожения. Аэробный и анаэробный распад углеводов. Механизм окисления пировиноградной кислоты. Цикл дикарбоно-вых и трикарбоновых кислот. Энергетическая эффективность цик-ла. Структура и механизм действия отдельных ферментов цикла ди- и трикарбоновых кислот. Прямое окисление углеводов. Пенто-зофосфатный путь. Глиоксилатный цикл. Образование органиче-ских кислот в растениях и при так называемых «окислительных брожениях». Глюконеогенез. Растительное сырье и микробиологи-ческие процессы как источник пищевых органических кислот. Липолиз. Ферментативный гидролиз жиров. Липазы, рас-пространение в природе и характеристика. Липоксигеназы, их свойства, механизм действия и роль в пищевой промышленности. Окислительный распад жирных кислот. Энергетическая эффективность распада жирных кислот. Роль карнитина в метаболических превращениях жирных кислот. Бета-, альфа- и омега-окисление жирных кислот. Коэнзим А и его роль в процессах обмена жирных кислот. 4фосфопантетеин и его роль в биосинтезе жирных кислот. Биосинтез жирных кислот. Синтаза жирных кислот. Биосинтез триглицеридов. Ферментативные превращения фосфатидов. Строение и функции мембран в клетке. Значение фосфатидов в пищевой промышленности. Биосинтез холестерина и его регуляция. Значение холестерина в организме. Синтез желчных кислот. Стероиды как провитамины Д. Эфирные масла и их превращение в растениях. Биосинтез изопреноидов, терпеноидов и каротиноидов. Первичный синтез аминокислот у растительных организмов и микробов. Заменимые и незаменимые аминокислоты. Пути повышения пищевой ценности растительных белков. Кетокислоты как предшественники аминокислот. Прямое аминирование. Переаминирование и другие пути превращения аминокислот. Аминотрансферазы. Другие пути биосинтеза аминокислот. Вторичное образование аминокислот при гидролизе белков. Специфический распад и превращения отдельных аминокислот. Протеолитические ферменты - пептидгидролазы, общая характеристика и распространение в природе. Отдельные представители (пепсин, трипсин, химотрипсин, папаин, сычужный фермент, амино- и карбоксипептидазы, лейцинаминопептидаза). Активирование протеиназ типа папаина сульфгидрильными соединениями. Лизосомы. Использование протеолитических ферментов в промышленности и меди¬цине. Биохимия распада аминокислот. Дезаминирование аминокислот. Типы дезаминирования. Роль аспарагина, глютамина и мочевины в обмене азота. Орнитиновый цикл. Структура и механизм действия трансаминаз и отдельных ферментов цикла мочевинооб-разования. Амины и алкалоиды, пути их образования и превраще-ний. Распад нуклеопротеинов. Нуклеазы. Синтез и распад пурино-вых нуклеотидов. Уреотелия, урикотелия и аммониотелия. Синтез и распад пиримидиновых нуклеотидов. Синтез гема. Распад гема и обезвреживание билирубина. Молекулярные основы подвижности биологических систем. Структура поперечно-полосатой и гладкой мускулатуры. Сократительные белки. Модели функционирования мышц. Подвижность жгутиков и ресничек у микроорганизмов. Поддержание ионного гомеостаза клеток. Транспортные АТФазы и ионные каналы. Биохимические основы передачи нервного импульса. Ион-ные потоки при возбуждении нерва. Синаптическая передача воз-буждения. Медиаторы центральной нервной системы. Ацетилхо-лин, ацетихолинэстераза, рецепция ацетилхолина. Рецептор аце-тилхолина как пример лигандзависимого ионного канала. 6.Хранение и реализация генети-ческой информации Понятия «ген» и «оперон». Клеточный цикл. Активный и неактивный хроматин. Структура хромосом. Роль нуклеиновых кислот в биосинтезе белков. Биосинтез нуклеиновых кислот и ДНКполимеразы. Репликация ДНК. Циклическая ДНК и технология включения генов в плазмиды. Мутации и направленный мутагенез. Работы С. Очоа и А. Корнберга. РНК- полимеразы. Информационная РНК как посредник в передаче информации от ДНК к рибосоме. Синтез мРНК, процесс транскрипции, информосомы. Посттранскрипционный процессинг мРНК. Биосинтез белка. Активирование аминокислот. Транспортные РНК и их роль в процессе биосинтеза белка. Генетический код. Рибосомы: структура, состав и функции. Механизм считывания информации в рибосомах. Процесс трансляции. Инициация трансляции, элонгация и терминация. Полисомы. Регуляция синтеза белка. Посттрансляционные изме-нения в молекуле белка, процессинг. Транспорт белков, их встраи-вание в мембраны и проницаемость биологических мембран для биополимеров. Проблемы клонирования ДНК. Цепные полимеразные реакции нуклеиновых кислот и их применение в биологии и медицине.7.Взаимосвязь и регуляция про-цессов обмена веществ в организме. Единство процессов обмена веществ. Связь процессов ката-болизма и анаболизма, энергетических и конструктивных процес-сов. Энергетика обмена веществ. Взаимосвязь между обменами белков, углеводов, жиров и липидов. Ключевые ферменты. Способы регулирования метаболизма. Регулирование экспрессии генов. Наследственные болезни. Посттрансляционная ковалентная моди-фикация белков (внутриклеточные протеазы, протеинкиназы, про-теинфосфатазы), метилирование, гликозилирование, амидирование и дезамидирование и др. модификации. Регулирование активности ферментов субстратом, продуктом и метаболитами. Молекулярные основы гомеостаза клетки. Кровь, плазма, лимфа. Транспорт кислорода эритроцитами. Карбоксиангидраза. Буферные системы крови. Система свертыва-ния крови. Белки плазмы крови и функциональная биохимия фор-менных элементов крови. Биохимические основы иммунитета. Понятие о цитокинах и хемокинах. Рецепторы цитокинов и хемокинов.. Гормоны. Классификация гормонов. Рецепторы гормонов. Ткане-вая и видовая специфичность рецепторов гормонов. Гормоны с трансмембранным механизмом действия. Мембранные рецепторы и вторичные посредники. Аденилатциклаза и фосфодиэстераза. Ц-АМФ как вторичный мессенджер и ковалентная модификация белков-ферментов. G-белки. Рецептор-зависимые ионные каналы. Инозитолтрифосфат и Са2+ как вторичные посредники. Гормонозависимая химическая модификация белков. Протеинкиназы. Простагландины. Внутриклеточные и ядерные рецепторы гормонов, их влияние на экспрессию генов. Стимуляторы роста растений и микроорганизмов; гербициды; антибиотики; фитонциды и их регуляторная роль. Рецепция света живыми системами. Апоптоз, молекулярные механизмы апоптоза и митоптоза. . 8.Метаболизм ле-карственных соединений Понятие о метаболизме чужеродных соединений в организ-ме. Лекарства как чужеродные соединения для организма. Судьба чужеродных соединений в организме, дезинтоксикация, усиление их активности или токсичности. Всасывание, распределение, метаболизм и выделение лекарственных средств из организма. Виды транспорта лекарственных веществ через мембраны. Метаболические превращения лекарств: окисление, восстановление, гидролиз, гидроксилирование, дезаминирование, дезалкилирование, трансметилирование, разрыв кольца (дециклизация), циклизация, изомеризация, декарбоксилирование. Конъюгация лекарственных веществ и ее разновидности, механизмы конъюгации и ферментные системы, участвующие в этих процессах. Локализация в клетке ферментных систем, осуществляющих метаболизм лекарственных средств. Микросомальное окисление и его значение в детоксикации лекарственных средств. Факторы, влияющие на метаболизм лекарственных средств. 9.Биохимия атеросклероза Атеросклероз – одна из ведущих проблем современной медицины. Современное состояние проблемы атеросклероза (этиология, пато-генез, основные принципы профилактики и лечения атеросклеро-за). Атеросклероз – болезнь обмена веществ. Изменения активно-сти ферментных систем, морфологической структуры и регулятор-ных механизмов – основные причины развития нарушений обмена веществ при атеросклерозе. Роль генетических и внешних факторов в возникновении атеросклероза. Характер изменений липидного обмена при атеросклерозе (общие липиды, холестерин, триглицериды, НЭЖК, лецитин-холестеринацилтрансфераза, липопротеидлипаза). Липопротеиды и нарушение их обмена при атеросклерозе (ХМ, ЛПОНП, ЛПНП, ЛПВП, ЛПОВП, аполипипротеиды, типы гиперлипопротеидемий по Фредриксону). Перекиси липидов и атеросклероз. Изменения протеинограммы как показатель нарушения белкового обмена при атеросклерозе. Изменения окислительных процессов при атеросклерозе. Изменения минерального обмена при атеросклерозе. Свертывающая система крови и атеросклероз. Иммунологические сдвиги при атеросклерозе. Моделирование атеросклероза на животных – один из путей выяснения механизма биохимических нарушений при атеросклерозе. Существующие экспериментальные модели для атеросклероза. Ведущие лаборатории в РФ и зарубежных странах, изучающих проблему атеросклероза. 10. Активированные кислородные метаболиты в био-логических сис-темах: физиоло-гическая роль и патогенетическое значение Характеристика основных форм АКМ: классификация, механизмы образования, физикохимические свойства и биологическое дейст-вие. Супероксидный анион-радикал (О2_), перекись водорода, гид-роксильный радикал, оксид азота, синглентный кислород, гипога-логениты, алкоксильные и пероксильные радикалы. Генерация О2_ НАДН-оксидазами, ксантиноксидазой, образование АКМ в митохондриях и при участии цитохрома Р450 и др. механизмы. Методы регистрации АКМ в биологических средах. Повреждение биомолекул АКМ и биологическое значение АКМ. Механизмы регуляторного действия АКМ (редокс-чувствительные факторы транскрипции, антиоксидант-респонсивный элемент). Образование оксида азота NO-синтазами в фагоцитах, эндотелиоцитах и нервных клетках. Молекулярные основы действия оксида азота. Молекулярные мишени для оксида азота и пути проведения сигнала. Включение оксида азота в физиологические и патологические процессы органов и систем. Оксид азота – модулятор апоптоза. Доноры NO. Методы регистрации NO. Антиоксиданты и ингибиторы радикальных окислительных процессов. Ферментативные антиоксиданты (СОД, каталаза, глутатионпероксидаза, глутатион-S-трансфераза, глутатионредуктаза, НАДФ+-редуктазы). Низкомолекулярные природные антиоксиданты (витамин Е, Ко Q, флавоноиды, гормоны, каротиноиды, аскорбиновая кислота, SH-соединения, хелаторы металлов). Синтетические фенольные антиоксиданты. Антагонизм и синергизм действия антиоксидантов. Методы исследования антиоксидантных свойств соединений. Проблемы изучения антиоксидантных свойств препаратов. Молекулярно-клеточные механизмы развития окислительного стресса. Понятие про-антиоксидантного гомеостаза в клетке как равновесного соот-ношения прооксидантов и антиоксидантов. Перекисное окисление липидов и его ингибирование антиоксидантами. Методы оценки активности свободно-радикальных процессов. Пути формирования эндогенной защиты и белки с протекторной функцией (ферменты антиоксидантной защиты, гем-оксигеназа, кристаллины, белки теплового шока, тирозингидроксилаза, белки срочного ответа на гипоксию (фактор, индуцируемый гипоксией – ИГФ-1), стресс, ишемию, реперфузию и т.д., специфические белки с шапероновой активностью). Варианты клеточного ответа на АКМ (компенсация, апоптоз и некроз). Морфологические и биохимические характеристики апоптической и некротической гибели клеток. Роль окислительного стресса в патогенезе заболеваний (воспаления, атеросклероза, токсических поражений печени, диабета, бронхолегочных патологий, постишемического повреждения миокарда, ревматоидного артрита, опухолевого роста, патологий нервной системы). Принципы коррекции апоптоза клетки. Методы терапии и профилактики свободно-радикальных патологий, обусловленных окислительным стрессом. Проблемы применения антиоксидантов. Код лекции Наименование разделов и тем лекций Количество часов 2 год 3 год 1 год Литература 4 год 1 сем. 2 сем. 3 сем. 4 сем. 5 сем. 6 сем. 7 сем. 8 сем. 1.1 1.2 1.3 1.4 1.5 Пептидная связь, ее свойства и влияние на конформацию полипептидов. Теория строения белковой молекулы. Ковалентные и нековалентные связи в белках. Работы А.Я. Даниловского, Э.Фишера, Л.1.1; Л2.1;Л Ф. Сенгера, Л. Полинга. 2.3;Л.2.4;Л 2.5; Уровни структурной Л2.6;Л2.7;Л2.8; организации белков. Л2.9 Первичная, вторичная, третичная и четвертичная структура белков. Уровни структурной организации белков. Первичная, вторичная, третичная и четвертичная структура белков. Витамины, коферменты и другие биологически активные соединения. Роль Л.1.1; Л2.1;Л витаминов в питании 2.3;Л.2.4;Л 2.5; животных и человека. Л2.6;Л2.7;Л2.8; Витамины как компоненты Л2.9 ферментов. Классификация ферментов и ее принципы. Л.1.1; Л2.1;Л Оксидоредуктазы, 2.3;Л.2.4;Л 2.5; важнейшие представители. Л2.6;Л2.7;Л2.8; Трансферазы, важнейшие Л2.9 представители.. Гидролазы, распространенные в природе, важнейшие Л.1.1; Л2.1;Л представители. Значение 2.3;Л.2.4;Л 2.5; их в пищевой технологии. Л2.6;Л2.7;Л2.8; Лиазы, важнейшие Л2.9 представители. Лигазы, важнейшие представители. Терминальное окисление. Механизмы активации кислорода. Оксидазы. Коферменты окислительновосстановительных реакций (НАД+/НАД Н, Л.1.1; Л2.1;Л НАДФ+/НАДФ Н, 2.3;Л.2.4;Л 2.5; ФМН/ФМН Н2; ФАД/ФАД Л2.6;Л2.7;Л2.8; Н2).Электронтрансферазн Л2.9 ые реакции. Убихинон, железосерные белки и цитохромы как компоненты ды-хательной цепи. 2 2 2 2 2 1.6 1.7 1.8 1.9 1.10 1.11 1.12 Локализация окислительных процессов в клетке. Митохондрии и их роль как биоэнергетических машин. Локализация Л.1.1; Л2.1;Л электронтрансфераз в 2.3;Л.2.4;Л 2.5; биологических мембранах. Л2.6;Л2.7;Л2.8; Структура дыхательной Л2.9 цепи. Хемиосмотическая теория сопряжения окислительного фосфорилирования и тканевого дыхания. 2 Химизм анаэробного и аэробного распада углеводов. Структура и механизм действия Л.1.1; Л2.1;Л отдельных ферментов 2.3;Л.2.4;Л 2.5; гликолиза и Л2.6;Л2.7;Л2.8; гликогенолиза. Л2.9 Энергетическая эффективность гликолиза, гликогенолиза и брожения. 2 Понятие о пентозофосфатном пути Л.1.1; Л2.1;Л катаболизма углеводов. 2.3;Л.2.4;Л 2.5; Биосинтез углеводов. Л2.6;Л2.7;Л2.8; Глюконеогенез. Биосинтез Л2.9 гликогена. 2 Механизм окисления пировиноградной кислоты. Л.1.1; Л2.1;Л Цикл дикарбоновых и 2.3;Л.2.4;Л 2.5; трикарбоновых кислот. Л2.6;Л2.7;Л2.8; Энергетическая Л2.9 эффективность цикла. Липолиз. Ферментативный гидролиз жиров. Липазы, распространение в природе и характеристика. Окислительный распад жирных кислот. Энергетическая эффективность распада жирных кислот. Роль карнитина в метаболических превращениях жирных кислот. Бета-, альфа- и омега-окисление жирных кислот. Биохимия распада аминокислот. Дезаминирование аминокислот. Типы дезаминирования. Роль аспарагина, глутамина и мочевины в обмене азота. Орнитиновый цикл. Структура и механизм действия трансаминаз и отдельных ферментов цикла мочевинообразования. 2 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 1.13 1.14 1.15 Код занятия Процесс трансляции. Инициация, трансляция, элонгация и терминация. Полисомы. Регуляция синтеза белка. Посттрансляционные изменения в молекуле белка. Процессинг. Метаболизм лекарств в организме. Фазы метаболизма лекарств. Микросо-мальные ферменты и их роль в метаболизме лекарств. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 Микросомальная монооксигеназная система в окислительной Л.1.1; Л2.1;Л биотрансформации 2.3;Л.2.4;Л 2.5; лекарства. Конъюгация, механизмы в метаболизме Л2.6;Л2.7;Л2.8; Л2.9 лекарств. Факторы, влияющие на метаболизм лекарств. Наименование разделов и тем практических занятий Литература 3 1 год Количество часов 2 год 3 год 4 год 1 2 3 4 5 6 7 8 сем. сем. сем. сем. сем. сем. сем. сем. 1.1 1.2 1.3 1.4 Химическое строение белков. Цветные реакции на функциональные группы белков и аминокислот. Л.1.1; Л2.1;Л Физико-химические свойства и 2.3;Л.2.4;Л 2.5; строение белков. Диализ белков. Л2.6;Л2.7;Л2.8; Исследование денатурации белков. Л2.9 Хроматография аминокислот 5 Роль витаминов в метаболизме и механизме действия ферментов. Л.1.1; Л2.1;Л Коферментные формы витаминов. 2.3;Л.2.4;Л 2.5; Качественные реакции на Л2.6;Л2.7;Л2.8; водорастворимые и жирорастворимые Л2.9 витамины. 5 Ферменты, строение, свойства. Л.1.1; Л2.1;Л Изучение кинетических свойств, 2.3;Л.2.4;Л 2.5; специфичности действия ферментов и Л2.6;Л2.7;Л2.8; модификации их активности. Л2.9 4 Механизм действия ферментов Классификация и номенклатура ферментов. Количественное определение активности альфаамилазы в сыворотке крови унифицированным методом Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 4 1.5 1.6 1.7 1.8 1.9 1.10 1.11 1.12 1.13 Обмен липидов. Изучение динамики гидролиза триацилглицеролов под действием панкреатической липазы. Определение ЛПОНП и ЛПНП в сыворотке крови. Определение кетоновых тел в моче. Определение содержания холестерина в сыворотке крови. Качественные реакции на стероиды Обмен аминокислот и белков. Количественное определение белка биуретовым методом. Обнаружение белка в моче. Количественное определение мочевины в сыворотке крови. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 5 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 5 Матричные биосинтезы: репликация, транскрипция и трансляция. Основные этапы белкового синтеза. Л.1.1; Л2.1;Л Посттрансляционная модификация 2.3;Л.2.4;Л 2.5; белков. Выделение дРНП из ткани Л2.6;Л2.7;Л2.8; селезѐнки. Качественная реакция на Л2.9 ДНК Метаболизм лекарственных соединений. Определение в моче свободной и ацетилированной форм сульфаниламидов Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 Биологическое окисление. Л.1.1; Л2.1;Л Количественное определение 2.3;Л.2.4;Л 2.5; каталазной активности крови. Обнаружение дегидрогеназ лимонно – Л2.6;Л2.7;Л2.8; Л2.9 кислого цикла Биологическое окисление. Исследование действия полифенолоксидазы. Определение активности пероксидазы Биологическое окисление. Редокссистемы. Стадии окисления в клетке. Окислительное декарбоксилирование пировиноградной кислоты 4 4 2 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 2 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 2 Окислительное фосфорилирование, Л.1.1; Л2.1;Л другие виды фосфорилирования. 2.3;Л.2.4;Л 2.5; Свободно-радикальное окисление. Л2.6;Л2.7;Л2.8; Антиоксидантная система клетки. Л2.9 Антиоксиданты как лекарственные препараты /Пр/ Обмен углеводов. Качественное и количественное определение глюкозы 2 2 Код Наименование разделов и тем самостоятельной работы Литература 1 год Количество часов 2 год 3 год 4 год 1 2 3 4 5 6 7 8 сем. сем. сем. сем. сем. сем. сем. сем. 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 1.9 1.10 Изучение витаминов, коферментов и других биологически активных соединений. Роль витаминов в питании животных и человека. Витамины как компоненты ферментов. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 3 Изучение пептидной связи, ее свойств Л.1.1; Л2.1;Л и влияние на конформацию 2.3;Л.2.4;Л 2.5; полипептидов. Л2.6;Л2.7;Л2.8; Л2.9 3 Изучение классификации ферментов и Л.1.1; Л2.1;Л ее принципов. 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 Изучением механизмов активации кислорода. Митохондрии и их роль как биоэнергетических машин. Л.1.1; Л2.1;Л Локализация электронтрансфераз в 2.3;Л.2.4;Л 2.5; биологических мембранах. Структура Л2.6;Л2.7;Л2.8; дыхательной цепи. Хемиосмотическая Л2.9 теория сопряжения окислительного фосфорилирования и тканевого дыхания. Изучение химизма анаэробного и аэробного распада углеводов. Л.1.1; Л2.1;Л Структура и механизм действия 2.3;Л.2.4;Л 2.5; отдельных ферментов гликолиза и Л2.6;Л2.7;Л2.8; гликогенолиза. Энергетическая Л2.9 эффективность гликолиза, гликогенолиза и брожения. Изучение механизма окисления Л.1.1; Л2.1;Л пировиноградной кислоты. Цикл 2.3;Л.2.4;Л 2.5; дикарбоновых и трикарбоновых Л2.6;Л2.7;Л2.8; кислот. Энергетическая Л2.9 эффективность цикла. Изучение липолиза. Ферментативный Л.1.1; Л2.1;Л гидролиз жиров. Липазы, 2.3;Л.2.4;Л 2.5; распространение в природе и Л2.6;Л2.7;Л2.8; характеристика. Л2.9 Окислительный распад жирных Л.1.1; Л2.1;Л кислот. Энергетическая 2.3;Л.2.4;Л 2.5; эффективность распада жирных Л2.6;Л2.7;Л2.8; кислот Л2.9 Роль карнитина в метаболических превращениях жирных кислот. Бета-, альфа- и омега-окисление жирных кислот. Изучение биохимии распада аминокислот. Дезаминирование аминокислот. Типы дезаминирования. 2 8 8 8 7 7 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 7 Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 7 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 Роль аспарагина, глутамина и мочевины в обмене азота. Орнитиновый цикл. Структура и механизм действия трансаминаз и отдельных ферментов цикла мочевинообразования. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 Передача генетической информации. Л.1.1; Л2.1;Л Синтез ДНК. Обратная транскрипция. 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 Передача генетической информации. Л.1.1; Л2.1;Л Матричный синтез РНК. 2.3;Л.2.4;Л 2.5; Неспецифический синтез РНК Л2.6;Л2.7;Л2.8; Л2.9 Изучение процесс трансляции. Л.1.1; Л2.1;Л Инициация, трансляция, элонгация и 2.3;Л.2.4;Л 2.5; терминация. Полисомы. Л2.6;Л2.7;Л2.8; Л2.9 6 8 8 8 Регуляция синтеза белка. Посттрансляционные изменения в молекуле белка. Процессинг. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 5 Генетическая изменчивость. Полиморфизм белков. Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 5 Фармацевтическая биохимия.. Использование ферментов в медицине и фармацевтической Л.1.1; Л2.1;Л промышленности. Биохимия - основа 2.3;Л.2.4;Л 2.5; биофармации. Лекарства как Л2.6;Л2.7;Л2.8; чужеродные соединения. Судьба Л2.9 лекарств в организме Лекарственные вещества – Л.1.1; Л2.1;Л ксенобиотики. Всасывание, 2.3;Л.2.4;Л 2.5; распределение и выведение лекарственных веществ из организма. Л2.6;Л2.7;Л2.8; Л2.9 Основные закономерности метаболизма биогенных и чужеродных лекарственных средств Л.1.1; Л2.1;Л 2.3;Л.2.4;Л 2.5; Л2.6;Л2.7;Л2.8; Л2.9 Фазы метаболизма лекарств. Л.1.1; Л2.1;Л Микросомальные ферменты и их роль 2.3;Л.2.4;Л 2.5; в метаболизме лекарств. Л2.6;Л2.7;Л2.8; Л2.9 Микросомальная монооксигеназная система в окислительной Л.1.1; Л2.1;Л биотрансформации лекарства. 2.3;Л.2.4;Л 2.5; Конъюгация, механизмы в Л2.6;Л2.7;Л2.8; метаболизме лекарств. Факторы, Л2.9 влияющие на метаболизм лекарств. 5 5 5 5 4 5 Тематика лабораторных и письменных работ Лабораторные работы: Лабораторные работы не предусмотрены Письменные работы не предусмотрены Авторы, составители Л. 1.1 Под ред. Е. С. Северина 6 Учебно-методическое обеспечение дисциплины 6.1 Рекомендуемая литература 6.1.1 Основная литература Заглавие Издательство, год Колич-во Биохимия : учебник [Электронный ресурс].-Режим доступа: М. : ГЭОТАРwww.pharma.studmedlib.ru Медиа, 2014. 6.1.2 Дополнительная литература Л. 2.1 Коваленко Л.В. Биохимические основы химии биологически активных веществ. [Текст] : учеб. пособие Л. 2.2 Камышников Клинико-биохимическая лабораторная диагностика: В.С. справочник: в 2 т. Л. 2.3 Кольман Я., Наглядная биохимия Рѐм К.-Г Л. 2.4 Марри Р. Д. Биохимия человека. Греннер, П. Мейес, В. Родуэлл Л. 2.5Василенко Ю.К. Биологическая химия: учеб. пособие Л. 2.6 ред. К. Уилсон, Принципы и методы биохимии и молекулярной биологии. Дж. Уолкер. Л. 2.7 Под ред. И.Ю. Малышев Л 2.8 Под ред. И.В. Шугалей. Стресс-белки в биологии и медицине Л. 2.9 Под ред. С.Е. Северина Биологическая химия с упражнениями и задачами. Химия белка. М.: Бином, 2013 3 Минск, Интерпресссервис, 2003 М.:Мир, БИНОМ, 2009 М.: Мир, 2009 3 2 2 М.: МЕДпресс, 2011 М.: Бином, 2013 100 М.: ГЭОТАРМедиа, 2012 СПб.: Проспект Науки, 2011. 1 М.: ГЭОТАРМедиа, 2013 20 3 3 6.2 Электронные образовательные ресурсы 6.2.1 Биохимия : учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп. - М. : ГЭОТАР-Медиа, 2014. - 768 с. : ил.. [Электронный ресурс]. – Режим доступа.www.pharma.studmedlib.ru 6.2.2 Биохимия. Руководство к практическим занятиям: учебное пособие. Чернов Н.Н., Березов Т.Т., Буробина С.С. и др. / Под ред. Н.Н. Чернова. - М. : "ГЭОТАР-Медиа", 2009.: [Электронный ресурс]. – Режим доступа.www.pharma.studmedlib.ru 6.3 Журналы Биохимия Вопросы биологической, медицинской и фармацевтической химии Бюллетень экспериментальной биологии и медицины Экспериментальная и клиническая фармакология 1. 2. 3. 4. 5. 6. 6.4 Программное обеспечение Операционные системы: Windows 98, Windows XP/Vista/Seven/8.; VS Office 97, 2000, 2003, 2007, 2010. Антивирус Касперского 1С Предприятие Гарант Hyper Chem 8.0 Total Commander 7 МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ (МОДУЛЯ) Дисциплина «Биохимия» Кафедра биохимии и микробиологии Расположение кафедры: учебный корпус №1 Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО ВолгГМУ Минздрава России, расположенный по адресу: г. Пятигорск, пр. Калинина, 11. Сайт кафедры http://www.pmedpharm.ru/departments/kafedra_biologicheskoy_himii_i_mikrobiologii/ Материально-техническое оборудование, используемое при реализации дисциплины «Биохимия»: Специализированная аудитории №417: 15 посадочных мест для обучающихся, место преподавателя, фотоэлектроколориметр КФК -3, водяная баня, учебный раздаточный материал, химическая посуда. Лаборатория (аспирантская) №428. Лаборатория располагает необходимой материально-технической и приборной базой для проведения физико-химических, биохимических и биологических исследований. В лаборатории ведутся исследования по изучению физико-химических механизмов биотранспорта различных групп лекарственных веществ и биохимических взаимоотношений лекарственных веществ с рецепторами и рецепторными системами. Лаборатория располагает следующим оборудованием: термостат жидкостный водяной ELMI TW-2.03 (баня водяная); магнитная мешалка, автоматические дозаторы пипеточные, пикнометр, электронные весы Scout, спектрофотометр СФ LEKI SS 1207, фотоэлектроколориметр КФК-3-01, хемилюминометр ХЛ – 003, рН-метрмилливольтметр (рН-150 М), центрифуга СМ-6, СМ-50



