Факторы каскада свертывания
реклама
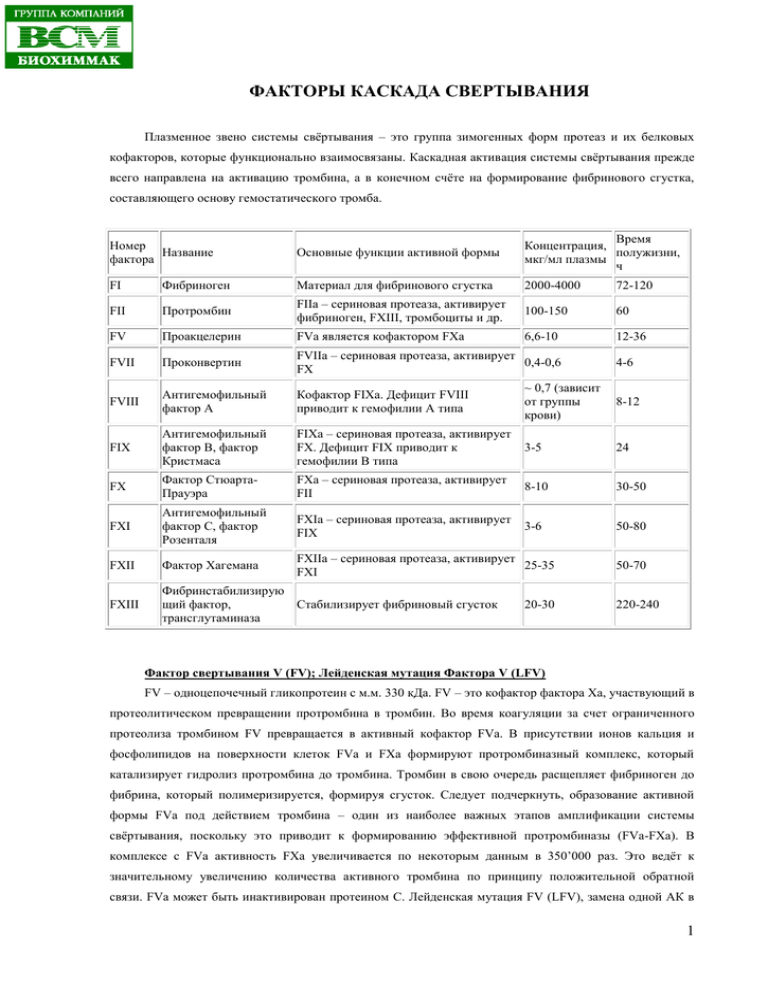
ФАКТОРЫ КАСКАДА СВЕРТЫВАНИЯ Плазменное звено системы свёртывания – это группа зимогенных форм протеаз и их белковых кофакторов, которые функционально взаимосвязаны. Каскадная активация системы свёртывания прежде всего направлена на активацию тромбина, а в конечном счёте на формирование фибринового сгустка, составляющего основу гемостатического тромба. Номер Название фактора Основные функции активной формы Время Концентрация, полужизни, мкг/мл плазмы ч FI Фибриноген Материал для фибринового сгустка 2000-4000 72-120 FII Протромбин FIIа – сериновая протеаза, активирует фибриноген, FXIII, тромбоциты и др. 100-150 60 FV Проакцелерин FVa является кофактором FXa 6,6-10 12-36 FVII Проконвертин FVIIa – сериновая протеаза, активирует 0,4-0,6 FХ FVIII Антигемофильный фактор А Кофактор FIXa. Дефицит FVIII приводит к гемофилии А типа ~ 0,7 (зависит от группы крови) 8-12 FIX Антигемофильный фактор В, фактор Кристмаса FIXa – сериновая протеаза, активирует FХ. Дефицит FIX приводит к гемофилии В типа 3-5 24 FХ Фактор СтюартаПрауэра FXa – сериновая протеаза, активирует FII 8-10 30-50 FXI Антигемофильный фактор С, фактор Розенталя FXIa – сериновая протеаза, активирует FIX 3-6 50-80 FXII Фактор Хагемана FXIIa – сериновая протеаза, активирует 25-35 FXI FXIII Фибринстабилизирую щий фактор, Стабилизирует фибриновый сгусток трансглутаминаза 20-30 4-6 50-70 220-240 Фактор свертывания V (FV); Лейденская мутация Фактора V (LFV) FV – одноцепочечный гликопротеин с м.м. 330 кДа. FV – это кофактор фактора Xa, участвующий в протеолитическом превращении протромбина в тромбин. Во время коагуляции за счет ограниченного протеолиза тромбином FV превращается в активный кофактор FVa. В присутствии ионов кальция и фосфолипидов на поверхности клеток FVa и FXa формируют протромбиназный комплекс, который катализирует гидролиз протромбина до тромбина. Тромбин в свою очередь расщепляет фибриноген до фибрина, который полимеризируется, формируя сгусток. Следует подчеркнуть, образование активной формы FVa под действием тромбина – один из наиболее важных этапов амплификации системы свёртывания, поскольку это приводит к формированию эффективной протромбиназы (FVa-FXa). В комплексе с FVa активность FXa увеличивается по некоторым данным в 350’000 раз. Это ведёт к значительному увеличению количества активного тромбина по принципу положительной обратной связи. FVa может быть инактивирован протеином С. Лейденская мутация FV (LFV), замена одной АК в 1 АК-последовательности FV, обусловливает резистентность FVa к расщеплению активированным протеином C. Следовательно, это приводит к избыточному синтезу тромбина, повышенной коагуляции и наследственным тромбофилическим заболеваниям. Отметим, что LFV – наиболее распространённый фактор риска тромботических осложнений у европейцев. Обследование среди пациентов (европейцев) с тромботическими осложнениями примерно у каждого третьего выявило LFV. Так, распространённость гетерозиготной LFV в общей популяции оценивается 2-4 % у голландцев, около 7% у шведов, 5% у американцев европейского происхождения, причём у афроамериканцев и американцев азиатского происхождения LFV практически не выявлялась. Считается, что гетерозиготная мутация увеличивает риск тромбоза в 4-8 раз, а гомозиготная в 80 раз по сравнению с общей популяцией. Тяжелый дефицит FV, падение уровня ниже 15-10% от нормы, связан развитием геморрагического диатеза от умеренно выраженного до тяжёлого. Существует предположение, что решающую роль в развитии геморрагического диатеза играет не плазменный FV, а его тромбоцитарная форма. Фактор IX (FIX) – зимогенная форма сериновой протеазы с м.м. 55 кДа, синтезируется гепатоцитами в виде одноцепочечного полипептида. После отщепления сигнального пептида (46 АК) от профактора, FIX проходит посттрансляционную модификацию – гликозилирование, витамин Кзависимое карбоксилирование и отщепление пропептида, в таком виде пептид секретируется в кровоток. В процессе коагуляции крови FIX трансформируется в активную форму – FIXа (сериновую протеазу) под действием коагуляционного FXIa или FVIIа. Для данного процесса необходимыми компонентами являются также коагуляционый FVIIIa (активированный гемолитический фактор), фосфолипиды и ионы кальция. FIXa в свою очередь трансформирует коагуляционный FX в активную форму. Мутация в Xхромосоме может быть причиной нарушения функциональной активности FIXа. На настоящий момент известно более сотни мутаций в гене, отвечающим за синтез FIX, причём часть мутаций никак не проявляется, часть отражается снижением активности FIXa, что в случае тяжёлого дефицита приводит к развитию гемофилии группы B (гемофилия Кристмаса). Наконец, в редких случаях, мутации проявляются повышением активности FIX в плазме, что является независимым фактором риска венозной тромбоэмболии. Впервые превышение нормальной активности FIX в 5-10 раз описано в 2009 г., эта мутация FIX получила название Падуанской (mutation Factor IX Padua). Фактор X (FX) и активность фактора Xa (FXа) – это сериновая протеаза проферментов плазмы крови, участвующая в каскаде реакций свертывания крови. FX выделенный из плазмы крови, представляет собой белок, состоящий из двух цепей: тяжелой – 45 кДа и легкой – 17 кДа. Тяжелая цепь FX при активации системы свёртывания расщепляется либо теназой внешнего пути (TF-FVIIa), либо теназой внутреннего пути (FVIIIa-FIXa), что приводит к образованию активной формы FXa. Активирующей способностью в отношении FX также обладают протеазы: фермент из яда гадюки Рассела (RVV) и трипсин. Образующийся Фактор Xa – активатор протромбина, считается центральным звеном системы свёртывания, связывающим два пути активации. Скорость образования активного тромбина значительно возрастает при формировании эффективной протромбиназы (FVa-FXa), которая собирается на отрицательно заряженной фосфолипидной поверхности в присутствии ионов Ca2+, в таком случае активность фактора Xa увеличивается по некоторым данным в 350 000 раз. 2 Фактор XI (FXI), именуемый также предшественник тромбопластина плазмы, важный участник активации внутреннего пути. FXI, циркулирует в плазме в зимогенной форме и представляет собой гомодимер, где каждая цепь имеет размер 607 АК и характеризуется м.м. 80 кДа. Нормальная концентрация фактора XI в кровотоке попадает в диапазон 4-6 мкг/мл. FXI активируется, не только по так называемой классической схеме внутреннего пути через фактор XIIa, но также по внешнему пути через активный тромбин. Дефицит FXI в общей популяции встречается редко: 1 : 100 000. Однако среди евреев-ашкенази этот дефицит является достаточно распространенным: 1 : 200. При инфузии FXI пациентам дефицитным по данному фактору время полужизни составляет 52 часа. В ряде работ было показано, что низкий уровень FXI ассоциирован со снижением риска тромбоза и ишемического инсульта, напротив, повышенные значения этого фактора коррелируют с высоким риском инсульта, артериального и венозного тромбоза. Фактор XII (FXII), или фактор Хагемана – это зимогенная форма сериновой протеазы плазмы крови. После контакта с отрицательно заряженными искусственными или биологическими поверхностями, FXII аутоактивируется и переходит в активную форму (FXIIa). Активная форма FXIIa в свою очередь выполняет несколько важных биологических функций: инициирует фибринолиз и внутренний путь коагуляции, а также активирует калликреин-кининовую систему через расщепление прекалликреина и систему комплемента через С1-компонент. Таким образом, FXII является основным связующим звеном между процессами свёртывания и воспаления. FXII синтезируется в виде протеинпредшественника 615 АК с м.м. 80 кДа, в результате отщепления сигнального пептида формируется зрелая форма FXII из 596 АК (76 кДа). Концентрация FXII в плазме крови составляет 29-40 мкг/мл. FXII – многодоменный белок, структурно сходен с EGF, доменами урокиназы (uPA) и активатора тканевого плазминогена (tPA). В каскаде системы свёртывания FXIIа, являясь сериновой протеазой, участвует во взаимоактивации с прекалликреином и самоактивации, расщепляя неактивный FXII, но при этом важнейшим субстратом для продолжения активации по внутреннему пути является фактор XI. Причём в присутствии анионных поверхностей и ВМК все ферментативные реакции с участием FXII ускоряются многократно. Основным естественным ингибитором, регулирующим активность FXIIa, является С1ингибитор. При этом С1-ингибитор с практически одинаковой эффективностью ингибирует FXIIа, расщепляющий прекалликреин и фактор XI, но концентрация прекалликреина в плазме в 18 выше. Известно также, что FXIIa может активировать плазминовую систему через ограниченный протеолиз плазминогена. Хотя скорость активации плазминогена фактором XIIa в сравнении с эквимолярным количеством tPA в 10 раз ниже, исходная концентрация FXII в 5 000 - 6 000 выше, поэтому нельзя не учитывать вклад фактора XIIa в активацию плазминовой системы. 3 Подпись к иллюстрации: Во внутрисосудистом пространстве FXII связывается с uPA-рецептором (uPAR) на эндотелиальных клетках, цитокератином 1, а также с рецептором комплемента (gC1qR). При дефиците или блокаде FXII отмечают низкий риск церебральной ишемии без явных геморрагических проявлений. Для пациентов с инсультом FXII может стать новой терапевтической мишенью при проведении антикоагулянтной терапии. Ингибирование FXII практически не сопряжено с риском кровотечения в качестве побочного эффекта (Schmaier A.H. The elusive physiologic role of Factor XII. Published in Volume 118, Issue 9, J Clin Invest. 2008; 118 (9): 3006-9, doi:10.1172/JCI36617). Комплекс тромбин-антитромбин III (TAT), образующийся при ковалентном связывании тромбина c антитромбином III (AT-III), рассматривается как косвенный реактивный маркер образования тромбина и потребления AT-III, характеризуется временем полужизни в плазме от 10 до 15 минут. Образование TAT значительно усиливается в присутствии гепарина и других гликозоаминогликанов. При гепарино- и фибринолитической терапии концентрация TAT возрастает. Предполагается, что высокий уровень TAT в плазме изменяет активацию системы гемостаза при Аргентинской геморрагической лихорадке, у пациентов на диализе, при токсикозе во время беременности. Повышенные значения TAT могут быть ассоциированы с сепсисом, ДВС, множественной травмой, острым панкреатитом, острой и хронической лейкемией, острыми и хроническими заболеваниями печени. При этом необходимо учитывать, что пределы нормальных значений TAT становятся выше при беременности, а также с возрастом. Повышенные уровни ТАТ часто ассоциированы с увеличением значений других маркёров: фрагмент протромбина F1+2, фибринопептида А, фибрина, фибриногена, ПДФ и D-димера. Хотя прогностическая ценность TAT уступает ценности D-димера, однако комплексное использование TAT с D-димером может расширять возможности мониторинга тромбоза. Например, нормальный уровень TAT на фоне повышенной концентрации D-димера свидетельствует о давно резвившемся тромбозе. Также определение TAT совместно с D-димером может использоваться для оценки риска морфологических изменений при хроническом расслоении аорты. Низкий уровень TAT в плазме наблюдается при диабете типа 1 (инсулин-зависимом), неонатальном респираторном дистресс-синдроме и первичном нелеченом раке; также значения TAT остаются заметно сниженными в течение 24 часов после приёма оральных антикоагулянтов. 4 Протромбин. Тромбин. Фрагмент протромбина F1+2 Протромбин (FII) – зимогенная форма тромбина (ключевого фермента системы гемостаза). При протеолитическом действии протромбиназы FII (72 кДа) переходит в активную форму – тромбин (аFII, 36 кДа) с высвобождением фрагмента протромбина F1 + 2 (34,6 кДа). Повышенный уровень маркёра F1 + 2 свидетельствует о состоянии гиперкоагуляции. Таким образом, F1 + 2 является прямым маркёром образования аFII и характеризуется очень коротким временем полужизни, выводится из кровотока всего через 1 час после активации протромбина. В свою очередь, аFII – сериновая протеаза, ключевой участник в каскаде коагуляции. Биологические функции аFII, превращающего растворимый фибриноген в нерастворимый фибрин, а также катализирующего многие другие реакции каскада коагуляции, не ограничиваются только системой свёртывания. аFII в форме альфа-тромбина является непосредственным конечным продуктом активации FII, кроме того, идентифицированы еще две формы аFII, бета- и гамма-тромбин. Это продукты деградации, которые могут образовываться в результате саморазрушения образовавшегося аFII. Фибриноген (FBG) – это гомодимер с м.м 340 кДа, состоящий из двух наборов α, β, γ полипептидных цепей, синтезируется в паренхимальных клетках, гепатоцитах и мегакариоцитах. После расщепления FBG тромбином образуется фибрин-мономер, который самопроизвольно полимеризуется в линейные цепи фибрина, получившего название – растворимый (нестабилизированный) фибрин. Эта бесструктурная сеть фибриновых волокон стабилизируется фактором XIIIa, в результате образуется нерастворимый фибрин. Сшитые между собой нити фибрина образуют прочную сеть, которая по сравнению с нестабилизированной формой менее подвержена фибринолизу и устойчива к механическим воздействиям. FBG играет ключевую роль в коагуляции, его концентрация значительно выше концентрации других белков системы гемостаза, составляя в норме у взрослых от 2 до 4 г/л; повышение и снижение уровня FBG имеют большое клиническое значение. Показано, что повышенный уровень FBG в плазме является независимым фактором риска развития атеросклероза и ИБС. Стоит отметить, что в норме у беременных уровень FBG может повышаться до 6 г/л. У людей с наследственным отсутствием FBG, афибриногенемией, время кровотечения увеличено. FBG также связывается с гликопротеиновым рецептором IIbIIIa тромбоцитов, таким образом, образуя мостики между тромбоцитами, что облегчает их агрегацию. 5 Фактор XIII (FXIII), фактор Лаки-Лоранда – зимогенная форма трансглутаминазы – FXIIIа, которая активируется тромбином. FXIII циркулирует в плазме 5-9 суток, нормальная концентрация около 10 мкг/мл. Основной биологической функцией FXIIIa является стабилизация фибринового сгустка. Для образования нормального стабилизированного сгустка достаточно 1% от нормальной активности FXIIIa. Наследственный называется дефицит болезнь (встречаемость 1:5 000 000). XIII фактора Лаки-Лоранда Приобретенный дефицит FXIII обусловлен выработкой антител к FXIII. Наследственный и приобретенный дефициты FXIII свертываемостью проявляются крови, плохой рецидивными случаями кровотечений даже в отсутствие заметных травм. Рутинные коагуляционные анализы не способны выявить дефицит FXIII. Для диагностики этого дефицита используются хромогенный и ИФА методы. Тканевой фактор (TF), CD142, тромбопластин или Фактор III - рецептор и кофактор Фактора VII, инициирующий активацию внешнего пути системы свертывания. При повреждении сосудистого эндотелия происходит образование комплекса TF/FVIIa, который активирует Факторы IX и X, что в итоге приводит к генерации тромбина и образованию фибриновых сгустков. Уровень TF повышается при стимуляции клеток эндотелия, моноцитов и макрофагов эндотоксинами, цитокинами и лектинами. Высокая концентрация ТF ассоциирована с риском тромботического риска, в частности, с развитием ДВС-синдрома. Ингибитор пути тканевого фактора (TFPI) ингибирует комплекс TF/FVIIa, а также Фактор Xa. TFPI с высокой степенью аффинности взаимодействует с гепарином, что позволяет эффективно ингибировать фактор Xa. Однако встречается форма TFPI укороченная в С-концевом фрагменте со сниженной аффинностью к гепарину, вследствие чего гепариновая терапия не дает должного эффекта. ИФА-наборы позволяют дифференцировать формы TFPI и определять концентрацию формы TFPI с укороченным С-фрагментом. Фибринопептид А (FPA) образуется при ферментативном действии тромбина в результате отщепления от N-конца Aα-цепи фибриногена. Повышенный уровень фибринопептида А в крови говорит о гиперактивности тромбина, он наряду с D-димером (см. подраздел «Плазминовая система») является маркером ДВС-синдрома и риска развития тромбозов. 6 ИНФОРМАЦИЯ ДЛЯ ЗАКАЗА: Кат. номер Фирма производитель Наименование, количество/упаковка 845 American Diagnostica Тканевой фактор, 96 846 American Diagnostica Активность TF, 96 848 BCM Diagnostics Активность TFPI (хромогенный набор), 100 ET1005-1 BCM Diagnostics TFPI (ингибитор внешнего пути свёртывания), 96 EF1005-1 BCM Diagnostics Фактор V, 96 EF1007-1 BCM Diagnostics Фактор VII, 96 827 BCM Diagnostics Фактор VIIa, 96 CF2007 BCM Diagnostics Активность Фактора VIIa (способность FVIIa к активации FXa, хромогенный метод, 405 нм), 96 CF1007 BCM Diagnostics Активность Фактора VII (способность комплекса TF-FVIIa к активации FXa, хромогенный метод, 405 нм), 96 884CON American Diagnostica Фактор VIII, 96 5344101 Technoclone Фактор VIII, определение активности (405 нм), ~80 тестов EF1009-1 BCM Diagnostics Фактор IX, 96 EF1010-1 BCM Diagnostics Фактор X, 96 CF1010 BCM Diagnostics Активность Фактора Xa (хромогенный, 405 нм), 96 EF1011-1 BCM Diagnostics Фактор XI, 96 EF1011-7 BCM Diagnostics Фактор XI (с медународными контролями ВОЗ), 96 EF1012-1 BCM Diagnostics Фактор XII, 96 EF1013-1 BCM Diagnostics Фактор XIII, 96 5360100 Technoclone Фактор XIII (тетрамер А2-В2) (количество), 96 5360110 Technoclone А-субъединица Фактора XIII в плазме (количественное определение), 96 5360120 Technoclone В-субъединица Фактора XIII в плазме (количественное определение), 96 EP3022-1 BCM Diagnostics Протромбин, 96 ET4010-1 BCM Diagnostics Тромбин (в супернатанте клеточных культур), 96 7 ET1020-1 BCM Diagnostics Комплекс тромбин-антитромбин III (TAT), 96 E90710Hu BCM Diagnostics Фрагмент протромбина 1+2, 96 EF1040-1 BCM Diagnostics Фибриноген, 96 SEA530Hu BCM Diagnostics Продукты деградации фибриногена/фибрина (FDP), 96 SEC010Hu BCM Diagnostics Протеин Z-зависимый ингибитор протеаз (PZI), 96 635 BCM Diagnostics Фибринопептид А, 96 2599006 Technoclone D-димер, 96 SEA530Hu BCM Diagnostics Продукты деградации фибриногена/фибрина (ПДФ, FDP), 96 8







