2 триместр Химия Тема Азот и его соединения 9 кл
реклама
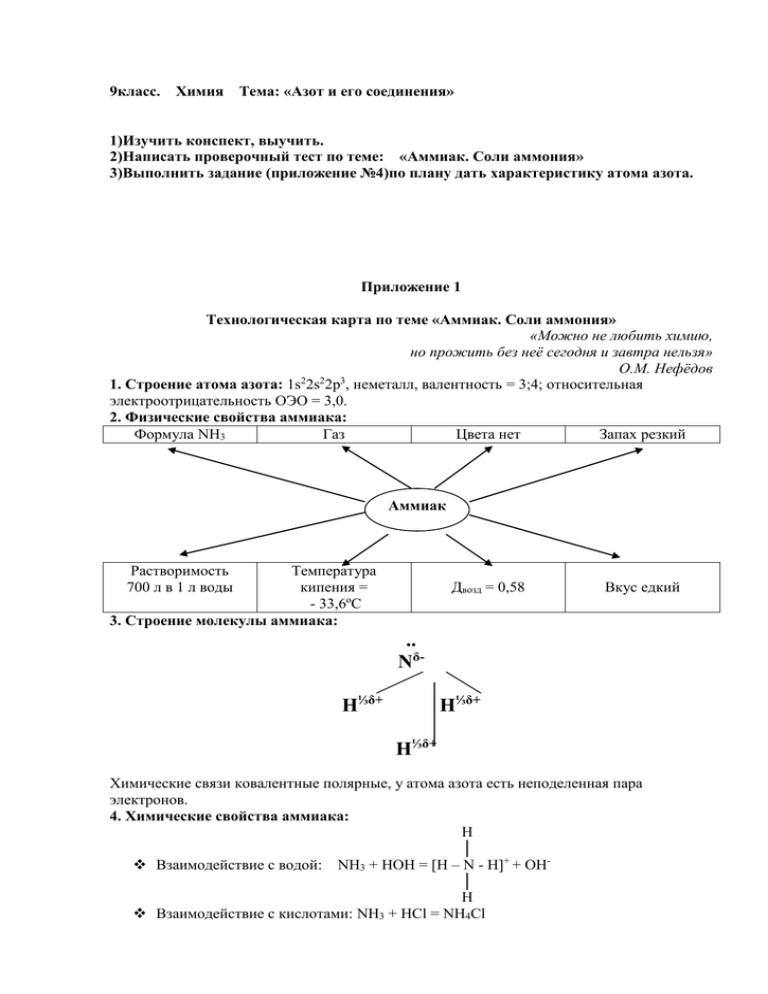
9класс. Химия Тема: «Азот и его соединения» 1)Изучить конспект, выучить. 2)Написать проверочный тест по теме: «Аммиак. Соли аммония» 3)Выполнить задание (приложение №4)по плану дать характеристику атома азота. Приложение 1 Технологическая карта по теме «Аммиак. Соли аммония» «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» О.М. Нефёдов 2 2 3 1. Строение атома азота: 1s 2s 2p , неметалл, валентность = 3;4; относительная электроотрицательность ОЭО = 3,0. 2. Физические свойства аммиака: Формула NH3 Газ Цвета нет Запах резкий Аммиак Растворимость 700 л в 1 л воды Температура кипения = - 33,6ºС 3. Строение молекулы аммиака: Двозд = 0,58 Вкус едкий .. NδН⅓δ+ Н⅓δ+ Н⅓δ+ Химические связи ковалентные полярные, у атома азота есть неподеленная пара электронов. 4. Химические свойства аммиака: H │ Взаимодействие с водой: NH3 + HOH = [H – N - H]+ + OH│ H Взаимодействие с кислотами: NH3 + HCl = NH4Cl Горение в кислороде и каталитическое окисление: 4 NH3 + 3 O2 = 2 N2 + 6 H2O Kat 4 NH3 + 5 O2 → 4 NO + 6 H2O Взаимодействие с оксидами металлов: 2 NH3 + CuO = N2 + 3 H2O + 3 Cu Качественная реакция на аммиак: Раствор аммиака + раствор сульфата меди (II) = васильковое окрашивание 5. Применение аммиака: Аммиак используют в холодильных установках, из аммиака получают удобрения, его применяют в медицине, в быту (при пайке, для нейтрализации кислот, как хорошее средство для тушения огня), для получения азотной кислоты и её солей 3. Строение молекулы аммиака: .. NδН⅓δ+ Н⅓δ+ Н⅓δ+ Химические связи ковалентные полярные, у атома азота есть неподеленная пара электронов. 4. Химические свойства аммиака: H Взаимодействие с водой: │ NH3 + HOH = [H – N - H]+ + OH│ H Взаимодействие с кислотами: NH3 + HCl = NH4Cl Горение в кислороде и каталитическое окисление: 4 NH3 + 3 O2 = 2 N2 + 6 H2O Kat 4 NH3 + 5 O2 → 4 NO + 6 H2O Взаимодействие с оксидами металлов: 2 NH3 + CuO = N2 + 3 H2O + 3 Cu Качественная реакция на аммиак: Раствор аммиака + раствор сульфата меди (II) = васильковое окрашивание 5. Применение аммиака: Аммиак используют в холодильных установках, из аммиака получают удобрения, его применяют в медицине, в быту (при пайке, для нейтрализации кислот, как хорошее средство для тушения огня), для получения азотной кислоты и её солей Приложение 3 к уроку «Аммиак. Соли аммония» Проверочные тесты I вариант 1. Азот входит в главную подгруппу: a) IV группы; b) V группы; c) VI группы; d) VII группы. 2. Раствор аммиака в воде окрашивает лакмус в: a) Красный цвет; b) Синий цвет; c) Фиолетовый цвет; d) Не окрашивает совсем. 3. Аммиак горит в кислороде без катализатора с образованием: a) Азота; b) Оксида азота (II); c) Оксида азота (III); d) Азотной кислоты. 4. Валентность азота может быть равна: a) 1,3; b) 2,3; c) 3,4; d) 3,5. 5. Нашатырный спирт – это: a) Раствор аммиака в воде; b) Раствор аммиака в спирте; c) Хлорид аммония; d) Медицинский спирт. 1. 2. 3. 4. 5. II вариант Азот при обычных условиях - … a) Тяжелый металл; b) Бесцветная маслянистая жидкость; c) Одноатомный инертный газ; d) Газ без цвета и запаха, состоящий из двухатомных молекул. Реакция между хлоридом аммония и гидроксидом кальция идет потому что: a) Выпадает осадок; b) Выделяется газ – аммиак; c) Образуется соль; d) Реакция не идет. Аммиак горит в кислороде в присутствии катализатора с образованием: a) Азота; b) Оксида азота (II); c) Оксида азота (III); d) Азотной кислоты Степень окисления азота в молекуле аммиака: a) 0; b) +3; c) -3; d) +5; Нашатырь – это: a) Раствор аммиака в воде; b) Раствор аммиака в спирте; c) Хлорид аммония; d) Поваренная соль. Приложение 4 Строение атома азота «Ключом ко всякой науке является вопросительный знак» О. Бальзак I. План характеристики химического элемента 1. Положение химического элемента в периодической системе Д.И. Менделеева (период, ряд, группа, подгруппа, семейство, порядковый номер). 2. Строение ядра атома (заряд ядра, количество протонов и нейтронов, относительная атомная масса). 3. Строение электронной оболочки (общее количество электронов, количество энергетических уровней, распределение электронов по уровням и подуровням, электронная формула, распределение электронов по энергетическим ячейкам). 4. Металл или неметалл. 5. Валентные возможности элемента. 6. ОЭО. Какие свойства проявляет химический элемент в химических процессах - является элемент окислителем или восстановителем? 7. Высший оксид и гидроксид элемента.
