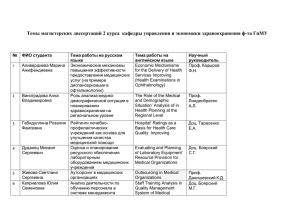
Кодекс маркетинговой практики
реклама

Принят в 2006 году. Настоящая редакция утверждена Общим собранием АМФП 25.06.2014 года. КОДЕКС ПРАКТИКИ Ассоциации международных фармацевтических производителей (АМФП) Редакция 2014 года 1 Министерство здравоохранения Республики Беларусь, рассмотрев обращение Ассоциации международных фармацевтических производителей (AIPM), сообщает, что в целом одобряет Положение Кодекса маркетинговой практики, разработанного и утвержденного для членов Ассоциации. Одновременно Министерство здравоохранения РБ предлагает всем представительствам и представителям зарубежных фармацевтических компаний, субъектам хозяйствования, получившим лицензию на медицинскую или фармацевтическую деятельность, также соблюдать Положение данного Кодекса до разработки и утверждения государственного нормативноправового акта в этой области. Из письма Министерства здравоохранения Республики Беларусь 2 Содержание Преамбула..........................................................................................................6 I. Цель и область применения..........................................................................8 II. Общие положения продвижения лекарственных средств.......................12 III. Особенности взаимодействия со специалистами здравоохранения, а также рекламы для них и иных методов продвижения фармацевтической продукции................................................16 IV. Особенности рекламы и иных методов продвижения лекарственных средств для населения.................................24 V. Исследования лекарственных средств.....................................................28 VI. Особенности взаимодействия с юридическими лицами. Благотворительная деятельность..................................................................31 VII. Процедуры и ответственность фармацевтических компаний..............34 VIII. Поддержание и развитие Кодекса..........................................................35 3 Компании – члены Ассоциации международных фармацевтических производителей (далее – АМФП) осознают свою высокую социальную ответственность перед обществом. Исходя из этого, они принимают и обязуются выполнять требования Кодекса практики АМФП (далее – Кодекс), а также следовать не только его букве, но и духу. Компании – члены АМФП обязуются соблюдать правила добросовестной конкуренции при осуществлении своей деятельности и не причинять ущерб имиджу и экономическим интересам конкурентов за счет ненадлежащего поведения, в том числе за счет ненадлежащей рекламы и иных недобросовестных методов продвижения лекарственных средств. Компании – члены АМФП прилагают необходимые усилия для продвижения Кодекса с целью его правильного понимания и применения как среди своих сотрудников, так и среди других представителей фармацевтического сообщества Республики Беларусь. Компании – члены АМФП стремятся к дальнейшему развитию норм Кодекса, в том числе вносят предложения по его актуализации, дополнению и изменению соответствующих требований. При выявлении фактов нарушения Кодекса компания, интересы которой затронуты, вправе немедленно прибегнуть к процедуре рассмотрения споров и нарушений, установленной настоящим Кодексом (Приложение 1). При этом АМФП приветствует случаи самостоятельного урегулирования споров между компаниями. Кодекс составлен на русском и английском языках. В случае возникновения споров о толковании положений Кодекса преимущество имеет текст на русском языке. В случае выявления противоречий между положениями настоящего Кодекса и нормами действующего законодательства Республики Беларусь должны применяться нормы действующего законодательства Республики Беларусь. При проведении любых программ и мероприятий фармацевтические компании обязаны обеспечить их соответствие нормам действующего законодательства, в том числе антимонопольного законодательства, законодательства о рекламе, о защите персональных данных. Настоящая редакция Кодекса вступает в силу с момента его утверждения Общим собранием АМФП. Компании – члены АМФП обязаны привести свою деятельность, в том числе рекламу и иные методы продвижения лекарственных средств, в соот- 4 ветствие с требованиями новой редакции Кодекса не позднее 31 декабря 2014 года. Заявления о нарушении Кодекса в отношении вновь введенных либо измененных в новой редакции Кодекса требований принимаются с 1 января 2015 года. 5 Преамбула Лекарственные средства представляет собой социально значимую группу товаров, от свойств которых зависит состояние здоровья населения. Фармацевтическая индустрия ответственна за предоставление обществу в целом, медицинскому и фармацевтическому сообществу, в частности, объективной информации о свойствах лекарственных средств, учитывая риск, которому может быть подвержено общественное здоровье при отсутствии необходимой регламентации порядка предоставления такой информации. Сознавая повышенную социальную ответственность, налагаемую на производителей фармацевтической продукции, представители фармацевтической индустрии развитых стран еще в середине прошлого столетия начали устанавливать нормы, регламентирующие маркетинговую и иную деятельность компаний в порядке саморегулирования. В 1981 году Международная федерация фармацевтических производителей и ассоциаций (International Federation of Pharmaceutical Manufacturers and Associations, IFPMA), объединявшая в то время 50 национальных ассоциаций, приняла «IFPMA Code of pharmaceutical marketing practices», соблюдение которого с 1988 года стало условием членства для национальных ассоциаций и, соответственно, требованием к маркетинговой деятельности входящих в их состав компаний. Многими ассоциациями – членами IFPMA разработаны и приняты собственные кодексы, учитывающие национальные условия, но при этом не противоречащие общим принципам, изложенным в Кодексе IFPMA. АМФП – некоммерческая организация, член IFPMA, осуществляющая деятельность в Республике Беларусь. Она была учреждена в 2005 году. В настоящее время АМФП представляет интересы 18 ведущих международных фармацевтических компаний на белорусском фармацевтическом рынке. В 2006 году был принят Кодекс маркетинговой практики. В условиях дефицита детализированных специальных требований в белорусском законодательстве этот документ сыграл положительную роль во внедрении норм цивилизованного продвижения лекарственных средств на фармацевтическом рынке Беларуси и был рекомендован Министерством здравоохранения в качестве стандарта отраслевого документа. Дальнейшее развитие сферы лекарственного обращения обусловило расширение арсенала методов и средств рекламы в продвижении лекарственных средств, что 6 вызвало необходимость внесения соответствующих изменений и дополнений в законодательные акты. С развитием национального и международного фармацевтического рынка, изменениями и дополнениями соответствующего законодательства Республики Беларусь, принятием новой редакции Кодекса IFPMA возникла необходимость в пересмотре и актуализации текста действующего Кодекса, в его дополнении новыми положениями, регулирующими более широкий спектр деятельности фармацевтических компаний. С этой целью в 2014 году была разработана обновленная редакция Кодекса с учетом актуальных методов продвижения и средств коммуникации, в том числе таких, как реклама и информация в Интернете, различные методы сотрудничества со специалистами здравоохранения, пациентскими организациями и другие. 7 I. Цель и область применения 1.1. ЦЕЛЬ Целью настоящего Кодекса является установление минимальных требований, которым должны следовать фармацевтические компании – члены АМФП при осуществлении маркетинговой, научно-исследовательской, образовательной, информационной и благотворительной деятельности на территории Республики Беларусь. 1.2. ОСНОВНЫЕ ПОНЯТИЯ Для целей настоящего Кодекса используются следующие основные понятия: лекарственное средство – вещество или комбинация нескольких веществ природного, синтетического или биотехнологического происхождения, обладающие фармакологической активностью и в определенной лекарственной форме применяемые для профилактики и диагностики заболеваний, лечения и медицинской реабилитации пациентов, предотвращения беременности путем внутреннего или внешнего применения (Закон Республики Беларусь «О лекарственных средствах»); продвижение – деятельность, которая осуществляется, организуется или спонсируется фармацевтической компанией в любой форме с использованием разнообразных каналов коммуникации (включая, но не ограничиваясь, сеть Интернет) и имеет целью способствовать привлечению внимания, формированию или поддержанию спроса, прописыванию, рекомендациям, поставкам, отпуску, применению, назначению и/или потреблению лекарственных средств данной компании; cпециалисты здравоохранения – работники здравоохранения, медицинские и фармацевтические работники, которые в процессе своей профессиональной деятельности имеют право назначать, рекомендовать, приобретать, поставлять и/или применять лекарственные средства; организация здравоохранения – юридическое лицо, являющееся учреждением здравоохранения, медицинской, фармацевтической или научной ассоциацией или организацией (вне зависимости от ее организационноправовой формы, кроме пациентских организаций), например, больница, клиника, фонд, университет или иные учебные заведения медицинского или фармацевтического профиля, чей юридический адрес, место реги- 8 страции юридического лица или основное место деятельности находится в пределах Республики Беларусь, в том числе те, которые оказывают услуги посредством одного или более специалистов здравоохранения; пациентская организация – некоммерческая общественная организация, зарегистрированная в установленном порядке в Республике Беларусь, первичной целью деятельности которой является представление интересов и потребностей пациентов, их семей и лиц, осуществляющих уход за ними; экспертный совет – группа внешних экспертов (например, специалистов здравоохранения и/или представителей пациентских организаций), компетентных в соответствующей области знаний, совместное заседание которых организуется фармацевтической компанией в целях проведения обсуждений и получения консультаций по заранее определенным темам или вопросам, касающимся клинических или научных аспектов, а также по вопросам доступа пациентов к инновационным методам терапии, которые невозможно рассмотреть должным образом с использованием только внутренних ресурсов компании; пострегистрационное клиническое (интервенционное) исследование – исследование лекарственного средства, проводимое в Республике Беларусь, в том числе с привлечением контрактной исследовательской организации, в целях дополнительного сбора данных о его эффективности, безопасности и переносимости, проводимое после государственной регистрации соответствующего лекарственного средства, в котором исследуемый фармацевтический продукт назначается в соответствии с условиями регистрации в стране, а специфическая терапия, диагностические и мониторинговые процедуры проводятся в строгом соответствии с протоколом исследования; пострегистрационное наблюдательное (неинтервенционное) исследование – это пострегистрационное исследование лекарственного средства, проводимое в Республике Беларусь, в том числе с привлечением контрактной исследовательской организации, в котором фармацевтический продукт и/или специфическая терапия назначается пациенту в рамках обычной клинической практики в соответствии с условиями регистрации соответствующего лекарственного средства в стране, решение о назначении лекарственного средства отделено от решения о включении пациента в исследование, пациентам не проводятся дополнительные диагностические, лечебные или мониторинговые процедуры, выходящие за пределы обычной клинической практики лечения соответствующего заболевания; 9 эпидемиологическое исследование – исследование распространенности, встречаемости и выраженности различных заболеваний, частоты лекарственных назначений или медицинских показателей состояний здоровья в целях определения причин их развития, факторов риска и взаимовлияния у различных групп населения; маркетинговое исследование – исследование, направленное на сбор, обработку и анализ маркетинговой информации с целью изучения текущих проблем на товарном рынке для принятия необходимых маркетинговых решений; медицинский представитель фармацевтической компании – сотрудник фармацевтической компании, имеющий специальную подготовку и непосредственно взаимодействующий со специалистами здравоохранения по вопросам клинического применения лекарственных средств; мероприятия – встречи, конгрессы, конференции, симпозиумы и другие формы взаимодействий маркетингового, научного или профессионального характера (включая, кроме прочего, посещения научно-исследовательских центров и производственных площадок, визиты медицинских представителей к работникам здравоохранения и в медицинские учреждения, а также тренинги, организационные совещания по планированию или совещания исследователей в области проведения клинических и неинтервенционных исследований), организованные или финансируемые фармацевтической компанией или от ее имени. 1.3. ОБЛАСТЬ ПРИМЕНЕНИЯ Настоящий Кодекс распространяется на: рекламу лекарственных средств, адресованную населению; рекламу лекарственных средств, адресованную специалистам здравоохранения; деятельность медицинских представителей фармацевтических компаний; взаимодействие со специалистами здравоохранения; взаимодействие с пациентскими организациями; пострегистрационные клинические (интервенционные), наблюдательные (неинтервенционные) и эпидемиологические исследования; маркетинговые исследования; 10 распространение фармацевтическими компаниями или организациями, представляющими их интересы, научной информации, имеющей отношение к здоровью или заболеваниям человека; осуществление безвозмездной спонсорской помощи; поддержку непрерывного медицинского образования; работу с запросами от пациентов и специалистов здравоохранения; мероприятия по продвижению лекарственных средств для специалистов здравоохранения; спонсирование научных и профессиональных мероприятий, в которых принимают участие специалисты здравоохранения; использование сети Интернет и других цифровых каналов связи для продвижения лекарственных средств; иные методы продвижения лекарственных средств. Настоящий Кодекс не распространяется на: маркировку лекарственных средств, инструкции по применению и иную информацию, размещаемую на товаре или его упаковке; фактические и информационные заявления и ссылки, например, в отношении изменения упаковки, предупреждений о нежелательных реакциях как части общих мер по мониторингу безопасности; случаи установления цен и иных коммерческих условий поставки лекарственных средств, включая торговые каталоги и прайс-листы при условии, что в них не содержатся конкретные утверждения рекламного характера о фармацевтическом продукте; предрегистрационные и регистрационные клинические исследования. 11 II. Общие положения продвижения лекарственных средств 2.1. ОСНОВНЫЕ ПРИНЦИПЫ ПРОДВИЖЕНИЯ Продвижение должно способствовать надлежащему применению лекарственного средства путем объективного представления данных о нем. Реклама лекарственных средств должна быть составлена так, чтобы товар ясно идентифицировался как лекарственное средство. Не допускается осуществлять продвижение лекарственного средства под видом пострегистрационных клинических (интервенционных), наблюдательных (неинтервенционных), эпидемиологических исследований, а также маркетинговых исследований. Такого рода исследования в первую очередь должны проводиться в научно-исследовательских целях и не должны быть направлены на стимулирование назначения лекарственного средства специалистами здравоохранения. Спонсируемые фармацевтической компанией материалы с информацией о фармацевтических продуктах и их использовании независимо от того, носят они рекламный характер или нет, должны содержать четкое указание на рекламодателя/источник информации. Не допускается использование горячих линий для рекламы лекарственных средств, отпускаемых по рецепту. Если работники фармацевтической компании делают на мероприятии презентацию для специалистов здравоохранения или являются авторами публикации, они должны быть четко идентифицированы как работники соответствующей фармацевтической компании. 2.2. РЕГИСТРАЦИОННЫЙ СТАТУС Продвижению на территории Республики Беларусь подлежат только зарегистрированные лекарственные средства в рамках зарегистрированных показаний к применению, указанных в инструкции к продукту и/или в клинических протоколах и иных нормативно-правовых актах, утверждённых Министерством здравоохранения Республики Беларусь. Данное условие не налагает ограничений на раскрытие информации по любому лекарственному средству с целью донесения ее заинтересованной стороне, которой эта информация должна быть предоставлена в соответствии с требованиями законодательства. Оно также не предполагает 12 нарушения прав научного сообщества на обмен научной информацией, относящейся к незарегистрированным фармацевтическим продуктам, при условии, что предоставление такой информации не является способом продвижения лекарственного средства. 2.3. СТАНДАРТЫ РЕКЛАМНОЙ ИНФОРМАЦИИ Реклама лекарственных средств должна отвечать требованиям действующего белорусского законодательства о рекламе и конкуренции. Реклама лекарственных средств должна содержать объективную, достоверную, полную и актуальную информацию, основанную на утвержденной в установленном порядке информации о лекарственном средстве – инструкции по медицинскому применению, клинических протоколах и маркировке, а также нормативных правовых актах Министерства здравоохранения Республики Беларусь, регулирующих ее. Производители должны стремиться к наиболее полному отражению в рекламе лекарственных средств основных характеристик, касающихся безо­ пасности их применения. Рекламная информация должна быть ясной, точной, взвешенной, честной, объективной и достаточно полной, основанной на современной оценке всех значимых фактов и четком их изложении, чтобы у потребителя рекламы могло быть сформировано объективное мнение о терапевтической ценности рекламируемого лекарственного средства. Рекламная информация не должна вводить в заблуждение путем искажения, преувеличения, умолчания существенной информации. Необходимо избегать ее двусмысленности. Утверждения о лечебном эффекте не должны превосходить данные, содержащиеся в инструкции по применению лекарственного средства. Рекламная информация о лекарственном средстве должна подтверждаться соответствующими научными данными. Такие свидетельства должны предоставляться по запросам заинтересованных лиц. Компании должны добросовестно относиться к таким запросам и предоставлять объективные данные, соответствующие полученному запросу. Приведение сравнительной информации о лекарственных средствах допустимо только на основании исследований и материалов, составленных третьей, независимой стороной. К печатным рекламным материалам применяются требования, установленные в пунктах 3.2 и 4.2 настоящего Кодекса. К аудио- и видеоматериа- 13 лам применяются требования действующего белорусского законодательства о рекламе. 2.4. ИСПОЛЬЗОВАНИЕ ЭКСПЕРТНЫХ ЗАКЛЮЧЕНИЙ, ССЫЛОК НА РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ЦИТАТ При использовании в рекламных материалах экспертных заключений и ссылок на результаты исследований/наблюдений следует указывать источник таких данных и дату их получения. При использовании в рекламных материалах для специалистов здравоохранения цитат из медицинской или научной литературы или чьих-то выступлений необходимо указывать источник цитирования/имя автора, дату и место публикации/выступления. 2.5. ПРОДВИЖЕНИЕ В СЕТИ ИНТЕРНЕТ Продвижение лекарственных средств в сети Интернет, в том числе посредством размещения баннеров, активных ссылок, информации на вебсайтах, в блогах, социальных сетях, на форумах, конференциях и других электронных ресурсах, должно соответствовать общим требованиям к рекламе и специальным требованиям к рекламе лекарственных средств, установленным законодательством Республики Беларусь. В частности, при использовании интернет-сайтов, связанных с лекарственными средствами, должно быть очевидно, от какой фармацевтической компании исходит информация и кому она адресована, а ее содержание должно соответствовать аудитории-адресату. Реклама лекарственных средств, отпускаемых по рецепту врача, в сети Интернет не допускается. Допускается предоставление информации о лекарственных средствах, отпускаемых по рецепту врача, в рамках онлайн-мероприятий (вебинаров) для специалистов здравоохранения, а также в разделах интернет-ресурсов, доступ к которым открыт исключительно для специалистов здравоохранения. Привлечение фармацевтической компанией рекламных агентств, а также иных лиц для продвижения лекарственных средств в сети Интернет не снимает с фармацевтической компании ответственности за нарушение положений настоящего Кодекса. Действие настоящего Кодекса распространяется на продвижение лекарственных средств на территории Республики Беларусь на любых веб- 14 сайтах, независимо от места осуществления услуг хостинга и зоны доменного имени, а также местонахождения и внутренних политик фармацевтической компании, продвигающей лекарственные средства. 2.6. ИНФОРМАЦИЯ, ИМЕЮЩАЯ ОТНОШЕНИЕ К ЗДОРОВЬЮ ИЛИ ЗАБОЛЕВАНИЯМ ЧЕЛОВЕКА Фармацевтические компании вправе предоставлять широкой общественности информацию о заболеваниях, их профилактике и лечении, соблюдая следующие правила: данная деятельность не должна составлять предмет лицензируемой медицинской деятельности; приводимая информация должна быть достоверной, добросовестной, этичной, полной, а также не должна подменять консультацию врача или призывать к самолечению; данная информация должна содержать указание на фармацевтическую компанию, от которой исходит информация; эта информация не должна содержать названий лекарственных средств, отпускаемых по рецепту, а равно изображений упаковки таких фармацевтических препаратов или ее элементов, или иным образом быть направленной на продвижение лекарственного средства, отпускаемого по рецепту; данная информация должна содержать указание на необходимость получения консультации специалиста здравоохранения. 15 III. Особенности взаимодействия со специалистами здравоохранения, а также рекламы для них и иных методов продвижения фармацевтической продукции 3.1. ОБЩИЕ ПРИНЦИПЫ ВЗАИМОДЕЙСТВИЯ СО СПЕЦИАЛИСТАМИ ЗДРАВООХРАНЕНИЯ Взаимодействие фармацевтических компаний со специалистами здравоохранения должно быть направлено на принесение пользы пациентам и совершенствование медицинской практики. Целью такого взаимодействия должно быть предоставление специалистам здравоохранения новых сведений о лекарственных средствах, обеспечение их информацией научного и образовательного характера, а также поддержка научных и клинических исследований. Сотрудничество фармацевтических компаний со специалистами здравоохранения не должно приводить к конфликту интересов, в частности между исполнением профессиональных обязанностей специалистами здравоохранения и их личной заинтересованностью. В том числе такой конфликт не должен возникать при назначении лекарственного средства медицинским работником, а также при рекомендации и продаже лекарственного средства фармацевтическим работником. Не допускается предлагать, обещать, предоставлять или передавать специалистам здравоохранения вознаграждение в любой форме за назначение или рекомендацию пациентам определенного лекарственного средства, а также заключать с ними соглашения о назначении или рекомендации пациентам какого-либо лекарственного средства (за исключением договоров о проведении клинических исследований лекарственных средств). Персональные данные специалистов здравоохранения могут включаться в базы данных исключительно при наличии их согласия в надлежащей форме и соблюдения иных требований законодательства в сфере защиты персональных данных. 3.2. ПЕЧАТНЫЕ РЕКЛАМНЫЕ МАТЕРИАЛЫ Печатные рекламные материалы, за исключением описанных в подпунк­ те, должны содержать следующий минимум информации: 16 название лекарственного средства (обычно торговое название); общепринятые наименования активных веществ (если лекарственное средство содержит не более трех активных веществ); наименование и адрес фармацевтической компании-производителя, а также организации, представляющей ее интересы на территории Республики Беларусь; дату создания рекламы; «сокращенную информацию по применению», включающую утвержденные показания к применению, при необходимости в сочетании с дозировкой и способом применения, краткое изложение противопоказаний, мер предосторожности и нежелательных эффектов; указание целевой аудитории, для которой предназначен данный рекламный материал. 3.3. МЕРОПРИЯТИЯ Целью всех мероприятий, в том числе визитов медицинских представителей к работникам здравоохранения и в медицинские учреждения, должно быть информирование специалистов здравоохранения о лекарственных средствах и/или обеспечение их информацией научного или образовательного характера в сфере здравоохранения или фармацевтики. Компании не должны организовывать мероприятия, которые проводятся вне страны проживания специалистов здравоохранения, если только уместность этого не оправдана с точки зрения логистики и безопасности. Международные научные конгрессы и симпозиумы, собирающие участников из многих стран, являются с этой точки зрения оправданными и разрешенными. Информация, распространяемая среди участников международных научных конгрессов или симпозиумов, может касаться лекарственных средств, не зарегистрированных в стране, где проводится мероприятие, или зарегистрированных на иных условиях, если соблюдаются следующие требования: распространение такой информации допускается действующим законодательством страны проведения мероприятия; мероприятие должно быть действительно международным научным мероприятием, в котором участвует (в качестве выступающих или слу- 17 шателей) значительное число специалистов здравоохранения из других стран; материалы по лекарственному средству, не зарегистрированному в стране, где проводится мероприятие, должны сопровождаться соответствующим ясным указанием на то, что в данной стране это лекарственное средство не зарегистрировано; материалы, содержащие информацию по применению (показания, предупреждения и т.д.), которая утверждена в другой стране/странах, где данное лекарственное средство зарегистрировано, должны сопровождаться заявлением о том, что условия регистрации в странах отличаются. Мероприятие должно проводиться в месте и условиях, способствующих достижению научных и образовательных целей данного мероприятия. Запрещается использовать объекты, которые в глазах общественности ассоциируются с развлечениями, роскошью или эксклюзивностью, независимо от их класса. Рекомендуется организовывать мероприятия в бизнес-центрах, учебных заведениях, отелях и других местах, предназначенных для проведения деловых и образовательных мероприятий. Проведение компанией мероприятия в месте общественного доступа возможно только в условиях изолированного помещения либо закрытия места общественного доступа на время проведения мероприятия. Запрещается использование развлекательных и спортивных мероприятий для привлечения специалистов здравоохранения к промоционным и научным мероприятиям. Допускается предоставление канцелярских принадлежностей (ручки, блокноты, карандаши и подобное) незначительной стоимости для составления конспектов, ведения записей, иных вспомогательных на мероприятии материалов и средств. Допускается сопровождение мероприятия подачей прохладительных напитков, чая/кофе, закусок и/или горячих блюд при условии, что это оправданно с точки зрения длительности мероприятия, является однозначно второстепенным по отношению к цели мероприятия и предоставляется только участникам мероприятия, но не сопровождающим их лицам и в ­разумных пределах. Фармацевтические компании не должны предоставлять или оплачивать развлечения как в рамках, так и вне рамок проведения мероприятия. 18 3.4. ПРИВЛЕЧЕНИЕ СПЕЦИАЛИСТОВ ЗДРАВООХРАНЕНИЯ ДЛЯ ОКАЗАНИЯ УСЛУГ Фармацевтические компании вправе привлекать специалистов здравоохранения с целью оказания услуг научного и информационного характера, создания объектов авторского права, а также при проведении клинических исследований лекарственных средств и выплачивать им вознаграждение за оказание данных услуг. При привлечении специалистов здравоохранения для оказания услуг должны быть соблюдены следующие требования: наличие договора в письменной форме, описывающего содержание оказываемых услуг и условия их оплаты; вознаграждение за оказанные услуги должно быть разумным и соответствовать существующей рыночной стоимости; наличие обоснованной необходимости в услуге; наличие непосредственной связи между критериями отбора специалистов здравоохранения и целью, которая должна быть достигнута в результате оказания услуги; соответствие количества привлеченных специалистов здравоохранения количеству, действительно необходимому для достижения поставленной цели; факт заключения договора оказания услуг не должен прямо или косвенно налагать обязательства на специалиста здравоохранения, связанные с рекомендациями и назначением лекарственных средств. Допускается оплата или возмещение расходов специалистов здравоохранения, непосредственно относящихся к оказываемым услугам, в том числе расходов, связанных с проездом специалистов здравоохранения к месту оказания услуг, проживанием и питанием. При оплате или возмещении расходов при исполнении договоров необходимо соблюдать следующие требования: запрещается использовать гостиницы или объекты, которые в глазах общественности ассоциируются с роскошью или эксклюзивностью, независимо от их класса; питание допускается в разумных пределах; при поездках специалистов здравоохранения, не превышающих четырех часов в дневное время, следует приобретать авиабилеты экономического класса; 19 не допускается возмещение каких-либо расходов сопровождающих лиц. Исключения должны быть обоснованы объективной необходимостью и согласованы с руководством компании. 3.5. ПОДАРКИ Возможность и порядок предоставления подарков специалистам здравоохранения (в том числе предметов медицинского и образовательного назначения) следует определять в соответствии с требованиями белорусского законодательства. 3.6. ОСНОВНЫЕ ПРАВИЛА И НОРМЫ ДЕЯТЕЛЬНОСТИ МЕДИЦИНСКИХ ПРЕДСТАВИТЕЛЕЙ Целью деятельности медицинских представителей фармацевтических компаний должно быть повышение профессионального уровня специалистов здравоохранения и выполнение обязанности фармацевтической компании по мониторингу безопасности лекарственных средств. Медицинские представители вправе участвовать в конгрессах, симпозиу­ мах, конференциях, презентациях, собраниях и иных мероприятиях для специалистов здравоохранения в медицинских организациях, включая визиты, в порядке, установленном данной медицинской организацией. В рамках данных мероприятий медицинские представители вправе предоставлять специалистам здравоохранения промоционные печатные материалы, а также информационные материалы, такие как частичные репринты отдельных глав и разделов специализированных изданий, научных монографий и справочников, научные статьи и тексты докладов и иные печатные материалы для повышения профессионального уровня специалистов здравоохранения. Допускается предоставление вышеуказанной информации на CD-дисках и картах памяти, не предназначенных для личного использования. При этом любые материалы, включая промоционные, должны повышать профессиональный уровень специалистов здравоохранения и не преследовать исключительно рекламные цели. Медицинские представители фармацевтических компаний должны иметь достаточную подготовку и обладать необходимыми знаниями, чтобы предоставлять специалистам здравоохранения полную, объективную, достоверную и актуальную информацию о фармацевтических продуктах. 20 Ответственность за содержание и форму предоставления информации, передаваемой медицинскими представителями специалистам здравоохранения, несет фармацевтическая компания. Медицинский представитель обязан по запросу специалиста здравоохранения предоставить инструкцию по медицинскому применению каждого лекарственного средства, о котором он информирует, а также сведения об условиях отпуска (отнесение к категории отпускаемых по рецепту либо без рецепта врача, отпускаемых для льготных категорий граждан и пр.) лекарственного средства и его наличии в аптеках. Медицинский представитель обязан соблюдать профессиональную этику по отношению к потребителям, специалистам здравоохранения, компании, чьи интересы он(а) представляет, а также к представителям конкурирующих компаний. Медицинские представители обязаны доводить до руководителя соответствующего подразделения своей компании информацию о практическом применении лекарственных средств компании, в том числе о нежелательных реакциях, полученную от специалистов здравоохранения. 3.7. ОБРАЗЦЫ Фармацевтические компании не вправе предоставлять непосредственно специалистам здравоохранения образцы лекарственных средств как для последующей передачи пациентам, так и для личного пользования (в том числе образцы для демонстрации (demo packs) и пустую вторичную и первичную упаковку). 3.8. ЭКСПЕРТНЫЕ СОВЕТЫ Целью Экспертного совета является обсуждение и получение консультаций внешних экспертов по заранее определенному научному вопросу, для решения которого недостаточно экспертизы или опыта внутри компании и при невозможности выяснения этого вопроса другими методами. Экспертные советы не могут использоваться в качестве инструмента распространения информации или для продвижения лекарственных средств, в то время как информация, полученная на Экспертном совете, может быть использована в качестве информации для решения маркетинговых вопросов (например, информации для внесения в маркетинговые планы или рекламные собрания). 21 Фармацевтические компании вправе выплачивать экспертам – специалистам здравоохранения вознаграждение за их работу в Экспертном совете (в том числе компенсировать их расходы, связанные с участием в Экспертном совете) только при условии, что деятельность таких экспертов в рамках Экспертного совета носит научный характер. При возмещении расходов должны соблюдаться требования пункта 3.4 настоящего Кодекса. Организация Экспертного совета возможна только при наличии обоснованной научной необходимости и не должна иметь целью финансирование мероприятий профессиональных сообществ. Выбор членов Экспертного совета должен основываться исключительно на их профессиональной компетенции и квалификации и не должен быть каким-либо образом связан с прошлыми, текущими или возможными будущими назначениями или рекомендациями лекарственных средств компании. Работники коммерческих отделов не должны иметь влияния на выбор экспертов и работу Экспертного совета. Количество привлеченных специалистов здравоохранения должно соответствовать количеству, действительно необходимому для достижения поставленной цели. Общее число работников компании, посещающих собрание Экспертного совета, не должно превышать одну четверть от числа независимых сторонних экспертов, участвующих в заседании. При этом сотрудники не вправе использовать участие в работе Экспертного совета для продвижения лекарственных средств компании. 3.9. РАБОТА С ЗАПРОСАМИ МЕДИЦИНСКОЙ ИНФОРМАЦИИ Запросы медицинской информации могут быть получены от специалистов здравоохранения и пациентов. Компания должна внимательно относиться к каждому запросу. Каждый запрос должен быть зарегистрирован в порядке, установленном законодательством об обращениях граждан и юридических лиц, и на него необходимо дать ответ. Информация, предоставляемая специалистам здравоохранения в ответ на запрос, должна соответствовать белорусскому законодательству, а также учитывать положения утвержденной инструкции по применению лекарственного средства и настоящему Кодексу. Ответ на запрос специалиста здравоохранения не должен служить целям продвижения лекарственного средства. Он должен ограничиваться только ответом на непосредственно заданный вопрос. 22 Информация о лекарственных средствах других компаний должна быть объективной. Все ответы необходимо предоставлять в доступной и этичной форме. Сотрудники фармацевтической компании не вправе инициировать обсуждение со специалистами здравоохранения и иными третьими лицами незарегистрированных лекарственных средств и/или незарегистрированных показаний к их применению. Информация о незарегистрированных лекарственных средствах и/или незарегистрированных показаниях предоставляется только специалистам здравоохранения исключительно по запросу, направленному в фармацевтическую компанию. Ответы на все запросы от специалистов здравоохранения предоставляются службой медицинской информации или любым другим уполномоченным персоналом медицинского/регуляторного отдела для обеспечения надлежащего качества и объективности информации. Все телефонные звонки принимаются и регистрируются персоналом с последующей передачей информации о запросах в медицинский/регуляторный отдел. Работники отделов продаж и маркетинга могут отвечать только на вопросы, полученные в ходе взаимодействия со специалистами здравоохранения, в рамках утвержденной инструкции по применению лекарственного средства. Полученные вопросы, выходящие за рамки утвержденной в установленном порядке информации о лекарственном средстве, работники отделов продаж и маркетинга должны перенаправлять для ответа в медицинский/регуляторный отдел. В ответе специалисту здравоохранения необходимо предоставить исчерпывающую научно обоснованную информацию по заданному вопросу. В письменных ответах все заявления и факты должны быть подкреплены соответствующими ссылками с указанием имени автора, полного названия статьи или монографии, места публикации (разрешаются традиционные аббревиатуры), года издания, номера тома, выпуска и страницы. Персональные данные специалистов здравоохранения и иных лиц, отсутствующие в открытом доступе, могут включаться в базы данных фармацевтических компаний исключительно при наличии их согласия в установленной законом форме и соблюдении иных требований законодательства в сфере защиты персональных данных. 23 IV. Особенности рекламы и иных методов продвижения лекарственных средств для населения 4.1. ОБЩИЕ ТРЕБОВАНИЯ Не допускается реклама для населения лекарственных средств, отнесенных к категории отпускаемых по рецепту врача. В рекламе для населения запрещается упоминание о факте включения рекламируемого лекарственного средства в любой из списков лекарственных средств, предназначенных для определенных категорий граждан, расходы на которые возмещаются или дотируются государством. В рекламе лекарственных средств для населения рекомендуется избегать специальных медицинских терминов, которые могут быть неправильно поняты или ввести в заблуждение потребителей рекламы. 4.2. ПЕЧАТНЫЕ РЕКЛАМНЫЕ МАТЕРИАЛЫ Печатные рекламные материалы, за исключением напоминающей рекламы, должны содержать следующий минимум информации: название лекарственного средства (обычно торговое название), а также международное непатентованное наименование, если продукт содержит только одно активное вещество; информацию, необходимую для правильного применения лекарственного средства (показание; информацию о наличии противопоказаний и побочных эффектах; необходимые для безопасного применения меры предосторожности); наименование и адрес фармацевтической компании или организации, представляющей ее интересы на территории Республики Беларусь; предупреждение о наличии противопоказаний к применению и использованию лекарственного средства, необходимости ознакомления с инструкцией по применению или получения консультации специалистов. Миниум для напоминающей рекламы должен включать: наименование лекарственного средства; предупреждение о наличии противопоказаний к его применению и использованию; 24 необходимость ознакомления с инструкцией по применению или получения консультации специалистов. 4.3. ОГРАНИЧЕНИЯ ПО СОДЕРЖАНИЮ РЕКЛАМНЫХ МАТЕРИАЛОВ ДЛЯ НАСЕЛЕНИЯ Реклама лекарственных средств для населения не должна: создавать впечатление ненужности обращения к врачу; содержать информацию, не соответствующую инструкции по медицинскому применению; гарантировать положительное действие, эффективность или безопасность лекарственного средства либо отсутствие нежелательных эффектов; содержать ссылки на конкретные случаи излечения от заболеваний, улучшения состояния здоровья в результате применения лекарственного средства; содержать выражение благодарности физическими лицами в связи с использованием лекарственного средства; обращаться к несовершеннолетним; создавать представление о преимуществах лекарственного средства путем ссылки на факт проведения исследований и испытаний, обязательных для государственной регистрации; создавать впечатление необходимости применения лекарственного средства здоровыми людьми, за исключением рекламы профилактических лекарственных средств; содержать утверждения или предположения о том, что безопасность или эффективность лекарственного средства обусловлены его натуральным происхождением; представлять лекарственное средство в качестве биологически активной добавки, косметического или другого товара, не являющегося лекарственным средством; содержать описания, изображения картины болезни, которые могут спровоцировать самостоятельную постановку ошибочного диагноза; содержать утверждения или предположения о наличии у потребителей рекламы тех или иных состояний, которые требуют применения лекарственного средства, либо утверждения, создающие у здорового человека впечатление о необходимости его применения; 25 указания на возможность использования любых форм материального поощрения в случае приобретения лекарственного средства; содержать образы и высказывания медицинских и фармацевтических работников; содержать рекомендации ученых, медицинских, фармацевтических работников или лиц, которые не относятся к этим категориям, но в связи с их известностью могут поощрить применение лекарственного средства; содержать рекомендации государственных органов и иных организаций, используемых в целях усиления рекламного эффекта; содержать неуместные, вызывающие тревогу или вводящие в заблуждение термины, живописные изображения изменений в человеческом организме, вызванные заболеванием, травмой или действием фармацевтического продукта на организм человека или части тела; cодержать иную информацию, запрещенную действующим законодательством Республики Беларусь. 4.4. ИНЫЕ МЕТОДЫ ПРОДВИЖЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ НАСЕЛЕНИЯ Не допускается продвижение лекарственных средств посредством телемагазинов, а также продажа лекарственных средств с использованием сети Интернет. Не допускается использование лекарственных средств в качестве призов и поощрений. Не допускается распространение в рекламных целях бесплатных образцов лекарственных средств населению, в том числе проведение дегустаций и проб лекарственных средств. 4.5. РАБОТА С ЗАПРОСАМИ О МЕДИЦИНСКОЙ ИНФОРМАЦИИ ОТ ПАЦИЕНТОВ При обращении пациента в фармацевтическую компанию за информацией необходимо удовлетворять такие запросы. Данное взаимодействие не должно использоваться в целях рекламы и продвижения лекарственного средства, в том числе после его осуществления, например, путем публикации переписки в средствах массовой информации. 26 Информация, предоставленная пациенту в ответ на запрос, должна полностью соответствовать утвержденной инструкции по применению лекарственного средства. Ответ должен быть точным, корректным и не вводящим в заблуждение. В случае возникновения вопросов, связанных, например, с постановкой диагноза, тактикой ведения или лечения заболевания, любой представитель компании (в том числе сотрудник медицинского отдела) обязан рекомендовать ему обратиться к медицинскому специалисту (врачу) или в службу предоставления неотложной медицинской помощи. 27 V. Исследования лекарственных средств 5.1. ПОСТРЕГИСТРАЦИОННЫЕ ИССЛЕДОВАНИЯ Пострегистрационные клинические исследования/испытания и эпидемиологические исследования (в дальнейшем – пострегистрационные исследования) должны соответствовать требованиям законодательства Республики Беларусь, а также положениям, установленным настоящим Кодексом. Пострегистрационные исследования должны иметь обоснование и научную цель/цели, отраженные в протоколе исследования. Контроль проведения пострегистрационных исследований осуществляется и находится в ответственности медицинского отдела или соответствующего медицинского функционального подразделения/работников фармацевтической компании. Выбор исследователей должен основываться исключительно на их профессиональной квалификации и клиническом опыте. Данные, полученные в ходе пострегистрационных исследований, должны быть статистически обработаны и проанализированы. Результаты таких исследований по вопросам эффективности и безопасности лекарственных средств должны быть доступны специалистам здравоохранения. При проведении пострегистрационных исследований должны быть соблюдены законы, правила и требования в отношении конфиденциальности персональных данных (включая сбор, обработку и использование персональных данных). Протокол пострегистрационного исследования должен быть одобрен в медицинском отделе либо ответственными медицинскими функциональными подразделениями/работниками. Медицинский отдел (соответствующие медицинские функциональные подразделения/работники) должен контролировать ход пострегистрационных исследований. Документация пострегистрационных исследований (протокол, индивидуальная регистрационная карта, информационный листок пациента и др.) должна пройти обязательную этическую экспертизу. В тех случаях, когда это допустимо, работники других отделов компании могут участвовать в решении административных задач (в частности, в передаче документации пострегистрационных исследований от медицинского отдела в исследовательский центр/исследователям и обратно). Это участие должно осуществляться под контролем медицинского отдела, ко- 28 торый должен обеспечить надлежащую подготовку сотрудников других отделов фармацевтической компании. Участие специалиста здравоохранения в пострегистрационном исследовании не должно быть побуждающим фактором к рекомендации/назначению, приобретению, продаже и/или использованию какого-либо конкретного лекарственного средства. Предоставляемое за пострегистрационные исследования вознаграждение оплачивается на основе официального договора с лечебно-профилактическим учреждением, на базе которого проводится исследование, должно быть разумным и отражать существующую рыночную стоимость выполненной работы. Запрещено проводить пострегистрационные исследования под видом маркетинговых исследований. Если различия между маркетинговыми исследованиями и пострегистрационными исследованиями не четкие, то цели маркетинговых исследований подлежат проверке медицинскими специалистами фармацевтической компании. 5.2. МАРКЕТИНГОВЫЕ ИССЛЕДОВАНИЯ Маркетинговые исследования, проводимые непосредственно фармацевтическими компаниями либо фармацевтическими компаниями с привлечением маркетинговых агентств, возможны лишь при условии соблюдения требований действующего законодательства. При этом фармацевтические компании и/или привлеченные агентства не вправе выплачивать специалистам здравоохранения вознаграждение за их участие в маркетинговом исследовании. Исключение могут составлять случаи проведения маркетинговых исследований, требующих специальных научных знаний и значительных трудозатрат со стороны специалиста здравоохранения, при условии что: маркетинговые исследования проводятся с привлечением независимых агентств; специалисту здравоохранения не сообщается и из материалов исследования не очевидно, какая фармацевтическая компания является заказчиком/спонсором исследования; фармацевтическая компания не участвует в отборе и не имеет доступа к идентификационным данным специалистов здравоохранения, принимающим участие в маркетинговом исследовании. Не допускается использование маркетинговых исследований: 29 с целью продвижения или продаж лекарственного средства или для управления мнением или поведением участников исследования. По этой причине следует избегать упоминания торгового наименования лекарственного средства, если только этого не требуют цели исследования; для сбора персональных данных пациентов; в целях дальнейшего исследования эффективности или безопасности лекарственного средства; для предрегистрационного продвижения лекарственного средства или показаний для его применения, подлежащих регистрации; для получения конфиденциальной информации о компаниях-конкурентах; с целью дискредитации лекарственных средств компаний-конкурентов. 30 VI. Особенности взаимодействия с юридическими лицами. Благотворительная деятельность 6.1. Взаимодействие с некоммерческими организациями Фармацевтические компании вправе осуществлять безвозмездную спонсорскую помощь некоммерческим организациям в общественно полезных целях в соответствии с нормами белорусского законодательства. В том числе безвозмездная спонсорская помощь может осуществляться для поддержки медицинского образования, развития научной деятельности в здравоохранении, призванных в конечном итоге повысить качество медицинской помощи пациентам. Благотворительная деятельность ни при каких условиях не может быть прямо или косвенно поставлена в зависимость от назначения или приобретения лекарственных средств компании. Запрещается предоставление безвозмездной спонсорской помощи в виде наличных денежных средств. Допускается предоставление лекарственных средств в качестве безвозмездной спонсорской помощи организациям здравоохранения при условии, что такая помощь не преследует коммерческих целей. Компания обязана информировать получателя помощи об остаточном сроке годности лекарственного средства. Безвозмездная спонсорская помощь может предоставляться только на основании письменного запроса некоммерческой организации и письменного договора о предоставлении безвозмездной спонсорской помощи. 6.2. ВЗАИМОДЕЙСТВИЕ С пациентскими ОРГАНИЗАЦИЯМИ Все взаимодействия с организациями пациентов должны носить этический характер. Допускается взаимодействие фармацевтических компаний с пациентскими организациями для решения следующих задач: изучение мнения пациентов о влиянии заболевания на качество жизни пациентов и мнения лиц, осуществляющих уход за ними, с целью 31 оптимизации программы клинических исследований лекарственных средств и ускорения разработки тех, которые лучше всего отвечают потребностям пациентов; осуществление информационной поддержки объединений пациентов путем ответов на запросы по правилам, предусмотренным пунктом 4.5 настоящего Кодекса для ответов на запросы пациентов; создание реестров пациентов при условии строгого соблюдения законодательства о защите персональных данных и врачебной тайны; проведение кампании по информированию широкой общественности о заболевании; сотрудничество по организации предоставления в медицинские организации незарегистрированного лекарственного средства для оказания медицинской помощи конкретным пациентам по жизненным показаниям;­ оказание безвозмездной спонсорской помощи; иные случаи, не противоречащие законодательству. Фармацевтическая компания не может являться единственной фармацевтической компанией – учредителем пациентской организации пациентов. При сотрудничестве фармацевтической компании с пациентской организацией факт и характер такого сотрудничества должны быть четко раскрыты фармацевтической компанией в доступных источниках. При этом фармацевтическая компания может являться единственным источником финансирования благотворительного и/или социального проекта пациентской организации при получении соответствующего письменного запроса от пациентской организации для реализации программ такой организации, направленных на профилактику и охрану здоровья граждан, пропаганду здорового образа жизни, помощь социально незащищенным слоям населения, если такое финансирование не направлено прямо или косвенно на стимулирование принятия пациентской организацией каких-либо решений в процессе осуществления ее уставной деятельности в пользу фармацевтической компании или ее продукции. В любом случае такая фармацевтическая компания не должна ограничивать права иных фармацевтических компаний на финансирование таких же проектов пациентской организации при их желании. Любые взаимоотношения фармацевтических компаний с пациентскими организациями должны быть четко документированы. 32 Фармацевтические компании могут предоставлять безвозмездную спонсорскую помощь для проведения мероприятий пациентских организаций при условии, что первичная цель мероприятия носит образовательный или научный характер, и для иных общеполезных целей, способствующих выполнению миссии такой организации. Когда компании предоставляют финансирование для проведения мероприятия пациентской организации, они обязаны убедиться, что место и условия проведения мероприятия соответствуют требованиям к пределам радушия, установленным в пункте 3.3 настоящего Кодекса. 6.3. ВЗАИМОДЕЙСТВИЕ С АПТЕКАМИ Медицинские представители фармацевтических компаний вправе посещать аптечные организации с целью информирования фармацевтических работников и руководителей аптечных организаций о производимых или реализуемых лекарственных средствах. Фармацевтические компании не вправе организовывать программы, в соответствии с которыми предоставляются имущественные призы фармацевтическим работникам, руководителям аптечных организаций и аптечным организациям за достижение определенных результатов по реализации лекарственных средств. 33 VII. Процедуры и ответственность фармацевтических компаний 7.1. УПОЛНОМОЧЕННОЕ ЛИЦО КОМПАНИИ Компании должны установить и поддерживать соответствующий порядок работы, обеспечивающий соответствие деятельности компании законодательству Республики Беларусь и настоящему Кодексу. В частности, компании должны на постоянной основе осуществлять мониторинг и анализ собственной деятельности по продвижению лекарственных средств и распространяемых в связи с этим материалов. Все рекламные материалы должны проходить процедуру предварительного одобрения уполномоченным сотрудником компании, имеющим соответствующий уровень образования и надлежащую квалификацию (научную или медицинскую). 7.2. ПРОГРАММЫ И ДОКУМЕНТАЦИЯ мероприятий Мероприятия по продвижению лекарственных средств, стимулированию продаж и т.п, должны проводиться в соответствии с утвержденными уполномоченным лицом компании программами, в процессе их проведения должна вестись отражающая ход мероприятий документация. 7.3. ХРАНЕНИЕ ДОКУМЕНТАЦИИ Программы мероприятий (акций), документация по их проведению, образцы рекламных материалов должны храниться в уполномоченном подразделении или у уполномоченного лица компании минимум 6 месяцев после завершения мероприятия, акции или рекламной кампании, если более длительный срок не предусмотрен действующим законодательством. Программы и документация должны представляться контролирующим органам в соответствии с действующим рекламным законодательством, а также в случае рассмотрения споров членами специально созданной группы АМФП. 7.4. ПОВЫШЕНИЕ КВАЛИФИКАЦИИ СОТРУДНИКОВ В целях поддержания высоких стандартов при осуществлении маркетинговой деятельности компании должны придерживаться принципа непрерывного повышения квалификации своих сотрудников в этой сфере. 34 VIII. Поддержание и развитие Кодекса 8.1. НЕОБХОДИМОСТЬ ПОСТОЯННОГО ПОДДЕРЖАНИЯ И РАЗВИТИЯ КОДЕКСА Расширение арсенала методов и средств практики компаний – членов АМФП в условиях развивающегося фармацевтического рынка Республики Беларусь и международных экономических отношений обусловливают необходимость постоянного поддержания и развития содержания Кодекса, чтобы он соответствовал требованиям времени с целью регулирования рекламных и иных методов продвижения лекарственных средств для обеспечения населения эффективными, качественными и безопасными лекарственными средствами. 8.2. АНАЛИЗ ПРАКТИКИ ФАРМАЦЕВТИЧЕСКИХ КОМПАНИЙ И АКТУАЛИЗАЦИЯ КОДЕКСА С целью обеспечения актуальности Кодекса и его приложений, своевременного выявления необходимости внесения изменений и дополнений ­Наблюдательным советом принимается решение о его актуализации. 35 Приложение 1 к Кодексу практики АМФП I. случаи нарушений КОДЕКСА 1.1. В случае возникновения ситуации по вопросам ненадлежащего соб­ людения членами Ассоциации этических норм и правил настоящего Кодекса заинтересованные стороны предпринимают попытки разрешения возникших проблем дружеским путем. 1.2. Если описанные выше действия не привели к достижению решения, удовлетворяющего спорящие стороны, компания-заявитель вправе подать заявление в Секретариат АМФП с целью рассмотрения дела и принятия решения. 1.3. Заявление о нарушении Кодекса компанией – членом АМФП может быть подано как членом АМФП, так и любым иным заинтересованным лицом. II. ПРОЦЕДУРА РАЗРЕШЕНИЯ СПОРОВ 2.1. Заявление направляется в письменном виде в Секретариат АМФП (далее – Секретариат) на имя Исполнительного директора АМФП с подробным описанием обстоятельств, послуживших причиной жалобы. 2.2. Заявление должно содержать: 2.2.1. Сведения о заявителе (имя для физического лица. 2.2.2. Наименование для юридического лица. 2.2.3. Адрес для корреспонденции и контактное лицо для связи. 2.2.4. Наименование компании, в отношении которой имеются подозрения в нарушении Кодекса. 2.2.5. Наименование(я) лекарственного(ых) средства(в), в отношении продвижения которого(ых) имеются подозрения в нарушении Кодекса. 2.2.6. Документы и материалы, свидетельствующие о предполагаемом нарушении, например, рекламные материалы. 2.2.7. Сведения о том, когда имело место предполагаемое нарушение. 2.2.8. Краткое описание сути предполагаемого нарушения, включая ссылки на соответствующие пункты Кодекса. 36 2.3. После получения заявления Секретариат удостоверяется в наличии необходимых документов и материалов на предмет нарушения положений Кодекса. 2.4. Материалы, относящиеся к заявлению (материалы дела), являются конфиденциальными. 2.5. Проверив соблюдение обязательных условий, Секретариат в течение двух рабочих дней со дня получения заявления подтверждает заявителю, что его заявление принято к рассмотрению, а также в течение двух рабочих дней информирует компанию, в отношении которой принято заявление, о поступившем заявлении, документах и материалах. 2.6. Компания, в отношении которой подано заявление, должна в течение 10 рабочих дней ответить на поступившее заявление. Начало данного срока исчисляется с момента извещения компании Секретариатом. 2.7. Ответ подается в письменной форме в Секретариат на имя Исполнительного директора АМФП. 2.7.1. Ответ должен содержать: 2.7.1.1.Признание факта нарушения и информацию о предпринятых шагах по исправлению ситуации. 2.7.1.2. Отказ в признании нарушения, а также четко сформулированные и в соответствующих случаях подтвержденные документально основания для такого отказа. 2.8. Получив ответ, Секретариат должен в течение двух рабочих дней направить его заявителю. В течение пяти рабочих дней заявитель должен рассмотреть полученный ответ и информировать Секретариат о том, считает ли он полученный ответ удовлетворительным, или нет. 2.9. В случае если ответ удовлетворяет заявителя, Секретариат письменно фиксирует факт урегулирования спора, и дело считается закрытым. 2.10. В случае отказа компании признать факт нарушения положений настоящего Кодекса вопрос рассматривается Наблюдательным советом АМФП с приглашением сторон спора. 2.11. Члены Наблюдательного совета знакомятся со всеми материалами, касающимися рассматриваемого случая, и принимают решение, имело место нарушение Кодекса либо нет. Решение выносится в форме признания либо непризнания факта нарушения. Возможно также вынесение рекомендаций по устранению негативных последствий имевшего место нарушения. 2.12. В случае если Наблюдательный совет принимает решение о невозможности рассмотрения дела без запроса дополнительных материалов 37 от сторон спора, Секретариат в течение двух рабочих дней направляет соответствующий запрос. Стороны обязаны представить дополнительные материалы в течение пяти рабочих дней с даты получения запроса. После этого назначается повторное заседание Наблюдательного совета в течение десяти рабочих дней. Решение Наблюдательного совета доводится до сторон в обычном порядке. 2.13. Наблюдательный совет Ассоциации решает, может ли конфликт считаться урегулированным, или должны быть предприняты дополнительные действия. 2.14. Дело может быть закрыто также в случае, если Наблюдательный совет считает полученный ответ удовлетворительным, а заявитель не выразил своего отношения к нему в течение предоставленного для этого вышеуказанного срока. 2.15. Вынесенное решение Наблюдательного совета в течение двух рабочих дней доводится Секретариатом до спорящих сторон в письменном виде. III. САНКЦИИ ЗА НАРУШЕНИЯ КОДЕКСА В случае, когда нарушение Кодекса компанией – членом Ассоциации установлено решением Наблюдательного совета, предусматривается наложение следующих санкций: 3.1. Обязать компанию-нарушителя пройти онлайн-тренинг по Кодексу. 3.2. Обнародовать нарушение, включая наименование компании-нарушителя, в случае серьезного или повторного нарушения на сайте Ассоциации. Данная информация размещается на сайте на трехмесячный период. 3.3. Информировать о нарушении штаб-квартиру компании-нарушителя. 3.4. Рекомендовать Общему собранию АМФП исключить компанию-нарушителя из членов АМФП. 3.5. Любая комбинация вышеуказанных санкций. Решения, вынесенные Наблюдательным советом по каждому конкретному спору, подлежат опубликованию на веб-сайте Ассоциации. Наименование соответствующих компаний не подлежит опубликованию, за исключением случаев, если обнародование наименования компании-нарушителя предусмотрено в качестве санкции за нарушение Кодекса, как описано выше. На каждом общем собрании АМФП Секретариат представляет отчет, в котором указывается количество споров, рассмотренных за период с предыдущего общего собрания, их общий характер и принятые решения. В указанном отчете отражаются наименования компаний, в отношении которых установлены случаи нарушений Кодекса АМФП. 38 для заметок 39 40 42 Adopted in 2006. Present addition is approved by the General Meeting of AIPM 25.06.2014 CODE OF PRACTICE of Association of International Pharmaceutical Manufacturers (AIPM) Edition of 2014 43 The Ministry of Health of the Republic of Belarus, having considered the appeal of the Association of International Pharmaceutical Manufacturers (AIPM) reports that generally approves Provision of marketing practices developed and approved by members of the Association. At the same time, the Ministry of Health offers all missions and representatives of foreign pharmaceutical companies, business entities licensed to medical or pharmaceutical activity, also comply with the provisions of this Code till the development and approval of the state regulatory act in this area. From a letter of the Ministry of Health of the Republic of Belarus 44 Contents PREAMBLE.......................................................................................................43 I. Objective and application area.......................................................................45 II. general statements on promotion of medicinal preparations.........................49 III. peculiarities of interaction with health care specialists, as well as promotion for them and other methods of medicinal preparation promotion...................................................................53 IV. Рeculiarities of advertising ot other methods of promotion of medicinal preparations for population............................................................60 V. Researches of medicinal preparations..........................................................63 VI. Peculiarities of cooperation with legal entities. Charity................................65 VII. Procedures and responsibility of pharmaceutical companies............................................................................68 VIII. Support and development of the code........................................................69 45 The member companies of Association of International Pharmaceutical Manufacturers (hereinafter – AIPM) realize a high social responsibility to the community. On this basis, they accept and undertake to carry out the requirements of the Code of Practice of AIPM (hereinafter – Code), as well as follow it legally and spiritually. The member companies of AIPM will follow the rules of fair competition at implementation of their activity and will not cause the damage to image and economic interests of competitors due to inadequate behavior, including inappropriate advertising and other unfair methods of promotion of medicinal preparations. The member companies of AIPM expend necessary efforts for promotion of the Code for the purpose of its correct understanding and implementation both among employees, and among other representatives of pharmaceutical community of the Republic of Belarus. The member companies of AIPM aim for further development of the Code norms, including making suggestions for its updating, addition and change of relevant requirements. If facts of Code violation are elicited, the company which interests are affected, has the right to repair immediately to the procedure of dispute and violations proceeding, established by the present Code (Appendix 1). Herewith AIPM welcomes cases of independent dispute settlement between the companies. The code is drawn up in Russian and English languages. In case of disputes on interpretation of provisions of the Code, text in Russian has advantage. In case of identification of contradictions between provisions of the present Code and norms of the current legislation of the Republic of Belarus, the norms of the current legislation of the Republic of Belarus have to be applied. When carrying out any programs and events, pharmaceutical companies shall provide their compliance with the norms of the current legislation, including the antitrust law, the legislation on advertizing, on protection of personal data. The present edition of the Code comes into force from the moment of its approval by the General Meeting of AIPM. The member companies of AIPM shall bring the activity, including advertizing and other methods of promotion of medicinal preparations, in line with requirements of the new edition of the Code not later than December 31, 2014. Claims on Code violation concerning newly applied or changed in the new Code edition requirements are accepted after January 1, 2015. 46 PREAMBLE Medicinal preparations represent socially significant group of goods on which properties the population state of health depends. Pharmaceutical industry is responsible for granting to the society as a whole, to medical and pharmaceutical community, in particular, of objective information on the properties of medicinal preparations, considering risk to which public health in the absence of necessary regulation of information provision order can be exposed. Realizing the increased social responsibility imposed on manufacturers of pharmaceutical production, the representatives of pharmaceutical industry in the developed countries in the middle of the previous century started to establish the norms regulating marketing and other activity of the companies in a selfregulation procedure. In 1981 International Federation of Pharmaceutical Manufacturers and Associations, IFPMA, which united 50 national associations at that time, accepted “IFPMA Code of pharmaceutical marketing practices” which observance since 1988 became a membership condition for national associations and, therefore, a requirement for marketing activity of the companies which were their part. Many associations – members of IFPMA developed and adopted their own codes considering national conditions, but however not contradicting the general principles stated in the Code of IFPMA. AIPM is a non-profit organization, a member of IFPMA which is carrying out its activity in the Republic of Belarus. It was founded in 2005. Now AIPM represents interests of 18 leading international pharmaceutical companies at the Belarusian pharmaceutical market. In 2006 the Code of Marketing Practice was adopted. During the deficiency of the detailed special requirements in the Belarusian legislation this document played a positive role in implementation of the norms of civilized promotion of medicinal preparations at the pharmaceutical market of Belarus and was recommended by the Ministry of Health as the standard of the industry document. Further development of the sphere of the medicinal preparations turnover caused expansion of the number of methods and advertizing media in promotion of medicinal preparations that caused the necessity to make corresponding amendments and additions in legislative acts. With the development of the national and international pharmaceutical market, changes and additions of the relevant legislation of the Republic of Belarus, and with the acceptance of a new edition of the Code of IFPMA, a necessity for revision and updating of the text of the existing Code occurred, in its addition 47 with new provisions regulating wider range of activity of pharmaceutical companies. In 2014 for this purpose an updated edition of the Code was developed considering actual methods of promotion and means of communication, including advertizing and information on the Internet, various methods of interaction with experts of health care, patient organizations and others. 48 I. Objective and application area 1.1. objective The purpose of the present Code is establishment of the minimal requirements which pharmaceutical companies – members of AIPM shall follow while carrying out marketing, research, educational, information and charity activity in the territory of the Republic of Belarus. 1.2. basic terms For the purpose of the present Code the following main terms are used: medicinal preparation – a substance or a combination of several substances of natural, synthetic or biotechnological origin, possessing pharmacological activity and applied in a certain medicinal form for prevention and diagnostics of diseases, treatment and medical rehabilitation of patients, pregnancy prevention by internal or external application (The law of the Republic of Belarus “On medicinal preparations”). promotion – activity which is carried out, organized or sponsored by pharmaceutical company in any form with use of various channels of communication (including but not limited to the Internet) and aims to promote attention arresting, formation or demand support, prescription, recommendations, deliveries, dispensing, application, administration and/or consumption of medicinal preparations of this company; health service specialists – workers of health care, medical and pharmaceutical workers who during their professional activity have the right to administrate, recommend, buy, deliver and/or use medicinal preparation. health care organization – a legal entity which is a healthcare institution, medical, pharmaceutical or scientific association or organization (regardless of its organizational and legal form, except the patient organizations), for example, hospital, clinic, fund, university or other educational institutions of medical or pharmaceutical profile, which legal address, place of registration of the legal entity or basic place of activity is situated within the Republic of Belarus, including those which render services by means of one or more specialists of health care; patients organization – a non-profit public organization registered in accordance with the established procedure in the Republic of Belarus, which primary aim of activity is representation of interests and needs of patients, their families and people who are taking care of them; expert council – a group of external experts (for example, health care specialists and/or representatives of patient organizations), competent in corresponding 49 field of knowledge, whose joint meeting is organized by pharmaceutical company to discuss and receive consultations on the subjects defined in advance or the questions concerning clinical or scientific aspects, as well as questions concerning patients’ access to innovative methods of therapy which can’t be considered properly only with the use of internal resources of the company; post-registration clinical (intervention) research – a research of medicinal preparation conducted in the Republic of Belarus, particularly with involvement of a contract research organization, for the purpose of data collection on its efficiency, safety and the tolerance, that is carried out after the state registration of the corresponding medicinal preparation in which the pharmaceutical product under study is administrated according to registration conditions in the country, and specific therapy, diagnostic and monitoring procedures are conducted in strict accordance with the research protocol; post-registration observational (non-intervention) research – is a postregistration research of medicinal preparation conducted in the Republic of Belarus, particularly with involvement of a contract research organization in which a pharmaceutical product and/or a specific therapy is administrated to the patient as part of normal clinical practice according to registration conditions of the corresponding medicinal preparation in the country, the decision on prescription of medicinal preparation is separated from the decision on inclusion of the patient in research, no additional diagnostic, medical or monitoring procedures of the patient are carried out if they stand beyond normal clinical practice of treatment of the corresponding disease; epidemiological survey – research of prevalence, occurrence and intensity of various diseases, frequency of medicinal appointments or medical parameters of health status for identification of the reasons of its development, risk factors and interactions in various population groups; marketing research – a research aimed at collecting, processing and analysis of marketing information for the purpose of studying of current problems at product market for adoption of necessary marketing decisions; medical representative of pharmaceutical company – an employee of pharmaceutical company who has specialized education and directly cooperates with experts of health care in questions concerning clinical use of medicinal preparation; events – meetings, congresses, conferences, symposiums, and other forms of interaction of marketing, scientific or professional character (including, but not limited to visiting of research and development centers and production areas, visiting by medical representatives of health care workers and in 50 medical institutions, as well as trainings, organizational meetings on planning or researchers’ conferences in the field of clinical and non-intervention trials) organized or financed by pharmaceutical company or on behalf of it. 1.3. Application area The present Code includes: medicinal preparation advertising, addressed to public; medicinal preparation advertising, addressed to health care specialists; activity of pharmaceutical companies’ medical representatives; interaction with health care specialists; interaction with patient organizations; post-registration clinical (intervention), post-registration observational (nonintervention) researches; marketing researches; distribution by pharmaceutical companies or organizations representing their interests, of scientific information concerning human health or diseases; conduction of gratis sponsor support; support of continuous medical education; work with requests of patients and health care specialists; actions for promotion of medicinal preparations for health care specialists; sponsorship of scientific and professional events, in which health care specialists take part; use of the Internet network and other digital communication channels for promotion of medicinal preparations; other methods of medicinal preparation promotion. The present Code does not include: medicinal preparations labeling, application data sheet and other information, placed on the product on its package; actual and informational notices or references, for example, in regard to package change, warnings about adverse reactions as a part of general measures on safety monitoring; cases of price formation or other commercial terms medicinal preparations delivery, including trade catalogues and price-lists if they do nor contain specific statements of advertising character about pharmaceutical product; fore-registration and registration clinical researches; 51 II. general statements on promotion of medicinal preparations 2.1. basic principles of promotion Promotion shall favor appropriate use of medicinal preparation by fair data representation about it. Medicinal preparation advertisement shall be made so that the good would be clearly identified as a medicinal preparation. It is not allowed to carry out medicinal preparation promotion under the pretence of post-registration clinical (intervention), observation (non-intervention), epidemiological trials, as well as marketing researches. First of all, such researches shall be conducted with scientific and research purposes and shall not be directed on stimulation of medicinal preparation prescription by health care specialists. Materials sponsored by pharmaceutical company with information about pharmaceutical products and their use irrespective of whether they have advertizing character or not, shall contain an clear instruction on information advertiser/source. Use of “hot lines” for advertizing of medicinal preparation issued on prescription is not allowed. If during the event employees of pharmaceutical company make a presentation for health care specialists or they are authors of publication, they shall be clearly identified as employees of the relevant pharmaceutical company. 2.2. registration status In the territory of the Republic of Belarus only registered medicinal preparations are subject to promotion in the frames of registered indications to application specified in the instruction to a product and/or in clinical protocols and other regulatory legal acts approved by the Ministry of Health of the Republic of Belarus. This condition does not impose limitations on disclosure of information on any medicinal preparation for the purpose of report to the interested party to which this information shall be provided according to the requirements of the legislation. It also does not assume violation of the rights of scientific community for exchange of scientific information concerning unregistered pharmaceutical products provided that reporting such information is not the way to promote medicinal preparation. 52 2.3. standards of advertising information Advertising of medicinal preparation shall meet the requirements of the applicable Belarusian legislation on advertising and competition. Advertizing of medicinal preparation shall contain the objective, reliable, full and actual information based on approved in accordance with the established procedure information on medicinal preparation – instruction on medical application, clinical protocols and labeling, as well as regulations of the Ministry of Health of the Republic of Belarus regulating it. Manufacturers shall seek to the fullest reflection in advertising of medicinal preparation of main characteristics concerning the safety of its application. Advertising information shall be clear, accurate, considered, honest, objective and full enough, based on a present-day assessment of all significant facts and their accurate statement so that the consumer of advertising will be able to make an objective opinion on the therapeutic value of the advertised medicinal preparation. Advertising information shall not mislead by distortion, exaggeration, default of significant information. It is necessary to avoid its ambiguity. Statements on medical effect shall not exaggerate the data containing in application data sheet of medicinal preparation. Advertising information on medicinal preparation shall be proved by the relevant scientific data. Such certificates shall be provided on request of the interested persons. The companies shall treat such requests honestly and provide the objective data according to the received request. Adduction of comparative information on medicinal preparations is allowable only on the basis of the researches and materials made by the third independent party. The requirements established in the articles 3.2 and 4.2 of the present Code are applied on the printing advertising materials. The requirements of the existing Belarusian legislation on advertising are applied on audio and video records. 2.4. use of expert opinion, references to results of researches and quotations When using expert opinions and references to results of researches/examinations in advertising materials it is necessary to specify a source of such data and date of its receipt. When using quotations from medical or scientific literature or someone’s speeches in advertising materials for health care specialists it is necessary to 53 specify a source a quotation/name of the author, date and place of publication/ speech. 2.5. promotion on the internet Promotion of medicinal preparations on the Internet, including by means of placement of banners, active links, information on websites, in blogs, social networks, at forums, conferences and other electronic resources, shall comply with general requirements for advertising and special requirements for advertising of medicinal preparations, established by the legislation of the Republic of Belarus. Particularly, when using the Internet sites connected with medicinal preparation it shall be obvious, from which pharmaceutical company the information proceeds and to whom it is addressed, and its contents shall comply with addressee audience. Advertising of medicinal preparation issued on prescription of the doctor is not allowed on the Internet. Providing information on medicinal preparations which are issued on prescription of the doctor, is allowed within online actions (webinars) for health care specialists, as well as in sections of Internet resources, access to which is open only for health care specialists. Involvement by pharmaceutical company of advertising agencies, as well as other persons for promotion of medicinal preparations on the Internet does not exonerate pharmaceutical company from the responsibility for violation of provisions of the present Code. Operation of the present Code applies to promotion of medicinal preparations in the territory of the Republic of Belarus on any websites, regardless the place of hosting and zone of domain name, as well as location and domestic policies of pharmaceutical company promoting medicines. 2.6. information, relating to human health and diseases Pharmaceutical companies have the right to provide to wide public information on diseases, their prevention and treatment, observing the following rules: Such activity shall not be the subject of the licensed medical activity; provided information shall be reliable, conscientious, ethic, full, as well as it shall not substitute consultation of the doctor or call for self-treatment; 54 such information shall include a reference to the pharmaceutical company from which information proceeds; such information shall not contain names of medicinal preparations which are issued on prescription, as well as package images of such pharmaceutical preparations or its elements, or otherwise to be directed on promotion of medicinal preparation which is issued on prescription; such information shall contain the instruction on the necessity of consultation of health care specialist. 55 III. peculiarities of interaction with health care specialists, as well as promotion for them and other methods of medicinal preparation promotion 3.1. general principles of interaction with health care specialists Interaction of pharmaceutical companies with health care specialists shall be directed on advantage bringing to patients and improvement of medical practice. Granting to health care specialists of new data on medicinal preparations, providing them with information of scientific and educational character, as well as support of scientific and clinical trials shall be the aim of such interaction. Cooperation of pharmaceutical companies with health care specialists shall not lead to a conflict of interests, in particular, between execution of professional duties by health care specialists and their personal interest. Particularly such conflict shall not arise at prescription of medicinal preparation by a medical worker, as well as while recommendation and medicinal preparation sale by pharmaceutical worker. It is not allowed to offer, promise, provide or give remuneration in any form to health care specialists for appointment or recommendation to patients of a certain medicinal preparation, as well as to make agreements with them on appointment or recommendation to patients of any medicinal preparation (except for contracts on carrying out of clinical researches of medicinal preparations). Personal information of health care specialists can be included in databases only granting their consent in due form and observance of other requirements of the legislation in the sphere of protection of personal data. 3.2. printed advertising materials Printing advertising materials, except for described in the subparagraph, shall contain the following minimum of information: Name of medicinal preparation (usually trade name); generally accepted names of active materials (if medicinal preparation no more than three active materials); name and address of pharmaceutical manufacturing companies, as well as organization, representing its interests in the territory of the Republic of Belarus; 56 date of advertisement production; «summary application information», including approved proposed clinical use, if necessary in conjunction with dose and method of application, summary of contra indications, precautionary measures and adverse effects. indication of target audience, for which this advertising material is intended. 3.3. Events The aim of all the events, including visits of medical representatives to health service workers and in healthcare settings shall be provision of information to health care specialists on medicinal preparations and/or maintenance them with information of scientific or educational character in the sphere of health care or pharmaceutics. Companies shall not organize events which are held out of the country of residence of health care specialists if only relevance of it is reasonable from the point of view of logistics and safety. International scientific congresses and symposiums which call together participants from many countries are from this point of view reasonable and allowed. Information distributed among participants of international scientific congresses or symposiums, can concern medicinal preparations which are not registered in the country where the event is held, or registered on other conditions if the following requirements are observed: distribution of such information is allowed by the current legislation of the country conducting the event; the event shall be actually an international scientific event, in which a large number of health care specialists from other countries participate (as speakers or listeners); materials on medicinal preparation which is not registered in the country where the event is held, shall be accompanied by the corresponding clear notice that such medicine is not registered in this country; the materials containing information on application (indications, warnings, etc.) which is approved in other country/countries where this medicinal preparation is registered, shall be accompanied by the statement that registration conditions in countries differ. The event shall be held in a place and conditions promoting achievement of scientific and educational purposes of this event. It is forbidden to use objects which public associate with entertainments, luxury or exclusivity, irrespective of their class. 57 It is recommended to organize events in business centers, educational institutions, hotels and other places intended for carrying out business and educational events. Carrying out event by the company in a place of public access is possible only under the conditions of an isolated room or closing of the place from public access during the time of the event. It is forbidden to use entertaining and sporting events to attract health care specialists to promotion and scientific events. Granting stationery (pens, notebooks, pencils and similar) of insignificant cost for drawing up abstracts, making records, other auxiliary materials on action and means is allowed. Provision of cooling drinks, tea/coffee, snacks and/or hot dishes during the event is allowed provided that it is justified from the point of view of action duration, it is clearly secondary in relation to the purpose of the event and it is provided only to participants of action, but not to the persons accompanying them and provided it is reasonable. Pharmaceutical companies shall not provide or pay for entertainment both within and outside of the event. 3.4. Engaging of health care specialists for rendering services Pharmaceutical companies have the right to engage health care specialists for the purpose of rendering services of scientific and information character, creation of objects of copyright, and also when carrying out clinical trials of medicinal preparations, and to pay them remuneration for rendering these services. While engaging health care specialists for rendering services the following requirements shall be observed: Presence of contract in writing form, describing the content of rendered services and conditions of payment for them; remuneration for the rendered services shall be reasonable and correspond to the existing market cost; presence of reasonable necessity in service; presence of direct connection between criteria of choice of health care specialists and the aim that shall be achieved as the result of rendering services; compliance of number of health care specialists involved with the quantity which is really necessary for achievement of the aim; 58 the fact of conclusion of services contract shall not impose directly or indirectly obligations on health care specialist connected with recommendations and prescription of medicinal preparations. Payments or reimbursements for health care specialists which are directly connected with rendered services, including the expenses connected with journey of health care specialists to the place of rendering services, accommodation and food are allowed. At payment or reimbursement while execution of contracts it is necessary to observe the following requirements: it is forbidden to use hotels or objects which public associate with luxury or an exclusivity, irrespective of their class; food is allowed provided it is reasonable; while the trips of health care specialists which do not exceed four hours during the daytime, it is recommended to get air tickets of economy class; compensation of any expenses of accompanying persons is not allowed. Exceptions shall be proved by objective need and coordinated with the management of the company. 3.5. presents Opportunity and order of granting gifts to health care specialists (including subjects of medical and educational application) shall be defined according to the requirements of the Belarusian legislation. 3.6. basic rules and standards of medical representatives operation Increase of professional level of health care specialists and performance of obligation of the pharmaceutical company to monitor safety of medicinal preparations shall be the purpose of activity of medical representatives of pharmaceutical companies. Medical representatives have the right to participate in congresses, symposiums, conferences, presentations, meetings and other events for health care specialists in medical organizations, including visits, in the order established by this medical organization. Within these actions medical representatives have the right to give health care specialists promotion printing materials, and also information materials, such as partial reprints of certain heads and sections of specialized editions, scientific 59 monographs and reference books, scientific articles, and texts of reports, and other printing materials for increase of professional level of health care specialists. Providing of the above information on CD disks and memory cards which are not intended for personal use is allowed. However any materials, including promotion, shall raise professional level of health care specialists and not pursue exclusively advertising aims. Medical representatives of pharmaceutical companies shall have appropriate education and have necessary knowledge to furnish health care specialists full, objective, reliable and actual information about pharmaceutical products. Pharmaceutical company bears responsibility for maintenance and form of providing information provided by medical representatives to health care specialists. Medical representative is obliged to provide the instruction on medical use of each medicinal preparation on which he informs, and also data on prescription conditions (reference to the category of issued on prescription or without prescription of the doctor, issued for reimbursement categories and so forth) of the medicinal preparation and its presence in pharmacies at the request of health care specialist. Medical representative is obliged to observe professional ethics in relation to consumers, health care specialists, the company, whose interests he (she) represents, and also to representatives of the competing companies. Medical representatives are obliged to bring information on practical use of medicinal preparation of the company, including adverse reactions received from health care specialists to the head of the relevant division of the company. 3.7. samples Pharmaceutical companies have no right to give directly health care specialists samples of medicinal preparations both for the subsequent transfer to patients, and for private use (including samples for demonstration (demo packs) and empty secondary and primary packing). 3.8. expert council The aim of Expert Council is discussion and consultations of external experts in preliminary defined scientific question for solution of which the company has not enough experience or lacks expert review and if it is impossible to clarify this question by other methods. 60 Expert Councils cannot be used as an instrument of distribution of information or for promotion of medicinal preparation while the information received on Expert Council can be used as information for the solution of marketing questions (for example, information for introduction into marketing plans or advertising meetings). Pharmaceutical companies have the right to pay to experts – health care specialists, remuneration for their work in Expert Council (including compensation of their expenses connected with participation in Expert Council) only provided that activity of such experts within Expert Council has scientific character. While reimbursement the requirements of the article 3.4 of the present Code shall be observed. Organization of Expert Council is possible only with reasonable scientific need and shall not be aimed at financing of actions of professional communities. The choice of members of Expert Council shall be based only on their professional competence and qualification and shall not be somehow connected with last, current or possible future appointments or recommendations of medicinal preparations of the company. Workers of the sales departments shall not have influence on a choice of experts and work of Expert Council. The number of health care specialists involved shall correspond to the quantity which is really needed for achievement of the goal. The total number of employees of the company visiting the meeting of Expert Council, shall not exceed one quarter of number of the independent third-party experts participating in meeting. However employees have no right to use participation in work of Expert Council for promotion of medicinal preparations of the company. 3.9. work with requests of medical information Requests of medical information can be received from health care specialists and patients. The company shall show consideration for each request. Each request shall be registered in the order established by the legislation on the addresses of citizens and legal entities, and it is necessary to give the answer to it. The information furnished to health care specialists on request, shall correspond to the Belarusian legislation, and also consider provisions of the approved instruction on application of medicinal preparations and to the present Code. The reply to the request of health care specialist shall not serve the purposes of promotion of medicinal preparation. It shall be limited only to the answer directly to the question asked. 61 Information on medicinal preparations of other companies shall be objective. All the answers shall be represented in popular and ethical form. The staff of pharmaceutical company has no right to initiate discussion with health care specialists and other third parties of unregistered medicinal preparation and/or unregistered indications to its application. Information on unregistered medicinal preparations and/or unregistered indications is provided only to health care specialists only on request sent to the pharmaceutical company. Answers to all requests from health care specialists are provided by the service of medical information or any other authorized personnel of medical/regulatory department for ensuring appropriate quality and objectivity of information. All phone calls are received and registered by the personnel with following transfer of information about requests in medical/regulatory department. Employees of sales and marketing departments can answer only the questions received during interaction with health care specialists within the approved instruction on use of medicinal preparation. Employees of sales and marketing departments have to redirect the received questions which are beyond the scope of information on medicinal preparation approved in accordance with the established procedure for the answer in medical/regulatory department. It is necessary to provide comprehensive scientifically based information concerning the question asked in the answer to health care specialist. In written answers all the statements and the facts shall be confirmed with corresponding links with indication of the name of the author, the full name of the article or monograph, the publication place (traditional abbreviations are allowed), years of the edition, the number of volume, edition and page. Personal information of health care specialists and other persons, absent in open access, can be edited in databases of pharmaceutical companies only in the presence of their consent in the form established by the law and under observance of other requirements of the legislation in the sphere of protection of personal information. 62 IV. Рeculiarities of advertising ot other methods of promotion of medicinal preparations for population 4.1. general requirements Public advertising of medicinal preparations referred to category of issued on prescription of the doctor is not allowed. Mention of the fact of inclusion of advertized medicinal preparation in any of the lists of medicinal preparations intended for certain categories of population, expenses on which are refunded or donated by the state, is forbidden in public advertising. It is recommended to avoid in public advertising of medicinal preparations special medical terms which can be misunderstood by or mislead consumers of advertising. 4.2. printed advertising materials Printed advertising materials, except for reminder advertising, shall contain the following minimum of information: Name of medicinal preparation (usually trade name), as well as international unpatented name, of the product contains only one active agent; information, necessary for the right administration of medicinal preparation (indication; information on presence of contra indications and adverse reactions; precautionary measures necessary for safe administration); name and address of pharmaceutical company or organization, representing its interest in the territory of the Republic of Belarus; warning about presence of contra indications to administration or use of medicinal preparation, necessity of inspection of application data sheet or consultation with specialists. Minimum for reminder advertisement shall include: Name of medicinal preparation; warning about presence of contra indications to its administration or use; necessity of inspection of application data sheet or consultation with specialists. 63 4.3. restrictions for content of advertising materials for population Advertisement of medicinal preparation for population shall not: Make impression of irrelevance of consultation with the doctor; contain information which does not correspond to the instruction on medical use; guarantee positive effect, efficiency or safety of medicinal preparation or absence of undesirable effects; contain references to concrete cases of treatment from diseases, improvements of state of health as a result of use of medicinal preparation; contain expression of gratitude by individuals in connection with medicine use; approach to the under age; create the idea of advantages of medicinal preparation by the reference to the fact of carrying out researches and the tests obligatory for the state registration; make impression of need in application of medicinal preparation by healthy people, except for advertising of prevention medicinal preparations; contain statements or assumptions that safety or efficiency of medicinal product is caused by its natural origin; represent medicinal preparation as biologically active supplement, cosmetic or other goods which is not medicinal preparation; contain descriptions, images of illness description which can provoke selfstatement of the wrong diagnosis; contain statements or assumptions that consumers of advertizing have one or another state which require to use medicinal preparation, or the statement making impression about the need of its application in healthy person; instructions on possibility of use of any forms of material compensation in case of purchase of medicinal preparation; contain images and statements of medical and pharmaceutical workers; contain recommendations of scientific, medical, pharmaceutical workers or persons who do not relate these categories, but in connection with their popularity can encourage use of medicinal preparation; contain recommendations of the government bodies and other organizations used for strengthening of advertising effect; 64 contain inappropriate, causing concerns or disorienting terms, picturesque images of changes in human organism, caused by a disease, a trauma or an action of pharmaceutical product on a human body or parts of body; contain other information forbidden by the current legislation of the Republic of Belarus. 4.4. other methods of promotion of medicinal preparations for population Promotion of medicinal preparations by means of TV shops, as well as sale of medicinal preparations with the use of the Internet is not allowed. Use of medicines as prizes and encouragement is not allowed. Distribution in advertising purposes of free samples of medicines to the population, including carrying out tastings and tests of medicinal products is not allowed. 4.5. work with requests of medical information from patients When patient applies to pharmaceutical company for the information it is necessary to satisfy such request. Such interaction shall not be used for advertising and promotion of medicinal preparation, including after its conduction, for example by publication of correspondence in the mass media. Information provided to the patient in response to request, shall correspond completely to the approved application data sheet of medicinal product. The answer shall be exact, correct and not disorienting. In case of the questions connected, for example, with establishing diagnosis, maintaining or treatment tactics of a disease, any representative of the company (including the employee of medical department) is obliged to recommend him to consult a medical specialist (doctor) or turn to the service providing emergency medical care. 65 V. Researches of medicinal preparations 5.1. post-registration researches Post-registration clinical researches/tests and epidemiological researches (hereinafter – post-registration researches) shall correspond to requirements of the legislation of the Republic of Belarus, as well as the provisions established by the present Code. Post-registration researches shall have justification and scientific aim/aims reflected in the protocol of research. Control of post-registration researches is conducted by and is under the responsibility of medical department or corresponding medical functional divisions/employees of pharmaceutical company. The choice of researchers shall be based only on their professional qualification and clinical experience. The data received during post-registration researches shall be statistically processed and analyzed. Results of such researches on questions of efficiency and safety of medicinal preparations shall be available to health care specialists. When carrying out post-registration researches the laws, rules and requirements concerning confidentiality of personal information (including collecting, processing and use of personal information) shall be observed. The protocol of post-registration research shall be approved in medical department or responsible medical functional divisions/workers. The medical department (the corresponding medical functional divisions/workers) shall control the course of post-registration researches. Documentation of post-registration researches (the protocol, the individual registration card, the information patient sheet, etc.) shall pass obligatory ethical examination. To the extent that it is admissible, employees of other departments of the company can participate in the solution of administrative tasks (in particular, in transfer of documentation of post-registration researches from medical department to research centers/researchers and back). This participation shall be carried out under control of medical department which shall provide appropriate training of staff of other departments of pharmaceutical company. Participation of a health care specialist in post-registration research shall not be an inducement to recommendation/administration, acquisition, sale and/or use of any concrete medicinal preparation. 66 Remuneration provided for post-registration researches is paid on the basis of an official contract with medical and preventive institution on the basis of which the research is conducted, shall be reasonable and reflect the current market cost of the performed work. It is forbidden to carry out post-registration researches under the pretence of market researches. If distinctions between marketing researches and postregistration researches are not accurate – the aims of marketing researches are subject to check by medical specialists of pharmaceutical company. 5.2. marketing researches Marketing researches conducted directly by pharmaceutical companies or by pharmaceutical companies with involvement of marketing agencies, are possible only if the requirements of the current legislation are observed. Herewith pharmaceutical companies and/or involved agencies have no right to pay remuneration to health care specialists for their participation in market research. Cases of carrying out market researches requiring special scientific knowledge and considerable labor costs from the health care specialist can be an exception provided that: Marketing researches are held with participation of independent agencies; it is not reported to health care specialist and it is not evident from materials of research, which pharmaceutical company is the customer/sponsor of the research; pharmaceutical company does not participate in selection and has no access to identification data of health care specialists, taking part in market research. It is forbidden to use marketing researches: with the aim to promote or sale a medicinal preparation or to manage the opinion or behavior of participants of research. For this reason it is necessary to avoid a mention of the trade name of medicinal preparation if only it is not required by the research objective; to collect personal data of patients; with the aim of further research of efficiency or safety of medicinal preparation; for prior-registration promotion of medicinal preparation or indications for its administration that are subject to registration; to collect confidential information about competitor companies; with the aim to discredit medicinal preparations of competitor companies. 67 VI. Peculiarities of cooperation with legal entities. Charity 6.1. cooperation with non-profit organizations Pharmaceutical companies have the right to carry out gratis sponsor aid to non-profit organizations with socially useful purposes in compliance with the standards of the Belarusian legislation. Particularly gratis sponsor aid can be carried out for support of medical education, development of scientific activity in health care, finally called to increase the quality of medical care to patients. Charity under no circumstances can be directly or indirectly subordinated from administration or acquisition of medicinal preparations of the company. It is forbidden to provide gratis sponsor aid in the form of cash money. Granting medicinal preparations as gratis sponsor aid to health care organizations is allowed provided that such help does not pursue commercial aims. The company is obliged to inform the recipient of the help about the remaining shelf life of medicinal preparation. Gratis sponsor aid can be provided only on the basis of the letter of inquiry of non-profit organization and the written contract on providing gratis sponsor aid. 6.2. cooperation with patient organization All interactions with patient organizations shall have ethical character. It is allowed for pharmaceutical companies to cooperate with patient organizations to solve the following tasks: studying of patients’ opinion about influence of the disease on quality of patients’ life and opinions of the persons who are taking care of them, for the purpose of optimization of the program of clinical trials of medicinal preparations and acceleration of development of those which meet the needs of patients best of all; implementation of information support of patient associations by replies to the requests according to the rules provided by the article 4.5 of the present Code for replies to the requests of patients; creation of registers of patients providing strict observance of the legislation on protection of personal data and patient confidentiality; 68 conducting of a campaign on informing of wide public about the disease; cooperation on organization of granting medical organizations unregistered medicinal preparation for medical treatment of specific patients according to vital indications; rendering gratis sponsor aid; other cases, without prejudice to the legislation. Pharmaceutical company cannot be the only pharmaceutical company – the founder of the patient organization of patients. When pharmaceutical company cooperates with patient organization the fact and the nature of such cooperation shall be accurately disclosed by the pharmaceutical company in available sources. Herewith pharmaceutical company can be the only source of financing of the charitable and/or social project of patient organization when obtaining the corresponding letter of inquiry from the patient organization for implementation of the programs of such organization directed on prevention and protection of public health, promotion of healthy lifestyle, help for socially unprotected segments of population if such financing is not referred directly or indirectly on stimulation of adoption of any decisions by the patient organization in the process of carrying out of its authorized activity in favor of pharmaceutical company or its production. In any case, such pharmaceutical company shall not limit the rights of other pharmaceutical companies for financing of similar projects of patient organization by their wish. Any interactions of pharmaceutical companies with patient organizations shall be clearly documented. Pharmaceutical companies can provide gratis sponsor aid for carrying out the events of patient organizations provided that the primary purpose of action has educational or scientific character, and for other all-useful purposes promoting the mission of such organization. When the companies provide financing for carrying out the events of patient organization, they are obliged to be convinced that the place and conditions of carrying out event conform to requirements for the limits of hospitality set in article 3.3 of the present Code. 6.3. cooperation with pharmacies Medical representatives of pharmaceutical companies have the right to visit pharmacy organizations for the purpose of informing of pharmaceutical workers and managers of pharmacy organizations about manufactured and marketable medicinal preparations. 69 Pharmaceutical companies have no right to organize programs, in accordance with which material prizes are offered to pharmaceutical workers, managers of pharmacy organizations and pharmacy organizations for achievement of certain results in sale of medicinal preparation. 70 VII. Procedures and responsibility of pharmaceutical companies 7.1. company authorized person Companies shall establish and maintain the corresponding operating procedure providing compliance of the activity of the company to the legislation of the Republic of Belarus and the present Code. In particular, the companies shall permanently carry out monitoring and analysis of their own activity on promotion of medicinal preparations and the materials distributes in this regard. All the advertising materials shall pass the procedure of preliminary approval by the authorized employee of the company having an appropriate level of education and appropriate qualification (scientific or medical). 7.2. event programs and documentation The events on promotion of medicinal preparations, stimulation of sales, etc., shall be carried out according to the programs approved by an authorized official of the company, while its carrying out the documentation reflecting the course of events shall be made. 7.3. record maintenance Programs of events (actions), documentation on their carrying out, samples of advertising materials shall be stored in an authorized division or by an authorized official of the company for at least 6 months after event, action or an advertizing campaign close if longer term is not specified by the current legislation. Programs and documentation shall be shown to the controlling bodies according to the current advertising legislation, as well as in case of consideration of disputes by the members of specially created AIPM group. 7.4. employee training and education To maintain the high standards while implementation of marketing activity, the companies shall follow the principle of continuous advanced training of the employees in this sphere. 71 VIII. Support and development of the code 8.1 the necessity of permanent support and development of the code Extension of the number of methods and means of practice of AIPM member companies under the conditions of the developing pharmaceutical market of the Republic of Belarus and the international economic relations cause the need of permanent maintenance and development of the contents of the Code, for it to conform to current requirements for the purpose of regulation of advertising and other methods of promotion of medicinal preparations for providing the population with effective, qualitative and safe medicinal preparations. 8.2 analyses of practice of pharmaceutical companies and code updating For the purpose of ensuring the relevancy of the Code and its appendices, timely detection of the need in amendments and additions by the Supervisory Council the decision on its updating is made. 72 appendix 1 to the code of practice of aipm I. cases of code violation 1.1. In case of situation occurrence concerning inadequate observance by the members of Association of ethical standards and rules of the present Code the interested parties make attempts to solve the arisen problems in a friendly way. 1.2. If the actions described above did not lead to reaching the decision satisfying the arguing parties, the applicant company has the right to submit the application to the Front Office of AIPM for the purpose of consideration of the case and decision-making. 1.3. The application about Code violation by the AIPM member company can be made both by the member of AIPM, and by any other interested person. II. procedure of conflict resolution 2.1. The application is addressed in written form to the Front Office of AIPM (hereinafter – Front Office) to the Chief Executive Officer of AIPM with a detailed description of the circumstances, which served as the reason of the claim. 2.2. The application shall contain: 2.2.1. Applicant’s details (the name for an individual); 2.2.2. The name of the legal entity; 2.2.3. The correspondence address and contact person for communication); 2.2.4. The name of the company, in regard to which the suspicions of Code violation take place; 2.2.5. The name(s) of medicinal product(s), in regard to which promotion the suspicions of Code violation take place; 2.2.6. The documents and materials, which bear evidence of the suspicions of violation, for example, advertising materials; 2.2.7. The information on the period when the suspected violation took place; 2.2.8. A short description of the main point of suspected violation, including references to the appropriate articles of the Code. 2.3. After the statement receipt the Front office makes sure in presence of necessary documents and materials, regarding violation of provisions of the Code. 73 2.4. The materials concerning the application (case records), are confidential. 2.5. After compliance verification of compulsory conditions, the Front Office within two working days from the date of the application receipt confirms to the applicant that his application is accepted to consideration, as well as within two working days he informs the company concerning which the application has been granted about the received application, documents and materials. 2.6. The company concerning which the application is submitted, shall respond within 10 working days to the received application. The beginning of this term is starts from the moment of the company notification by the Front Office. 2.7. The response is made in writing to the Front Office addressing the Chief Executive Officer of AIPM. 2.7.1. The response shall contain: 2.7.1.1. Recognition of the fact of violation and information on the steps taken to improve the situation; 2.7.1.2. Refusal in violation recognition, as well as accurately formulated and in appropriate cases approved with the documents basis of such refusal. 2.8. After the receipt of the response, the Front Office shall send it within two working days to the applicant. Within five working days the applicant shall consider the received response and inform the Front Office, whether he considers the received response satisfactory or not. 2.9. If the response satisfies the applicant, the Front Office fixes in writing the fact of dispute settlement, and the case is considered closed 2.10. In case of refusal of the companies to admit the fact of violation of provisions of the present Code the question is considered by the Supervisory Council of AIPM with invitation of the parties of dispute. 2.11. The members of the Supervisory Council get acquainted with all the materials concerning the case under consideration, and make the decision, whether violation of the Code took place or not. The decision is rendered in the form of recognition or non-recognition of the fact of violation. It is also possible to render recommendations about elimination of negative consequences of violation that took place. 2.12. If the Supervisory Council makes the decision on impossibility of consideration of the case without the request of additional materials from the dispute Parties, the Front Office within two working days directs the corresponding request. The parties are obliged to present additional materials within five working days from the date of request receipt. After that, the second 74 meeting of the Supervisory Council within ten working days is appointed. The decision of the Supervisory Council is carried to the Parties according to the normal procedure. 2.13. The Supervisory Council of Association decides if the conflict can be considered settled or additional actions shall be undertaken. 2.14. The case shall be closed also in case the Supervisory Council considers the received answer satisfactory, and the applicant does not express the attitude towards him during the abovementioned term provided for this. 2.15. The decision rendered by the Supervisory Council within two working days is carried by the Front Office to the arguing parties in writing. III. SANCTIONS FOR CODE VIOLATION In case, when Code violation by the Association member company is established by the decision of Supervisory Council, a provision for imposing of the following sanctions is made: 3.1. To oblige the violator company pass online-training for the Code; 3.2. To publish violation, including the violator company name, in case of serious or repeated violation on the Association site. This information shall be published on the website for a three-months period. 3.3. To inform the violator company headquarters about violation; 3.4. To recommend to the General Meeting of AIPM to exclude the violator company from the members of AIPM. 3.5. Any combination of abovementioned sanctions. The decisions made by the Supervisory Council on each concrete dispute are subject to publication on the website of the Association. The name of the relevant companies is not subject to publication, except for cases when publication of the name of the violator company is specified as a sanction for violation of the Code as it is described above. At each general meeting of AIPM the Front Office represents the report in which the number of disputes studied during the previous General Meeting, their general character and the decisions made are specified. Names of the companies in regard to which the cases of violations of the Code of AIPM are established, are reflected in the specified report. 75 for notes 76