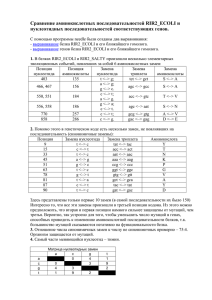
1 004330 2 ,
реклама

1 Область техники, к которой относится изобретение Настоящее изобретение относится к профилактической и/или лечебной вакцине против ВИЧ, против СПИДа и против опухолей и синдромов, связанных с ВИЧ-инфекцией, в которой в качестве иммуногенов используют белки дикого типа или мутированные белки, пептиды или ДНК Tat ВИЧ, одни или в сочетании с белками, пептидами или ДНК других вирусных продуктов (Nef, Rev, Gag) или с цитокинами, потенциирующими антивирусную иммунную реакцию. Изобретение также относится к иммунизации Tat или его производными путем использования аутологичных дендритных клеток, посредством иммунизации через слизистые оболочки или иммунизации ex-vivo периферических клеток крови, размноженных посредством костимуляции с моноклональными антителами против CD3 и против CD28, и к доставке вышеуказанных иммуногенов с использованием эритроцитов или наночастиц. Уровень техники СПИД (синдром приобретенного иммунодефицита) вызывается ВИЧ (вирусом иммунодефицита человека) и характеризуется иммунодефицитом, опухолями, такими как карцинома Капоши (KS) и В-клеточные лимфомы, инфекциями, вызванными условно-патогенными микроорганизмами, и расстройствами центральной нервной системы. Так как СПИД широко распространен в мире и приводит к высокой смертности, одной из наиболее важных задач общественного здравоохранения является разработка профилактической и/или лечебной вакцины против ВИЧ или СПИДа. В большинстве прежних и нынешних разработок в качестве иммуногенов используются оболочка вируса или его субъединицы, но с неудовлетворительными результатами из-за высокой изменчивости оболочки вируса (ссылки 162, 112; в данном описании в круглых скобках указываются разные ссылки, где полнее описывается уровень техники, к которой относится настоящее изобретение; полные библиографические сведения для каждой ссылки приводятся в конце описания непосредственно перед формулой изобретения). Поэтому в качестве альтернативы стерильному иммунитету распространено мнение, что он может быть достаточным для блокирования развития инфекции и начала заболевания. Более того, иммуннозащитные реакции можно получить с использованием в качестве иммуногенов участков ДНК ВИЧ (ссылки 91, 17). Исходя из опубликованных экспериментальных данных, изобретатель полагает, что необходимо получить вакцину, в которой используются иные, чем env, вирусные продукты. В частности, вирусные белки, используемые в качестве иммуногенов, должны быть более консервативными среди изолятов ВИЧ, способными индуцировать эф- 004330 2 фективную иммунную реакцию, как гуморальную, так и клеточную, и должны обладать жизненной для вируса функцией. Такие продукты необходимо опробовать на модели приматов, не являющихся людьми (поскольку их иммунная система наиболее схожа с иммунной системой человека по сравнению с системами филогенетически более далеких животных), и у которых после заражения вирусом может развиваться СПИД. Белок Tat ВИЧ-1 обладает всеми характеристиками, чтобы быть хорошим иммуногеном для целей разработки вакцины: он консервативен, является иммуногенным и важен на ранних стадиях заражения вирусом. Более того, Tat играет ключевую роль не только в репликации вируса, передаче и развитии инфекции, но также в возникновении и развитии связанных со СПИДом опухолей, например, KS, которая является опухолью, наиболее часто связанной со СПИДом, и других синдромов и симптомов, развивающихся после заражения ВИЧ. Tat представляет собой белок в 86-102 аминокислоты, в зависимости от штамма вируса, кодированный двумя экзонами. Tat продуцируется вскоре после заражения, локализуется в ядре и трансактивирует экспрессию всех генов вируса посредством взаимодействия с "чувствительным к Tat элементом" (TAR), присутствующим в LTR (ссылка 25). Tat также играет роль в вирулентности ВИЧ (ссылки 63, 113, 60, 84). Продукт первого экзона (аминокислоты 172) является консервативным среди различных вирусных изолятов (ссылка 112) и достаточным для трансактивации продуктов ВИЧ-1 (ссылка 25). Он содержит 4 домена. Кислотный домен (аминокислоты 1-21) важен для взаимодействия Tat с клеточными белками; богатая цистеином область (аминокислоты 22-37) представляет трансактивирующий домен. Эта область наиболее консервативна среди первичных изолятов (ссылка 108) цистеина 22, причем глицин устраняет способность Tat трансактивировать LTR ВИЧ (ссылка 166), коровый домен (аминокислоты 38-48) также консервативен и важен для функционирования. Замена лизина 41 на треонин инактивирует трансактивирующую активность Tat в отношении LTR ВИЧ (ссылка 70); основной домен (аминокислоты 49-57), богатый аргинином и лизином, необходим для ядерной локализации Tat и специфически связывает его РНК-мишень (TAR) (ссылка 25). Кроме того, основная область ответственна за связывание внеклеточного Tat с гепарином и с гепарансульфат-протеогликанами (HSPG) (ссылка 26). Мутации в основной области устраняют такие взаимодействия. Карбоксиконцевая часть Tat не является необходимой для трансактивации LTR, но содержит последовательность аргининглицин-аспарагиновая кислота (RGD), обычно присутствующую в белках внеклеточного матрикса (ЕСМ), ответственную за связывание Tat с 3 интегриновыми рецепторами α5β1 и αvβ3. Эти взаимодействия опосредуют действие Tat на связанные со СПИДом опухоли и на иммунную, сосудистую и нервную системы (ссылки 11, 42, 170, 25). Во время острого заражения Т-клеток ВИЧ-1 или после трансфекции гена tat в клетки COS-1 белок Tat секретируется в остутствие гибели клеток во внеклеточной окружающей среде (ссылки 40, 41, 25). Секреция из инфицированных клеток также происходит in vivo, так как внеклеточный Tat присутствует в сыворотке инфицированных субъектов (ссылка 164) и в СПИД-KS повреждениях (ссылка 42). После секреции часть белка остается в растворимой форме, а часть связывается с HSPG ECM. Tat, связанный с HSPG, можно извлечь в растворимой форме посредством добавления гепарина. Связывание с гепарином происходит благодаря основной области Tat; оно предотвращает действие внеклеточного Tat и защищает белок от окисления. Эта особенность использована авторами изобретения для получения чистого Tat с высокой биологической активностью (ссылка 26). Внеклеточный Tat может быть интернализован клетками, может мигрировать в ядра и трансактивировать экспрессию гена вируса (ссылки 49, 98, 100, 41). Интернализация Tat происходит посредством эндоцитоза, опосредованного связыванием RGD-области Tat с α5β1 и αvβ3 (ссылка 10, 42, Ensoli et al., неопубликованные данные), и/или основной областью, связывающейся с HSPG. Tat может активировать репликацию вируса и передачу вируса также через косвенные механизмы, включающие модуляцию экспрессии клеточных генов, играющих ключевую роль в регуляции выживания клеток, и экспрессии цитокинов области воспаления (IС) с воздействием на репликацию вируса (ссылка 25). Помимо своего значения при репликации вируса, Tat играет важную роль в патогенезе СПИДа. Tat способен модулировать выживание и пролиферацию инфицированных и неинфицированных клеток, вызывая активацию или подавление цитокинов, таких как IL-2 (ссылки 123, 163, 31), или генов, играющих ключевую роль в клеточном цикле (ссылки 145, 169, 164, 173). Анти- и проапоптозное действие Tat зависит от ряда факторов, таких как тип клетки, факта экспрессируется ли Tat клеткой или добавляется к клетке, и от его концентрации (ссылки 40, 41, 171). Tat является фактором, ответственным за усиленную частоту и агрессивность KS у инфицированных ВИЧ-1 субъектов (ссылки 43, 33). KS представляет собой опухоль сосудистого происхождения, и она является наиболее частой неоплазией у ВИЧ-инфицированных индивидуумов. Tat индуцирует клетки KS и эндотелиальные клетки, активированные IС, к миграции, экспрессии коллагеназы типа IV, внедрению 004330 4 ЕСМ и пролиферации, причем такие механизмы необходимы для ангиогенеза и инвазии опухоли (ссылки 40, 41, 42, 2, 46). Такое действие Tat индуцируется IС, так как они стимулируют экспрессию Tat-рецепторов, α5β1 и αvβ3 (ссылка 10). Tat имитирует действие белков ЕСМ, таких как фибронектин и витронектин, и как область RGD, так и основная область необходимы для действия внеклеточного Tat на клетки KS, на ангиогенез и на развитие KS. Способность внеклеточного Tat к связыванию in vivo своих рецепторов в СПИД-KS повреждениях (ссылка 40) подтверждает мысль, что Tat вовлекается в появление и поддержание связанной со СПИДом KS. Более того, у мышей, трансгенных для гена tat, развитие KS или других фенотипов зависит от уровня экспрессии трансгена (ссылки 160, 34). Предполагается, что Tat играет некую роль в явлении гиперпролиферации и в патогенезе Влимфом, часто наблюдаемых у сероположительных субъектов и у tat-трансгенных мышей (ссылка 157), через механизмы, включающие усиление экспрессии bcl-2 и цитокинов (ссылка 122). Другие свидетельства подтверждают возможную роль Tat в онкогенезе (ссылка 72). Tat также может активировать экспрессию вирусных промоторов, таких как промоторы вируса герпеса и других вирусов, которые реакционноспособны в организмах индивидуумов со СПИДом, промотируя начало и развитие инфекций, вызванных условно-патогенными микроорганизмами (ссылка 25). Оказывается, что Tat также способен проявлять нейротоксическое действие как непосредственно (через основную и RGD-области), так и косвенно через индукцию IС, обладающих токсическим действием на нейроны центральной нервной системы или на гематоэнцефалический барьер (ссылка 25). С учетом иммунной реакции на Tat, в некоторых исследованиях предполагается, что антитела против Tat играют защитную роль в регуляции развития болезни in vivo (ссылки 130, 135, 136, 149, 127). Кроме того, антитела против Tat in vitro не только подавляют интернализацию, трансцеллюлярную активацию Tat и заражение вирусом (ссылки 41, 127), но также ингибируют пролиферацию и индуцированную Tat миграцию клеток KS и образование KS-подобных повреждений у мышей (ссылки 40, 41, 42). Наконец, результаты, полученные предварительно авторами изобретения, показывают, что антитела против Tat отсутствуют у субъектов со СПИД-KS, что наводит на мысль, что у таких субъектов не может происходить блокировка активности внеклеточного Tat. Развитие клеточноопосредованной реакции против Tat в начальной фазе заражения важно для регуляции самого заражения (ссылки 161, 133, 59), и существует обратная зависимость между наличием специфических CTL 5 против Tat и развитием болезни (ссылка 156). Такие результаты получены при исследованиях на макаках, инокулированных SIVmac (ссылки 91, 158). Кроме того, данные, полученные в последнее время на мышах разных видов, которым Tat инокулирован или в виде плазмиды, или в виде белка, показывают, что можно индуцировать как гуморальную, так и клеточную реакцию на белок (ссылка 61). Однако среди некоторых видов мышей наблюдается вариабельность, и такие результаты с теми же иммуногенами не воспроизводятся на приматах, не являющихся человеком (ссылка 124). Отсутствие воспроизводимости на такой приматной модели результатов экспериментов с вакциной, выполненных на мышах, часто и вероятно происходит из-за различий в иммунных системах этих двух видов, что может вызвать различные иммунные реакции на один и тот же иммуноген, как показано для белка ВИЧ-Env. Таким образом, возможные вакцины для людей должны проверяться на приматах, а не только на низших видах. Изобретатель полагает, что другие вирусные белки или их части можно соединять с Tat для усиления специфической иммунной реакции против ВИЧ, и что такое соединение также будет благоприятным при вакцинации против появления опухолей и других патологий и симптомов, связанных с ВИЧ-инфекцией. Такими продуктами являются белки ВИЧ Nef, Rev и Gag. Nef является еще одним вирусным регуляторным белком, важным для развития болезни (ссылки 3, 48, 58). Nef продуцируется сразу же после заражения, и он секретируется во внеклеточную среду (Ensoli, неопубликованные данные). В системе SIVmac/мака-ка присутствие Nef коррелирует с высокой репликацией вируса и с развитием СПИДа (ссылка 71). Nef более вариабелен, чем Tat (ссылка 112). Nef является иммуногенным белком (ссылки 53, 32, 35, 151) и способен индуцировать CTL (ссылки 16, 36). В частности, идентифицирована иммунодоминантная область Nef (область 73-144), распознаваемая CTL у большинства ВИЧинфицированных пациентов. Rev является регуляторным вирусным белком, продуцируемым во время инфекции (ссылки 51, 119), и секретируемым во внеклеточную среду (Ensoli, неопубликованные данные). Rev важен для репликации ВИЧ и для развития болезни, и он кодируется двумя экзонами, частично перекрывающими области, кодирующие Tat. Rev является ядерным белком (ссылка 44), необходимым для экспрессии вирусных матричных РНК, кодирующих поздние белки (ссылка 97). Rev является высококонсервативным белком среди различных вирусных изолятов ВИЧ-1 (ссылка 111), и он является иммуногенным. Действительно, этот белок индуцирует продуцирование специфических антител, направленных против двух функциональных доменов бел- 004330 6 ка (ссылка 120) в процессе естественного заражения у людей (ссылка 131) и после инокуляции мышам (ссылка 61). Оказывается, что пониженное содержание антител против Rev в сыворотках инфицированных индивидуумов коррелирует с развитием СПИДа (ссылка 131). Rev может индуцировать CTL как у человека, так и у обезьяны (ссылки 156, 158), и сообщается, что специфическая реакция CTL против Rev, в начальный момент заражения, коррелирует в обратной зависимости с развитием заболевания (ссылки 156, 158). Другой мишенью вируса является ген gag, который экспрессируется позже во время заражения и кодирует группу высоко иммуногенных структурных белков капсиды (ссылки 18, 147). Титры антител против Gag высоки и стабильны во время асимптоматической фазы заражения и достигают очень низких значений, когда инфекция развивается до полного СПИДа, в сочетании с падением числа (CD4+)-лимфоцитов и присутствием вируса в периферической крови (ссылки 174, 73). Белки Gag индуцируют раннюю активность CTL во время заражения как у людей, так и у приматов (ссылки 103, 168), и их присутствие существенно соотносится с регуляцией начальной виремии и с развитием болезни (ссылки 175, 6, 134, 167, 92). Наконец, белки р17 и р24 содержат иммунодоминантные эпитопы, которые сохраняются в различных изолятах ВИЧ-1 и ВИЧ-2 и распознаются CTL (ссылки 89, 19, 114, 155, 115). Изобретатель полагает, что цитокины или их части, такие как IL-2 и IL-15, или другие иммуномодулирующие цитокины, такие как IFNα или IFNβ, или другие белки, усиливающие иммуногенное действие Tat, можно использовать в качестве адъювантов при составлении вакцины против Tat. IL-12 является сильным иммуномодулирующим цитокином, продуцируемым антигенпредставляющими клетками (АРС), такими как В-клетки и дендритные клетки (ссылка 154). IL-12 продуцируется рано после заражения ВИЧ и обладает противовоспалительным действием, побуждая NK-клетки и Т-лимфоциты продуцировать IFNγ, который активирует фагоциты и промотирует индукцию Th1-лимфоцитов. IL-12 играет некую фундаментальную роль в сопротивлении ряду инфекций, вызываемых бактериями, грибами, вирусами, и показывает высокую противоопухолевую активность. Некоторые данные наводят на мысль, что вирусы, индуцирующие иммуносупрессию, такие как ВИЧ и вирус кори, также действуют через механизмы, по которым подавляется продуцирование IL-12 (ссылки 57, 50, 144). IL-15 представляет собой плейотропный цитокин, экспрессируемый нелимфоидными тканями, активированными моноцитами/макрофагами и дендритными клетками (DC) (ссылки 125, 66). IL-15 играет важную роль в 7 регуляции NK-активности, в пролиферации Тлимфоцитов и активности CTL (ссылки 67, 24). IL-15 индуцирует экспрессию CTL против антигенов ВИЧ в отсутствие IL-2 и функциональных (CD4+)-Т-лимфоцитов (ссылки 68, 1). Кроме того, подобно IL-2, IL-15 индуцирует экспансию лимфоцитов с цитотоксической активностью ("лимфокин-активированные клетки-киллеры", LAK) и стимулирует продуцирование IFNγ в РВМС сероположительных пациентов (ссылка 93). IL-15 активирует моноциты для продуцирования хемокинов, участвуя в зарождении воспалительных процессов (ссылка 8). Последние исследования показали, что костимуляция (CD4+)-лимфоцитов парамагнитными гранулами, сенсибилизированными моноклональными антителами против CD3 и против CD28, определяет логарифмическую и поликлональную экспансию лимфоцитов от ВИЧинфицированных субъектов (ссылка 82) без активации репликации и передачи вируса. Такая антивирусная активность является следствием как негативной модуляции экспрессии CCR5 корецептора моноцитотропных штаммов ВИЧ-1 (ссылка 23), так и, в меньшей степени, высокого содержания хемокинов, индуцированных костимуляцией моноклональными антителами против CD3 и против CD28 (ссылка 132). Изобретатель полагает, что возможность экспансии аутологичных лимфоцитов от ВИЧ-инфицированных субъектов в отсутствие репликации и передачи вируса позволяет получить эффективную иммунизацию ех vivo, описанную в примерах, которая может быть весьма полезной при разработке вакцины против Tat. В разных системах, нацеленных на получение эффективных антивирусных и противоопухолевых вакцин, как полагает изобретатель, использование дендритных клеток могло стать ключом к индукции иммунной реакции на Tat. Это происходит вследствие того факта, что такие клетки являются наиболее эффективными в представлении антигена и способны одни стимулировать нативные лимфоциты в отсутствие адъювантов (ссылка 150). Использование дендритных клеток заменяет функцию некоторых адъювантов, участвующих в индукции неспецифической иммунной реакции (природный иммунитет), которая, в свою очередь, генерирует сильную специфическую первичную реакцию в присутствии антигена. Так как передача ВИЧ-инфекции происходит, главным образом, в слизистых оболочках (в ректальной слизистой и слизистой оболочке половых органов у взрослых, в слизистой оболочке рта у новорожденных), изобретатель полагает, что первоочередной задачей является индукция защитного иммунитета в слизистых оболочках. В последнее время во многих исследованиях показана возможность индуцирования иммунизации в слизистых оболочках - местной и системной. В частности, показано, что назаль- 004330 8 ный и пероральный способы являются наиболее эффективными при индуцировании эффективной иммунной реакции в слизистых оболочках, даже в отдаленных участках, таких как слизистая оболочка половых органов (ссылки 138, 118). В частности, изобретатель полагает, что использование бактерий S. Gordonii и Lactobacillus, модифицированных для экспрессии вышеуказанных вирусных антигенов, может являться действенной стратегией индуцирования или потенцирования специфической иммунной реакции на уровне слизистых оболочек у обезьян и у человека. Эти бактерии, действительно, способны заселять слизистую оболочку рта и влагалища мыши и индуцировать специфическое - локальное и системное образование антител против гетерологичных антигенов, экспрессированных на поверхности рекомбинантных бактерий (ссылки 116, 104, 106, 121, 117, 139, 105, 107). Наконец, эти бактерии действуют как живые векторы и могут индуцировать пролонгированную стимуляцию иммунной системы. Кроме того, изобретатель полагает, что нереплицирующие и непатогенные рекомбинантные вирусные векторы, такие как вирусы простого герпеса типа 1 (HSV-1) (ссылка 99), можно использовать для экспрессии вирусных белков для системной (интрадермальной) иммунизации и иммунизации через слизистые оболочки (пероральный, вагинальный и назальный способы). Действительно, эти векторы могут разместить большие экзогенные последовательности (ссылки 52, 64), такие как некоторые гены ВИЧ (регуляторные, добавочные и структурные). Кроме того, векторы герпеса также можно вводить пероральным, назальным или вагинальным способом (ссылки 176, 75). Изобретатель полагает, что Tat (или в виде белка или в виде ДНК), один или в сочетании с другими иммуногенами, описанными выше, можно инокулировать также с использованием новых систем доставки, таких как эритроциты или наночастицы. В частности, изобретатель полагает, что можно доставлять антигены, связанные с мембраной аутологичных эритроцитов (ссылки 95, 96). Так как такие эритроциты удаляются из крови макрофагами - "профессиональными" антигенпредставляющими клетками, только через 120 дней, эту особенность можно использовать для целей вакцинации. Наконец, другая стратегия доставки состоит в использовании наночастиц, которые могут нести белки и ДНК (ссылки 27, 172). Наносферы являются полимерными коллоидальными частицами разного химического состава размером 10-1000 нм. Различные вещества (олигонуклеотиды, лекарственные средства, белки, пептиды, ДНК) можно нагрузить на их поверхность или абсорбировать в частице и доставлять в цитоплазму или ядра клеток, из которых они медленно высвобождаются. Это обстоятельство позволяет использовать очень небольшие количества достав- 9 ляемого вещества. Основываясь на результатах, описанных выше, изобретатель полагает, что иммунизация Tat, одним или в сочетании с другими вирусными продуктами или иммуномодулирующими цитокинами или их частями, в присутствии или в отсутствие адъювантов, может блокировать репликацию вируса у субъектов, испытавших воздействие после вакцинации, и у инфицированных субъектов, удерживая инфекцию в абортивной фазе, которую иммунная система может легче контролировать. Поэтому изобретатель полагает, что вакцина на основе Tat должна быть способной индуцировать иммунную реакцию, как гуморальную так и клеточную, достаточную для блокирования или снижения репликации или передачи вируса и, следовательно, должна быть способной к регуляции репликации вируса и блокированию продуктивной инфекции, развития ее до болезни и возникновения опухолей и других связанных со СПИДом синдромов и симптомов. Следовательно, возможно применение вакцины против Tat как в профилактических, так и в лечебных целях. Действительно, гуморальная реакция против Tat может нейтрализовать действие внеклеточного Tat, ослабляя и ограничивая инфекцию, в то время как клеточноиндуцированная реакция против Tat, как и против других вирусных белков, входящих в состав вакцины, может разрушить инфицированные вирусом клетки, что ведет к регулированию заражения. Это предоставит иммунной системе время, необходимое для развития комплексной реакции на все вирусные компоненты инфицирующего вируса в отсутствие необратимых изменений из-за репликации вируса. Применение Tat в качестве иммуногена описано (WО 95/31999). Однако описывается применение биологически неактивного белка; кроме того, в этой же заявке на патент не приводятся доказательства биологической активности "нативного" белка Tat. Кроме того, существует сильное техническое предубеждение против применения биологически активного белка Tat относительно того, что, как полагают, он усиливает репликацию вируса у инфицированных субъектов и/или осуществляет иммуносупрессию у сероотрицательных или сероположительных индивидуумов (A. Tonelli: Aids, un vaccino per sperare. "La Repubblica", pag. 10, 24, Oct., 1988). Как доказательство вышеописанного, несмотря на предпринятые усилия, эффективная вакцина против ВИЧ на основе Tat пока не разработана. Сущность изобретения Целью настоящего изобретения является белок Tat или пептиды Tat или ДНК Tat для применения в качестве вакцины, причем подразумевается, что Tat должен находиться в биологически активной форме. 004330 10 Другой целью настоящего изобретения является вакцина для применения к людям, на основе белка или пептида, профилактическая или лечебная, против СПИДа, связанных со СПИДом опухолей и связанных с ВИЧ синдромов и симптомов, и содержащая рекомбинантный белок Tat дикого типа или его мутанты (послед. 1-5), экспрессированные и очищенные так, как описано, или пептиды Tat дикого типа или мутированного (послед. 1-7), вводимые отдельно или в сочетании с Т-хелперным эпитопом столбнячного анатоксина или другими Тхелперными эпитопами. Другой целью изобретения является вакцина, описанная выше, в сочетании с рекомбинантными белками ВИЧ Nef, Rev и/или Gag или пептидами Nef, Rev и Gag, вводимыми в виде слитых белков Tat/Nef, Tat/Rev, Tat/Gag или в виде частей таких белков. Другой целью изобретения является вакцина, описанная выше, в сочетании с рекомбинантными белками иммуномодулирующих цитокинов, таких как IL-12, IL-15, или другими молекулами или их частями, способными усиливать антивирусную иммунную реакцию, или вакцина, состоящая из Tat/IL-12, Tat/IL-15 или Tat и других составных белков или их частей, способных усиливать антивирусную иммунную реакцию. Другой целью изобретения является профилактическая или лечебная вакцина на основе ДНК, вводимая людям против СПИДа, связанных со СПИДом опухолей и связанных с ВИЧ синдромов и симптомов, содержащая векторы, кодирующие Tat дикого типа или его мутантов (послед. 1-5), или их части, встроенные в экспрессирующий плазмидный вектор pCV0 или другие векторы. Другой целью изобретения является вакцина на основе ДНК, описанная в п.4, в сочетании с генами ВИЧ rev, nef или gag или их частями, встроенными в вектор pCV0, или вакцина на основе ДНК, вводимая в виде вектора, коэкспрессирующего гены tat/rev, tat/nef, tat/gag или их части. Другой целью изобретения является вакцина на основе ДНК, описанная выше, в сочетании с ДНК, кодирующей IL-12 и IL-15, или другими генами, кодирующими иммуномодулирующие цитокины или их части, встроенными в pCV0 или другие векторы, или вакцина на основе ДНК, вводимая в виде вектора, коэкспрессирующего Tat/IL-12, Tat/IL-15 или Tat и другие молекулы или их части, способные к усилению антивирусной иммунной реакции. Другой целью изобретения является вакцина против Tat, в виде белка, пептида и/или ДНК, одних или в описанных выше сочетаниях, для иммунизации аутологичными дендритными клетками путем обработки ex vivo. Другой целью изобретения является вакцина против Tat, в виде белка, пептида и/или 11 ДНК, одних или в описанных выше сочетаниях, для иммунизации через слизистые оболочки (назальную, оральную, вагинальную или ректальную). Другой целью изобретения является вакцина против Tat, в виде белка, пептида и/или ДНК, одних или в описанных выше сочетаниях, для иммунизации ex vivo клеток периферической крови от инфицированных субъектов, выращенных посредством костимуляции моноклональными антителами против CD3 и против CD28, конъюгированными с парамагнитными гранулами, и снова введенными хозяину. Другой целью изобретения является вакцина против Tat, в виде белка, пептида и/или ДНК, описанная выше, в сочетаниях с ингибиторами репликации вируса. Другой целью изобретения является уже описанная вакцина против Tat в сочетании с адъювантами, усиливающими иммунную реакцию. Другой целью изобретения является вакцина против Tat, одна или в уже описанных сочетаниях, вводимая с помощью специфических систем доставки, таких как наночастицы, векторы герпеса, эритроциты, бактерии, или любой другой системы доставки, с помощью которой можно ввести описанную выше вакцину во всех ее сочетаниях. Другие цели будут очевидны из подробного описания изобретения. Краткое описание фигур Фиг. 1А. Ингибирование поглощения 10 нг/мл родаминированного белка Tat посредством предварительной инкубации активированных цитокином эндотелиальных клеток с антителами против интегрина. Фиг. 1А, часть А. Клетки, предварительно инкубированные с буфером, инкубированные с BSA. Фиг. 1А, часть В. Клетки, предварительно инкубированные с буфером, инкубированные с Tat. Фиг. 1А, часть С. Клетки, предварительно инкубированные с моноклональными антителами CDw49e и CD29, инкубированные с Tat. Фиг. 1А, часть D. Клетки, предварительно инкубированные с моноклональными антителами CD51 и CD61, инкубированные с Tat. Фиг. 1А, часть Е. Клетки, предварительно инкубированные с антителами против фактора человека VIII (контрольные антитела), инкубированные с Tat. Фиг. 1B. Способность очищенного белка Tat-cys22 (Tat22) конкурировать с трансактивирующей активностью белка Tat дикого типа, контролируемая методом cat-анализа. Фиг. 2А. Специфическое продуцирование IgG против Tat у обезьян, вакцинированных белком Tat, определенное при помощи иммуноферментного анализа (ELISA). Результаты получены на двух обезьянах, инокулированных 004330 12 подкожно 10 или 100 мкг рекомбинантного белка Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI. Фиг. 2В. Специфическое продуцирование IgG против Tat у обезьян, вакцинированных белком Tat, определенное при помощи иммуноферментного анализа (ELISA). Результаты получены на контрольной обезьяне (М3). Фиг. 3. Титрование антител против Tat в плазме от обезьян, инокулированных 100 (Ml) и 10 (М2) мкг рекомбинантного белка Tat, описанных на фиг. 2А и фиг. 2В. Фиг. 4А. Картирование эпитопов Tat, узнаваемых IgG против Tat от обезьян, инъецированных 100 (Ml) и 10 (М2) мкг рекомбинантного белка Tat, описанным на фиг. 2А и фиг. 2В. Для каждого пептида приводятся средние результаты при двукратном испытании в плазме, разведенной 1:50. Фиг. 4В. Картирование в соответствии с фиг. 4А. Приводятся титры антител в плазме, выраженные в виде обратной величины наибольшего разведения, при котором проба все еще положительна. Фиг. 5. Анализ специфической гуморальной IgM-реакции против Tat у обезьян, инокулированных белком Tat, определенной методом ELISA. Фиг. 6. Анализ специфического продуцирования IgG против Tat у обезьян, инокулированных белком Tat, при испытании методом ELISA. Фиг. 7. Титрование антител против Tat в плазме обезьян, инокулированных рекомбинантным Tat (10 мкг) в присутствии RIBI (М1-3) или Alum (M4-6), описанных на фиг. 6. Фиг. 8А. Эпитопы Tat, распознаваемые IgG против Tat от обезьян, инокулированных в соответствии с описанием фиг. 6. Результаты относятся к образцам, разведенным 1:50, и являются средними результатами, полученными в двух лунках. Фиг. 8В. Эпитопы Tat в соответствии с фиг. 8А. Результаты относятся к титрованию плазмы, показанному на фиг. 8А, и выражаются в виде обратной величины наибольшего разведения плазмы, при котором проба все еще положительна. Фиг. 9. Анализ Tat-специфических CTL. Фиг. 10. Анализ реакции замедленной гиперчувствительности к Tat методом кожной пробы. Фиг. 11А. Гуморальная IgG-реакция на Tat у обезьян, вакцинированных ДНК Tat. Приводятся результаты, полученные на двух обезьянах, вакцинированных 200 (Ml) и 500 (М2) мкг плазмиды pCV-Tat. Фиг. 11В. Гуморальная IgG-реакция на Tat у обезьян, вакцинированных ДНК Tat. Приводятся результаты для контрольной обезьяны (М3). Фиг. 12. Титрование антител против Tat в 13 плазме от обезьяны М2, инокулированной i.d. 200 мкг pCV-Tat. Фиг. 13. Анализ продуцирования IgG против Tat у трех обезьян (М9-М11), инокулированных 1 мг pCV-Tat, и у одной контрольной обезьяны (М12), инокулированной 1 мг контрольного вектора pCV-0. Фиг. 14. Кинетика пролиферативной реакции РВМС от Масаса fascicularis на костимуляцию моноклональными антителами против CD3 и против CD28 на парамагнитных гранулах (анти-СD3/28 гранулы). Фиг. 15А. Антивирусное действие костимуляции анти-СD3/28 гранулами на РВМС Масаса fascicularis. Обезьяна МК 193. Фиг. 15В. Антивирусное действие костимуляции анти-СD3/28 гранулами на РВМС Масаса fascicularis. Обезьяна МК D91. Фиг. 15С. Антивирусное действие костимуляции анти-СD3/28 гранулами на РВМС Масаса fascicularis. Обезьяна МК 9301. Фиг. 15D. Антивирусное действие костимуляции анти-СD3/28 гранулами на РВМС Масаса fascicularis. Обезьяна МК 9401. Фиг. 16А. Функциональная характеристика дендритных клеток (DC), полученных из периферической крови обезьяны. 3Н-Тимидин вводят на 4 день выращивания аллогенных смешанных лейкоцитов (AMLR). Фиг. 16В. Функциональная характеристика дендритных клеток, полученных из периферической крови обезьяны. АРС, такие как DC и М∅, полученные так, как описано на фигуре 16А, заражали Т-лимфоцитами от другой обезьяны. Подробное описание изобретения Настоящее изобретение относится к Tat как активной основе профилактической и/или лечебной вакцины против ВИЧ-инфекции, развития ее до СПИДа и развития опухолей и других синдромов и симптомов у субъектов, инфицированных ВИЧ. Tat, или Tat дикого типа, находится в своей активной форме, или точнее - в биологически активной форме (как поясняется далее), или в виде рекомбинантного белка или пептида или ДНК. Конкретнее, изобретение относится к вакцине на основе Tat ВИЧ-1 как иммуногена, инокулируемой в виде ДНК и/или рекомбинантного белка, или в виде пептидов, одних или в сочетании с другими генами или вирусными генными продуктами (Nef, Rev, Gag) или их частями, или в сочетании с различными иммуномодулирующими цитокинами (IL-12, IL15) или с геном, кодирующим иммуномодулирующий цитокин или его часть. Tat, Nef, Rev, Gag и иммунoмoдулирующие цитокины вводят как в виде смеси рекомбинантных белков, пептидов или слитых белков (Tat/Nef, Tat/Rev, Tat/Gag, Tat/IL-12, Tat/IL-15), так и в виде плазмидной ДНК. В настоящем описании "Tat дикого типа" и "Tat в активной форме" должны рассматриваться как синонимы выражения "биоло- 004330 14 гически активный Tat". В соответствии с настоящим изобретением под "биологически активным Tat" подразумевается белок, который в пикомолярных или наномолярных концентрациях (от 10 нг/мл или менее до 1 мкг/мл, предпочтительно - от 0,1 нг/мл до 100 нг/мл) способен (i) проникать и локализоваться в ядрах активированных эндотелиальных клеток или дендритных клеток, как определяется в примере 1А; (ii) активировать пролиферацию, миграцию и инвазию клеток саркомы Капоши (KS) и белка активированных цитокином эндотелиальных клеток (ссылки 40, 2); (iii) активировать репликацию вируса при добавлении к инфицированным клеткам, что определяют а) посредством "спасения" дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка (ссылка 41); b) посредством трансактивации экспрессии генов ВИЧ-1 в клетках, трансфицированных промотором ВИЧ-1 и репортерным плазмидным белком (ссылка 41); (iv) индуцировать у мышей развитие KSподобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления (ссылка 42). Изобретатель считает, что в случае биологически активного Tat совершенно необходимо, чтобы подтверждались пункты (i) или (ii), предпочтительно, должны подтверждаться оба пункта, предпочтительнее, должны подтверждаться пункт (i) или (ii), или оба, в сочетании с пунктом (iii)a) и/или (iii)b). Наилучшие результаты получатся, когда подтвердятся все пункты (i)(iv). Белок Tat или фрагменты Tat с такими свойствами способны индуцировать in vivo цитотоксическую или антивирусную иммунную реакцию. Действительно, биологически активный Tat с указанными выше свойствами способен связываться со специфическими рецепторами клеточной поверхности и поглощаться при помощи этих рецепторов. Поглощение Tat важно для индуцирования цитотоксической реакции. В исследованиях, проведенных ранее и осуществляемых в настоящее время, относящихся к разработке вакцины на основе Tat, не использовался биологически активный Tat с указанными выше свойствами. Способ получения и работа с биологически активным Tat, в соответствии с настоящим изобретением, описаны в примере 1. Также описан способ иммунизации с использованием аутологичных дендритных клеток, обработанных ex vivo рекомбинантным белком Tat или его пептидами, одними или в смеси с рекомбинантными белками или пептидами (Tat, Nef, Rev, Gag), или белком Tat и одним или несколькими иммуномодулирующими цитокинами или их частями, или трансдуциро- 15 ванными эукариотными векторами, содержащими ген tat один или в сочетании с вирусными генами, кодирующими Nef, Gag или Rev, или tat и ген, кодирующий иммуномодулирующий цитокин или его часть. Способы индукции иммунной реакции в слизистой оболочке также описаны. Tat или его пептиды, одни или в сочетании с вирусными белками и/или цитокинами, инокулируют в слизистую для усиления и индукции локальной иммунной реакции. Белок ВИЧ-1 Tat или его субъединицы также можно использовать для иммунизации ex vivo (CD4+)-лимфоцитов и (CD8+)-лимфоцитов, выделенных из периферической крови инфицированных субъектов. Tatантигенспецифические клетки затем можно размножить in vitro посредством костимуляции моноклональными антителами против CD3 и CD28 и ввести снова. Наконец, также описано применение мутантов Tat, идентифицированных в примерах, используемых в качестве иммуногенов, как альтернативы Tat дикого типа. Мутантами Tat являютсятся i) мутант в области цистеина (cys22) и ii) мутант в коровой области (lys41), iii) мутант с удаленной последовательностью RGD; iv) двойной мутант с удаленными лизином 41 и RGD. С другой стороны, при применении мутантов Tat или пептидов Tat (дикого типа или мутированных в виде белка) в случае лечебной вакцинации вместе с иммуногеном можно использовать ингибиторы репликации вируса. В этом отношении под "ингибиторами репликации вируса" подразумеваются все молекулы, известные в настоящее время, или те, которые будут обнаружены в дальнейшем (нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы протеаз, антисмысловая РНК и, вообще, все молекулы, способные блокировать экспрессию генов ВИЧ), способные уменьшать или блокировать репликацию ВИЧ. Как указывалось ранее, описываются различные способы иммунизации, при которых используются белок Tat, пептиды и ДНК Tat в сочетании с другими вирусными генами или белками или их частями, или иммуномодулирующими цитокинами или генами, кодирующими иммуномодулирующие цитокины, или их частями. Под "его частями" подразумеваются сегменты генов или белков, описанных выше, демонстрирующие такую же эффективность индуцирования, как иммуногенное действие полного гена или белка. Кроме того, так как эффективность адъювантов в вакцинах известна, настоящее изобретение относится к применению известных адъювантов и тех адъювантов, которые будут найдены в дальнейшем, вводимых вместе с Tat (белком или ДНК) и с сочетаниями Tat и других генов или вирусных или клеточных белков. Подобным образом, делается предположение об эффективности различных систем доставки Tat (белка или ДНК) и сочета- 004330 16 ний Tat и других генов или вирусных или клеточных белков при индуцировании как системной, так и локальной иммунной реакции на Tat (иммунизация через слизистые оболочки). Результаты, полученные изобретателем (неопубликованные), показывают, что только белок Tat, в своей биологически активной форме, способен связываться со специфическими клеточными рецепторами и проникать в клетку. Эта особенность является основой иммунной реакции А-клеток и, кроме того, иммунокомпетентных клеток вообще, и, согласно изобретателю, имеет фундаментальное значение для индуцирования значительно более сильной иммунной реакции, чем та, которую способен выявить неактивированный белок. В итоге, в отличие от применения в качестве иммуногена неактивированного Tat, предлагаемого рядом исследователей, изобретатель предполагает использовать Tat ВИЧ-1 или его мутанты в их биологически активных формах, для того, чтобы вызвать весьма сильную иммунную реакцию против ВИЧ, способную предотвратить заражение или развитие болезни, и создает возможность для эффективного подхода к лечению индивидуумов, инфицированных ВИЧ-1. Согласно изобретателю, вакцину можно доставлять системными (внутримышечно, i.d., подкожно и т.п.) или местными способами (через слизистые оболочки). Последний способ предпочтителен, когда в качестве систем доставки используются бактерии (см. ниже). Вакцину можно получить следующим образом. Tat можно получить согласно примеру 1, его можно лиофилизовать и хранить. В момент применения его можно ресуспендировать в биологически приемлемой жидкости, такой как сыворотка, плазма или их фракции. Трансформированные клетки, содержащие вектор экспрессии Tat или вектор экспрессии мутанта Tat, или их частей, как описано ранее, и клетки, выращенные для экспрессии белка Tat, которые будут выделены для применения, все они входят в объем настоящей заявки на патент. Подразумевается, что все варианты Tat (включая все типы и субтипы штаммов ВИЧ) с аналогичной или с большей активностью, чем описано выше, входят в рамки изобретения. Настоящее изобретение теперь будет описываться с помощью иллюстрирующих, но не ограничивающих его конкретных примеров, в которых будут делаться ссылки на прилагаемые фигуры. Подробное описание фигур Фиг. 1А. Ингибирование поглощения 10 нг/мл родаминированного белка Tat посредством предварительной инкубации активированных цитокином эндотелиальных клеток с антителами против интегрина. Активированные цитокином клетки пупочной вены человека (HUVE), обработанные так, как описано в пояснении к табл. 2А, предварительно инкубируют в бессывороточной среде, содержащей буфер или 17 антитела, а затем инкубируют в течение 15 мин при 37°С с 10 нг/мл родаминированного Tat или родаминированного BSA. Часть А: клетки, предварительно инкубированные с буфером, инкубированные с BSA. Часть В: клетки, предварительно инкубированные с буфером, инкубированные с Tat. Часть С: клетки, предварительно инкубированные с моноклональными антителами CDw49e (против α5) и CD29 (против β1, инкубированные с Tat. Часть D: клетки, предварительно инкубированные с моноклональными антителами CD51 (против αv) и CD61 (против β3), инкубированные с Tat. Часть Е: клетки, предварительно инкубированные с антителами против фактора человека VIII (контрольные антитела), инкубированные с Tat. Фиг. 1B. Показана способность очищенного белка Tat-cys22 (Tat22) конкурировать с трансактивирующей активностью белка Tat дикого типа, контролируемая методом cat-анализа. Клетки Н3Т1, содержащие репортерный ген LTR-CAT ВИЧ-1 (ссылка 148), инкубировали с белком Tat дикого типа (100 нг), одним или в присутствии молярного избытка белка Tat-cys22 (1 мкг). Трансактивирующую активность Tat в отношении LTR ВИЧ-1 и способность белка Tat-cys22 конкурировать с Tat дикого типа определяют через 48 ч после трансфекции посредством определения cat-активности в цитоплазматических экстрактах (соответствующих 200 мкг белка), как описано ранее (ссылка 41). Указывается процент (%) ацетилирования 14Схлорамфеникола. Фиг. 2. Специфическое продуцирование IgG против Tat у обезьян, вакцинированных белком Tat, определенное при помощи иммуноферментного анализа (ELISA). (А) показывает результаты, полученные на двух обезьянах, инокулированных подкожно 10 или 100 мкг рекомбинантного белка Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI. (В) показывает результаты, полученные на контрольной обезьяне (М3). Обезьян инокулировали в момент времени 0 и через 2, 5, 10, 15, 22, 27, 32 и 37 недель. Антитела против Tat оценивали также на 41 неделе у обезьяны М2, инокулированной 10 мкг белка Tat, и для обезьяны М3. Присутствие антител против Tat в плазме вакцинированных животных оценивали методом ELISA и характеризовали следующим образом. Белок Tat адсорбировали в ПВХ 96луночных планшетах (100 нг/лунку в 200 мкл 0,05 М карбонатного буфера, рН 9,6) в течение 12 ч при 4°С. После 3 промываний PBS 1х, не содержащим Са++ и Mg++ (PBS-A), содержащим твин 20 (0,05%), добавляли плазму, разведенную 1:50 в 200 мкл карбонатного буфера (в две 004330 18 лунки), и планшеты инкубировали при 37°С в течение 90'. Затем лунки промывали PBS-A 1х с 0,05% твина, после чего добавляли 100 мкл вторичных антител (разведенных 1:1000 в PBS-A с 0,1% твина и 1% BSA), конъюгированных с пероксидазой из хрена, (и инкубировали) в течение 90' при комнатной температуре. После 5 промываний лунок добавляли 100 мкл субстрата (ABTS, 1 мМ, Amersham) в течение 30-45' при комнатной температуре. Считывание осуществляли на спектрофотометре (405 нм). Каждый ELISA включал кроличью поликлональную сыворотку против Tat (положительный контроль), разведенную 1:200-1:6400, и предиммунную плазму (отрицательный контроль), разведенную 1:50. Предельную критическую величину вычисляли как среднее значение оптической плотности (O.D.) отрицательной плазмы обезьян + 3 стандартных отклонения (S.D.), полученной во всех экспериментах с предиммунной плазмой. Приведенные результаты являются средними для двойного количества лунок. >2,7 показывает, что величина оптической плотности вышла за рамки шкалы. Фиг. 3. Титрование антител против Tat в плазме от обезьян, инокулированных 100 (Ml) и 10 (М2) мкг рекомбинантного белка Tat, описанных на фиг. 2. ELISA осуществляли так, как описано для фигуры 2, и анализировали плазму (при двукратном повторе) при скалярном разведении от 1:50 до 1:25600. Величины на ординате представляют обратные величины наибольшего разведения плазмы, при котором проба все еще положительна. Предельную критическую величину вычисляли для каждого разведения и указывали как среднюю O.D. предиммунной плазмы от всех обезьян во всех экспериментах + 3 S.D. Фиг. 4. Картирование эпитопов Tat, узнаваемых IgG против Tat от обезьян, инъецированных 100 (Ml) и 10 (М2) мкг рекомбинантного белка Tat, описанным на фиг. 2. ELISA в случае картирования эпитопов осуществляли с использованием 8 синтетических пептидов, соответствующих аминокислотам (ак) Tat 1-20, 21-40, 3650, 46-60, 52-72, 56-70, 65-80, 73-86. По 100 мкл каждого пептида (10 мкг/мл в PBS-A с 0,1% BSA) абсорбировали на ПВХ 96-луночных планшетах в течение 12 ч при 4°С. Затем планшеты промывали и инкубировали со 100 мкл PBS-A с 3% BSA в течение 2 ч при 37°С. После инкубации планшеты промывали PBS-A 1х с 0,05% твина 20, и затем в каждую лунку добавляли 50 мкл плазмы, разведенной в PBS-A с 3% BSA. Затем ELISA продолжали так, как описано для фиг. 2. Плазму получали на 37 неделе после первичной иммунизации. Предельные критические величины, вычисленные для каждого пептида и для каждого разведения плазмы, соответствуют средним значениям оптической плотности (O.D.), полученным во всех экспериментах с 19 предиммунной плазмой, + 3 S.D. (А) показывает средние результаты при разведении плазмы 1:50 для каждого пептида при двукратных испытаниях; (В) показывает титры антител в плазме в случае (А), выраженные в виде обратной величины наибольшего разведения, при котором проба все еще положительна. Фиг. 5. Анализ специфической IgMреакции против Tat у обезьян, инокулированных Tat, при определении методом ELISA. Трех обезьян (М1-3) инокулировали подкожно 10 мкг рекомбинантного Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI; 3 обезьян (М4-6) инокулировали подкожно 10 мкг рекомбинантного белка Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл Alum; 2 контрольных обезьян инокулировали подкожно RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) или Alum (250 мкл и 250 мкл аутологичной сыворотки) (М8). Обезьян инокулировали в момент времени 0 и через 2, 6, 11 и 15 недель. Наличие антител исследовали на 2, 6, 11 и 15 недели. Метод ELISA описан для фиг. 2. В данном случае плазму животных анализировали (при двукратном повторе) при разведении 1:100, и в качестве вторичных антител использовали козью антиобезьянью IgM-сыворотку (разведенную 1:1000), конъюгированную с пероксидазой из хрена. Предельную критическую величину вычисляли как среднюю величину (+2 S.D.) O.D. предиммунной плазмы. Результаты представляют средние величины O.D. (при 405 нм) для двух лунок за вычетом величины снижения (∆O.D. 405). Фиг. 6. Анализ специфического продуцирования IgG против Tat у обезьян, инокулированных Tat, при испытании методом ELISA. Трех обезьян (М1-3) инокулировали 10 мкг рекомбинантного Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI; 3 обезьян (М4-6) инокулировали 10 мкг рекомбинантного Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл Alum; двух контрольных обезьян инокулировали RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) или Alum (250 мкл и 250 мкл аутологичной сыворотки) (М8). Обезьян инокулировали в момент времени 0 и через 2, 6, 11, 15, 21, 28 и 32 недели. На 36 неделе обезьян М1-М6 инокулировали 16 мкг белка Tat, ресуспендированного в 200 мкл ISCOM и 300 мл PBS. Антитела определяли также на 40 и 44 недели. Метод ELISA и определение предельной критической величины описаны в случае фиг. 2. Приведенные результаты относятся к образцам, разведенным 1:50. >2,7 показывает, что величина O.D. выходит за рамки шкалы. Фиг. 7. Титрование антител против Tat в плазме от обезьян, инокулированных рекомбинантным Tat (10 мкг) в присутствии RIBI (М1-3) или Alum (M4-6), описание к фиг. 6. Для каждой 004330 20 плазмы результаты приводятся в виде величин, обратных наибольшему разведению сыворотки, при котором проба все еще положительна. Фиг. 8. Эпитопы Tat, узнаваемые IgG против Tat от обезьян, инокулированных рекомбинантным Tat (10 мкг) в присутствии RIBI (M1М3) или Alum (M4-M6), описание к фиг. 6. Плазму получали на 21 неделе после первичной иммунизации. Метод ELISA и определение предельной критической величины описаны в случае фиг. 4. Результаты в части (А) относятся к образцам, разведенным 1:50, и являются средними результатами, полученными в лунках при двукратном повторе. Результаты на части (В) относятся к титрованию плазмы, часть (А), и выражены в виде обратной величины наибольшего разведения плазмы, при котором проба все еще положительна. Фиг. 9. Анализ Tat-специфических CTL. Анализ осуществляли так, как описано в табл. 5. Приводятся данные, являющиеся примером состояния на 36-ой неделе для обезьяны Ml, получившей подкожно инъекцию 10 мкг Tat и RIBI, как описано в случае фиг. 6. Квадраты (контроль) соответствуют клеткам, инкубированным с клетками-мишенями BLCL; ромбы соответствуют клеткам, инкубированным с клеткамимишенями BLCL с добавлением Tat (1 мкг на 250000 клеток). Фиг. 10. Анализ реакции замедленной гиперчувствительности к Tat методом кожной пробы. Белок Tat (5, 1 и 0,2 мкг), ресуспендированный в 150 мкл PBS, содержащего 0,1% BSA, или буфер, в котором ресуспендировали Tat, сразу же инокулировали (i.d.) в обритый участок спины животного. Этот участок фотографировали в момент времени 0 и через 24, 48 и 72 ч. Контрольных обезьян инокулировали только буфером. Приводятся результаты для обезьяны М2 (15 неделя), инокулированной 10 мкг Tat и RIBI, как описано в случае фиг. 6. Положительная реакция на Tat была явной через 48 ч после кожной пробы. Фиг. 11. Гуморальная IgG-реакция на Tat у одной обезьяны (M1), инокулированной i.d. 200 мкг плазмиды pCV-Tat, ресуспендированной в 150 мкл PBS-A, в два места вблизи подмышечных лимфоузлов; одной обезьяне (М2) давали инъекцию 500 мкг pCV-Tat, ресуспендированной в 250 мкл PBS-A, внутримышечно, в два места на спине; контрольную обезьяну (М3) не инокулировали ДНК Tat, но проводили, как специфический контроль, повторные кожные пробы с Tat. Обезьянам инъецировали pCV-Tat в момент времени 0 и через 5, 10, 15, 22, 27, 32 и 37 недель. Наконец, через 42 недели, обезьянам давали повторную инъекцию рекомбинантного белка Tat (16 мкг), ресуспендированного в 200 мкл ISCOM и 300 мкл PBS. Антитела оценивали на 2, 5, 10, 15, 22, 27, 32, 37, 42, 48 и 58 недели. Образование антител против Tat в плазме (разведенной 1:50) анализировали методом ELISA 21 так, как описано в случае фиг. 2. Результаты представляют средние величины OD для лунок при двукратном повторе. (А) представляет результаты, полученные на двух обезьянах, вакцинированных 200 (Ml) и 500 (М2) мкг плазмиды pCV-Tat. (В) представляет результаты, полученные для контрольной обезьяны (М3). Фиг. 12. Титрование антител против Tat в плазме от обезьяны М2, инокулированной i.d. 200 мкг pCV-Tat. Метод ELISA описан для фиг. 2. Результаты на ординате выражены в виде величин, обратных наибольшему разведению, при котором проба все еще положительна. Фиг. 13. Анализ продуцирования IgG против Tat у трех обезьян (М9-М11), инокулированных 1 мг pCV-Tat, и у одной контрольной обезьяны (М12), инокулированной 1 мг контрольного вектора pCV-О. ДНК ресуспендировали в 1 мл PBS-A и вводили внутримышечно в два места на спине. Обезьян инокулировали в момент времени 0 и через 6, 11, 15, 21, 28 и 32 недели. На 36-ой неделе обезьянам М9-М11 давали повторную инъекцию 16 мкг рекомбинантного белка Tat, ресуспендированного в 200 мкл ISCOM и 300 мкл PBS. Присутствие антител против Tat оценивали на 2, 6, 11, 15, 21, 28, 32, 36, 40 и 44 недели. ELISA и определение предельной критической величины описаны в случае фиг. 2. Фиг. 14. Кинетика пролиферативной реакции РВМС от Масаса fascicularis на костимуляцию моноклональными антителами против CD3 и против CD28 на парамагнитных гранулах (анти-СD3/28 гранулы). РВМС извлекали из CD8положительной субпопуляции иммуномагнитными методами. Впоследствии половину извлеченных лимфоцитов против CD8 стимулировали РНА и IL-2 (40 Е/мл), начиная с 3 дня; оставшуюся часть оставляли прилипать к антителам, нанесенным на анти-СD3/28 гранулы, причем таким образом получали обедненную CD8 и CD3/28-положительную популяцию лимфоцитов. К этой клеточной фракции добавляли IL-2 (40 Е/мл), начиная с 10 дня культивирования. Клетки считали и определяли их жизнеспособность каждые 2-3 дня. Соотношение гранулы:клетки поддерживали постоянным. Приводится число клеток в разные моменты времени. Фиг. 15. Антивирусное действие костимуляции с анти-СD3/28 гранулами на РВМС от Масаса fascicularis. Обедненные CD8 и обедненные CD8 CD3+/CD28+ лимфоциты, полученные от 4 обезьян (фиг. 15A-15D) методами, описанными в случае фиг. 14, стимулировали так, как описано в примере 7. Две фракции инфицировали in vitro в день 0 0,1 M.O.I. SIVmac251/63M. Стимуляцию осуществляли с РНА и IL-2, добавленными позднее в день 3, и с анти-СD3/28 гранулами без добавления экзогенного IL-2. Вирусные продукты оценивали посредством определения количества р27 (нг/мл) в клеточных супернатантах в дни 6 и 12 004330 22 после заражения так, как описано в примере 7. (На светло-сером поле PHA+IL-2, на темносером поле анти-СD3/28 гранулы на РВМС CD8/CD3+/CD28+). Фиг. 16. Функциональная характеристика дендритных клеток (DC), полученных из периферической крови обезьяны. (А) Введение 3Нтимидина в день 4 выращивания аллогенных смешанных лейкоцитов (AMLR) для сравнения антигенпредставляющей функции (АРС, определенной в виде индукции пролиферации аллогенных Т-клеток) DC и макрофагов (М∅), полученных из РВМС Масаса fascicularis, после разделения в градиенте перколла и прилипания к пластику. Неприлипшие клетки удаляли, а прилипшие клетки индуцировали к созреванию до DC посредством добавления GMCSF (200 нг/мл) и IL-4 (200 единиц на мл) каждые 3 дня. Половину культуральной среды (RPMI, 10% FCS) удаляли и заменяли свежей средой каждые 3 дня. Через 6-7 дней наблюдали морфологические изменения цитокининдуцированных клеток, которые приобретали свойства типичного фенотипа CD (утрата адгезии, образование кластеров, "отпечатки пальцев"), подтвержденные также посредством определения типичных мембранных маркеров (данные не приводятся). Моноциты не были цитокининдуцированными и выращивались в той же среде, которую заменяли каждые 3 дня. Клетки сохраняли свойства моноцитов-макрофагов, такие как адгезия. В день 7 обе клеточные популяции заражали Тлимфоцитами из крови донора-человека, очищенными методом градиента фиколла и перколла и посредством прилипания и последующего замораживания. Анализы пролиферации клеток осуществляли в 48-луночном планшете. Стимулировали 5000 DC или М∅ (отношение Т:АРС = 100:1) 500000 Т-лимфоцитов. Культивирование поддерживали в течение 4 суток, и фиксированные аликвоты клеточной суспензии переносили в 96-луночные планшеты при трехкратном повторе. Затем в течение 16 ч добавляли 1 мкКи 3 Н-тимидина, и с помощью счетчика β-частиц определяли число импульсов в минуту (чим) введенного предшественника. (В) АРС, такие как DC и М∅, полученные так, как описано в случае фиг. 16А, заражали Тлимфоцитами от другой обезьяны, полученными так, как описано выше в случае донорачеловека. Более высокая способность представлять антиген является типичным свойством DC при сравнении с М∅. К Т-лимфоцитам добавляют АРС в скалярных концентрациях, для того, чтобы оценить пролиферативные реакции при разных соотношениях Т:АРС (DC или М∅). Приведенные далее примеры следует рассматривать как иллюстративные и не ограничивающие объем изобретения. Пример 1. Экспрессия, очистка и характеризация белка Tat дикого типа (изолят IIIB), мутированных белков Tat и пептидов Tat дикого 23 типа. В прошлом встречалось много трудностей при очистке и сохранении биологической активности белка Tat вследствие легкости окисления, агрегации и потери активности. Это происходит из-за большого количества цистеиновых остатков, которые могут образовывать внутри- и межмолекулярные связи, изменяя, таким образом, конформацию нативного белка (ссылки 159, 41). Для экспрессии белка в Е. coli использовали кДНК или ген tat (посл. 1, пример 2), клонированные в векторе pL-syn, предоставленном Dr.J.F. DeLamarter и В. Allet (Glaxo Institute for Molecular Biology S.A., Ginevra, Svizzera). Для того, чтобы достичь эффективной иммунизации Tat с целью получения вакцины, изобретатель считает основным получение биологически активного белка Tat так, как описано в разделе "Подробное описание изобретения". Поэтому в способах получения и очистки Tat, описанных в данном примере и в последующих примерах 1В, 2 и 3, описываются необходимые процедуры и методы контроля для получения биологически активного белка Tat, который является эффективным иммуногеном для защиты от ВИЧ-инфекции, СПИДа или от развития связанных с ВИЧ заболеваний. Первый способ, который авторы изобретения использовали для получения активного белка, основан на последовательных стадиях жидкостной хроматографии высокого давления и жидкостной и ионообменной хроматографии (ссылки 15, 41). Белок, полученный такими способами, имеет чистоту свыше 95% и является активным (ссылки 41, 42). Однако не получилось хорошего воспроизведения от партии к партии вследствие окисления белка, которое представляет основную проблему при промышленном получении Tat. Благодаря наблюдениям, что основная область белка Tat обладает сильной аффинностью к гепарину и что гепарин предотвращает его окисление, авторы изобретения использовали гепаринаффинную хроматографию и составили новый протокол очистки Tat, как описано в Chang et al. (ссылка 26). Клетки (масса 10 г) Е. coli, экспрессирующие Tat, обрабатывали ультразвуком в 40 мл буфера для лизиса (20 мМ динатрийфосфата, рН 7,8; 2,5% глицерина; 0,2 мМ PMSF; 5 мМ DTT; 50 мМ маннита; 10 мМ аскорбиновой кислоты; 500 мМ NaCl) с использованием жидкостной ультразвуковой установки (модель XL2020, Heat System Inc) с тремя разрядами, каждый по 20 с. Лизат центрифугировали при 12000 g в течение 30 мин, и супернатант инкубировали в течение одного часа при комнатной температуре с 2 мл гепаринсефарозной смолы, предварительно промытой буфером для лизиса. Смолу загружали в стеклянную колонку и промывали буфером для лизиса до тех пор, пока в промывочной среде обнаружить белок не удавалось. Связанный материал элюировали буфером 004330 24 для лизиса, содержащим 2М NaCl, и элюат собирали в фракции по 1 мл. Однородность элюированного белка анализировали методом гельэлектрофореза (SDS-PAGE). Очищенный белок хранили в лиофилизованном виде при -70°С и перед применением ресуспендировали в обезгаженном буфере. Биологическую активность очищенного белка Tat, согласно указанной выше схеме, оценивали анализом методом "спасения" вирусной инфекции в клетках HML-1, полученных из клеток HeLA-CD4+ , содержащих провирус, дефектный по гену tat, полученных и описанных в Sadaie et al. (ссылка 140). Анализ методом "спасения" вирусной инфекции, описанный Ensoli et al. (ссылка 41), заключался в комплементации отсутствия экспрессии Tat в клетках HLM-1 (2 х 105) путем добавления экзогенного белка Tat (2 мкг/мл) и путем оценки репликации вируса посредством определения антигена р24, секретированного в культуральную среду через 48 ч после добавления экзогенного Tat, с помощью коммерческих наборов. Результаты экспериментов со "спасением", приведенные Chang et al. (ссылка 26), показывают, что белок Tat, очищенный данным способом, является активным, и что этот способ очистки лучше, проще и дешевле, как в смысле чистоты, так и биологической активности Tat, по сравнению с описанными ранее способами (ссылки 40, 41, 42). Различными препаратами рекомбинантного Tat, очищенного так, как описано выше, инокулировали в присутствии адъюванта Фрейнда мышей и кроликов, в соответствии со стандартными протоколами (ссылка 4). Результаты по образованию антител, индуцированному иммунизацией, приводятся в табл. 1. Таблица 1. Анализ образования специфических антител против Tat в сыворотках мышей и кроликов, иммунизированных рекомбинантным Tat Рекомбинантный белок Tat, продуцированный в Е. coli, использовали для иммунизации мышей и кроликов в соответствии со стандартными протоколами иммунизации (ссылка 4). Сыворотки иммунизированных животных анализировали методом ELISA на наличие антител против Tat, используя три разведения сыворотки (1:500 - 1:2000). Результаты являются средним из результатов считывания при 405 нм для двух кроликов и трех мышей. Кроме того, сыворотки проверяли методом Вестерн-блоттинга с рекомбинантным белком Tat (100 нг). Результаты, приведенные в табл. 1, показывают, что рекомбинантный Tat, полученный 25 авторами изобретения, способен индуцировать образование антител у обоих видов животных, при испытаниях методами ELISA и Вестернблоттинга, при котором используется рекомбинатный Tat. Такие антитела были способны ингибировать интернализацию и биологическую активность Tat (ссылки 40, 41, 42). Вектор pLsyn и схема очистки белка Tat используются для экспрессии и очистки мутантов Tat, описанных в примере 2. Биологическую активность мутированных и очищенных белков Tat измеряют при помощи анализов "спасения" вирусной инфекции в клетках HLM-1, анализов пролиферации клеток KS и in vivo на мышах, как описано выше для белка Tat дикого типа. Кроме того, мутированные белки Tat проверяют в присутствии Tat дикого типа (при серийных концентрациях) для подтверждения отрицательного трансдоминантного действия на репликацию вируса. Вектор pL-syn и схему очистки белка Tat используют для экспрессии и очистки составных белков такого типа: Tat (дикого типа или его мутанты) /IL-2 или Tat (дикого типа или его мутанты) /IL-15 или их части, или Tat (дикого типа или его мутанты)/другие молекулы (или их части), способных усиливать иммунную реакцию на один Tat или связанный с другими вирусными продуктами. Составные рекомбинантные молекулы получают посредством использования последовательностей и праймеров, описанных в примерах 2 и 3. Как альтернативу, в качестве иммуногенов используют синтетические пептиды, соответствующие областям Tat или других вирусных продуктов или цитокинов, используемые в сочетании с Tat. Ниже перечислены пептидные последовательности Tat. Пептиды мутантов Tat будут содержать те же замены аминокислот мутированных белков Tat, какие описаны в примере 2. Пептиды будут использоваться в сочетании с пептидом, представляющим универсальный Т-хелперный эпитоп столбнячного анатоксина, или другими пептидами, представляющими Т-хелперные эпитопы (ссылка 77). Пример 1А. Поглощение пикомолярных концентраций (10-100 нг/мл) биологически активного Tat активированными эндотелиальными клетками опосредуется интегриновыми рецепторами. Когда нормальные эндотелиальные клетки активируют in vitro цитокинами воспалительного инфильтрата, они становятся чувствительны- 004330 26 ми к воздействию внеклеточного Tat, и это происходит вследствие индукции интегринов α5β1 и αvβ3 (ссылки 9, 10). Подобным образом, цитокины воспалительного инфильтрата (IС) или bFGF увеличивают экспрессию интегрина на эндотелиальных клетках in vivo, и это обстоятельство приводит к синергичному промотированию KS, когда биологически активный Tat инокулируют мышам одновременно с bFGF или после него (ссылка 42). Кроме того, ICактивированные эндотелиальные клетки приобретают функцию АРС. В данном примере демонстрируется, что эндотелиальные клетки, активированные IС, эффективнее поглощают родаминированный биологически активный белок Tat, и что это явление опосредуется интегриновыми рецепторами. Из-за сложностей при наблюдении интернализации очень малых концентраций немеченного Tat белок метили родамином (ссылка 98). Родаминированный Tat все еще демонстрировал активацию пролиферации клеток KS в том же интервале концентраций, что и немеченный Tat, что указывает, что процедура мечения не угрожала его биологической функции. Эксперименты по поглощению Tat осуществляли следующим образом: клетки пупочной вены человека (HUVE) выращивали и обрабатывали IС в течение 5 дней так, как описано ранее (ссылки 9, 4 6). Затем клетки обрабатывали трипсином, высевали в 8-луночные планшеты (Nunc Inc., Напервиль, Иллинойс) в количестве 0,5 х 105 клеток на лунку и инкубировали в течение 18 ч в среде, содержащей 15% сыворотки плода коровы (FBS), в присутствии IС. Добавляли бессывороточную среду (SF, RPMI, 1% BSA, 0,1% антибиотиков, фунгизон), и планшеты предварительно инкубировали в течение 2 ч при 4°С. К клеткам добавляли свежую среду, содержащую серийное разведение родаминированного Tat, и клетки инкубировали при 37°С в течение указанного времени. Отрицательным контролем служил родаминированный BSA в том же буфере, что и Tat. Клетки фиксировали в охлажденной льдом смеси ацетона и метанола (1:1), и поглощение и локализацию Tat визуализировали и фотографировали с использованием флуоресцентной микроскопии. Результаты оценивали посредством сравнения с флуоресценцией образцов с отрицательным контролем, и поглощение выражали количественно по шкале от 0 до ++++, не зная предварительно кода образца. Для того, чтобы исследовать пути, по которым Tat поглощается активированными эндотелиальными клетками, осуществляли эксперименты с использованием активированных клеток HUVE с экзогенным Tat в широком интервале концентраций, которые использовались ранее для индукции роста клеток HUVE или KS (10-50 нг/мл), или трансактивации ВИЧ-1 по- 27 средством добавления белка к клеткам, содержащим промотор ВИЧ-1 или провирус (0,5-1 мкг/мл). В этих экспериментах для согласования с экспериментами по ингибированию поглощения (см. ниже) клетки предварительно инкубировали при 4°С в течение 2 ч со средой, лишенной фетальной телячьей сыворотки. Предварительная инкубация не влияет на последующее поглощение родаминированного Tat. С родаминированным Tat поглощение и транслокация белка в ядре или ядрах активированных клеток HUVE становится явной в пределах 15-минутной инкубации с таким небольшим количеством родаминированного Tat, как 10 нг/мл. Плотность поглощенного Tat в клетках возрастала в зависимости от дозы и в зависимости от времени. Родаминированный Tat или буфер не показывали сигналов, и привычно использовались в качестве отрицательного контроля. Для того, чтобы определить, опосредуется ли поглощение Tat активированными клетками HUVE теми же интегринами, которые, как обнаружено, экспрессировались на клетках KS, эксперименты по ингибированию осуществляли посредством предварительной инкубации ICактивированных эндотелиальных клеток с немеченным Tat (конкурент), физиологическими лигандами для этих рецепторов, такими как фибронектин (FN) или витронектин (VN), или посредством предварительной инкубации клеток с моноклональными антителами против RGD-связывающих участков рецепторов α5β1 и αvβ3. Вот краткое описание эксперимента. После высевания на 8-луночные планшеты клетки HUVE инкубировали со средой, содержащей 15% FBS, в течение 18 ч, а затем инкубировали со средой SF, содержащей немеченный Tat (немеченный конкурент) (табл. 1А), FN, VN (табл. 1В) или моноклональные антитела против RGDсвязывающей последовательности FN- или VNрецепторов (α5β1 и αvβ3, соответственно), или моноклональные антитела против человеческого фактора VIII (контрольные антитела) (фиг. 1А), в течение 2 ч при 4°С. Затем клетки инкубировали с родаминированным Tat в течение указанного времени. Контрольные клетки обрабатывали одной средой SF в течение 2 ч при 4°С и инкубировали с родаминированным BSA. Клетки фиксировали, визуализировали и фотографировали, и результаты представляли в значениях по шкале, указанной выше. 004330 28 ции клеток с 1 мкг/мл немеченного Tata а Клетки HUVE выращивали так, как описано ранее (ссылка 40). IС получали из трансформированных Т-лимфотрофным вирусом человека типа II (HTLV-II) (CD4+)-Т-клеток или стимулированных фитогемагглютинином Тклеток, и использовали супернатанты (1:8) для активации клеток HUVE (пассаж 8-14) в течение 5 суток, как описано ранее (ссылки 9, 46). Такой супернатант содержит интерлейкин-1α (IL-1α) и -β (IL-1β), фактор некроза опухоли α (TNF-α) и -β (TNF-β) и интерферон-γ (IFN-γ) (ссылка 9). Белок Tat родаминировали по остаткам лизина, по существу, так, как описано ранее (ссылка 98). Коротко, 50 мкг рекомбинантного Tat (2 мг/мл) приводили к рН 9,0 посредством добавления 2,5 мкл 1М раствора Nа2СО3. Добавляли 2,5 мкл раствора TRITC в диметилсульфоксиде (ДМСО) (1 мг/мл), и проводили реакцию в течение 8 ч при 4°С. Непрореагировавший TRITC гасили посредством добавления 2,5 мкл 0,5 М раствора NH4Cl, снижали рН до 7,0, используя 1М НСl, и родаминированный Tat диализовали против двух замен 50 мМ трисHCl, рН 7,0, 1 мМ дитиотрейтола (DTT) для удаления погашенного TRITC. В качестве отрицательного контроля использовали BSA или PBS, родаминированные таким же способом. Родаминированный Tat проверяли на активность при росте клеток СПИД-KS, как описано, чтобы убедиться, что биологическая активность сохранилась (ссылка 40). Клетки HUVE предварительно инкубировали в течение 2 ч с бессывороточной средой или 1 мкг/мл немеченного Tat в бессывороточной среде, инкубировали со 100 нг/мл или 1 мкг/мл родаминированного Tat в течение 60 мин, и визуализировали поглощение Tat с помощью флуоресцентной микроскопии. Отрицательный контроль (поглощение +/-) предварительно инкубировали с бессывороточной средой, а затем инкубировали с родаминированным BSA. Таблица 1В. Ингибирование поглощения 10 нг/мл родаминированного Tat клетками HUVE, активированными цитокином, посредством предварительной инкубации клеток с избытком FN или VNa а Таблица 1А. Ингибирование поглощения 100 нг/мл и 1 мкг/мл родаминированного Tat активированными цитокином клетками HUVE посредством предварительной инкуба- Клетки HUVE предварительно инкубировали в течение 2 ч с бессывороточной средой или FN или VN в бессывороточной среде, инкубировали с 10 нг/мл родаминированного Tat в 29 течение 60 мин, и поглощение Tat визуализировали методом флуоресцентной микроскопии. Отрицательный контроль (поглощение +/-) предварительно инкубировали с бессывороточной средой, а затем инкубировали с родаминированным BSA. Поглощение Tat ингибировалось немеченным Tat (табл. 1А), FN или VN (табл. 1В) или предварительной обработкой клеток моноклональными антителами против RGDсвязывающих областей как FN-рецептора α5β1, так и VN-рецептора αvβ3 (фиг. 1А). Интенсивность флуоресценции в клетках снижалась до уровней, наблюдаемых с отрицательным контролем, и никакого ингибирования не наблюдалось при предварительной инкубации клеток с моноклональными антителами против фактора VIII человека, используемого в качестве отрицательного контроля, что указывает, что ингибирование было специфическим (фиг. 1А). Поглощение и ядерная локализация 100 нг/мл Tat ингибировались путем предварительной инкубации клеток с моноклональными антителами против RGD-связывающих областей как рецептора α5β1, так и рецептора αvβ3. Однако в обоих случаях ингибирование было неполным. Эти результаты показывают, что поглощение пикомолярных концентраций Tat опосредуется теми же интегринами, которые участвуют в адгезии клеток к Tat (ссылка 10). Однако при более высоких концентрациях внеклеточного Tat (таких как ≥100 нг/мл) за поглощение некоторой части белка ответственен путь без посредничесва интегринов. В противоположность этим результатам, показано, что поглощение иодированного Tat линиями лимфоцитов и эпителиальных клеток является линейным и зависит от концентрации Tat в среде, и избыток немеченного Tat составлял ему слабую конкуренцию или не составлял таковой, что указывает на отсутствие участия в процессе рецепторов (ссылка 98). Однако интервал концентраций Tat в среде при этом исследовании составлял приблизительно 1-100 мкг/мл (ссылка 98) - значительно выше, чем необходимо для наблюдения поглощения Tat клетками, чувствительными к его биологической активности, такими как активированные первичные эндотелиальные клетки. Кроме того, иодирование Tat может усложнить его строение и затруднить поглощение клетками, и авторы этой работы не приводят данных по биологической активности иодированного Tat. Эти результаты, являющиеся неопубликованными, показывают, что поглощение Tat происходит, по меньшей мере, двумя путями, в зависимости от концентрации белка. При низких (10-100 нг/мл) концентрациях Tat его поглощение опосредуется рецепторами α5β1 и αvβ3 через взаимодействие с последовательностью RGD 004330 30 белка, в то время как при более высоких концентрациях внеклеточного Tat более важен интегриннезависимый путь. Интегринопосредованное поглощение пикомолярных концентраций Tat IС-активированными эндотелиальными клетками показывает, что полностью активный белок способен проникать в антигенпредставляющие клетки, такие как активированные эндотелиальные клетки и дентдритные клетки, что инициирует иммунную реакцию. Пример 2. Конструирование и характеризация мутированных генов tat. Авторы изобретения получили 19 мутантов в различных участках Tat посредством сайтспецифического мутагенеза или посредством делеции. Последовательность каждой мутированной ДНК проверяли путем секвенирования. кДНК мутированных генов tat клонировали в сайт Pstl вектора pCV0, описанный в примере 3. Каждый мутант котрансфицировали, как описано Ensoli et al. (ссылка 41), в клетки COS-1 или в линию Т-клеток Юрката, плазмидой LTR-CAT ВИЧ-1, в которой репортерный ген CAT контролируется LTR ВИЧ-1. Неопубликованные результаты этих экспериментов приводятся в табл. 2. Таблица 2. Действие мутантов Tat на трансактивацию LTRCAT ВИЧ-1 и блокирующее действие (отрицательная трансдоминанта) в отношении активности Tat дикого типа а Результаты приводятся как инкремент активации величин САТ-активности, индуцированной Tat дикого типа (слож. = 1). b Результаты выражены как процент (%) ингибирования активности Tat дикого типа. Из результатов, представленных в табл.2, очевидно, что для большинства мутантов трансактивирующее действие LTR ВИЧ-1 снижено или отсутствует, за исключением мутанта RGD, который имел активность, схожую с активностью Tat дикого типа. Авторы выбрали 4 мутанта (cys22, lys33, phe38, lys41) с наименьшей 31 (почти нулевой) трансактивирующей активностью и определили отрицательное трансдоминирующее действие на трансактивирующую активность Tat дикого типа. Для этого клетки COS-1 котрансфицировали каждым вектором, содержащим мутант Tat и вектор pCV-Tat (в молярном соотношении 10:1), в присутствии вектора LTR-CAT ВИЧ-1. Как видно из табл.2, мутанты lys41 и tyr47 ингибировали активность Tat почти полностью, в то время как мутанты lys33 и cys22 ингибировали активность Tat частично. Однако рекомбинантный белок cys22 (описанный далее в примере 3) конкурирует с белком Tat дикого типа в отношении трансактивации LTR-CAT ВИЧ-1 (фиг. 1В). Были отобраны мутант в цистеиновой области (cys22), мутант в коровой области (lys41), мутант с делецией последовательности RGD (RGD∆) и двойной мутант, содержащий мутацию по lys41 и делецию последовательности RGD (lys41-RGD∆). Последовательности вставки tat и мутантов, отобранных для вакцинации, приводятся далее. Описывается ряд мутантов, полученных путем 1) замены основания для получения замены аминокислоты и 2) делеции основания для получения делеции соответствующих аминокислот. Замены и делеции получали путем направленного мутагенеза. Последовательности гена tat дикого типа и мутантов гена tat, приведенные далее, встраивали в плазмидный вектор pCV0 так, как описано выше. Под SEQ ID N 1 подразумевается последовательность гена tat ВИЧ-1 из клона ВН-10 и его производный белок. Под SEQ ID N 2 подразумевается последовательность мутанта cys22 (и его производный белок), создаваемого посредством замены нуклеотида тимина (Т) в позиции 66, начиная от 5'-конца, на нуклеотид гуанин (G). Эта замена приводит, в полученной аминокислотной последовательности, к замене цистеина (С в однобуквенном коде) в позиции 22 в аминоконце на глицин (G в однобуквенном коде). Под SEQ ID N 3 подразумевается последовательность мутанта lys41 (и его производный белок), создаваемого посредством замены нуклеотида тимина (Т) в позиции 123 от 5'-конца на нуклеотид цитозин (С). Эта замена приводит, в полученной аминокислотной последовательности, к замене лизина (К в однобуквенном коде) в позиции 41 от аминоконца на треонин (Т в однобуквенном коде). Под SEQ ID N 4 подразумевается последовательность мутанта RGD (и его производный белок), создаваемого посредством делеции из гена tat дикого типа нуклеотидной последовательности CGAGGGGAC от нуклеотида 232 до нуклеотида 240, начиная от 5'конца. Это приводит к делеции аминокислот аргинина, глицина и аспарагиновой кислоты (RGD в однобуквенном коде) в позициях 78-80 от аминоконца. Под SEQ ID N 5 подразумевается последовательность двойного мутанта lys41- 004330 32 RGD∆ (и его производный белок), создаваемого посредством сочетания описанных выше мутантов. Нуклеотидная последовательность tat дикого типа SEQ. id. NO. 1 Пример 3. Конструирование и характеризация ДНК-иммуногенов. Молекулы ДНК для инокуляции животных встраивают в плазмидный вектор pCV0 в 6,4 кб (ссылка 5). Эта плазмида содержит две точки начала репликации SV40, главный поздний промотор аденовируса (AdMLP) и сплайсингпоследовательности аденовируса и генов мышиного иммуноглобулина, кДНК мышиного дигидрофолатредуктазного гена (dhfr) и сигнал полиаденилирования SV40. Сайт для рестриктазы Pstl локализуется в 3' AdMLP и представляет сайт, в котором клонируется представляющий интерес экзогенный ген. кДНК гена tat (261 пара оснований) (послед. 1, пример 2) ВИЧ-1 была получена из клона ВН10 ВИЧ-1 (ссылка 126) и кодировала белок длиной в 86 аминокислот. Вектор pCV-Tat (ссылка 5) получали посредством клонирования кДНК tat в сайт pCVO Pstl, контролируемый AdMLP. Выбор указанного 33 вектора основан на том, что AdMLP индуцировал более сильные экспрессию и секрецию Tat по сравнению с другими эукариотными промоторами, такими как, например, промотор немедленно-ранней области цитомегаловируса (CMV), как показано Ensoli et al. (ссылка 41) и в табл.3. Таблица 3. Экспрессия, субклеточная локализация, секреция и активность Tat в клетках COS-1, трансфицированных pCV-Tat и CMV-Tata а Клетки COS-1 (5х106)трансфицировали посредством электропорации 30 мкг pCV-Tat, CMV-Tat или контрольной ДНК. Через 48 ч после трансфекции экспрессию Tat оценивали методом иммуногистохимии с моноклональными антителами (приведенные величины являются средними процентами показателей положительных клеток) и по локализации ядерного и цитоплазматического Tat. Наличие внутри- и внеклеточного Tat анализировали с помощью радиоиммунопреципитации на клеточных экстрактах (500 мкл) и в культуральных средах (4 мл) и полученных затем результатов по денситометрии (Gelscan XL; Pharmacia) полос осажденного Tat. Активность внутриклеточного Tat измеряли на клеточных экстрактах клеток COS-1, котрансфицированных Tatэкспрессирующими векторами или контрольным вектором и плазмидой LTR-CAT ВИЧ-1; активность внеклеточного Tat в отношении пролиферации клеток СПИД-KS (определяемую методом анализа с включением 3Н-тимидина) измеряли в культуральной среде (разведенной 1:2 и 1:4) клеток, трансфицированных плазмидами, экспрессирующими Tat, или контрольной плазмидой. Результаты представляют собой среднее результатов пяти независимых экспериментов. b Денситометрический анализ полосы иммунопреципитированного Tat. Величины выражены в показателях условной шкалы, причем общая определяемая минимальная величина (внутри- и внеклеточный Tat) равна 10. с - означает, что клетки Tat-отрицательные; + означает, что Tat-положительных клеток 50%; ++ означает, что Tat-положительных клеток 50100%. d CAT-активность после 20-минутной инкубации относительно контрольного вектора, показатель активации которого принимается за 1. е Рост клеток СПИД-KS измеряли методом анализа с включением 3[Н]-тимидина (стандартное отклонение (SD) 12%). Супернатанты клеток, трансфицированных контрольной ДНК, включали 1400 чим 3[Н]-тимидина (SD 11,5%). 004330 34 Культуральная среда, полученная от активированных Т-лимфоцитов (положительный контроль), включала 2400 чим 3[Н]-тимидина (SD 10%). Табл.3 показывает, что в случае клеток, трансфицированных pCV-Tat, по сравнению с клетками, трансфицированными CMV-Tat, более высокими являются процент Tatположительных клеток и общее содержание Tat, количество выделившегося Tat значительно выше и соотносится с общим содержанием Tat и содержанием его в цитоплазме, и поэтому выше биологическая активность внеклеточного Tat в отношении роста клеток СПИД-KS. Такие результаты показывают, что вектор pCV-Tat кодирует биологически активный белок, индуцирует высокие уровни экспрессии гена tat и может высвободить из клеток значительно большее количество Tat, чем вектор CMV-Tat. Вектор pCV0 также используют для экспрессии генов ВИЧ-1 nef, rev и gag, и генов, кодирующих цитокины IL-12 и IL-15. кДНК генов nef (618 пар оснований, штамм NL43) (ссылка 112), rev (348 пар оснований, штамм NL43) (ссылка 95) и gag (1500 пар оснований, штамм NL43) (ссылка 95), или кДНК генов IL-12 (ссылка 165) или генов IL-15 (ссылка 56) амплифицируют посредством метода полимеразной цепной реакции (PCR) с использованием специфических праймеров, комплементарных первым 15 нуклеотидам 5'-области (прямые праймеры) (послед. Р1, Р3, Р5, Р7, Р9) или последним 15 нуклеотидам 3'-области (обратные праймеры) (послед. Р2, Р4, Р6, Р8, Р10). Кроме того, каждый праймер, как прямой, так и обратный, содержит последовательность рестриктазы Pstl, допускающую клонирование амплифицированного продукта в вектор pCV0. После клонирования последовательность встроенных генов проверяют методом секвенирования ДНК. Вектор pCV0 также используют для коэкспрессии Tat с другими генами вируса ВИЧ-1 (rev, nef или gag) или с генами цитокинов IL-12 или IL15. Для этого кДНК гена tat ВИЧ-1 в 261 пару оснований (послед. 1, пример 2) амплифицируют методом PCR с прямым праймером, включающим последовательность для рестриктазы Pstl (послед. Р11), и обратным праймером, комплементарным последним 15 нуклеотидам гена tat (послед. Р12). Гены вируса (nef, rev или gag) или гены, кодирующие цитокины IL-12 или IL15, амплифицируют с помощью прямого праймера, включающего также последовательность 15 оснований, комплементарных 3'-области, позволяющего гену находиться в рамке считывания с геном tat (послед. Р13, Р14, Р15, Р16, Р17), и обратного праймера, включающего последовательность рестриктазы Pstl (послед. Р2, Р4, Р6, Р8, Р10). Затем осуществляют третью PCR, при которой ДНК-матрица представляется амиплифицированными продуктами гена tat и нужного гена. Прямой праймер представляется 35 праймером, используемым для амплификации tat (послед. Р11), а обратный праймер - праймером, используемым при амплификации нужного гена (послед. Р2, Р4, Р6, Р8, Р10). Амплифицированный продукт tat/(нужный ген) очищают в агарозе, расщепляют Pstl и клонируют в pCV0. После клонирования последовательность встроенных генов проверяют методом секвенирования ДНК, в то время как экспрессию белка определяют с помощью трансфекции, как описано выше (ссылка 41). Указанными выше праймерами являются Пример 4. Инокуляция здоровых Масаса fascicularis вакциной против белка Tat: оценка безопасности, толерантости, специфической иммунной реакции и эффективности защиты от заражения вирусом. Толерантность, безопасность и способность вызывать специфическую иммунную реакцию (гуморальную и клеточную) и защиту от заражения вирусом вакцины на основе рекомбинантного Tat, полученного описанным способом и очищенного с помощью гепаринаффинных колонок, оценивали на экспериментальной модели собакоподобной (cynomolgus) обезьяны (Масаса fascicularis). Для того, чтобы индуцировать полиспецифическую иммунную реакцию, авторы использовали фосфат алюминия (Alum), который проверен на многих моделях, и он один одобрен для применения к людям. Из ряда специфических адъювантов авторы использовали RIBI (относящийся к группе эмульгаторов или состоящий из монофосфорилированного липида A, dimycolic trehasole и каркаса бактериальной 004330 36 стенки палочки Кальметта-Герена) (ссылки 7, 109). В первом пилотном эксперименте оценивали толерантность, безопасность и способность вызывать специфическую иммунную реакцию (гуморальную и клеточную). Так, 3 обезьян инокулировали по следующей схеме: обезьяну 1 (Ml) инокулировали рекомбинантным Tat (100 мкг), ресуспендированным в 250 мкл аутологичной сыворотки и 250 мкл RIBI, подкожным методом в одном месте; обезьяну 2 (М2) инокулировали рекомбинантным Tat (10 мкг), ресуспендированным в 250 мкл аутологичной сыворотки и 250 мкл RIBI, подкожным методом в одном месте; и обезьяна 3 (М3) была контрольным животным, инокуляция которой не проводилась. У всех обезьян в дни -42 и -35 перед первой вакцинацией брали по 10 мл крови для определения базовых параметров. Образцы сыворотки и плазмы замораживали при -20°С или -80°С и в дальнейшем использовали для ресуспендирования белкового инокулята. Обезьян 1 и 2 инокулировали в момент времени 0 и через 2, 5, 10, 15, 22, 27, 32 и 37 недель. Иммунизацию прерывали на 37 неделе для обезьяны Ml и на 41 неделе для обезьяны М2. Животных умервщляли, и исследовали иммунологические параметры некоторых органов и тканей (селезенка и лимфоузлы), например, оценивали наличие пролиферативной реакции на Tat и CAF- и CTLактивность против Tat. CAF-активность является антивирусной активностью, опосредованной (CD8+)-лимфоцитами, не ограниченной ГКГС и нецитолитической. В те же дни, когда проводили инокуляцию иммуногена, у каждой обезьяны брали по 10 мл крови для лабораторных испытаний (химико-физические анализы, количественное определение электролитов, лейкоцитов, числа тромбоцитов и гемоглобина), оценки иммунологических параметров, таких как наличие специфических иммуноглобулинов (IgM, IgG, IgA), содержание цитокинов типа Thl (IL-2, IFN?) и типа Th2 (IL-4, IL-10), продуцирование хемокинов (RANTES, МIР-1α и МIР-1β), лимфоцитарный фенотип (CD4, CD8, CD3, CD14, CD20, CD25, CD56, HLA-DR, CD45RA), пролиферативная реакция на Tat, наличие специфической цитотоксической активности (CTL), наличие антивирусной активности (CAF) и наличие общей антивирусной активности (ТАА), опосредованной РВМС и аутологичной сывороткой. Кроме того, для того, чтобы оценить in vivo наличие клеточноопосредованной иммунной реакции, на всех вакцинированных и контрольных обезьянах проводили кожную пробу на Tat. Результаты этого эксперимента следующие. Не наблюдали никаких изменений химикофизических, гематологических и поведенческих параметров. У вакцинированных и контрольных обезьян признаков воспаления и неоваскуляризации в местах инокуляции не обнаружено. Эти результаты показывают, что белок Tat хорошо 37 переносился животными и не был токсичным в введенных дозах и при данном способе введения. У обезьян Ml и М2 присутствие антител IgG типа, специфического для Tat, обнаруживалось на 5 неделе после первой вакцинации. На 37 неделе IgG против Tat можно было обнаружить в плазме, разведенной 1:6400, у обеих обезьян, а на 41 неделе при разведении плазмы 1:12800 у обезьяны М2. Эти результаты приводятся на фиг. 2 и 3. У контрольной обезьяны М3 обнаружены антитела против Tat с очень низкими титрами, подобными тем, какие вызываются повторными инокуляциями малого количества Tat, которое инъецировали данной обезьяне для контроля за специфичностью реакций на кожную пробу. У обезьян Ml и М2 антитела против Tat были направлены, главным образом, против аминоконцевой области (ак 1-20) Tat, с титром 1:3200 (фиг. 4). У обезьяны М2, вакцинированной 10 мкг Tat, также обнаруживались антитела, направленные против ак Tat 36-50 и 44-60, с титрами 1:50 и 1:100, соответственно (фиг. 4). Способность сыворотки обезьян нейтрализовать Tat определяли посредством анализов in vitro, при которых измеряли ингибирование сохранения репликации ВИЧ-1 в клетках HLM-1 после добавления экзогенного Tat, как описано ранее (ссылка 41). Эти анализы показали, что плазма от обезьян M1 и М2 на 27 неделе после первой вакцинации блокировала репликацию вируса, индуцированную экзогенным Tat, что определяли по количеству антигена р24 в культуральных супернатантах. Напротив, предиммунная плазма от тех же обезьян не блокировала активность Tat (табл.4). Таблица 4. Нейтрализующая активность плазмы обезьян в отношении сохранения репликации вируса, индуцированной внеклеточным Tata а Нейтрализующую активность плазмы определяли в клетках HLM-1 (клетки HeLa-CD4+, содержащие интегрированную копию провируса ВИЧ-1, дефектного по гену tat). Клетки HML-1 высевали в количестве 6 х 105 клеток на лунку в 24-луночные планшеты и инкубировали при 37°С в течение 16 ч. Клетки дважды промывали PBS, содержащим 0,1% бычьего сывороточного альбумина (BSA), и культивировали в течение 48 ч со свежей средой (0,3 мл) в присутствии рекомбинантного белка Tat и равного объема плазмы животного, отобранной в момент времени 0 (предиммунная плазма) или на 27 неделе (иммунная плазма). Отрицательный контроль был представлен клетками, обработанными только пулом предиммунной плазмы, пулом иммунной плазмы или PBS, содержащим 0,1% 004330 38 BSA (PBS + 0,1% BSA), без Tat. Во всех контрольных образцах не наблюдалось влияния на сохранение репликации вируса. Каждую плазму проверяли дважды. Присутствие вируса, выделенного клетками, анализировали посредством количественного определения антигена Gag p24 с использованием коммерческого набора для ELISA антигена р24 (NEN-Dupont). Результаты выражены в процентах ингибирования сохранения вируса [измеренного для каждой плазмы в виде среднего показателя для р24 (пг/мл) в двух лунках] иммунной плазмой при сравнении с предиммунной плазмой (ингибирование 0%). Обезьян M1 и М2 вакцинировали рекомбинантным белком Tat (100 мкг и 10 мкг, соответственно), ресупендированным в 250 мкл аутологичной сыворотки и 250 мкл RIBI, и делали подкожную инъекцию в одном месте. Результаты показывают наличие пролиферативной реакции на Tat на 22 неделе (табл.5) у обезьян, вакцинированных рекомбинантным Tat, причем более сильной у обезьяны М2, получавшей 10 мкг рекомбинантного Tat при каждой повторной иммунизации. Таблица 5. Пролиферативная реакция на Tata а РВМС, выделенные методом градиента плотности фиколла, высевали при концентрации 2x105 клеток на лунку при трехкратном повторе в 96-луночный планшет с плоскодонными лунками, культивировали в RPMI-1640 с добавлением 10% фетальной телячьей сыворотки (FCS) и стимулировали Tat (1 или 5 мкг/мл), РНА (4 мкг/мл) или столбнячным анатоксином (ТТ), против которых вакцинировали обезьян. Нестимулированные контрольные клетки инкубировали в среде RPMI, 10% FCS. Усиление клеточной пролиферации измеряли на 5 день методом с включением 3[Н]-тимидина, как описано ранее (ссылки 39, 22). Результаты выражали в виде индекса стимуляции и вычисляли следующим образом: среднее испытываемого образца (чим)/ среднее контроля (чим). Величины свыше 2,5 считали положительными. Обезьян M1 и М2 иммунизировали подкожно 100 мкг или 10 мкг рекомбинантного Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI. М3 представляет контрольную обезьяну. Как показано в табл. 6, цитотоксическая активность в отношении Tat у обезьян M1 и М2, 39 иммунизированных рекомбинантным Tat, не обнаружена. Таблица 6. Анализ цитотоксической активности в отношении Tat (CTL)a а РВМС, выделенные центрифугированием в градиенте плотности фиколла, ресуспендировали при концентрации 1 х 107 клеток/мл в RPMI-1640 с добавлением 10% термоинактивированной FCS и высевали в 24-луночный планшет (500 мкл на лунку), и инкубировали в течение 12 ч при 37°С в присутствии 1 мкг Tat. На другой день клетки, инкубированые без Tat, центрифугировали при 1500 об/мин и ресуспендировали в 50 мкл RPMI-1640 с добавлением 10% FCS, инкубировали в течение 3 ч при 37°С с 1 мкг Tat, промывали, ресуспендировали в 500 мкл свежей среды и добавляли в лунку, содержащую предварительно стимулированные РВМС. В день 2 клетки разводили 1 мл среды, содержащей IL-2 (2 МЕ/мл) и культивировали в течение 14 суток. Аутологичные В-лимфоциты, взятые от каждой обезьяны до начала осуществления вакцинации, использовали в качестве клеток-мишеней (BLCL). С этой целью РВМС, выделенные посредством центрифугирования в градиенте плотности фиколла, в день 35 высевали, при концентрации 3 х 105 клеток на лунку, в 96-луночный планшет и культивировали в течение 2 или 3 недель в присутствии 50% среды, собранной с клеточной линии, продуцирующей Papovirus, как описано ранее (ссылка 28). Десять линий В-клеток, полученных для каждого животного, размножали и замораживали. Для проверки токсичности использовали цитотоксический тест Delifa (Wallac, Турку, Финляндия), основанный на флуоресценции, разрешенной во времени (ссылки 12, 13, 14). С этой целью BLCL культивировали при концентрации 1 х 106 клеток на 200 мкл RPMI 1640 с добавлением 10% FCS, содержащей 4 мкг Tat, в течение 12 ч при 37°С. В качестве контроля другую аликвоту аутологичных BLCL инкубировали с той же средой без Tat. BLCL промывали и ресуспендировали в 1 мл RPMI 1640 с добавлением 10% FCS, содержащей 5 мкл усиливающего флуоресценцию лиганда, и инкубировали в течение 15 мин при 37°С в соответствии с рекомендациями изготовителя. После 5 промываний BLCL ресуспендировали в концентрации 5 х 104 клеток/мл и сразу же центрифугировали, чтобы собрать супернатант, который использовали для измерения фонового уровня. РВМС (эффекторы) высевали, при двукратном повторе и концентрации 2,5 х 104 клеток на 100 004330 40 мкл в среде, содержащей IL-2, и сразу же разводили в 96-луночном планшете. В каждую лунку добавляли 5 х 103 клеток-мишеней на 100 мкл (выращенных с Tat или без него). Соотношения мишень-эффектор составляли 1:50, 1:25, 1:12,5, 1:6,25, 1:3,125. РВМС и клетки-мишени (кратковременно обработанные Tat или необработанные) инкубировали в течение 2 ч при 37°С с i) 20 мкл 5% тритона, чтобы измерить максимальное высвобождение, ii) 100 мкл среды для выращивания для обнаружения спонтанного высвобождения, iii) 200 мкл супернатанта от клеток-мишеней для обнаружения фонового уровня. По окончании времени инкубации планшеты центрифугировали. По 20 мкл каждого супернатанта переносили в новый планшет и инкубировали в присутствии 200 мкл Еврораствора, содержащегося в наборе. Флуоресценцию измеряли после 20-минутной инкубации с помощью аппарата для регистрации разрешенной во времени флуоресценции (Victor, Wallac, Турку, Финляндия). Специфическую CTL-активность определяли следующим образом: % специфического высвобождения = [(среднее, обнаруженное для образца - фон) - (спонтанное высвобождение -фон)]/ [(максимальное высвобождение фон) - (спонтанное высвобождение - фон)] х 100. Пробу считали положительной, когда Tatспецифическое высвобождение превышало 4% при наибольших соотношениях эффектормишень при испытаниях. 4% являются произвольной величиной, установленной на основании предварительных контрольных экспериментов. ND означает, что величины не определены. Обезьяну М2 иммунизировали подкожно 10 мкг рекомбинантного Tat, ресуспендированного в 250 мкл аутологичной сыворотки и 250 мкл RIBI. М3 представляет контрольную обезьяну. ND означает, что определения не проводились. * РВМС выделяли из периферических лимфоузлов после умервщления обезьяны М2. Кроме того, результаты показывают в недели 22, 27 и 37 присутствие растворимой антивирусной активности, опосредованной (CD8+)Т-лимфоцитами (CAF), измеренной как способность клеточных супернатантов от (CD8+)-Тлимфоцитов обезьяны ингибировать острую инфекцию химерного вируса SHIV 89.6Р в клетках СЕМх174 или регулировать реактивацию хронической ВИЧ-1-инфекции в клетках ОМ10-1 (табл. 7). При сравнении с контрольными животными у вакцинированных обезьян, как правило, наблюдали CAF-активность. Таблица 7. Анализ присутствия растворимой антивирусной активности, опосредованной (CD8+)-Т-лимфоцитами (CAF)a 41 а РВМС от обезьян, вакцинированных 100 мкг (M1) и 10 мкг (М2) рекомбинантного белка Tat, и от контрольной обезьяны (М3), которую не вакцинировали, но повторяли для нее кожные пробы с Tat, выделяли в градиенте плотности фиколла. Культуры, обогащенные (CD8+)Т-лимфоцитами, выделяли из РВМС с помощью магнитных гранул против CD8 (Dynabeads, Dynal, Норвегия) согласно рекомендациям изготовителя. Чистоту культур контролировали с помощью FACS-анализа с использованием ряда антител, направленных против специфических клеточных маркеров (CD3, CD4, CD8). Культуры, обогащенные CD8+, высевали (при двукратном повторе) в количестве 5 х 105 клеток на 500 мкл на лунку в 48-луночные планшеты, предварительно сенсибилизированные моноклональными антителами против CD3 (2,5 мкг/мл, Bio-Source International, Camarillo, CA), (и инкубировали) в течение 12 ч при 4°С, и выращивали в RPMI 1640, содержащей 10% фетальной телячьей сыворотки и IL-2 (20 Е/мл). Каждые три дня в течение двух недель собирали 250 мкл среды и заменяли равным объемом свежей среды. Клеточные супернатанты центрифугировали, фильтровали (0,45 мкм) и хранили при -80°С. Клеточные супернатанты, полученные во все указанные моменты времени, за исключением первого, собирали, и проверяли наличие антивирусной активности как их способности ингибировать репликацию вируса в двух системах, представленных острой и хронической инфекцией, соответственно. В случае острой инфекции использовали клеточную линию СЕМ х 174, которая происходит от линии В-клеток человека 721.174, слитой с линией Тклеток человека СЕМ (ссылка 143). Клетки (2 х 105) инкубировали в полипропиленовых пробирках с 200 мкл супернатантов CD8+, полученных так, как описано выше, или без них, в течение 2 ч при 37°С. Клетки промывали 3 раза свежей средой, высевали в количестве 2 х 104 клеток на лунку в 96-луночные планшеты и инкубировали в 200 мкл без культуральных супернатантов (необработанные клетки) или с разными объемами (50 мкл, 5 мкл и 0,5 мкл) культуральных супернатантов (обработанные клетки), полученных от (CD8+)-Т-лимфоцитов обезьян, инъецированных вакциной, или от контрольной 004330 42 обезьяны. После заражения аликвоты культуральных супернатантов собирали каждые три дня и заменяли равным объемом полной среды, в которую предварительно добавляли культуральный супернатант CD8+ от вакцинированных и контрольных обезьян. Результаты, приведенные в таблице, соответствуют 7 дню после заражения и выражены в виде процента (%) ингибирования репликации вируса в клетках, обработанных культуральными супернатантами CD8+, полученных от вакцинированных обезьян, по сравнению с необработанными клетками. Репликацию вируса определяли посредством измерения показателей RT, как описано ранее (ссылка 54), или показателей Gag p27, методом ELISA, в культуральных супернатантах, собранных в каждый момент времени. В случае хронической инфекции использовали клеточную линию ОМ-10-1 (ссылки 20, 21), которая представляет линию Т-лимфоцитов человека, хронически инфицированного ВИЧ-1. Клетки высевали (при двукратном повторе) в количестве 5 х 104 клеток в 200 мкл на лунку в 96луночные планшеты в присутствии антител против TNF? (40 мкг/мл) без клеточных супернатантов или с разными объемами (50 мкл, 5 мкл и 0,5 мкл) клеточных супернатантов (CD8+)-Т-лимфоцитов, полученных от вакцинированных или контрольных обезьян. Клетки для пролиферации активировали РМА (10-7 М). Через 24 ч собирали аликвоты культуральной среды для определения репликации вируса посредством измерения содержания RT или Gag p24 методом ELISA. Результаты представлены в виде % ингибирования реактивации инфекции в обработанных клетках по сравнению с необработанными клетками. Результаты для острой и хронической инфекции, приведенные в таблице, относятся к клеткам, обработанным 5 мкл супернатанта, полученного от культур клеток CD8+. ND означает, что определения не проводились. Анализ замедленной гиперчувствительности (DTH) с помощью кожной пробы показал, что как вакцинированные (M1 и М2), так и контрольная (М3) обезьяны были в этом отношении отрицательными (табл. 8). Таблица 8. Кожная проба на Tata a Tat (1 и 5 мкг) в 150 мкл PBS-0,1% BSA или в одном буфере инокулировали интрадер- 43 мальным способом в предварительно выбритый участок спины вакцинированных и контрольных (контроль специфичности реакции) обезьян в недели 10, 15, 22, 27, 32 и 37 после первой иммунизации. Обезьян M1 и М2 вакцинировали рекомбинантным белком Tat (100 мкг и 10 мкг, соответственно) в 250 мкл аутологичной сыворотки и 250 мкл RIBI, вводимым подкожным способом в одном месте. Обезьяна М3 является контрольным животным, которое не вакцинировали. Появление узловатой эритемы через 48-72 ч наводило на мысль о реакции замедленной гиперчувствительности (DTH): ++ соответствует ∅ ≥ 5 мм; + соответствует ∅ ≥ 1-4 мм; +/соответствует эритеме без затвердевания; - соответствует ∅ < 1 мм. Результаты пилотного эксперимента показывают, что рекомбинантный Tat, полученный и очищенный по схеме, описанной авторами изобретения, был нетоксичен при дозах 100 и 10 мкг, введенных подкожным способом. Кроме того, белок Tat выявлял специфическую и обширную иммунную реакцию с антивирусными активностями, как гуморальную, так и клеточноопосредованную. Более сильную и специфическую иммунную реакцию против Tat наблюдали у обезьяны М2, вакцинированной 10 мкг рекомбинантного белка. Кроме того, адъювант RIBI не показал сколько-нибудь явных признаков токсичности на вакцинированных обезьянах. На основании этих результатов был спланирован второй пилотный эксперимент для того, чтобы определить влияние иммунизации 10 мкг Tat в сочетании с адъювантами RIBI или Alum. Обезьян инъецировали подкожным способом в одном месте по описанной далее схеме. Обезьяны М1-3: 10 мкг рекомбинантного белка Tat в 250 мкл аутологичной сыворотки и 250 мкл RIBI. Обезьяны М4-6: 10 мкг рекомбинантного белка Tat в 250 мкл аутологичной сыворотки и 250 мкл Alum. Обезьяна М7: 250 мкл RIBI и 250 мкл аутологичной сыворотки (контрольная обезьяна). Обезьяна М8: 250 мкл Alum и 250 мкл аутологичной сыворотки (контрольная обезьяна). У каждой обезьяны в день -9, предшествующий первой иммунизации, брали по 10 мл крови для осуществления проверок, описанных в предыдущем пилотном эксперименте, и для определения базовых параметров каждого животного. Обезьян инокулировали в момент времени 0 и через 2, 6, 11, 15, 21, 28 и 32 недели. На 36 неделе обезьяны М1-6 получили последнюю инъекцию рекомбинантным белком Tat (16 мкг) в 200 мкл ISCOM (иммунностимулирующий комплекс) и 300 мкл PBS. ISCOM представляет собой адъювант, содержащий квил-А-сапонин, холестерин и фосфолипиды, усиливающий гуморальную и клеточноопосредованную иммунную реакцию (ссылки 109, 90). Обезьянам М7 и М8 в те же моменты времени инъецировали только адъюванты. В 004330 44 каждый момент вакцинации и в недели 40, 44 и 50 у животных брали по 10 мл крови для анализа клинических и иммунологических параметров, описанных в предыдущем пилотном эксперименте. Кроме того, собирали образцы мочи и влагалищные мазки для анализа на присутствие Tat-специфического секреторного IgA. Для того, чтобы оценить защитное действие иммунизации Tat против инфекции, вакцинированных и контрольных обезьян заражали химерным "вирусом иммунодефицита обезьяны/человека" (SHIV), штамм 89.6Р, содержащим ген tat ВИЧ-1, предварительно выращенным и оттитрованным в Масаса fascicularis (ссылки 128, 129, 69). После заражения у животных контролировали (каждые две недели в первый месяц, каждые четыре недели в следующие три месяца и каждые 8 недель до 6-12 месяцев) вирусологические параметры, такие как антигенимия плазмы на р27 и вирусный груз плазмы и клеток. Для того, чтобы подтвердить, что заражение произошло, также проводился поиск антител против SIV с помощью коммерческого набора, применяемого для обнаружения антител против ВИЧ-2, который распознает также антитела против SIV (набор Elavia Ac-Ab-Ak II, Diagnostic Pasteur, Париж, Франция). На данный момент результаты второго пилотного эксперимента следующие. Не наблюдалось никаких изменений химико-физических, гематологических и поведенческих параметров. У обезьян не было каких-либо признаков воспаления или неоваскуляризации в месте инокуляции. Наблюдали образование специфических антител (IgM, IgG). В 15 неделю титры антител против Tat (IgG) достигли высоких уровней, причем интервал составлял от 1:64000 до 1:25600 (фиг. 5-7). Антитела с титрами от 1:1600 до 1:3200 (фиг. 8) реагировали, по существу, с аминоконцевой областью (ак 1-20) Tat, как видно на 22 неделе. Кроме того, также обнаружены антитела против ак 46-60 Tat с титрами в интервале от 1:100 до 1:200 (фиг. 8). Способность плазмы обезьян нейтрализовать Tat-активность проверяли посредством оценки ингибирования спасения вируса в клетках HLM-1, инкубированных с серийными количествами экзогенного Tat, как описано ранее в первом пилотном эксперименте. Результаты этих экспериментов показывают, что иммунная плазма (разведенная 1:2) от обезьян M1-6 на 15 неделе блокировала репликацию вируса, индуцированную 30 нг/мл экзогенного Tat, что определили путем измерения антигена р24, секретированного в культуральную среду. Напротив, предиммунная плазма обезьян M1-6 или плазма контрольных обезьян (М7, М8) не блокировали Tatактивность (табл. 9). Кроме того, иммунная плазма (разведенная 1:2) обезьян M1-6, взятая на 21 неделе, блокировала репликацию вируса, индуцированную 60 нг/мл, 120 нг/мл, 240 нг/мл и 500 нг/мл экзогенного Tat. В частности, в этих 45 образцах плазмы определили 10-кратное снижение репликации вируса, индуцированной весьма высокими дозами внеклеточного Tat (240 нг/мл и 500 нг/мл) (табл. 9). Таблица 9. Нейтрализующая активность иммунной плазмы в отношении спасения репликации вируса, индуцированной внеклеточным Tata 004330 46 ной плазмы обезьяны или в 15 или в 21 неделю (иммунная плазма). Обезьян М1-3 вакцинировали 10 мкг Tat в 250 мкл аутологичной сыворотки и 250 мкл RIBI; обезьян М4-6 вакцинировали 10 мкг Tat в 250 мкл аутологичной сыворотки и 250 мкл Alum; контрольных обезьян инъецировали RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) или Alum (250 мкл и 250 мкл аутологичной сыворотки) (М8). Результаты представлены в таком виде, как описано в пояснении к табл. 4. Способность плазмы обезьян нейтрализовать активность внеклеточного Tat, секретированного клетками во время острой инфекции, проверяли на клетках СЕМ х 174, инфицированных химерным вирусом SHIV 89.6Р. На 7 день после заражения наблюдали репликацию вируса в 50% контрольных клеток, инфицированных SHIV и культивированных с предиммунной плазмой обезьян М1-6. Напротив, репликации вируса не обнаружили в инфицированных клетках, которые выращивали в присутствии иммунной плазмы, взятой у обезьян М1-6 на 44 неделе (табл. 10). Таблица 10. Нейтрализующая активность иммунной плазмы в отношении передачи вирусной инфекцииа а а Способность плазмы против Tat нейтрализовать Tat-активность определяли на клетках HLM-1, как описано в пояснении к табл. 4. Рекомбинантный белок Tat (30 нг/мл, 60 нг/мл, 120 нг/мл, 240 нг/мл и 500 нг/мл) добавляли один или вместе с равным объемом предиммун- Клетки СЕМ х 174 (3 х 104 клеток на 150 мкл) в 96-луночных планшетах инфицировали химерным вирусом SHIV 89.Р6 (5 х 10-5 TCID50/клетку) в течение 2 ч при 37°С в RPMI 1640, содержащей 10% FCS. Клетки дважды промывали RPMI 1640 и ресуспендировали в 150 мкл полной среды с добавлением 5% предиммунной плазмы обезьян или иммунной плазмы (44 неделя), полученной от животных, вакцинированных рекомбинантным Tat (10 мкг) и RIBI (M1-3) или Alum (M4-6). Плазму животных предварительно грели при 56°С в течение 30 мин и анализировали методом ELISA для контроля за титрами антител против Tat. Каждую сыворотку проверяли дважды. В дни 3, 5 и 7 после заражения собирали 120 мкл культуральной среды и заменяли равным объемом свежей среды, содержащей 5% предиммунной плазмы или иммунной плазмы от обезьян М1-6. Способность плазмы нейтрализовать внеклеточный Tat, секретированный во время острой инфекции, и борьбу с передачей инфекции in 47 vitro определяли посредства поиска вирусного Gag p27 в культуральной среде методом ELISA (Coulter International, Майами, Флорида). Результаты, представленные в виде количества р27 (пг/мл), соответствуют среднему значению, полученному в двух лунках для каждой сыворотки на 7 день после заражения. Кроме того, с 11 недели наблюдали пролиферативную реакцию на Tat (табл. 11). 004330 48 обезьян, вакцинированных Tat и Alum (М4 и М5), в то время как у обезьяны М6, иммунизированной Tat и Alum, CTL-реакция была слабее (фиг. 9 и табл. 12). Таблица 12. Анализ CTL-реакции Таблица 11. Пролиферативная реакция на Tata а Анализ осуществляли так, как описано для табл. 6. Обезьян М1-3 иммунизировали 10 мкг рекомбинантного Tat в 250 мкл аутологичной сыворотки и 250 мкл RIBI; обезьян М4-6 инокулировали 10 мкг рекомбинантного Tat в 250 мкл аутологичной сыворотки и 250 мкл Alum; двух контрольных обезьян инокулировали RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) и Alum (250 мкл и 250 мкл аутологичной сыворотки) (М8). ND означает, что определения не проводились. На 44 неделе определяли наличие общей антивирусной активности (ТАА). ТАА измеряли как способность РВМС от обезьян, вакцинированных рекомбинантным Tat, выращенных в присутствии аутологичной сыворотки, противостоять заражению SHIV 89.6Р (табл. 13). Таблица 13. Анализ наличия общей антивирусной активности (ТАА)а а Лимфоциты периферической крови выделяли, активировали РНА (4 мкг/мл), столбнячным анатоксином (ТТ) (10 мкг/мл) и Tat (5 мкг/мл), и проводили анализы, как описано в пояснении к табл.5. Обезьян М1-3 инокулировали 10 мкг рекомбинантного белка Tat в 250 мкл аутологичной сыворотки и 250 мкл RIBI; обезьян М4-6 инокулировали 10 мкг рекомбинантного Tat в 250 мкл аутологичной сыворотки и 250 мкл Alum; двух контрольных обезьян инокулировали RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) и Alum (250 мкл и 250 мкл аутологичной сыворотки) (М8). ND означает, что определения не проводились. Сильная цитотоксическая реакция Тклеток (CTL) обнаружилась у одной обезьяны, вакцинированной Tat и RIBI (Ml), и у двух а РВМС собирали в 44 неделю от обезьян, вакцинированных рекомбинантным белком Tat (10 мкг) и RIBI (M1-3) или Alum (М4-6), и от контрольных обезьян, инокулированных RIBI (M7) или Аlum (М8). РВМС, очищенные в градиенте плотности фиколла и высеянные при трехкратном повторе в количестве 5х105 в 200 49 004330 мкл на лунку в 48-луночные планшеты, выращивали в RPMI 1640, содержащей 10% FCS и 5% аутологичной плазмы, предварительно прогретой при 56°С в течение 30 мин, в присутствии моноклональных антител против CD3 (5 нг/мл) и IL-2 (2 Е/мл) в течение 48-72 ч при 37°С. Клетки инфицировали серийными разведениями химерного вируса SHIV 89.6Р (10-2, 10-3, 10-4, 10-5 TCID50/клетку) в течение 2 ч при 37°С, промывали 3 раза PBS-A и ресуспендировали в 50% кондиционированной среды и 50% свежей среды при 5x105 клеток/мл/лунку. В дни 3, 7, 10, 14 и 17 после заражения собирали аликвоты культуральной среды и заменяли равными объемами свежей среды. Репликацию вируса определяли в клеточных супернатантах посредством ELISA Gag p27 (Coulter International, Майами, Флорида). Результаты приводятся в виде минимальной инфицирующей дозы SHIV (ТСID 50/клетку) в дни 7 и 17 после заражения, способной инфицировать лимфоциты обезьян. Результаты показывают наличие растворимой антивирусной активности, опосредованной (CD8+)-Т-лимфоцитами (CAF) (табл. 14). Наблюдали общее повышение CAF-активности у вакцинированных обезьян по сравнению с контрольными животными. Таблица 14. Анализ присутствия растворимой антивирусной активности, опосредованной (CD8+)-Т-лимфоцитами (CAF)a а 50 ной активности, опосредованной (CD8+)-Тлимфоцитами (CAF) от обезьян, вакцинированных рекомбинантным белком Tat (10 мкг) и RIBI (М1-3) или Alum (М4-6), и от контрольных обезьян, инокулированных RIBI (M7) или Alum (M8). Испытания с острой инфекцией проводили на клетках СЕМ х 174, инфицированных SHIV 89.6Р. Анализ выполняли так, как описано для табл. 7, а результаты относятся к 7 дню после заражения. Наличие CAF в системе хронической инфекции проверяли на клеточной линии U1 (ссылка 47), которая представляет собой линию промоноцитов человека, хронически инфицированного ВИЧ-1. Клетки U1, высеянные в 96-луночные планшеты в количестве 1 х 104 клеток на 200 мкл на лунку, инокулировали РМА (10-5 М), чтобы индуцировать реактивацию инфекции ВИЧ-1, без культуральных супернатантов или с разными объемами (50 мкл, 5 мкл, 0,5 мкл) культуральных супернатантов от (CD8+)-Т-лимфоцитов, полученных от вакцинированных и контрольных обезьян. Через три дня после обработки РМА посредством RT-анализа или ELISA Gag p24 определяли наличие ВИЧ-1 в культуральной среде. Результаты приводятся в виде % инигибирования репликации ВИЧ-1 в клетках, обработанных супернатантами (CD8+)Т-клеток, по сравнению с необработанными клетками. Результаты ингибирования острой и хронической инфекции относятся к клеткам, обработанным 5 мкл супернатантов CD8+. Также определяли продуцирование цитокинов (γIFN, IL-4, TNFα) и хемокина RANTES РВМС обезьян, вакцинированных Tat и RIBI (M1-3) или Tat и Alum (M4-6), и контрольных обезьян М7 и М8 (табл. 15). Анализ наличия растворимой антивирус- Таблица 15. Анализ продуцирования цитокинов и хемокинов 51 004330 52 а Анализ продуцирования цитокинов и хемокинов через 48 и 96 ч (48/96) в культуре РВМС обезьян, вакцинированных 10 мкг Tat и RIBI (M1-3) или Alum (M4-6). Контрольных обезьян (М7 и М8) инокулировали адъювантами RIBI или Alum, соответственно. РВМС, отобранные на 44 неделе и очищенные с помощью градиента плотности фиколла, высевали в 24-луночные планшеты в количестве 1 х 106 клеток/мл на лунку, и выращивали в RPMI 1640, содержащей 10% FCS. РВМС не стимулировали (контроль), чтобы оценить спонтанную секрецию цитокинов и хемокинов, или стимулировали РНА (2 мкг/мл), столбнячным анатоксином (ТТ, 5 мкг/мл) или Tat (1 или 5 мкг/мл). Аликвоты культуральных супернатантов отбирали через 48 и 96 ч после стимуляции, и определяли наличие цитокинов и хемокинов с помощью коммерческих наборов для ELISA от Bio-Source International (Camarillo, Калифорния, США), чтобы оценить продуцирование цитокинов, и от R&D Systems (Abdigdon, Оксон, Соед. К-во), чтобы оценить продуцирование RANTES. Результаты приводятся как число пг/мл в культуре через 48 и 96 ч (48/96), соответственно. Предельные критические величины составляли (пг/мл) 31,2 для γIFN; 3,12 для IL-4; 15,6 для TNF?; 6,25 для RANTES. Величины (-) были ниже, чем соответствующие предельные критические величины. Nd означает, что измерения не проводились. Кроме того, на 15 неделе пять обезьян, вакцинированных рекомбинантным белком (М2-6), показали положительную реакцию при кожной пробе на Tat при сильной реакции замедленной чувствительности (табл. 16 и фиг. 19). У обезьян 4 и 5 в последующие недели реакция при кожной пробе была даже сильнее (табл. 16). Таблица 16. Кожная проба на Tata a Tat (1 и 5 мкг) в 150 мкл PBS-0,1% BSA или в одном буфере инокулировали интрадермальным способом в выбритый участок спины вакцинированных обезьян. Контрольным животным в недели 11, 15, 21, 28, 32, 36 и 44 после первой иммунизации инокуляцию не проводили (ND, не проводили). Обезьян М1-3 вакцинировали 10 мкг рекомбинантного Tat в 250 мкл аутологичной сыворотки и 250 мкл RIBI; обезьян М4-6 вакцинировали 10 мкг рекомбинантного Tat в 250 мкл аутологичной сыворотки и 250 мкл Alum; двух контрольных обезьян инокулировали RIBI (250 мкл и 250 мкл аутологичной сыворотки) (М7) или Alum (250 мкл и 250 мкл аутологичной сыворотки) (М*). Наличие эритематозного узла через 48-72 ч наводило на мысль о реакции замедленной гиперчувствительности (DTH): ++ соответствует ∅ ≥ 5 мм; ++ соответствует ∅ ≥ 1-4 мм; +/- соответствует эритеме без затвердевания; - соответствует ∅ < 1 мм. Результаты, полученные после заражения, показывают, что 4/6 (67%) вакцинированных обезьян были защищены от заражения 10 MID50 SHIV 89.6Р, как видно из результатов вирусологических анализов (табл. 17). В частности, антиген Gag h27 не обнаруживался в плазме обезьян Ml, М2, М4 и М6, провирусная ДНК в лимфоцитах этих обезьян методом PCR не обнаружена, и цитовиремия была отрицательной. Обезья- 53 004330 ны М3 и М5 были инфицированы, как показали наличие в плазме антигена Gag р27, обнаружение провирусной ДНК в клетках и положительная цитовиремия (табл. 17). Оба контрольных животных (М7 и М8) оказались инфицированными, как показали результаты тех же вирусологических анализов. Для дополнительного контроля за инфективностью дозы вируса, используемой для заражения, к контрольным животным присоединили еще одну исходную обезьяну (М13), и инфицировали ее 2,85 MID50 SHIV 89.6Р (соответствует дозе вируса в 3,5 раза меньшей, чем доза, использованная для заражения животных по протоколу). В результате, как показали все вирусологические анализы, обезьяна М13 оказалась инфицированной. Для того, чтобы подтвердить, что вирус воздействовал на животных, проводили анализ на присутствие антител против антигенов SIV, кодированных химерным вирусом SHIV 89.6Р (Gag, Pol, RT, Nef), так, как уже описано в данном примере. Присутствие антител против SIV у 54 обезьян, отрицательных по вирусологическим параметрам (M1, М2, М4 и М6), подтверждает, что вирус воздействовал на этих животных, и показывает, что имела место абортивная инфекция SHIV у этих обезьян. Обезьян с антителами против SIV с низкими титрами исследовали на продуцирование in vitro специфического антивирусного IgG (IVAP) (ссылки 177, 178), как описано далее. РВМС (2 х 106/лунку) высевали в 24-луночные планшеты и стимулировали PWM (2 мкг/мл, Sigma, Сент-Луис, США). После 7 дней инкубации (при 37°С в присутствии 5% СО2 и 95% влажности) культуральные супернатанты собирали и анализировали на продуцирование антител против ВИЧ с помощью коммерческого набора для ELISA для обнаружения антител против ВИЧ-1 и ВИЧ-2 (Abbott, HIV-l/HIV-2 EIA Third Generation Plus). В результате все зараженные обезьяны оказались положительными в отношении продуцирования антител против ВИЧ Env, так как Env ВИЧ-1 присутствует в SHIV 89.6Р. Таблица 17. Анализ вирусологических параметров Анализ вирусологических параметров после заражения обезьян, вакцинированных 10 мкг рекомбинантного Tat и RIBI (М1-3) или Alum (М4-6). Контрольных обезьян (М7 и М8) инокулировали RIBI или Alum, соответственно. Обезьяна М13 была исходным животным, инфицированным 2,85 MID50 SHIV89.6P. а Антигенимию плазмы оценивали методом ELISA Gag p27 (Inno-genetics, Бельгия), и выражали ее в количестве р27 (пкг/мл). Отр соответствует величинам ниже соответствующей предельной критической величины (18 пкг/мл). b ДНК выделяли из цельной крови с использованием набора QIAmp blood (Angiogen Gmbh and Qiagen Inc., Hilden, Германия). Качество ДНК регулировали посредством PCRамплификации β-глобинового гена, как описано ранее (ссылка 141). Присутствие провирусной ДНК анализировали методом полуколичественной PCR- амплификации gag SIV. PCR осуществляли с 1 мкг клеточной ДНК с использованием праймеров SG1096Ngag (соответствует нуклеотидам 1096-1119 генома SIVmac251; SEQ ID N 35, 5'TTAGGCTACGACCCGG CGGAAAGA3') и SG1592CgagD (картируется по нуклеотидам 1569-1592 генома SIVmac251; SEQ ID N 36, 5'ATAGGGGGTGCAGCCTTCTGACAG3'), которые амплифицируют фрагмент гена gag SHIV в 496 пар оснований, как описано ранее (ссылка 153). Для того, чтобы количественно определить число копий провирусной ДНК, в каждом эксперименте получали стандартную кривую с использованием в качестве матричной ДНК плазмиды pCMRII-∆gag (с делецией в 100 пар оснований в гене gag SIVmac251) и праймеров, описанных выше, аплифицирующих фрагмент ДНК в 396 пар оснований. Продукты PCR анализировали методом электрофореза и устанавливали количество с помощью денситометрического анализа (Ultrascan LX Enhancer Laser, LKB, Бромма, Швеция). Соотношение между величинами OD и числом молекул плазмиды gag коррелировали методом линейного регрессионного анализа (Statgraphics, Manugistics, Inc. Cambridge, Миннесота). Величины OD оставались линейными до 1000 молекул (коэффициент корреляции = 0,954 ± 0,026). Число копий провирусной ДНК SHIV на мкг клеточной ДНК опре- 55 004330 56 деляли посредством интерполяции величин ОD целью РВМС (3 х 106) от обезьян, инфицирокаждого образца к стандартной кривой. Чувстванных разными дозами SHIV 89.6Р, очищенвительность анализа составляла 1 копию провиных в фиколле, культивировали с клетками руса на мкг ДНК. СЕМ х 174 (1 х 106) в 1 мл среды, содержащей с Цитовиремию определяли при анализах 10% FCS. Через 24 ч клетки разводили до 1 х методом сокультивирования. С этой целью 1 х 106 на мл и культивировали в течение 3 суток. 4 10 клеток СЕМ х 174 культивировали в присутЗатем отбирали 2 мл среды, и клетки повторно ствии серийных разведений РВМС, обедненных высевали в количестве 3 х 105/мл в 7 мл. ИзбыCD-8, при исследовании (всего 12 разведений ток клеток отбрасывали. Эту процедуру повтоот 1 х 106 до 3,9 х 103 клеток на лунку) в 96ряли дважды в неделю в течение 4 недель. Прилуночных планшетах. В дни 3, 7 и 10 после засутствие вируса определяли методом ELISA ражения извлекали 150 мкл для анализа на приGag p27 (Innogenetics, Бельгия), а затем методом сутствие Gag p27 методом ELISA (Innogenetics, RT-анализа. Изоляцию вируса считали положиБельгия) и заменяли равным объемом свежей тельной (+), когда оба анализа (р27 и RT) 3 посреды. Результаты анализировали с помощью следовательных образцов были положительныформулы Reed и Muench для определения числа ми. продуктивно инфицированных РВМС на милВ противном случае изоляцию вируса счилион всех клеток. тали отрицательной (-). d f Наличие антител против SHIV определяДля обезьяны М13 осуществляли количели на серийных разведениях плазмы животных ственную PCR ДНК. при двукратном повторе с использованием наВирусологические данные перекрывают бора Elavia Ac-Ab-Ak II (Diagnostic Pasteur, Паабсолютное число CD4-лимфоцитов, которое в риж, Франция) согласно рекомендациям изготорезультате драматически снижалось у инфицивителя. Показано наибольшее разведение, при рованных обезьян (М3, М5, М7, М8) и было котором величины для плазмы выше, чем превысоким и устойчивым у вирусотрицательных дельная критическая величина. животных (M1, М2, М4, М6), как видно из табл. е В случае обезьяны М13 вместо цитови18. ремии осуществляли изоляцию вируса. С этой Таблица 18. FACS-анализ (CD4+)- и (CD8+)-лимфоцитова а FACS-анализ (CD4+)- и (CD8+)лимфоцитов от обезьян, вакцинированных 10 мкг рекомбинантного Tat и RIBI (M1-3) или Alum (М4-6). Контрольных обезьян (М7 и М8) инокулировали только адъювантами RIBI или Аlum, соответственно. Обезьяна М13 была исходным животным, инфицированным 2,85 MID50 SHIV 89.6Р. Анализ осуществляли методом возбужденной флуоресценции сортирован- ных клеток (FACS), как описано ранее (ссылка 137), с использованием меченных моноклональных антител (anti-CD4-FITC, BioSource; antiCD8-PerCp, Becton-Dickinson). ND означает, что анализ не проводился. Результаты, полученные до заражения, показывают, что Tat как иммуноген, как и RIBI и Alum как адъюванты (или ISCOM, который использовали в качестве адъюванта при последней 57 инъекции), хорошо переносились животными и были нетоксичными, что подтверждает результаты относительно безопасности и толерантности иммунизации Tat, полученные в первом пилотном эксперименте. Кроме того, эти данные подтверждают наблюдения в первом пилотном эксперименте, дополнительно проясняя тот факт, что рекомбинантный белок Tat выявляет сильную гуморальную и клеточную реакцию, специфическую к Tat, с антивирусным действием in vitro и in vivo. Результаты, полученные после заражения (4 защищенных обезьяны из 6), подтверждают ожидаемые результаты in vitro и показывают, что вакцина против Tat индуцирует защиту от инфекции и, следовательно, от болезни. Контроль за двумя вакцинированными и инфицированными обезьянами прояснит действие вакцинации на развитие болезни. Пример 5. Инокуляция Масаса fascicularis вакциной против Tat на основе ДНК: анализ безопасности, толерантности, специфической иммунной реакции и эффективности защиты от заражения вирусом. Предполагается прямая инокуляция ДНК плазмиды pCV-Tat, содержащей кДНК гена tat, и плазмиды pCV0 в качестве контрольной ДНК. Плазмидные ДНК, которые вводят животным, амплифицируют в Е. coli (штамм DH5) в соответствии со стандартными процедурами (ссылка 110) и протоколами, утвержденными "European Agency for the evaluation of medical products; Human Medicine Evaluation Unit" (техническое сообщение, серия № 17, январь, 1997), очищают в двух градиентах CsCl и диализуют в течение 48-72 ч против 100 объемов PBS. Затем ДНК контролируют посредством расщепления рестриктазами. Функциональность плазмидной ДНК проверяют с помощью трансфекции 5-10 мкг ДНК, с использованием кальцийфосфатного метода (ссылка 110), в клетки Н3T1 (1 х 106), содержащие интегрированную копию репортерной плазмиды LTR-CAT ВИЧ-1, и, спустя 48 ч, посредством анализа САТ-активности (ссылка 55). Толерантность, безопасность, способность выявлять специфическую иммунную реакцию (как гуморальную, так и клеточную) и эффективность защиты от заражения вирусом после иммунизации плазмидной ДНК pCV-Tat оценивали на собакоподобных обезьянах (Масаса fascicularis). В первом пилотном эксперименте трех обезьян иммунизировали по следующей схеме: обезьяну Ml инокулировали 200 мкг pCV-Tat в 300 мкл PBS i.d. способом в 2 места на спине вблизи подмышечных лимфоузлов (150 мкл на место); обезьяну М2 инокулировали 500 мкг pCV-Tat в 500 мкл PBS i.m. способом в 2 места на спине (250 мкл на место). В 1 и 5 дни до i.m. инокуляции в два предварительно отмеченных места, в которые должна быть инокулирована плазмидная ДНК, инъецировали 250 мкл физиологического раствора, содержащего 0,5% бупивацина и 0,1% метилпарабена. Это делали для 004330 58 того, чтобы повысить поглощение и экспрессию ДНК в мышце (ссылки 37, 45). Обезьяну МЗ не инокулировали и использовали в качестве контрольного животного. Однако, начиная с 10 недели, эту обезьяну инокулировали i.d. 6 мкг (5+1 мкг) Tat как контроля в случае кожных проб. У всех обезьян в 42 и 35 дни, предшествующие первой инокуляции, брали по 10 мл крови для анализа базовых параметров. Обезьян инокулировали в момент времени 0 и через 5, 10, 15, 22, 27, 32 и 37 недель. Наконец, на 42 неделе животные получали последнюю инъекцию рекомбинантного белка Tat (16 мкг) в 200 мкл ISCOM и 300 мкл PBS. За животными наблюдали ежедневно для оценки клинических параметров, как описано в примере 4. Кроме того, по 10 мкл крови отбирали в тот же день, когда проводили инокуляцию, как описано в примере 4. Защитное действие вакцинации определяли после заражения обезьян 10 MID50 SHIV89.6P, которую инъецировали внутривенно на 65 неделе. Продолжали наблюдение после заражения, как описано в примере 4. Результаты эксперимента следующие. У двух вакцинированных обезьян и у контрольной обезьяны не наблюдалось никаких изменений клинических, гематологических и поведенческих параматров. Не обнаружено признаков воспаления или неоваскуляризации в местах инъекций. Эти результаты показывают, что ДНК pCV-Tat хорошо переносилась животными и не была токсичной при дозах и способах введения, использованных в эксперименте. У обезьяны Ml, вакцинированной 200 мкг ДНК i.d. способом, с 32 недели развивались Tatспецифические антитела IgG (фиг. 11). Титры антител (с 32 недели по 58 неделю) колебались от 1:100 до 1:800 (фиг. 12). На 37 неделе анализ картирования эпитопов (осуществленный так, как описано в пояснении к фиг. 4) показал, что эти антитела направлены против специфических областей Tat, с картированием в ак 1-20, ак 4660 и 65-80 с титрами 1:200, 1:100 и 1:50, соответственно (данные не приводятся). У обезьяны М2, вакцинированной 500 мкг ДНК i.m. способом, антитела против Tat едва обнаруживались (с титром 1:50, не показано) на протяжении всего периода исследования. Результаты показаны на фиг. 11. Способность плазмы обезьяны Ml, вакцинированной 200 мкг ДНК i.d. способом, нейтрализовать Tat-активность проверяли путем анализа ингибирования сохранения репликации вируса в клетках HLM1, инкубированных с экзогенным Tat, как описано в примере 4. Этот анализ показал, что плазма обезьяны Ml, разведенная 1:2 и полученная на 37 неделе, снижала репликацию вируса, индуцированную 30 нг/мл экзогенного Tat. Напротив, плазма той же обезьяны, полученная в момент времени 0 (предиммунная) не блокировала внеклеточный Tat (табл. 19). Таблица 19. Нейтрализующая активность плазмы в отношении сохранения вирусной инфекции, индуцированной вне- 59 клеточным Tata а Способность антител против Tat нейтрализовать Tat-активность определяли путем добавления 30 нг/мл рекомбинантного Tat к клеткам HLM1, предварительно инкубированным с равным объемом плазмы, полученной в момент времени 0 (предиммунная) или на 37 неделе (иммунная) от обезьяны Ml, вакцинированной 200 мкг плазмидной ДНК pCV-Tat i.d. способом. Анализ осуществляли и результаты выражали так, как описано в пояснении к табл. 4. Результаты, приведенные в табл.20, показывают наличие пролиферативной реакции на Tat на 42 неделе у обезьяны Ml, иммунизированной 200 мкг ДНК i.d. способом, в то время как у обезьяны М2 клеточной реакции такого типа не обнаружено. Таблица 20. Пролиферативная реакция на Tata а РВМС выделяли, стимулировали РНА (4 мкг/мл), столбнячным анатоксином (ТТ) и Tat (1 или 5 мкг/мл), и проводили испытания так, как описано в пояснении к табл.5. Обезьян вакцинировали 200 мкг (M1) pCV-Tat i.d. способом или 500 мкг (М2) pCV-Tat i.m. способом. Обезьяну (М3) не вакцинировали, но после 10 недели инокулировали i.d. 6 мкг (5+1 мкг) Tat как контроль в случае кожных проб. ND означает, что определения не проводились. Цитотоксическую активность против Tat (CTL) обнаружили у обезьяны M1 на 42 и 48 неделе и у обезьяны М2 на 48 неделе. Кроме того, на неделе 48 наблюдали положительную CTL-реакцию у обезьяны М3, которую инокулировали только после недели 10 6 мкг Tat как контроль в случае кожных проб (табл. 21). Таблица 21. Анализ Tat-специфической цитотоксической активности (CTL)a а Анализ осуществляли так, как описано в пояснении к табл. 6. Обезьян вакцинировали 200 мкг (Ml) pCV-Tat i.d. способом или 500 мкг (М2) pCV-Tat i.m. способом. Обезьяну (М3) не 004330 60 вакцинировали, но после 10 недели инокулировали i.d. 6 мкг (5 + 1 мкг) Tat как контроль в случае кожных проб. ND означает, что определения не проводились. Результаты, приведенные в табл.22, показывают на 52 неделе наличие общей антивирусной активности (ТАА) у обеих обезьян, вакцинированных 200 и 500 мкг ДНК. Таблица 22. Анализ общей антивирусной активности (ТАА)а 13. Обезьян инокулировали 200 мкг (Ml) pCVTat i.d. способом или 500 мкг (М2) pCV-Tat i.m. способом. Обезьяну (М3) не вакцинировали, но после 10 недели давали i.d. 6 мкг (5+1 мкг) Tat как контроль в случае кожных проб. РВМС собирали на 52 неделе от первичной иммунизации и когда инфицировали SHIV 89.6Р (10-2, 10-4, 10-6, 10-8 TCID50/клетку). Результаты представлены в виде минимальных инфицирующих доз SHIV (ТСID50/клетку), которые еще способны инфицировать клетки. Результаты, приведенные в табл. 23, показывают наличие на неделе 22 и 27 растворимой антивирусной активности (CAF), опосредованной (CD4+)-Т-лимфоцитами, у обеих вакцинированных обезьян. Эта активность у контрольной обезьяны была ниже. Таблица 23. Анализ опосредованной клетками CD8+ растворимой антивирусной активности (CAF)a а Анализ наличия растворимой антивирусной активности, продуцированной (CD8+)-Тлимфоцитами (CAF), полученными от обезьян, инокулированных 200 мкг (M1) и 500 мкг (М2), и от обезьяны (М3). Антивирусную активность анализировали при острой и хронической инфекции в клетках СЕМ х 174, инфицированных SHIV 89.6Р, и в клетках ОМ-10-1, хронически инфицированных ВИЧ-1, как описано в пояснении к табл. 7. Результаты представлены в виде процента (%) ингибирования репликации вируса в клетках, обработанных супернатантами от (CD8+)-Т-лимфоцитов, по сравнению с необработанными клетками. Результаты по острой и хронической инфекции, приведенные в таблице, относятся к образцам, обработанным 5 мкг супернатантов культур CD8+. ND означает, что определения не проводились. 61 Результаты, приведенные в табл. 24, показывают, что у обезьяны Ml, инокулированной 200 мкг ДНК i.d. способом, кожная проба на Tat положительна на 22 неделе. Таблица 24. Кожная проба на Tata a 004330 62 нантным белком Tat), так и клеточную иммунную реакцию против Tat с противовирусным действием. Что касается эффективности защиты после заражения (осуществленного на 65 неделе от первичной иммунизации), то вирулогические данные, в том числе, измерения антигенимии и цитовиремии, и определение числа копий провирусной ДНК (ДНК-PCR) в РВМС, показывают, что обезьяна М2, иммунизированная i.m. ДНК Tat, защищена от заражения 10 MID50 SHIV-89.6.P, в то время как макака M1, иммунизированная i.d. меньшей дозой ДНК Tat (200 мкг), оказалась зараженной, что наводит на мысль, что, относительно иммунизации ДНК, i.m. способ более эффективен, чем i.d. инокуляция. Контрольная обезьяна, в результате, также резистентна к инфекции. Однако, как описано ранее, эта обезьяна, в отличие от контрольных животных в других схемах экспериментов, получала повторные кожные пробы на Tat для того, чтобы проверить специфичность теста (табл. 24), и антитела против Tat, хотя с низкими титрами (1:100), обнаруживались с 32 недели от начала иммунизации (данные не приводятся). Кроме того, пролиферативная реакция на Tat у этой обезьяны показала слабую и спорадическую реактивность на антиген (табл. 20). Наконец, обезьяна М3 показала наличие специфических CTL против Tat (табл. 21). Хотя и предварительно, эти данные показывают, что повторная i.d. инъекция 6 мкг Tat могла привести к иммунизации животного и к защите от заражения. Таким образом, обезьяна М3 будет считаться вакцинированной i.d. белком Tat и исследоваться как таковая. Оценка методом FACS процента и абсолютного числа копий CD4- и CD8-лимфоцитов подтвердила вирусологические данные, показав четкое снижение (приблизительно в 4 раза) числа CD4-лимфоцитов у зараженной обезьяны уже при первом анализе после заражения (30 день) и позднее (60 день) (табл. 25). Tat (1 и 5 мкг) в 150 мкл PBS-0,1% BSA или в одном буфере (контроль) инокулировали i.d. в предварительно подготовленную (thrichotomized) область верхней части спины вакцинированных животных и контрольной обезьяны (контроль на специфичность реакции) в недели 10, 15, 22, 27, 32, 37, 42, 48, 52 и 58 от первичной иммунизации. Обезьяну Ml инокулировали i.d. 200 мкг ДНК плазмиды pCV-Tat, в то время как макака М2 получала 500 мкг той же плазмиды i.m.. Обезьяну М3 (контроль) не вакцинировали, но после 10 недели она получала i.d. 6 мкг (5 + 1 мкг) Tat как контроль в случае кожных проб. Появление эритематозного узла через 48 и 72 ч показало наличие гиперчувствительности замедленного типа (DTH): ++ соответствует ∅ ≥ 5 мм; + соответствует ∅ 1-4 мм; ± соответствует эритеме без затвердевания; + соответствует ∅ < 1 мм. Эти результаты показывают, что плазмида pCVTat (ДНК pCVTat) хорошо переносилась и была безопасна как при внутрикожном, так и при внутримышечном введении в данных дозах. Кроме того, эти результаты показывают, что иммунизация ДНК pCVTat индуцирует как гуморальную (хотя и более слабую, чем индуцируемая посредством иммунизации рекомбиТаблица 25. Анализ вирусологических параметров Обезьяна M1 иммунизирована i.d. 200 мкг pCVTat, обезьяна М2 - 500 мкг pCVTat i.m.. Макаке М3 несколько раз делали инъекции 6 мкг белка Tat, интрадермально, для того, чтобы контролировать специфичность кожной пробы. Поэтому со времени заражения макаку М3 рассматривали, как вакцинированную обезьяну. Вирусологические параметры оценивали так, как описано в пояснении к табл. 17. Оценка методом FACS процента и абсолютного числа копий CD4- и CD8-лимфоцитов подтвердила вирусологические данные, показав четкое снижение (приблизительно в 4 раза) числа CD4-лимфоцитов у зараженной обезьяны уже при первом анализе после заражения (30 день) и позднее (60 день) (табл. 26). 63 004330 64 Таблица 26. FACS- анализ подмножеств CD4 и CD8 Анализ осуществляли так, как указывается в пояснении к табл. 18. Обезьяна Ml иммунизирована i.d. 200 мкг плазмидной ДНК pCVTat, обезьяна М2 - 500 мкг pCVTat i.m.. Макака М3 вакцинирована 6 мкг белка Tat интрадермально. На основании этих результатов планировали второй эксперимент, при котором оценивали действие иммунизации ДНК pCVTat на 3 обезьянах (М9-11) при сравнении с контрольной обезьяной (М12), которая получала ДНК pCV0. Всех животных инокулировали i.m. в 2 места на спине в целом 1 мг pCVTat (М9-11) или pCV0 (M12). За 1 или 5 дней до вакцинации в два отмеченных места, в которые затем должна быть инъецирована плазмида, инъецировали 250 мкл физиологического раствора, содержащего 0,5% бупивацина и 0,1% метилпарабена. Макак вакцинировали в момент времени 0 и в недели 6, 11, 15, 21, 28 и 32. Последнюю повторную инъекцию осуществляли на 36 неделе рекомбинантным белком Tat (16 мкг), ресуспендированным в 200 мкл ISCOM и 300 мкл PBS. Животных проверяли каждый день на клинические параметры, как описано в примере 4. Кроме того, за 9 дней до первичной иммунизации и при каждой иммунизации брали 10 мл крови, как описано в примере 4. Для того, чтобы оценить защитное действие вакцинации, обезьян заражали на 50 неделе от начала иммунизации путем внутривенной (i.v.) инъекции 10 MTD50 SHIV-89.6P. Наблюдение продолжали и осуществляли и после заражения так, как описано в примере 4. Результаты этого эксперимента следующие. Не отмечено никаких изменений в поведении, клинических параметрах и химическом составе крови как у вакцинированных, так и у контрольных животных. В местах инъекций не обнаружено никаких признаков воспаления или новых сосудистых образований. Эти результаты подтверждают, что плазмида ДНК pCVTat, инъецированная i.m. в количестве 1 мг, хорошо переносилась и не была токсичной. IgG против Tat обнаруживали с 15 недели (фиг. 13), причем титры колебались от 1:50 до 1:100 (данные не приводятся). Кроме того, у одной обезьяны (М11) вскоре (на 2 неделе) обнаружили пролиферативную реакцию на Tat (табл. 27). Таблица 27. Пролиферативная реакция на Tata а РВМС выделяли, стимулировали РНА (4 мкг/мл), столбнячным анатоксином (ТТ, 10 мкг/мл) или Tat (1 или 5 мкг/мл) и анализировали так, как описано в пояснении к табл. 5. Обезьян инъецировали i.m. 1 мг или pCVTat (M9-M11) или pCV0 (M12, контроль). ND означает, что определения не проводились. CTL против Tat определялили на 32 неделе после иммунизации (табл.28). Таблица 28. Анализ цитотоксической активности против Tat (CTL)a а Анализ осуществляли так, как описано в пояснении к табл. 6. Макак инъецировали i.m. 1 мг или pCVTat (M9-M11) или pCV0 (М12, контроль). РВМС, полученные от обезьяны М11 на 44 неделе, оказались резистентными к заражению in vitro серийными разведениями химерного вируса SHIV-89.6P при анализе методом, описанным ранее, при котором обнаруживается наличие общей антивирусной активности (ТАА). Фактически, ТАА оценивается как способность РВМС от обезьян, вакцинированных ДНК pCVTat, выращенных в присутствии аутологичной сыворотки, сопротивляться заражению серийными разведениями вируса (табл. 29). 65 Таблица 29. Анализ общей антивирусной активности (ТАА)а 004330 66 Таблица 30. Анализ растворимой антивирусной активности, опосредованной (CD8+)-Т-лимфоцитами (CAF)a а Анализ осуществляли так, как описано в пояснении к табл. 13. Макак инъецировали i.m. 1 мг или pCVTat (M9-M11) или pCV0 (M12, контроль). РВМС отбирали на 44 неделе от первой иммунизации и инфицировали in vitro 10-2, 10-3, 10-4, 10-5 TCID50 SHIV-89.6P. Результаты выражены в виде минимальной инфицирующей дозы SHIV (ТСID50/клетку), еще способной инфицировать клетки. * Нет культуры, инфицированной при наибольшей концентрации SHIV, использованной при анализе (10-2 TCID50/клетку). ** Культуры стали отрицательными на 17 день после заражения. Результаты, приведенные в табл. 30, показывают наличие растворимой противовирусной активности (CAF), опосредованной (CD8+)-Тлимфоцитами, у вакцинированных обезьян и у контрольной обезьяны (М12), инъецированной пустым вектором (pCV0). а Анализ наличия растворимой антивирусной активности, опосредованной (CD8+)-Тлимфоцитами (CAF). РВМС получены от трех обезьян (М9-М11), инъецированных 1 мг pCVTat, и от контрольной обезьяны (М12), инокулированной 1 мг pCV0. Анализ острой инфекци осуществляли в клетках СЕМ х 174, инфицированных SHIV-89.6P, как описано в пояснении к табл.14. Анализ хронической инфекциии осуществляли в клетках U1, хронически инфицированных ВИЧ-1, как описано в пояснении к табл. 14. Результаты выражены в виде процента (%) ингибирования репликации вируса в клетках, выращенных в отсутствие (контроль) или в присутствии 5 мкл супернатантов от (CD8+)-T-клеток. Продуцирование цитокинов (γIFN, IL-4, TNFα) и хемокинов RANTES оценивали в 44 неделю в РВМС как вакцинированных, так и контрольных обезьян (табл. 31). Таблица 31. Анализ продуцирования цитокинов и RANTESa а Анализ осуществляли так, как описано в пояснении к табл. 15. Макак инъецировали i.m. 1 мг или pCVTat (M9-M11) или pCV0 (М12, контроль). РВМС отбирали на 44 неделе после первичной иммунизации. Результаты приводятся в виде пкг/мл цитокинов и RANTES, обнару- женных через 48 и 96 ч, соответственно. (-) означает, что величины ниже величины снижения. Предельные критические величины (пкг/мл) составляли 31,2 для γIFN, 3,12 для IL-4; 15,6 для TNFα; 62,5 для RANTES. nd означает, что определение не проводилось. 67 Результаты показывают наличие слабой реактивности на кожные пробы с Tat у одной обезьяны (М9) на 11 неделе (табл. 32). Таблица 32. Кожная проба на Tata а Tat (1 и 5 мкг) в 150 мкл PBS-0,1% BSA или в одном буфере (контроль) инокулировали i.d. в предварительно подготовленную (thrichotomized) область верхней части спины вакцинированных животных, кроме контрольной обезьяны, в недели 11, 15, 21, 28, 32, 36 и 44 от первичной иммунизации. Макакам инъецировали i.m. 1 мг или pCVTat (M9-M11) или pCV∅ (M12, контроль). Появление эритематозного узла через 48-72 ч указывало на наличие гиперчувствительности замедленного типа (DTH) : ++ соответствует ∅ ≥ 5 мм; + соответствует ∅ 1-4 мм; ± соответствует эритеме без затвердевания; - соответствует ∅ < 1 мм. Результаты, полученные после заражения, показывают, что все вакцинированные животные защищены от инфекции 10 MID50 SHIV89.6P, как показали вирулогические пробы (антигенимия плазмы, определение числа копий провирусной ДНК, цитовиремия), которые все оказались отрицательными (табл. 33). Кроме того, наличие антител против SIV у обезьяны М11 показало воздействие вируса или абортивную инфекцию. В противоположность этому, они не обнаружены у остальных обезьян, на основании чего авторы решили осуществить анализ на продуцирование антител in vitro (IVAP), а также на лимфопролиферативную реакцию на SIV-антигены. Эти анализы и предварительные результаты показывают наличие Env антител против ВИЧ у всех обезьян, инокулированных ДНК. Макаки будут инокулированы большей дозой вируса, так как даже контрольное животное М12 оказалось резистентным к инфекции. Эта обезьяна была вакцинирована пустым вектором pCV0. Последние литературные данные показывают роль адъюванта, исполняемую некоторыми последовательностями ДНК, встречающимися в бактериях чаще, чем в эукариотных клетках, и что они, подобно LPS и маннозе, представляют сильный стимул для естественного иммунитета (ссылка 179). Таким 004330 68 образом, можно представить, что защита, наблюдаемая у обезьяны М12, может иметь место вследствие индукции неспецифического антивирусного иммунитета такими бактериальными последовательностями, такого как продуцирование IFNα, IFNβ, IL-12 и IL-18, которые, как известно, проявляют иммуномодулирующие и антивирусные функции. К такому предположению энергично приводит наличие у этой макаки антивирусных ТАА-активности (табл. 29) и CAF-активности (табл. 30) при отсутствии специфического против Tat гуморального и клеточного иммунитета. Действительно, эти анализы также определяют неантигенспецифические антивирусные активности. Исходная обезьяна М13, инокулированная дозой вируса в 3,5 раза меньшей, чем доза, инъецированная макаке M12, оказалась зараженной. Эти результаты подтверждают, что доза заражения 10 MID50, инокулированная обезьяне М12, была инфицирующей (табл. 33). На основании такого результата изобретатель намеревается использовать вектор pCV0 или его части в качестве адъюванта. Таблица 33. Анализ вирусологических параметров Дни после заражения вирусом SYIV89.6Р а, b, с, d Анализы осуществляли так, как описывается в пояснении к табл. 17. Макак инъецировали i.m. 1 мг или pCVTat (М9-М11) или pCV0 (M12, контроль). Обезьяна М13 являлась исходным животным, инфицированным 2,85 MID50 SHIV89.6P. е Вместо цитовиремии осуществляли изоляцию вирусов, результат положительный. f PCR ДНК неколичественная, результат положительный. FACS-анализ популяций CD4 и CD8 (табл.34) подтвердил вирусологические данные. Действительно, существенное падение процентного отношения и абсолютного числа CD4-лимфоцитов наблюдали в 15 и 60 дни после заражения только у исходной обезьяны М13, в итоге инфицированной, как показано положительной антигенимией плазмы, провирусной ДНК и выделением вируса (табл. 34). 69 004330 70 Таблица 34. FACS анализ лимфоцитов CD4 и CD8. Анализ осуществляли так, как указывается в пояснении к табл. 18. Макакам давали инъекции i.m. 1 мг или pCVTat (M9-M11), или pCV0 (M12, контроль). Макака М13 является исходным животным, инфицированным 2,85 MID50 SHIV89.6P. Эти результаты показывают, что вакцинация плазмидой pCVTat хорошо переносилась и не была токсичной, и подтверждают результаты по безопасности и толерантности вакцинации ДНК, полученные в первом пилотном исследовании. Кроме того, эти данные ясно показывают, что плазмида ДНК pCVTat индуцирует как специфическую гуморальную (хотя и более слабую, чем индуцируемая рекомбинантным Tat), так и клеточную иммунную реакцию с противовирусным действием, часть которых может иметь место благодаря определенным последовательностям ДНК, присутствующим в векторе pCV0, которые могут функционировать как адъюванты. Предстоит оценить протоколы иммунизации, включающие сочетания ДНК, кодирующей другие гены ВИЧ-1 и цитокинов, описанные в примере 3. В этих экспериментах будет использоваться SHIV, содержащий гены ВИЧ tat, rev и nef (ссылки 146, 85, 142, 65, 94, 129). Плазмиды pCV0 и pCVTat будут инокулироваться животным с использованием других систем доставки, которые могут усилить эффективность иммунизации, таких как липосомы, наночастицы, эритроциты, генная "пушка", или ДНК Tat будет доставляться с использованием герпесных векторов, как описано далее в примерах 9 и 10. Пример 6. Лечебная вакцина. Составлен протокол вакцинации на основе как белка Tat, так и ДНК Tat, для того, чтобы оценить безопасность и токсичность вакцины против Tat для уже инфицированных индивидуумов. Эксперимент осуществляли на обезья- нах, инфицированных снижающимися дозами SHIV89.6P, и в иммунодефицитным состоянии (СПИД). Вирусный штамм, использованный для заражения, получали из селезенки и лимфоузлов собакоподобной обезьяны, инфицированной 14 днями раньше. Лимфоциты, очищенные посредством механического разделения, разделили на две аликвоты (каждая по 1,5 х 106 клеток/мл). Одну аликвоту обеднили (CD8+)-Т-клетками, используя иммуномагнитные гранулы (Dynal, Норвегия). Обе культуры стимулировали РНА (1 мкг/мл) в течение трех суток и высевали в концентрации 1 х 106 клеток/мл в присутствии 50 Е/мл IL-2. Репликацию вируса определяли по наличию обратной транскриптазы (RT) в культуральной среде, собранной через трое суток. Перед испытанием супернатант осветляли и подвергали ультрацентрифугированию при 4°С при 100000 об/мин в течение 11 мин (ультрацентрифуга Beckman TL-100), и осадок лизировали. Добавляли 30 мкл суспензии к реакционной смеси (трис-НСl, 1 М, рН 8; 0,5 М MgCl2; 1 M KCl; 1 мг/мл поли-А; 100 мкг/мл олиго-dT 1218; 0,02 М DTT; 1 мКи/мл 1,2-3[Н]-метилтимидинтрифосфата) и инкубировали при 37°С в течение 60 мин. Реакцию прекращали посредством добавления 500 мкл раствора пирофосфата Na, 0,1М, рН 5, и 600 мкл 20% трихлоруксусной кислоты (ТСА), и образец наносили в виде капель на фильтр 0,45 мкм (Millipore), и затем, после добавления 0,5 мл сцинтилляционной смеси (Filter Count, Packard), снимали показания с помощью счетчика β-частиц. Культуральные среды, содержащие свыше 20000 ч.им, центрифугировали и добавляли 10% сыворотки АВ человека. Вирус концентрировали посредством ультрацентрифугирования при 30000 об/мин (90 мин при 4°С), ресуспендировали в RPMI 1640, содержащей 10% сыворотки человека (группа АВ), и затем хранили в небольших аликвотах в жидком азоте. Вирусный 71 штамм титровали in vitro на клеточных линиях человека СЕМ х 174 и С8166 (3 х 103 ТСID50/клетку) и in vivo на собакоподобных обезьянах (3,17 х 105,69 MID50/мл). Первый пилотный эксперимент осуществили на 7 обезьянах, инфицированных i.d. SHIV89.6P, полученным так, как описано выше. Каждая обезьяна получила 1 мл SHIV, разведенного в солевом буфере с добавлением 2% сыворотки человека (АВ, Rh-), по следующей схеме. Одну обезьяну (IM1) инокулировали вирусным разведением 1:500; две обезьяны (IM2, IM3) получили разведение 1:5000; двух обезьян (IM4, IM5) инокулировали вирусом 1:50000; обезьяна IМ6 получила разведение 1:500000; последняя обезьяна (IM7) получила разведение 1:5000000. У каждой обезьяны брали кровь в день 7 до заражения SHIV для определения базовых параметров. Образцы сыворотки и плазмы замораживали при -20°С или при -80°С, и затем использовали для ресуспендирования белкового инокулума. В момент времени 0 всех обезьян инокулировали SHIV89.6P. Обезьян контролировали ежедневно. Кроме того, в день 0 и через 2 и 4 недели у них брали кровь, и 10 мл крови использовали для гематохимических определений (химико-клинический анализ, электролиты, число лейкоцитов и эритроцитов, гемоглобин) и вирусологического и иммунологического анализа (т.е., определения Ag р27 в плазме и вирусного груза в плазме и клетках). На 4 неделе после заражения 6 обезьян (IM1-6) были инфицированными. Обезьяна IM7, получившая наименьшее разведение вируса (1:5000000), была SHIV-отрицательной (табл. 35). Таблица 35. Обнаружение наличия SHIV89.6P у обезьян, инфицированных серийными разведениями вируса а Изоляцию вируса и b Ag р27 в плазме (пкг/мл) определяли так, как описано в пояснении к табл.17. Обезьян инокулировали i.v. серийными разведениями вирусного штамма, как описано в тексте. Через 7 недель после заражения всех животных, показавших серьезные симптомы иммунодефицита, вакцинировали как белком Tat, так и ДНК плазмиды pCVTat согласно следующему протоколу. Обезьяны IM1, IM3, IM5 и IM6 получили белок Tat (20 мкг), растворенный в 250 мкл PBS-A с добавлением 0,1% BSA и 20% аутологичной плазмы и затем добавленный 004330 72 к 250 мкл адъюванта Alum. Инокуляцию белка осуществляли подкожно в одном месте верхней части спины обезьяны, или в другое место на спине инъецировали i.m. плазмиду pCVTat (1 мг), ресуспендированную в 1 мл PBS-A. Обезьянам IM2 и IM4 (контрольные животные) инъецировали 250 мкл Alum и 250 мкл PBS-A-0,1% BSA и 20% аутологичной плазмы, подкожно, в место в верхней части спины, и pCV-0 (1 мг), ресуспендированный в 1 мл PBS-A, i.m., в другое место в верхней части спины, отличное от первого. Неинфицированную обезьяну IM7 не вакцинировали. Схема вакцинации включала момент времени 0, соответствующий 7 неделям после заражения SHIV, и последующие 1, 4, 5, 10, 11, 13, 14, 17, 18 недель. Для того, чтобы оценить действие такой вакцинации на развитие болезни, каждую макаку проверяли ежедневно на наличие признаков болезни, и в момент времени 0 и через 3, 8, 12, 16 и 21 неделю отбирали по 10 мл крови для лабораторных исследований (химико-клинический анализ, электролиты, число лейкоцитов и эритроцитов, гемоглобин), для оценки иммунологического статуса (наличие специфических иммуноглобулинов, количество Th1 и Th2 цитокинов, продуцирование хемокинов), для характеризации лимфоцитов при помощи FACS-анализа (CD4, CD8, CD40, CD86, CD20, CD2, CD26 и CD20), и, наконец, для оценки вирусологических параметров (обнаружение провирусной ДНК с помощью полуколичественной PCR, вирусного груза плазмы с помощью конкурентной RT-PCR, антигена Gag p27 в плазме с помощью ELISA и наличия антител против SHIV, как описано ранее). Другие повторные инъекции будут делаться на основе результатов иммунологического, вирусологического и клинического анализов. После последней инокуляции схема контроля будет ежемесячной, и при появлении клинических изменений образцы РВМС, сыворотки, плазмы и мочи будут замораживаться в каждый момент времени для последующих испытаний, как описано ранее. Описываются результаты, уже доступные из эксперимента, полученные на 8 неделе после иммунизации. Как у вакцинированных бессимптомных, так и у контрольных обезьян не наблюдалось никаких признаков воспаления и образования новых сосудов в местах инокуляции или общих симптомов болезни. У обезьян, у которых симптомы уже были, не было явных изменений клинического статуса. Кроме того, не обнаруживалось активации или репликации вируса. Все вместе эти результаты указывают на отсутствие токсичности или возросшей репликации вируса у обезьян, вакцинированных биологически активным белком Tat или ДНК (табл. 36). 73 004330 Таблица 36. Анализ вирусологических параметров 74 и IM6 инъецировали s.c. белок Tat (20 мкг) и адъювант Alum и i.m. pCVTat (1 мг). Обезьянам IM2 и IM4 (контрольные инфицированные животные) инъецировали s.c. адъювант Alum и и i.m. pCV0 (1 мг). IM7 была неинфицированной исходной обезьяной. FACS-анализы показывают, что после вакцинации не наблюдается изменений в количестве (CD4+)- и (CD8+)-T-лимфоцитов (табл. 37). Испытания проводили так, как описано в пояснении к табл.17. Обезьянам IM1, IM3, IM5 Таблица 37. FACS анализ CD4+ и CD8+ лимфоцитов FACS-анализ осуществляли так, как указывается в пояснении к табл. 18. Макакам IM1, IM3, IM5, IМ6 делали инъекции белка Tat (20 мкг) и адьюванта Alum, s.c, и pCVTat (1 мг), i.m.. Макакам IM2 и IM4 (инфицированные контрольные животные) вводили адьювант Alum, s.c, и pCV0 (1 мг), i.m.. IM7 являлись инфицированной исходной обезьяной. Эти данные подтверждают, что как белок Tat, так и плазмида PCVTat в использованных дозах и способах инокуляции, переносились хорошо и без токсического воздействия на вакцинированных обезьян, и, кроме того, они не повышали репликации вируса или не снижали числа CD4-T-клеток у инфицированных животных. Пример 7. Костимуляция очищенных (CD4+)-лимфоцитов от SIV-инфицированных обезьян с гранулами с анти-СD3/28 покрытием приводит к логарифмическому росту числа клеток без существенной репликации и передачи вируса. Мононуклеарные клетки периферической крови обедняли популяцией клеток CD8+, используя анти-СD3/28 иммуномагнитные гранулы (Dynal, Осло; Dynabeads M-450 CD8). Степень очистки оценивали с помощью FACSанализа и считали приемлемой, если она пре- вышает 95%. Обедненные CD8 клетки (названные CD8-PBMC) выращивали в присутствии РНА (2 мкг/мл) и IL-2 (40 Е/мл) или иммуномагнитных гранул, предварительно сенсибилизированных двумя моноклональными антителами - против CD3 (клон FN18, BioSource) и антигенами CD28 (клон 9.3) (анти-СD3/28 гранулы). Для улучшения связи анти-СD3/28 гранул с клетками-мишенями осуществляли инкубацию на устройстве с вращающимся колесом (rotating wheel disposal). Затем присоединенные клетки (названные CD8-CD3+CD28+) отбирали с помощью магнита и высевали для культивирования. Три раза в неделю концентрацию клеток доводили до исходного уровня, и при необходимости добавляли IL-2; кроме того, что касается клеток, стимулированных анти-СD3/28 гранулами, то предварительные результаты наводят на мысль, что режим непрерывной стимуляции в сочетании с постоянным регулированием соотношения гранулы:клетки, подгоняемым в каждый момент времени, является высокоэффективным при индукции пролиферативной реакции. Предварительные исследования авторов изобретения показали, что в отсутствие экзогенного IL-2 популяция клеток CD8CD3+CD28+ пролиферирует лучше, чем CD8PBMC, стимулированные анти-СD3/28 гранула- 75 ми. Кроме того, добавление экзогенного IL-2 (40 Е/мл, три раза в неделю) существенно повышает кинетику пролиферации как в отношении числа клеток, так и в отношении длительности действия (фиг. 14). Для того, чтобы оценить антивирусную активность такой стимуляции, очищенные клетки CD8-CD3+CD28+ от 4 неинфицированных обезьян инфицировали в день 0 0,1 M.O.I. SIV, и затем культивировали в условиях непрерывной стимуляции. CD8-РВМС, стимулированные РНА и IL-2, были контрольными при этом эксперименте. Заражения вирусом заканчивалось обнаружением антигена Gag p27 в культуральном супернатанте с помощью коммерческого набора для ELISA (Coulter, Hialeah, FL). Содержание антигена Gag р27 (нг/мл) измеряли в день 6 и 12 после заражения. Как показано на фиг. 15, существует значительное различие в заражении при двух режимах стимуляции. Действительно, в 6 день после заражения антигена р27 в культурах, стимулированных CD3/28 гранулами, было на 40-80% меньше, чем в культурах, стимулированных РНА с добавлением IL-2, и на 12 день это различие возросло у 2 обезьян из 4. Это наводит на мысль о снижении чувствительности вирусной инфекции. Только в одном случае (МК 9401) наблюдали размножение вируса при обоих режимах стимуляции. Результаты, описанные здесь, показывают, что Масаса fascicularis является хорошей моделью для размножения ex vivo субпопуляции лимфоцитов посредством костимуляции антиСD3/28 гранулами без репликации вируса. Это является причиной предложения авторами лечебной вакцины для ВИЧ-инфицированных индивидуумов, в основе которой размножение и реинфузия аутологичных антивирусных специфических лимфоцитов. Пример 8. Применение для вакцинации дендритных клеток. Дендритные клетки (DC) и макрофаги в меньшей степени способны эффективно представлять антигены Т-лимфоцитам и индуцировать, в данной клеточной популяции, пролиферацию или приобретение специфических цитотоксических активностей. Эти клетки называются "антигенпредставляющими клетками" (АРС) и могут вызвать иммунную реакцию. Таким образом, DC можно использовать в протоколах иммунизации ex vivo. По этой причине предшественников DC из периферической крови Масаса fascicularis выделяли путем культивирования in vitro прилипающих клеток после 7 суток стимуляции с GM-CSF и IL-2. С другой стороны, клетки CD34+ очищали с помощью иммуномагнитных гранул и затем культивировали in vitro с GM-CSF и TNF-α в течение 14 суток. Для того, чтобы подтвердить, что DC выделены, осуществляли морфологический анализ и характеризацию фенотипов (FACS-анализ и иммуногистохимия). Функциональный анализ 004330 76 основывался на уникальной способности DC индуцировать пролиферацию аллогенных лимфоцитов. Полученные результаты полностью подтверждают эффективность очистки и функциональную характеризацию DC. Подробно, для того, чтобы выделить предшественников DC, РВМС, полученные посредством центрифугирования в градиенте плотности фиколла, снова расслаивали в ступенчатом градиенте перколла (50% и 42,5%). Клеточная фракция, которая после центрифугирования при 500 g в течение 30 мин находилась между двумя градиентами, состояла, главным образом, из моноцитов (что подтвердил FACS-анализ, данные не приводятся). Эти клетки выдерживали при 4°С, чтобы избежать прилипания клеток к пластиковым пробиркам, затем собирали, промывали, считали и высевали для выращивания при 37°С. На другой день неприлипшие клетки вымывали путем 4-кратной осторожной промывки. Для того, чтобы индуцировать дифференциацию в DC, к прилипающим клеткам добавляли полную среду с добавлением GM-CSF (200 нг/мл, Leucomax, Sandoz, Милан, Италия) и IL-4 (200 Е/мл, Pepro tech, Лондон, Англия). В качестве контроля добавляли полную среду без цитокинов, чтобы индуцировать нормальную дифференциацию моноцитов в линии дифференциации макрофагов. Дважды в неделю половину супернатанта заменяли свежей средой, идентичной среде, использованной в день 0. Созревание DC в клетках, обработанных цитокинами, определяли по типичным морфологически изменениям, подобным образованию кластеров, потери адгезии и разрастанию клеток в стороны. Прилипающие моноциты/макрофаги, выращенные без цитокинов, отделяли посредством обработки ЭДТК (0,5 М в PBS-A), дважды промывали, считали и ресуспендировали в свежей среде при разных концентрациях, в зависимости от выполняемого эксперимента. Для реакций аллогенных смешанных лейкоцитов (AMLR) полученные АРС (DC или макрофаги) проверяли с фиксированным количеством аллогенных Т-лимфоцитов, очищенных с помощью градиентов фиколла и перколла и прилипания, и затем замороженных. AMLR осуществляли в 48-луночных планшетах с 0,5 х 106 Т-лимфоцитов и серийными разведениями АРС. На 4 день культивирования фиксированное количество клеточной суспензии высевали в 96-луночный планшет при трехкратном повторе. В каждую лунку добавляли 1 мКи 3Нтимидина, и затем планшет инкубировали при 37°С в течение 16 ч. По окончании инкубации с помощью счетчика β-частиц определяли количество 3Н-тимидина, поглощенное клетками, и выражали его в числе импульсов в минуту (чим). Результаты показывают, что полученные DC являются сильными АРС, как показала более высокая индукция пролиферации в аллогенных лимфоцитах человека по сравнению с мак- 77 рофаговой стимуляцией, и способность индуцировать пролиферацию Т-лимфоцитов у обезьян при всех использованных концентрациях (фиг. 16В). Для применения при вакцинации DC будут ресуспендированы в концентрации 1 х 105 клеток/100 мкл в RPMI 1640 с добавлением 5% аутологичной сыворотки, 10 мМ буфера Hepes, 100 Е/мл пенициллина или стрептомицина, 0,5 мг/мл амфотерицина В и 0,03% глутамина, и затем инкубированы в течение 2 ч при 37°С в присутствии белка Tat или пептидов Tat, или сочетания Tat, Rev, Nef, Gag, и/или цитокинов. Затем обработанные DC будут инокулированы внутривенно два раза или более в течение 2-4 недель после первой инъекции. С другой стороны, DC будут трансдуцированы с содержащими ген tat векторами, одними или в сочетании с другими векторами, указанными выше, и затем инъецированы внутривенно. Пример 9, перспективный. Описанные иммуногены будут использованы для индукции и/или потенциирования специфической иммунной реакции в слизистых оболочках. Один из подходов основан на применении бактерий (S. Gordonii и Lactobacillus), "преобразованных" для экспрессии вирусных антигенов, указанных выше. Эти бактерии располагаются в слизистых рта и влагалища мыши и индуцируют специфическое, как локальное, так и системное, образование антител против гетерологичных антигенов, экспрессируемых на поверхности рекомбинантных бактерий (ссылки 116, 104, 106, 121, 117, 139, 105, 107). Эти бактерии могут работать как живые векторы вакцин и вносят преимущество вызывания пролонгированной стимуляции иммунной системы. Кроме того, авторы будут оценивать возможность коэкспрессии на поверхности бактерий вирусных антигенов и молекул, участвующих в иммунной реакции, таких как В-субъединица термочувствительного токсина Е. coli или цитокины. Получение рекомбинантных штаммов S. Gordonii будет осуществлено так, как описано ранее (ссылка 116). Коротко, осуществляют (i) хромосомную интеграцию молекул рекомбинантной ДНК; (ii) транскрипционное слияние с сильными хромосомными промоторами; (iii) транскрипционное слияние с геном, кодирующим белок М6 - поверхностный белок Streptococcus. Рекомбинантные штаммы S. Gordonii будут использоваться для заселения слизистой оболочки влагалища обезьяны. Показано, что рекомбинантные штаммы S. Gordonii, экспрессирующие область V3 gp120 ВИЧ-1 и белок Е7 HPV-16, постоянно образуют колонии в слизистой оболочке влагалища мыши после одной инокуляции, индуцируя как локальное, так и системное образование антигенспецифических антител. Системная реакция состоит в преобладании антител IgG2a, что предполагает реакцию типа Th1 (ссылки 105, 106). Авторы будут вы- 004330 78 бирать штаммы Lactobacillus из влагалища человека, которые способны образовывать колонии в слизистой оболочке влагалища обезьяны. Затем будет использована уже разработанная генетическая система, допускающая экспрессию гетерологичных генов на поверхности Lactobacillus (Rush, 1997). Такая стратегия основана на (i) клонировании генетических гибридов (emm6/гетерологичный ген) в инсерционные векторы, несущие гомологию с конъюгативным транспозоном Tn916; (ii) трансформации векторов в бактериальных штаммах, работающих как промежуточный хозяин (Bacillus Subtilis); (iii) конъюгативной мобилизации рекомбинантных транспозонов из В. subtilis в Lactobacillus. Рекомбинантные штаммы Lactobacillus будут использоваться для заселения слизистой оболочки влагалища обезьяны. Вагинальные образцы будут получены с использованием специальных поглощающих фильтров (ссылки 38, 105, 106). Колонизация будет оцениваться посредством высевания вагинальных образцов на селективные планшеты, а экспрессия ВИЧ-антигенов in vivo будет контролироваться с помощью иммунофлуоресценции при вагинальных обменах (ссылка 105). С использованием уже стандартизованных методов (ссылка 38) вагинальный обмен будет использоваться в случае (i) метода Папаниколау, в случае вакцинации через слизистую оболочку влагалища; (ii) присутствия антигенов вакцины в клетках; (iii) фенотипической характеризации клеток посредством цитофлуорометрического анализа (CD1, CD2, CD4, CD5, CD8, CD11c, CD14, CD20, CD28, CD40, CD25, HLA-DR); iv) оценки продуцирования цитокинов (IL-2, IFNγ, TNFα, IL-4, IL-10, IL-15, полуколичественная RT-PCR), определения присутствия цитокинов и ?-хемокинов в жидкостях слизистых оболочек методом ELISA; v) дозировки общих и специфических иммуноглобулинов (IgA и IgG) в жидкости слизистой методом ELISA [Di Fabio et al., Vaccine, 15: 1 (1997)]. Через месяц после последней инокуляции иммуногена обезьяны будут инфицированы внутривенно или через слизистые оболочки SHIV 89.6Р. Контроль за обезьянами будет осуществляться так, как описано в примере 4. Будут взяты образцы крови для того, чтобы осуществить обычные лабораторные проверки, оценку иммунологических параметров, как гуморальных, так и клеточных, как описано в примере 4. Изобретатель полагает, что данный способ можно с успехом использовать для индукции специфической иммунизации у обезьян с использованием пути через слизистую оболочку влагалища. С другой стороны, иммунитет слизистых оболочек можно индуцировать посредством введения белковых иммуногенов, описанных выше, прямо в слизистые оболочки, в присутствии адъювантов, таких как термочув- 79 ствительный токсин Е. coli и холероген, или с использованием других бактериальных и небактериальных систем доставки, таких как цитофектины и липосомы, или посредством инокуляции другими способами, позволяющими индуцировать наиболее эффективную и защитную иммунную реакцию (ссылки 83, 81, 62). Кроме того, изобретатель полагает, что рекомбинантные герпесные векторы, экспрессирующие указанные выше вирусные белки, могут являться прекрасными системами для индуцирования эффективной иммунной реакции в слизистых оболочках. Рекомбинантные вирусные векторы из вируса простого герпеса типа 1 (HSV-1) будут использоваться для экспрессии вирусных белков для индукции системной (иммунизация через кожу, i.d.) реакции и реакции в слизистых оболочках (пероральным, вагинальным или назальным путем). Не будут использоваться ни патогенные, ни репликативные векторы герпеса (ссылка 99) из-за их способности включать большие экзогенные последовательности, не влияя на эффективность инфекции (ссылки 52, 64). Следовательно, будут сконструированы векторы, способные содержать несколько генов ВИЧ (добавочный, регуляторный и структурный). Иммунитет слизистых оболочек можно индуцировать пероральной, вагинальной или назальной вакциной. При таких подходах к вакцине можно использовать герпесные векторы, так как HSV-1 можно вводить непосредственно через слизистые оболочки (ссылки 176, 75). Рекомбинантные вирусы будут конструироваться с использованием двухстадийного способа, который облегчает встраивание экзогенных последовательностей в вирусный геном. Первая стадия требует встраивания экспрессионной кассеты с репортерным геном (β-галактозидаза, LacZ), клонированным в сайте рестрикции PacI, отсутствующем в геноме HSV1, фланкированный нужной последовательностью-мишенью HSV-1, с использованием стандартной процедуры для гомологичной рекомбинации, чтобы прервать ген HSV-1. Рекомбинатный вирус отбирают посредством образования бляшек с синим фенотипом, с использованием "окрашивания x-gal". Расщепление вирусной ДНК PacI высвобождает маркерный ген и генерирует два крупных фрагмента вирусной ДНК, неспособных продуцировать инфицирующие частицы вируса. Вторая стадия состоит в котрансфекции вирусной ДНК, расщепленной той же плазмидой, которая использована для образования делеции, где репортерный ген замещен нужным геном. Рекомбинантные вирусы будут идентифицированы посредством отбора бляшек с белым фенотипом после "окрашивания x-gal". Такая рекомбинация приведет к удалению сайтов PacI, что позволит использовать этот способ для встраивания многих генов в различные локусы генома HSV-1 (ссылка 74). Посредством скрещивания различных векторов, 004330 80 содержащих отдельные гены, авторы изобретения смогут создать все различные генетические комбинации. Вектор, содержащий все нужные гены, будет выделен посредством скрининга с различными маркерами, фенотипами, и селективно выращен на компетентных клетках. Все комбинации будут созданы путем изменения трансфекций ДНК и вирусных рекомбинаций. Векторы, экспрессирующие отдельные гены tat, rev, nef или gag, будут сконструированы с использованием, в качестве базового вектора, вектора, содержащего мутации в генах 4-/22/27-/41, что предпочтительнее для низкой токсичности и сильной экспрессии экзогенного гена, по сравнению с другими нерепликативными векторами HSV-1. Будут использоваться конститутивные промоторы, такие как промоторы из HCMV (немедленно-ранний промотор цитомегаловируса человека), или как ICPO 1ер (немедленно-ранний промотор белка инфицированной клетки) и вирус мышиного лейкоза Мелони LTR, для индуцирования экспрессии вышеуказанных генов. Будут сконструированы нерепликативные векторы HSV-1, экспрессирующие ВИЧ-белки в различных сочетаниях. Продуцирование таких вирусов, содержащих больше разных генов, будет достигаться путем генетического скрещивания векторов, содержащих отдельные гены, описанные в предыдущем пункте. Будут созданы двойные, тройные и четверные векторы. Векторы будут инокулироваться обезьянам i.d. или через слизистые оболочки (рта, влагалища или носа), причем особое внимание будет уделено последнему типу введения (ссылки 176, 101, 102). Схема вакцинации включает множество инъекций в разные моменты времени, которые должны определяться в зависимости от иммуногена или сочетания иммуногенов. Во время иммунизации животные будут контролироваться с целью оценки гематохимических и иммунологических параметров, как описано в примере 4. Образцы из влагалища будут браться уже стандартизованными способами и будут исследоваться так, как описано ранее в данном примере. Пример 10, перспективный. Системы доставки. Tat (белок и/или ДНК), один или в сочетании (как описано выше), будет инокулирован с использованием новых систем доставки, таких как эритроциты или наночастицы. Система доставки, включающая использование эритроцитов, основана на возможности доставки антигена, связанного с аутологичными эритроцитами. В действительности, эритроциты в конце своего жизненного цикла (у человека примерно 120 дней) удаляются из кровотока макрофагами, являющимися, как известно, "профессиональными" антигенпредставляющими клетками. Это свойство можно использовать для вакцин. Таким образом, антигены будут присоединены к эритроцитам определенным способом (ссылки 81 95, 96), позволяющим сохранить иммуногенные свойства антигена (ссылки 29, 30). При этой процедуре можно осуществить биотинилирование эритроцитов при отсутствии существенных изменений их свойств и жизненного цикла (ссылка 95). Фагоцитоз старых эритроцитов клетками-макрофагами запустит иммунную реакцию. Опсонизация антител эритроцитов, несущих антиген, поможет вывести антиген из кровотока. Основными преимуществами такой методологии являются 1) небольшое количество антигена, необходимое для индуцирования гуморальной и клеточной иммунной реакции, 2) длительная иммунизация вследствие длительного присутствия антигенов, которые несут эритроциты на периферии, 3) функции адъюванта, обеспеченные самой системой. Действительно, при исследованиях на животных показано, что введение антигенов, связанных с мембранами аутологичных эритроцитов, индуцирует иммунную реакцию, подобную или более сильную, чем иммунная реакция, полученная с тем же антигеном, введенным с адъювантом Фрейнда (ссылка 29). Эти свойства очень полезны для разработки вакцины против ВИЧ, в частности, когда требуется повысить иммуногенность антигена и доступность антигена, и когда требуется малое число иммунизаций. Кроме того, такой подход можно применить, когда адъюванты не включены в протокол иммунизации. Действительно, на мышиной модели показано, что антигены, введенные с помощью аутологичных эритроцитов, индуцируют иммунные реакции схожие или более сильные, если сравнивать с иммунными реакциями, вызванными тем же антигеном, введенным с адъювантом Фрейнда, известным как самый сильный адъювант, доступный коммерчески (ссылка 29), хотя он и не одобрен для исследований на людях из-за существенных побочных действий. Таким образом, эффект адъюванта у эритроцитов, несущих белок Tat, один или в сочетании с другими иммуногенами, описанными ранее, будет проанализирован на приматах, но не на людях. Будет осуществлено сравнение полученных при этом данных и данных, полученных при введении белка Tat в присутствии Alum, RIBI или ISCOM. Применение наночастиц может представлять еще один подход к доставке. Функциональные наночастицы представляют важную систему для переноса и секреции белков и ДНК (ссылки 27, 172). Наносферы представляют собой коллоидные полимерные частицы разного химического состава с диаметром в широком диапзоне от 10 до 1000 нм. На поверхности или внутри наносфер могут адсорбироваться самые разные вещества (олигонуклеотиды, лекарственные средства, белки, пептиды, ДНК), которые затем переносятся в цитоплазму или в ядра клеток, где они постепенно высвобождаются. Кроме того, вследствие свойств наносфер тре- 004330 82 буется небольшое количество доставляемого иммуногена. Наночастицы являются хорошей системой доставки, особенно, в случае молекул с низкой устойчивостью в окружающей клетки среде, или когда доставка направлена на специфическую клетку-мишень. Изобретатель полагает, что наносферы можно использовать для доставки описанных выше вирусных антигенов. Можно получить и охарактеризовать три типа наносфер, создаваемых для доставки и регулирования высвобождения ДНК (наносферы типа 1 и 2) и белков (наносферы типа 3). Для доставки ДНК пригодны два типа наносфер (наносферы типа 1 и 2). Первый тип наносфер (наносферы типа 1) имеет трехслойную структуру с наружным слоем из полиоксиэтиленгликоля (PEG). Последние сообщения на основе исследований скрытых систем (ссылки 180, 78) показывают, что PEG делает наносферы невидимыми для клеток Купфера. Напротив, лежащий глубже слой изготовляют из мономеров с тензиоактивными свойствами, содержащих группы четвертичного аммония, которые обратимо адсорбируют ДНК через механизм ионного обмена, а внутреннее ядро изготовляют на основе мономера метилметакрилата. Такие наносферы получают посредством полимеризации в микроэмульсии, включающей полимеризацию винилового или винилиденового мономера в присутствии смеси тензиоактивных реагентов. Таким образом, эти реагенты способны полимеризовать мономер. Один из них содержит группу четвертичного аммония, взаимодействующую с олигонуклеотидами, а другой содержит длинную цепь PEG. Второй тип системы доставки ДНК получают из функциональных нано- и микросфер (наносферы типа 2) со свойствами гидрогеля. Такие наносферы должны изготовляться в присутствии ДНК, чтобы захватить ее во внутренней части системы доставки. Наносферы ядро-оболочка требуются для доставки белков (наносферы типа 3). Они содержат внутреннюю часть (ядро) из полиметилметакрилата и наружную часть (оболочку) из водорастворимого статистического сополимера акриловой кислоты и метилметакрилата, который, как известно, обладает высокой степенью сродства к белкам (ссылки 79, 80). Этот сополимер доступен коммерчески (EUDRAGIT), и его получают при разных процентных соотношениях двух сомономеров. Способ получения, ведущий к изготовлению наносфер второго типа, включает полимеризацию в дисперсии. Синтез включает радикальную полимеризацию винилового или винилиденового мономера в присутствии EUDRAGIT, обладающего пространственными стабилизирующими функциями. После образования ядер наносфер EUDRAGIT упорядочивает внешнюю сторону частиц. Таким образом, изменяя концентрацию инициатора радикальной 83 полимеризации, соотношение мономера и EUDRAGIT и время реакции, получают множество образцов наносфер с различными морфологическими и химическими характеристиками. Таким образом, можно оценить, будет ли доставка белка Tat или ДНК Tat, одних или в сочетании с указанными выше иммуногенами (или белком или ДНК), индуцировать иммунную реакцию против ВИЧ. В частности, на обезьяней модели будут оцениваться гуморальные и клеточноопосредованные иммунные реакции и сравниваться с реакциями, вызываемыми недоставленными иммуногенами. Изобретатель полагает, что информация, полученная при данных исследованиях, может быть полезна для разработки вакцины против ВИЧ. Кроме того, информация, полученная при данном протоколе эксперимента, будет учитываться также при исследованиях других вакцин, в частности, исследованиях вакцин с рекомбинантными белками или пептидами с низкой иммуногенностью. Возможность разработки вакцины, требующей только одного введения, приведет к огромным выгодам в смысле эффективности вакцины и снижения стоимости программ, связанных с вакцинами. Ссылки Agostini et al., Blood 90:1115 (1997). Albini et al., Proc. Natl. Acad. Sci. USA 92:4838 (1995). Allan et al., Science 230:813 (1985). Antibodies - A laboratory manual, Eds. Harlow E., Lane D., Cold Spring Harbor Laboratory (1988). Arya et al., Science 229:69 (1985). Aryoshi et al., AIDS 9:555 (1995). Audibert et al., Immunol. Today 14:281 (193). Badolato et al., Blood 90:2804 (1997). Barillari et al., J. Immunol. 149:3727 (1992). Barillari et al., Proc. Natl. Acad. Sci. USA 90:7941 (1993). Barillari et al., Proc. Natl. Acad. Sci. USA 149:3727 (1993). Blomberg et al., J. Immunol. Methods 160:2734 (1993). Blomberg et al., J. Immunol. Methods 168:267-273 (1994). Blomberg et al., J. Immunol. Methods 193: 199-206 (1996). Bohan et al., Gene Expr. 2:391 (1992). Bourgault et al., J. Virol. 66:75 (1992). Boyer et al., Nature Med. 3:526 (1997). Bruisten et al., J. Infect. Dis. 166:620 (1992). Buseyne et al., J. Virol. 67:694 (1993). Butera et al., J. Virol. 65:4645 (1991). Butera et al., J. Virol. 68:2726 (1994). Cafaro et al., AIDS Res. Hum. Retrov. 7:204 (1991). Carrol et al., Science. 276: 273-276, (1997). Carson et al., J. Clin. Invest. 99:937 (1997). Chang et al., J. Biomed. Sci. 2:189 (1995). 004330 84 Chang et al., AIDS 11: 1421 (1997). Chavany et al., Phar. Res. 9: 441 (1994). Chen et al., J. Immunol. 149:4060 (1992). Chiarantini et al., Vaccine 15: 276 (1997). Chiarantini e at., Clin. Diag. Lab. Immunol. 5: 235 (1998). Chirmule et al., J. Virol. 69:492 (1995). Choppin et al., J. Immunol. 147:569 (1991). Corallini et al., Cancer Res. 53: 1 (1993). Corallini et al., Cancer Res, 53: 5569 (1993). Culman et al., J. Immunol. 146:1560 (1991). Couillin et al., J. Exp. Med. 180:1129 (1994). Danko et al., Vaccine 12:1499 (1994). Di Fabio et al., Vaccine 15: 1 (1997). Ensoli et al., IV International Conference on AIDS, Stockholm, 1:241 (1988). Ensoli et al., Nature 345:84 (1990). Ensoli et al., J. Virol. 67:277 (1993). Ensoli et al., Nature 371:674 (1994). Ensoli et al., AIDS Updates, Eds. V. De Vita, Jr., Hellman S., Rosenberg S.A., Lippincott J.B., Philadelphia; 7: 1 (1994). Felber et al., Proc. Natl. Acad. Sci. 86:1495 (1989). Fine et al., Ann. Plast. Surg. 20:6 (1988). Fiorelli et al., J. Clin. Invest. 95:1723 (1995). Folks et al., Science 238:800 (1987). Franchini et al., Virology 155:593 (1986). Frankel et al., Cell 55:1189 (1988). Fugier-Vivier et al, J. Exp. Med. 186: 813 (1997). Gait et al., Trends Biochem. Sci. 18:255 (1993). Glorioso et al., Ann. Rev. Microbiol. 49:675 (1995). Gobert et al., Virology 176:458 (1990). Goletti et al., J. Virol. 69:2540 (1995). Gorman et al., Mol. Cell. Biol. 2:1044 (1982). Grabstein et al., Science 264:965 (1994). Grosjean et al., J. Exp. Med. 186: 801 (1997). Guy et al., Nature 330:266 (1987). Harrer et al., AIDS Res. Hum. Retrov. 12:585 (1996). Harrich et al., EMBO J. 16:6 (1997). Hinkula et al., J. Virol. 71:5528 (1997). Honenbang et al., Infect. Immun. 62:15 (1994). Huang et al., EMBO J. 13:2886 (1994). Huard et al., Gene Ther. 2:385 (1995). Igarashi et al., AIDS Res. Hum. Retrov. 10:1021 (1994). Jonuleit et al., J. Immunol. 158:2610 (1997). Jullien et al., J. Immunol. 158:800 (1997). Kanai et al., J. Immunol. 157:3681 (1996). Karlosson et al., J. Virol. 71:4218 (1997). Kashanchi et al., J. Virol. 70:5503 (1996). Kestler et al., Science 248:1109 (1991). Kim et al., Oncogene 7: 1525 (1992). Koup et al., J. Virol. 68:4650 (1994). Krisky et al., Gene Ther. 4:1120 (1997). Kuklin et al., J. Virol. 240:245 (1998). Landes, Austin, p. 107 (1997). 85 Lanzavecchia, Science 260: 937 (1993). Lasic et al., Chemical Reviews 95: 2601 (1995). Laus et al., Polymer 37: 343 (1996). Laus et al., Polymers for Adv. Techn. 7: 548 (1996). Lehnen et al., Vaccine Research 1:319 (1992). Levine et al., Science. 272: 1939-1943 (1996). Lewis et al., Vaccine Press, Ed. Robinson, Farrar, Wiblin; Human Press, Totowa, New Jersey (1996). Li et al., Proc. Natl. Acad. Sci. USA 94:8116 (1997). Li et al., J. AIDS 5:639 (1992). Li et al., Science 268:229 (1995). Li et al., Proc. Natl. Acad. Sci. USA 94:8116 (1997). Lippincott J.B., Stockholm, Sweden, May 31June 3 (1997). Littaua et al. , J. Virol. 65:40 (1991). Lovgren et al., Vaccine 14:753 (1996). Lu et al., J. Virol. 70:3978 (1996). Lubaki et al., J. Infect. Dis. 175:1360 (1997). Lucey et al., Clin. Diagn. Lab. Immunol. 4:43 (1997). Luciw et al., Proc. Natl. Acad. Sci. 92:7490 (1995). Magnani et al., Biotech. Appl. Biochem. 16: 188 (1992). Magnani et al. , Biotech. Appl. Biochem. 20: 335 (1994). Malim et al., Nature 338:254 (1989). Mann et al., EMBO J. 10:1733 (1991). Marconi et al., Proc. Natl. Acad. Sci 93:11319 (1996). Marcuzzi et al., J. Virol. 66:4228 (1992). McLean et al., J. Infect. Dis. 66:341 (1994). McLean et al., Vaccine 14:987 (1996). Mcfarland et al., J. Inf. Dis. 170:766 (1994). Medaglini et al., Proc. Natl. Acad. Sci. USA 92: 6868 (1995). Medaglini et al., Biotech. Annu. Rev. 3:297 (1997). Medaglini et al., Vaccine 15:1330 (1997). Medaglini et al., Am. J. Reprod. Immunol. 39:199 (1998). Meyerhans et al., Cell 58:901 (1989). Morein et al., AIDS Res. Hum. Retrov. S10:S109 (1994). Molecular cloning - A laboratory manual; Eds. Maniatis Т., Fritsch E.F., Sambrook J., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York (1992). Myers et al., Human Retroviruses and AIDS: A compilation and analysis of nucleic acid and amino acid sequences, Los Alamos Laboratory, Los Alamos, NM p.1 (1993). Myers et al., Human Retroviruses and AIDS. Theoretical Biology and Biophysics Group. Los Alamos, NH (1995). Neuvet et al., J. Virol. 70:5572 (1996). Nietfield et al., J. Immunol. 154:2189 (1995). 004330 86 Nixon et al., Nature 336:484 (1988). Oggioni et al., Vaccine 13:775 (1995). Oggioni, et al., Gene 169:85 (1996). O'Hagan et al., Novel Delivery Systems for Oral Vaccines, Eds. O'Hagan, D.T. CRC Press Boca Raton, FL, p. 176 (1994). Parslow, Human Retroviruses, Ed. B.R. Cullen, IRL press, Oxford, England, p. 101 (1993). Pilkington et al., Mol. Immunol. 33:439 (1996). Pozzi et al., in "Gram-positive bacteria as vaccine vehicles for mucosal immunization", eds. Pozzi G. & Wells, J.M. - Landes, Austin, p. 35 (1997). Puri et al., Cancer Res., 52:3787 (1992). Puri et al., AIDS Res. 11:31 (1995). Quesada-Rolander et al., ABS 6-S1, 2nd European Conference on Experimental AIDS Research, Stockholm, Sweeden, May 31-June3 (1997). Quinn et al., Biochem. Biophys. Res. Commun. 239:6 (1997). Ratner et al., Nature 313:277 (1985). Re et al., J. Acquir. Immun. Defic. Syndr. 10:408 (1995). Reimann et al., J. Virol. 70:3189 (1996). Reimann et al., J. Virol. 70:6922 (1996). Reiss et al., J. Med Virol. 30:163 (1990). Reiss et al., AIDS Res. Hum. Retrov. 5:621 (1989). Riley et al., J.Immunol. 158: 5545-5553, (1997). Rinaldo et al., AIDS Res. Hum. Retrov. 11:481 (1995). Rinaldo et al., J. Virol., 69:5838 (1995). Rodman et al., Proc. Natl. Acad. Sci. USA 90:7719 (1993). Rodman et al., J. Exp. Med. 175:1247 (1992). Rosenberg et al., Int. Immunol. 9 (5):703 (1997). Rosenthal et al., Seminars in Immunology 9:303 (1997). Rush, et al., in "Gram-positive bacteria as vaccine vehicles for mucosal immunization", eds. Pozzi G. & Wells, J.M. - Landes, Austin, p. 107 (1997). Sadaie et al., New Biol. 2:479 (1990). Saiki et al., Science 230:1350 (1985). Sakuragi et al., J. Gen. Virol. 73:2983 (1992). Salter et al., Immunogenetics 21:235 (1985). Schnorr et al., Proc. Natl. Acad. Sci. USA. 94: 5326 (1997). Sharma et al., Biochem. Biophys. Res. Co. 208:704 (1995). Shibata et al., J. Virol. 65:314 (1991). Sipsas et al., J. Clin. Invest. 99:752 (1997). Sodroski et al., Science 227:171 (1985) Steinaa et al., Arch. Virol. 139:263 (1994). Steinman R.M., Exp. Hematol. 24: 859 (1996). Tahtinen et al., Virology 187:156 (1992). Theoretical Biology and Biophysics, Los 87 Alamos, NH, (1995). Titti et al., Cell. Pharmacol. AIDS 3:123 (1996). Trinchieri, Curr. Opin. Hematol. 4:59 (1997). van Baalen et al., J. Gen. Virol., 77:1659 (1996). van Baalen et al., J. Gen. Virol. 78:1913 (1997). Vellutini et al., AIDS Res. Hum. Retrov. 11:21 (1995). Venet et al., J. Immunol. 148:2899 (1992). Viscidi et al., Science 246:1606 (1989). Vogel et al., Nature 335: 601 (1988). Voss et al., Virology 208:770 (1995). Wain-Hobson, Curr. Opin. Genet. Dev. 3:878 (1993). Westendorp et al., J. Virol. 68:4177 (1994). Westendorp et al., Nature 375:497 (1995). Wolf et al., J. Immunol. 146:3074 (1991). Yang et al., J. Virol. 70:4576 (1996). Yang et al., J. Virol. 70:5799 (1996). Yasutomi et al., J. Virol. 70:678 (1996). Zauli et al., Blood 86:3823 (1995). Zauli et al., Blood 80:3036 (1996). Zauli et al., J.Immunol. 157:2216 (1996). Zobel et al., Antisense Nucleic Acid Drug Dev. 7: 483 (1997). Gibellini et al., Blood 89:1654 (1997). Bauer et al., J. Infect. Dis. 165:419 (1992). Klein et al., J. Exp. Med. 181:1365 (1995). Bowen et al., Res. Virol. 143:269 (1992). Zamarchi et al., AIDS Res. Human Retrov. 9:1139 (1993). Fiore et al., AIDS 5:1034 (1992). Roman et al., Nature Med. 3:849 (1997). Allen et al., Biochim. Biophis. Acta 1237:99 (1995). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Биологически активный изолированный белок Tat, имеющий последовательность, определенную в SEQ ID N 2, способный 1) проникать в активированные эндотелиальные клетки или дендритные клетки в концентрациях до 10 нМ и 2) осуществлять по меньшей мере одно действие, выбранное из группы, состоящей из следующих действий: i) активация пролиферации, миграции и инвазии клеток саркомы Капоши (KS) или цитокинактивированных эндотелиальных клеток; ii) активация репликации вируса при добавлении к инфицированным клеткам при измерении: а) методом сохранения дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка и/или б) методом трансактивации экспрессии гена ВИЧ1 в клетках, трансфицированных промотором ВИЧ-1 - репортерной плазмидой; и iii) индукция у мышей развития KS-подобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления. 2. Изолированная ДНК, определенная в по- 004330 88 следовательности SEQ ID N 1, кодирующая белок Tat по п.1, который способен 1) проникать в активированные эндотелиальные клетки или дендритные клетки в концентрациях до 10 нМ и 2) осуществлять по меньшей мере одно действие, выбранное из группы, состоящей из следующих действий: i) активация пролиферации, миграции и инвазии клеток саркомы Капоши (KS) или цитокинактивированных эндотелиальных клеток; ii) активация репликации вируса при добавлении к инфицированным клеткам при измерении: а) методом сохранения дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка и/или б) методом трансактивации экспрессии гена ВИЧ-1 в клетках, трансфицированных промотором ВИЧ-1 репортерной плазмидой; и iii) индукция у мышей развития KS-подобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления. 3. Биологически активный изолированный фрагмент белка Tat по п.1, имеющий последовательность, выбранную из группы следующих последовательностей: SEQ ID N 11, SEQ ID N 12, SEQ ID N 13, SEQ ID N 14, SEQ ID N 15, SEQ ID N 16, SEQ ID N 17 и способный: 1) проникать в активированные эндотелиальные клетки или дендритные клетки в концентрациях до 10 нМ и 2) осуществлять по меньшей мере одно действие, выбранное из группы, состоящей из следующих действий: i) активация пролиферации, миграции и инвазии клеток саркомы Капоши (KS) или цитокинактивированных эндотелиальных клеток; ii) активация репликации вируса при добавлении к инфицированным клеткам при измерении: а) методом сохранения дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка и/или б) методом трансактивации экспрессии гена ВИЧ1 в клетках, трансфицированных промотором ВИЧ-1 - репортерной плазмидой; и iii) индукция у мышей развития KS-подобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления. 4. Биологически активный изолированный мутант белка Tat по п.1, имеющий последовательность, выбранную из группы последовательностей: аминокислотная последовательность cys22, определенная в SEQ ID N 7, аминокислотная последовательность lys41, определенная в SEQ ID N 8, аминокислотная последовательность RGD∆, определенная в SEQ ID N 9, аминокислотная последовательность lys41RGD∆, определенная в SEQ ID N 10, способный: 1) проникать в активированные эндотелиальные клетки или дендритные клетки в концентрациях до 10 нМ и 2) осуществлять по меньшей мере одно действие, выбранное из группы, состоящей из следующих действий: i) активация пролиферации, миграции и инвазии клеток саркомы Капоши (KS) или цитокинакти- 89 вированных эндотелиальных клеток; ii) активация репликации вируса при добавлении к инфицированным клеткам при измерении: а) методом сохранения дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка и/или б) методом трансактивации экспрессии гена ВИЧ-1 в клетках, трансфицированных промотором ВИЧ-1 - репортерной плазмидой; и iii) индукция у мышей развития KSподобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления. 5. Изолированная ДНК, кодирующая биологически активный изолированный мутант белка Tat, который способен: 1) проникать в активированные эндотелиальные клетки или дендритные клетки в концентрациях до 10 нМ и 2) осуществлять по меньшей мере одно действие, выбранное из группы, состоящей из следующих действий: i) активация пролиферации, миграции и инвазии клеток саркомы Капоши (KS) или цитокинактивированных эндотелиальных клеток; ii) активация репликации вируса при добавлении к инфицированным клеткам при измерении: а) методом сохранения дефектных по Tat провирусов в клетках HLM-1 после добавления экзогенного белка и/или б) методом трансактивации экспрессии гена ВИЧ-1 в клетках, трансфицированных промотором ВИЧ-1 репортерной плазмидой; и iii) индукция у мышей развития KS-подобных повреждений в присутствии ангиогенных факторов или цитокинов зоны воспаления, причем указанная последовательность, является последовательностью, представляющей нуклеотидную последовательность мутанта cys22, определенную в SEQ ID N 3, или нуклеотидную последовательность lys41, определенную в SEQ ID N 4, или нуклеотидную последовательность RGD∆, определенную в SEQ ID N 5, или нуклеотидную последовательность lys41-RGD∆, определенную в SEQ ID N 6. 6. Биологически активный изолированный белок Tat, его фрагмент и/или мутант, и/или ДНК Tat по пп.1-5, полезные при профилактике и/или лечении СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией. 7. Вакцина профилактическая и/или лечебная против СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией, на основе биологически активного изолированного белка Tat, его фрагмента и/или мутанта, и/или ДНК Tat по пп.1-5. 8. Фармацевтическая композиция, содержащая в качестве активной основы биологически активный выделенный белок Tat, его фрагменты и/или мутанты, и/или ДНК Tat по любому из пп.1-5 в сочетании с подходящими эксципиентами и/или разбавителями (для профилактики и/или лечения СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией). 9. Фармацевтическая композиция по п.8 004330 90 для профилактики и/или лечения СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией. 10. Фармацевтическая композиция по п.8, которая представляет собой вакцину для профилактики и/или лечения СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧинфекцией. 11. Фармацевтическая композиция по п.8, в которой Tat представлен в очищенной неагрегированной и неокисленной форме, причем он лиофилизирован для хранения и ресуспендируем в биологически приемлемой жидкости при применении. 12. Фармацевтическая композиция по пп.811, выполненная в форме, подходящей для введения, выбранного из группы, состоящей из введения в слизистую оболочку, назального, перорального, вагинального, ректального, внутримышечного, подкожного, интрадермального, системного и местного введения. 13. Фармацевтическая композиция, содержащая в качестве активной основы биологически активный выделенный белок Tat, его фрагмент и/или мутант и/или Tat ДНК в сочетании с подходящими эксципиентами и/или разбавителями, причем указанный Tat получен способом, включающим стадию очистки, осуществляемую в условиях, предотвращающих его окисление и агрегацию. 14. Фармацевтическая композиция по п.13, где указанную стадию очистки осуществляют методом гепаринаффинной хроматографии. 15. Фармацевтическая композиция по п.13, где за указанной стадией очистки следует хранение белка Tat в лиофилизированной форме и его ресуспендирование в буфере, лишенном газа. 16. Фармацевтическая композиция по п.13, причем указанная композиция представляет собой вакцину для профилактики и/или лечения СПИДа, опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией. 17. Фармацевтическая композиция по п.13, в которой Tat кодирован ДНК, имеющей последовательность, идентифицированную как SEQ ID N 1. 18. Фармацевтическая композиция по п.13, в которой Tat имеет последовательность SEQ ID N 2. 19. Фармацевтическая композиция по пп.13-16, в которой мутант выбран из группы мутантов, имеющих перечисленные далее нуклеотидные последовательности или часть их: нуклеотидная последовательность мутанта cys22, идентифицированная как SEQ ID N 3; нуклеотидная последовательность мутанта lys41, идентифицированная как SEQ ID N 4; нуклеотидная последовательность мутанта RGD∆, идентифицированная как SEQ ID N 5; нуклеотидная последовательность мутанта 91 lys41-RGD∆, идентифицированная как SEQ ID N 6. 20. Фармацевтическая композиция по пп.13-16, в которой мутант выбран из группы мутантов, имеющих перечисленные далее аминокислотные последовательности или часть их: аминокислотная последовательность мутанта cys22, идентифицированная как SEQ ID N 7; аминокислотная последовательность мутанта lys41, идентифицированная как SEQ ID N 8; аминокислотная последовательность мутанта RGD∆, идентифицированная как SEQ ID N 9; аминокислотная последовательность мутанта lys41-RGD∆, идентифицированная как SEQ ID N 10. 21. Фармацевтическая композиция по пп.13-16, в которой фрагмент Tat выбран из группы пептидов, имеющих последовательности, идентифицированные как SEQ ID N 11, SEQ ID N 12, SEQ ID N 13, SEQ ID N 14, SEQ ID N 15, SEQ ID N 16, SEQ ID N 17. 22. Фармацевтическая композиция по пп.13-21, выполненная в форме, подходящей для введения, выбранного из группы, состоящей из введения в слизистую оболочку, назального, перорального, вагинального, ректального, внутримышечного, подкожного, интрадермального, системного и местного введения. 23. Фармацевтическая композиция по пп.822, содержащая белки или пептиды, конъюгированные с универсальным хелперным эпитопом столбнячного анатоксина или любыми Тхелперными эпитопами. 24. Фармацевтическая композиция по пп.822 в сочетании с рекомбинантными белками или пептидами ВИЧ Nef, Rev или Gag или частью из них. 25. Фармацевтическая композиция по пп.822, содержащая слитые белки Tat (дикого типа или его мутанты)/Nef, Tat (дикого типа или его мутанты)/Rev или Tat (дикого типа или его мутанты)/Gag или часть из них. 26. Фармацевтическая композиция по пп.825 в сочетании с рекомбинантными иммуномодулирующими цитокинами, или другими молекулами, или частью из них, усиливающими антивирусную иммунную реакцию. 27. Фармацевтическая композиция по п.26, в которой цитокины представляют собой IL-12, и/или IL-15, или α-IFN, или β-IFN. 28. Фармацевтическая композиция по пп.822, в которой белки Tat представляют собой слитые белки Tat (дикого типа или его мутанты)/иммуномодулирующие цитокины, Tat (дикого типа или его мутанты)/IL-12, Tat (дикого типа или его мутанты)/IL-15, Tat (дикого типа или его мутанты)/другие молекулы или часть их, усиливающие антивирусную иммунную реакцию. 29. Фармацевтическая композиция по пп.822, содержащая ДНК, кодирующую Tat дикого 004330 92 типа, или его мутанты, или часть их, встроенную в экспрессирующие векторы. 30. Фармацевтическая композиция по пп.822, дополнительно содержащая в сочетании с ним экспрессирующий вектор, включающий гены ВИЧ rev, nef и gag или часть из них. 31. Фармацевтическая композиция по п.27 или 30, в которой вектор представляет собой плазмиду, коэкспрессирующую tat (дикого типа или его мутанты)/rev, tat (дикого типа или его мутанты)/nef, tat (дикого типа или его мутанты)/gag или часть из них. 32. Фармацевтическая композиция по пп.822 в сочетании с молекулой ДНК, встроенной в экспрессирующий вектор, кодирующий иммуномодулирующие цитокины или другие иммуномодулирующие молекулы, или часть их, усиливающую противовирусную иммунную реакцию. 33. Фармацевтическая композиция по п.32, в которой цитокином является IL-12 и/или IL15. 34. Фармацевтическая композиция по п.32 или 33, в которой вектор представляет собой плазмиду, коэкспрессирующую tat (дикого типа или его мутанты)/IL-12, tat (дикого типа или его мутанты)/IL-15, tat (дикого типа или его мутанты)/другие молекулы или часть их, способную усиливать антивирусную иммунную реакцию. 35. Фармацевтическая композиция по пп.29-34, в которой вектором является pCV0. 36. Фармацевтическая композиция по пп.835, дополнительно содержащая аутологичные дендритные клетки. 37. Фармацевтическая композиция по пп.836, дополнительно содержащая адъювант, выбранный из группы, состоящей из Alum, ISCOM, RIBI и/или парамагнитных гранул, покрытых моноклональными антителами против CD3 и против CD28, и их смесей. 38. Фармацевтическая композиция по пп.837, дополнительно содержащая систему для доставки. 39. Фармацевтическая композиция по п.38, в которой систему для доставки выбирают среди наночастиц, герпесных векторов, эритроцитов, бактерий и их сочетаний. 40. Фармацевтическая композиция по п.39, в которой бактерии выбирают среди Streptococcus gordonii и Lactobacillus. 41. Фармацевтическая композиция по пп.39 и 40, в которой бактерии модифицируют для экспрессии вирусных антигенов. 42. Фармацевтическая композиция по пп.841 для иммунизации клеток периферической крови от инфицированных индивидуумов, выращенных посредством костимуляции с магнитными гранулами, сенсибилизированными антителами против CD3 и против CD28. 43. Фармацевтическая композиция по пп.8-42 в сочетании с ингибиторами репликации вируса. 44. Фармацевтическая композиция по пп.8- 93 43, в которой активную основу вводят без адъювантов интрадермально в количестве 1-6 мкг. 45. Применение белка Tat, его фрагментов, и/или мутантов, и/или Tat ДНК по пп.1-5 в их неокисленной и неагрегированной форме при лечении (СПИДа, связанных со СПИДом опухолей, синдромов и симптомов, связанных с ВИЧ-инфекцией). 46. Применение белка Tat, его фрагмента, варианта или ДНК по пп.1-5 для приготовления вакцины на основе белка, или пептида, или ДНК, профилактической и/или лечебной, против СПИДа, связанных со СПИДом опухолей, синдромов и симптомов, связанных ВИЧинфекцией. 47. Применение лиофилизованного Tat для приготовления вакцины по п.46, причем указанный лиофилизованный Tat для введения ресуспендируют в биологически приемлемой жидкости. 48. Экспрессионный вектор, экспрессирующий биологически активный белок Tat, его фрагмент и /или мутант по пп.1-5. 49. Экспрессионный вектор по п.48, представляющий собой pCV0. 50. Экспрессионный вектор по пп.48-49, дополнительно содержащий последовательность ДНК, кодирующую ген, выбранный среди tat, rev, nef, gag, IL-12, IL-15 и их сочетаний. 51. Линия прокариотических и/или эукариотических клеток, содержащих вектор по пп.48-50. 52. Применение вектора pCV0, модифицированного по пп.49-50, для приготовления профилактической и/или лечебной вакцины против СПИДа, связанных со СПИДом опухолей, синдромов и симптомов, связанных с ВИЧинфекцией. 53. Линия первичных дендритных клеток, Список последовательностей 004330 94 обработанных белком Tat, или его пептидами, или мутантами по пп.1-5 в сочетании с фармацевтическими композициями по пп.8-44. 54. Линия первичных дендритных клеток, обработанных по меньшей мере одним из соединений из числа белков Rev, Nef и Gag и/или цитокинов, в сочетании с фармацевтическими композициями по пп.8-45. 55. Линия первичных дендритных клеток по пп.53-54, трансдуцированных экспрессирующим вектором, содержащим ген tat. 56. Терапевтический способ лечения СПИДа, связанных со СПИДом опухолей, синдромов и симптомов, ассоциированных с ВИЧ инфекцией, включающий введение в терапевтическом или профилактическом количестве биологически активного Tat, его фрагмента, мутанта и/или Tat ДНК по пп.1-5. 57. Терапевтический способ лечения по п.56, в котором Tat используют в его неокисленной и неагрегированной форме. 58. Терапевтический способ лечения по п.56, в котором используют лиофилизированный Tat, который ресуспендирован в физиологически приемлемой жидкости. 59. Терапевтический способ лечения по п.56, включающий введение в терапевтическом или профилактическом количестве биологически активного Tat, его фрагмента, мутанта и/или Tat ДНК по пп.1-5 в сочетании с Alum, ISCOM, RIBI или с их смесями. 60. Терапевтический способ лечения по п.56, включающий введение в терапевтическом или профилактическом количестве биологически активного Tat, его фрагмента, мутанта и/или Tat ДНК по пп.1-5 в сочетании с парамагнитными гранулами, покрытыми моноклональными антителами против CD3 и CD28. 95 004330 96 97 004330 98 Фиг. 1А Фиг. 1В Фиг. 2А 99 Фиг. 2В 004330 100 Фиг. 8А Фиг. 3 Фиг. 8В Фиг. 4А Фиг. 9 Фиг. 4В Фиг. 10 Фиг. 5 Фиг. 11А Фиг. 6 Фиг. 7 Фиг. 11В 101 004330 102 Фиг. 12 Фиг. 15С Фиг. 13 Фиг. 15D Фиг. 14 Фиг. 16А Фиг. 15А Фиг. 16В Фиг. 15В Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6