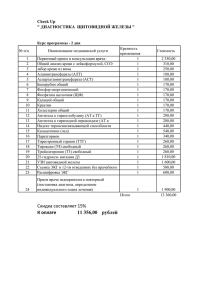
Пологойко Галина Петровна (размещена 27.11.2014).
реклама

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ПЕРВЫЙ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМ. АКАД. И.П.ПАВЛОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ На правах рукописи ПОЛОГОЙКО ГАЛИНА ПЕТРОВНА ГОРМОНАЛЬНАЯ КОНТРАЦЕПЦИЯ У ЖЕНЩИН С АУТОИММУННЫМ ТИРЕОИДИТОМ И ДИФФУЗНЫМ НЕТОКСИЧЕСКИМ ЗОБОМ 14.01.01 – акушерство и гинекология Диссертация на соискание ученой степени кандидата медицинских наук Научные руководители: заслуженный деятель науки РФ, доктор медицинских наук, профессор Тарасова Марина Анатольевна заслуженный деятель науки РФ, доктор медицинских наук, профессор Потин Владимир Всеволодович Санкт-Петербург – 2015 2 ОГЛАВЛЕНИЕ Список сокращений…………………………………………………...…………..4 Введение………………………………………………………………….…..........6 Глава 1. Обзор литературы……………………………………………………...12 1.1.Заболевания щитовидной железы у женщин репродуктивного возраста: эпидемиология, патогенез, влияние на фертильность………………………...12 1.2.Метаболические изменения у женщин репродуктивного возраста при патологии щитовидной железы…………………………………………………19 1.3.Патология органов репродуктивной системы у женщин с заболеваниями щитовидной железы……………………………………………………………..22 1.4.Влияние половых стероидных гормонов на щитовидную железу……….27 1.5.Гормональная контрацепция при заболеваниях щитовидной железы…...29 Глава 2. Материалы и методы исследования……………………………….…38 2.1. Характеристика групп обследованных женщин и дизайн исследования……………………………………………………………………38 2.2. Методы исследования……………………………………………………....42 2.2.1. Лабораторные методы исследования………………………………...….43 2.2.2. Ультразвуковые методы исследования………………………………….45 2.2.3. Методы статистического анализа ……….……………………………....46 Глава 3. Результаты исследования……………………………………………...48 3.1. Характеристика обследованных женщин…………………….…………...48 3.2. Размеры и функциональное состояние щитовидной железы у женщин, принимающих гормональные контрацептивы………………………………...59 3.2.1. Размеры и функциональное состояние щитовидной железы у здоровых женщин, принимающих комбинированные или гестагенные гормональные контрацептивы…………………………………………………………………...59 3 3.2.2.Результаты обследования женщин с диффузным нетоксическим зобом, получающих комбинированные или гестагенные гормональные контрацептивы…………………………………………………………………...62 3.2.3. Результаты обследования женщин с аутоиммунным тиреоидитом, получающих комбинированные гормональные или гестагенные гормональные контрацептивы………………………………………………….67 3.3. Показатели липидного обмена у женщин репродуктивного возраста с заболеваниями щитовидной железы, принимающих комбинированные или гестагенные гормональные контрацептивы………...………………………….76 3.4. Показатели свертывающей системы крови у женщин репродуктивного возраста с заболеваниями комбинированные или щитовидной железы, гестагенные принимающих гормональные контрацептивы…………………………………………………………………..83 3.5. Биохимические показатели функции печени у женщин репродуктивного возраста с заболеваниями комбинированные или щитовидной железы, гестагенные принимающих гормональные контрацептивы……………………………………………………………….…..88 Глава 4. Обсуждение полученных результатов………………………………..91 Выводы………………………………………………………………………….101 Практические рекомендации ………………………………………………….102 Список литературы……...……………………………………………………...103 4 СПИСОК СОКРАЩЕНИЙ АДФ – аденозин-дефосфат АЛТ – аланинаминотрансфераза АПТВ – активированное парциальное тромбопластиновое время АСТ – аспартатаминотрансфераза АТ – аутоиммунный тиреоидит ВОЗ – Всемирная Организация Здравоохранения ГАМК – гамма-аминомасляная кислота ГРГ – гонадотропин-рилизинг гормон ГСПС – глобулин, связывающий половые стероиды ДНЗ – диффузный нетоксический зоб ДНК – дезоксирибонуклеиновая кислота ДТЗ – диффузный токсический зоб ИМТ – индекс массы тела КА – коэффициент атерогенности КоА – кофермент A КОК – комбинированные оральные контрацептивы ЛГ – лютеинизирующий гормон ЛПВП – липопротеиды высокой плотности ЛПНП – липопротеиды низкой плотности ЛПОНП – липопротеиды очень низкой плотности МД – микродозированные препараты МНО – международное нормализованное отношение НД – низкодозированные препараты РНК – рибонуклеиновая кислота Т3 – трийодтиронин Т4 – тироксин св. Т3 – свободный трийодтиронин 5 св. Т4 – свободный тироксин ТПО – тиреоидная пероксидаза ТГ – тиреоглобулин ТРГ – тиреотропин-рилизинг гормон ТСГ – тироксин-сязывающий глобулин ТТГ – тиреотропный гормон Э2 – эстрадиол ЭЭ – этинилэстрадиол ХС – холестерин ФСГ – фолликулостимулирующий гормон 6 ВВЕДЕНИЕ Комбинированные эстроген-гестагенные и содержащие только гестагенный компонент контрацептивы применяются как для предохранения от нежелательной беременности, так и с лечебными целями [43, 53, 55, 76]. Эти препараты используют более 120 млн. женщин в мире [4, 76, 90, 102]. Безопасность их применения у женщин с экстрагенитальной патологией является ключевым вопросом при выборе метода контрацепции. Патология щитовидной железы у женщин репродуктивного возраста встречается в 5-10 раз чаще, чем у мужчин [56, 73, 109]. Диффузный нетоксический зоб (ДНЗ) является распространенным заболеванием щитовидной железы, особенно в регионах с дефицитом йода в окружающей среде. Другим частым заболеванием щитовидной железы является аутоиммунный тиреоидит – органное аутоиммунное заболевание. В современных комбинированных препаратах эстрогенный компонент представлен этинилэстрадиолом (ЭЭ) в дозе от 15-35 мкг и реже – 17-β эстрадиолом или эстрадиола валератом. Согласно категориям приемлемости методов контрацепции [216], препараты с низкой дозой эстрогенов и содержащие только гестагенный компонент не противопоказаны женщинам с патологией щитовидной железы (диффузным нетоксическим зобом, субклиническим гипотиреозом и субклиническим тиреотоксикозом). В то же время имеются данные [8,137] о стимулирующем влиянии эстрогенов на интактные и опухолевые клетки щитовидной железы независимо от уровня тиреотропного гормона (ТТГ) в крови. В эксперименте [267] показано, что эстрогены стимулируют пролиферацию тиреоцитов, повышая уровень ТТГ в плазме крови и количество рецепторов к нему в клетках щитовидной железы. При беременности высокий уровень плацентарных эстрогенов в крови приводит к увеличению объема щитовидной железы в среднем на 24,1% [52]. 7 Эстрогены снижают секрецию тиреотропного гормона за счет прямого влияния на клетки аденогипофиза, секретирующие ТТГ [141]. Под влиянием эстрогенов повышается чувствительность тиреоцитов к ТТГ, что может приводить к увеличению функциональной активности щитовидной железы [154]. В клетках щитовидной железы имеются α- и β-рецепторы к эстрогенам [134, 173, 267]. Установлено, что процент клеток, содержащих α-рецепторы к эстрогенам, значительно выше при аденоматозном зобе, фолликулярной аденоме и карциноме щитовидной железы, чем в неизменённой ткани [158, 167, 169, 173]. В ряде исследований показано [57, 241], что комбинированные гормональные контрацептивы могут влиять на увеличение размеров щитовидной железы у женщин с диффузным нетоксическим зобом. По данным О.М. Моисеевой [57], этот эффект зависит от исходной степени увеличения щитовидной железы. Имеются сведения о стимулирующем влиянии эстрогенов на продукцию антитиреоидных аутоантител у женщин с аутоиммунным тиреоидитом [220]. В отличие от комбинированных препаратов, гестагенные контрацептивы не оказывают влияние на структуру и функцию щитовидной железы [57]. Таким образом, сведения о влиянии эстрогенсодержащих препаратов на размеры и функцию щитовидной железы у женщин репродуктивного возраста, имеющих патологию щитовидной железы (диффузный нетоксический зоб и аутоиммунный тиреоидит), не однозначны. Актуальной задачей, требующей уточнения, является оценка особенностей влияния синтетических стероидов на гемостаз, липидный обмен и функцию печени у женщин с патологией щитовидной железы. Цель исследования состояла в изучении влияния микродозированных и низкодозированных комбинированных и гестагенных гормональных контрацептивов на размеры и функцию щитовидной железы у женщин с 8 диффузным нетоксическим зобом и аутоиммунным тиреоидитом. Задачи исследования 1. Изучить влияние микродозированных и низкодозированных комбинированных и гестагенных гормональных контрацептивов на объем и функцию щитовидной железы женщин без патологии щитовидной железы. 2. Изучить влияние комбинированных и гестагенных гормональных контрацептивов на объем и функцию щитовидной железы у женщин с диффузным нетоксическим зобом и аутоиммунным тиреоидитом. 3. Изучить влияние применения контрацептивов в сочетании с комбинированных йодидом калия гормональных на размеры и функциональное состояние щитовидной железы у больных диффузным нетоксическим зобом. 4. Оценить изменение уровня антитиреоидных аутоантител в крови женщин с аутоиммунным тиреоидитом при применении микро- и низкодозированных комбинированных гормональных контрацептивов и гестагена дезогестрела. 5. Изучить показатели свертывающей системы крови, липидного обмена, функции печени у женщин с диффузным нетоксическим зобом и женщин с аутоиммунным микродозированных и тиреоидитом низкодозированных при применении комбинированных гормональных контрацептивов и гестагена дезогестрела. Научная новизна и теоретическая значимость работы Показано, что у женщин репродуктивного возраста без патологии щитовидной железы применение микродозированных и низкодозированных 9 комбинированных гормональных контрацептивов и гестагена дезогестрела не оказывает влияния на объем и функцию щитовидной железы. У женщин с диффузным гормональных нетоксическим зобом контрацептивов в после течение приема 12 комбинированных месяцев установлено достоверное увеличение объема щитовидной железы без изменения ее функции. Впервые показано, что у женщин с диффузным нетоксическим зобом применение микродозированных и низкодозированных комбинированных гормональных контрацептивов в сочетании с йодидом калия в суточной дозе 100 мкг предупреждает увеличение объема щитовидной железы. Прием гестагена дезогестрела в течение 12 месяцев не вызывает изменений структуры и функции щитовидной железы. Впервые установлено иммуносупрессивное влияние гормональных контрацептивов у женщин с аутоиммунным тиреоидитом. Прием микро- и низкодозированных комбинированных гормональных контрацептивов в течение 12 месяцев приводит к достоверному снижению в сыворотке крови уровня аутоантител к тиреопероксидазе и к тиреоглобулину, прием гестагена дезогестрела в течение 12 месяцев приводит к достоверному снижению в сыворотке крови только уровня аутоантител к тиреопероксидазе. Практическая значимость Показано, что сочетанное использование микро- и низкодозированных комбинированных гормональных контрацептивов и йодида калия (100 мкг в сутки) предупреждает увеличение размера щитовидной железы у женщин с диффузным нетоксическим зобом. У женщин с аутоиммунным тиреоидитом прием как комбинированных гормональных контрацептивов, так и гестагена дезогестрела приводит к снижению в крови уровня антитиреоидных антител. Установлено, что прием комбинированных гормональных контрацептивов и гестагена дезогестрела в течение 12 месяцев не вызывает клинически 10 значимых изменений показателей свертывающей системы крови, функции печени и липидного обмена у женщин с диффузным нетоксическим зобом и аутоиммунным тиреоидитом. Обоснована безопасность применения микро- и низкодозированных комбинированных гормональных контрацептивов и гестагена дезогестрела у женщин репродуктивного возраста с патологией щитовидной железы. Основные положения, выносимые на защиту 1. Увеличение размеров щитовидной железы у женщин с диффузным нетоксическим зобом при приеме эстроген-гестагенных контрацептивных препаратов в течение 12 месяцев не связано с изменением функциональной активности щитовидной железы. 2. Использование йодида калия в суточной дозе 100 мкг у больных диффузным нетоксическим зобом предупреждает увеличение размеров щитовидной железы на фоне приема эстроген-гестагенных контрацептивных препаратов. 3. У женщин с аутоиммунным тиреоидитом после 12 месяцев приема микро- и низкодозированных комбинированных гормональных контрацептивов наблюдается снижение в сыворотке крови уровня аутоантител к тиреопероксидазе и к тиреоглобулину, при приеме гестагена дезогестрела – снижение в сыворотке крови уровня аутоантител к тиреопероксидазе, что может свидетельствовать о позитивном воздействии аутоиммунного тиреоидита. гормональных препаратов на течение 11 Апробация и внедрение результатов работы в практику Материалы диссертации доложены на конференции молодых ученых в рамках VI регионального форума «Мать и дитя», Ростов-на-Дону, 2012; на III ежегодной научной конференции молодых ученых и специалистов «Репродуктивная медицина: взгляд молодых – 2012», Санкт-Петербург, апрель 2012; на VIII междисциплинарной конференции по акушерству, перинатологии, неонатологии «Здоровая женщина – здоровый новорожденный», Санкт-Петербург, ноябрь 2013 года. Основные положения диссертации внедрены в работу отдела эндокринологии репродукции ФГБУ « Научно-исследовательского института акушерства и гинекологии им. Д.О.Отта»; в учебный процесс кафедры акушерства и гинекологии с курсом УЗД с клиникой ГБОУ ВПО ПСПбГМУ им. И.П. Павлова Минздрава России. По теме диссертации опубликовано 7 работ, в том числе 2 статьи – в рецензируемых научных журналах. Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, 4 глав, с результатами исследования, выводов, практических рекомендаций и списка литературы. Материалы диссертации изложены на 131 странице машинописного текста, иллюстрированы 33 таблицами и 11 рисунками. Список литературы включает 125 отечественных и 154 зарубежных источника. 12 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Заболевания щитовидной железы у женщин репродуктивного возраста: эпидемиология, патогенез, влияние на фертильность Заболевания щитовидной железы встречаются в 5-10 раз чаще у женщин, чем у мужчин и, как правило, развиваются в репродуктивном возрасте [56, 72, 79]. Несмотря на достижения в области тиреоидологии, медицинская и социальная значимость заболеваний щитовидной железы остается высокой. Так, по данным ВОЗ (2001), около 30% населения земного шара имеет риск развития йоддефицитных заболеваний, около 700 млн. человек страдает различными формами зоба, более 50 млн. детей имеют задержку умственного развития, связанную с дефицитом йода. Для России эта проблема является не менее актуальной, поскольку большая часть ее территории относится к регионам дефицита йода различной степени выраженности [25, 26, 36, 118, 173]. Наиболее распространенным заболеванием щитовидной железы является ДНЗ. Частота выявления ДНЗ в различных регионах колеблется от 5-10% до 80-90% и зависит от содержания йода в окружающей среде [73, 78, 118]. Отличие эндемического и спорадического зоба состоит в том, что при спорадическом зобе синтез тиреоидных гормонов ограничен эндогенными первично-тиреоидными факторами, тогда как при эндемическом нетоксическом зобе решающее значение имеет дефицит йода в окружающей среде и потребляемой пище [16, 25, 73]. Недостаточное поступление йода уменьшает синтез тиреоидных гормонов, что приводит к усилению секреции ТТГ, стимулирует рост щитовидной железы [60]. C другой стороны, в условиях дефицита йода повышается чувствительность щитовидной железы к нормальному уровню 13 ТТГ в крови [23, 116]. Несмотря на то, что дефицит йода является наиболее распространенным струмогенным фактором, в некоторых случаях имеет место зобная эндемия смешанного генеза [29]. Все большее значение приобретает не абсолютная, а относительная йодная недостаточность. В патогенезе ДНЗ уделяется внимание изменению кровотока в щитовидной железе [170, 184, 190, 200]. Пролиферация тиреоцитов и увеличение локального кровотока рассматривают как признаки эндемического нетоксического зоба [152, 200]. В ряде исследований [160, 176, 196] показано, что кровоток в щитовидной железе чувствителен к содержанию йода: он усиливается при дефиците йода и уменьшается при его адекватном потреблении. Имеются сообщения [187, 244, 251] о наличии ростостимулирующих иммуноглобулинов в крови 60-70% больных ДНЗ и о нарушении Т-клеточного звена иммунитета с понижением активности Тсупрессоров. В регионах с достаточным или пограничным потреблением йода ДНЗ не сопровождается снижением функции щитовидной железы и не оказывает отрицательного действия на функциональное состояние яичников, течение и исход беременности. В то же время ДНЗ часто сочетается у больных с бесплодием, обусловленным гормональной недостаточностью яичников, миомой матки, эндометриозом и фиброзно-кистозной мастопатией. В патогенезе всех этих заболеваний существенную роль играет абсолютная или относительная гиперэстрогенемия [45, 47, 206]. Эстрогены через активацию ростовых факторов стимулируют гиперпластические процессы в различных тканях и органах, в том числе и в щитовидной железе [46, 97, 206]. У больных ДНЗ часто наблюдается овариальная недостаточность, проявляющаяся ановуляцией или лютеиновой недостаточностью с нарушением секреторных преобразований эндометрия [112]. Это, по мнению Э.К. Айламазяна и соавт. [3], может быть одним из объяснений высокой частоты привычного невынашивания (19,5%) в ранние сроки беременности у 14 женщин с ДНЗ. У значительной части женщин с ДНЗ репродуктивная функция сохранена, что требует подбора гормональной контрацепции. Диффузный токсический зоб (ДТЗ) органное – аутоиммунное заболевание, сопровождающееся увеличением щитовидной железы, ее гиперфункцией (гипертиреозом) и реакцией тканей и органов на избыток тиреоидных гормонов (тиреотоксикозом). Распространенность ДТЗ достигает 0,5% [8, 117, 252]. Центральным звеном патогенеза ДТЗ является появление в циркуляции аутоантител к ТТГ-рецепторам тиреоцитов, которые не блокируют, а стимулируют функцию щитовидной железы и увеличивают ее размеры. Соединяясь с рецепторами ТТГ в других тканях, тиреостимулирующие иммуноглобулины приводят к развитию эндокринной офтальмопатии и дермопатии [66, 104]. Катаболическое действие избытка тиреоидных гормонов определяет снижение массы тела, слабость. Большое число рецепторов к тиреоидным гормонам в миокарде и синергизм с катехоламинами определяет такие симптомы заболевания, как тахикардия, тремор, нервозность, нарушение толерантности к глюкозе [66, 74, 211]. Повышение содержания тиреоидных гормонов в крови, как правило, не сопровождается нарушением гормональной и овуляторной функции яичников. Лишь у части больных, преимущественно с тяжелой формой ДТЗ, наблюдаются различные нарушения менструального цикла, как в виде аменореи, так и мено- или метроррагии [18, 66, 106, 115]. Некоторые авторы [265] предполагают, что нарушения менструального цикла у женщин с ДТЗ могут быть связаны и с функциональным состоянием системы гемостаза. Снижение менструальной кровопотери предположительно может быть связано с изменением синтеза факторов свёртывания крови, в частности, VIII фактора [265]. Существуют гипертиреоидных исследования женщин [161, усилена 250], показавшие, продукция что у тестостерона и андростендиона яичниками и их конверсия в эстрогены. Другие авторы [39, 15 133, 134, 195] отметили, что уровень эстрогенов в крови женщин с тиреотоксикозом повышен на протяжении всего менструального цикла. Гиперфункция щитовидной железы усиливает синтез эстрадиола в гонадах и увеличивает продукцию глобулина, связывающего половые стероиды (ГСПС). Таким образом, нарушение менструального цикла у больных ДТЗ с неустраненным тиреотоксикозом можно связать с изменениями адренергической регуляции секреции гонадотропин-рилизинг гормона (ГРГ) гипоталамусом и метаболизма половых стероидных гормонов под влиянием тиреоидных гормонов. Данные литературных источников [36, 103, 217] об уровне гонадотропных гормонов при тиреотоксикозе противоречивы. У женщин с ДТЗ содержание лютеинизирующего гормона (ЛГ) как в фолликулярную, так и в лютеиновую фазы менструального цикла были в 2-3 раза выше, чем у эутиреоидных женщин [36]. По данным В.М. Кеттайл [38], через несколько недель от начала применения антитиреоидных средств уровень ЛГ нормализуется. У больных ДТЗ овуляторный пик ЛГ при олигоменорее не выражен, а при аменорее отсутствует [38]. При этом базальный уровень ЛГ и фолликулостимулирующего гормона (ФСГ) в крови женщин с неустраненным тиреотоксикозом не изменен [125, 265]. Большинство больных ДТЗ сохраняют фертильность, в связи с чем перед клиницистами встает вопрос о подборе методов контрацепции. Другим частым заболеванием щитовидной железы является аутоиммунный тиреоидит (АТ) – органное аутоиммунное заболевание. Аутоиммунный тиреоидит встречается в 15-20 раз чаще у женщин, чем у мужчин и является одной из наиболее частых причин развития гипотиреоза [38, 44, 65]. Частое выявление аутоиммунного тиреоидита у членов одной семьи и высокая частота наличия у больных антигенов системы HLA (HLADR3 и HLA-DR5) указывают на генетическую предрасположенность к заболеванию. Наличие этих антигенов объясняет частое сочетание 16 аутоиммунного тиреоидита аутоиммунными диабетом 1 с заболеваниями типа, другими системными (ревматоидным системной красной и артритом, волчанкой, органными сахарным склеродермией, аутоиммунным оофоритом, антифосфолипидным синдромом и др.) [61, 62, 70]. Развитию аутоиммунного тиреоидита нередко предшествуют инфекционные заболевания, инсоляция или избыточное поступление йода в организм. Аутоиммунный тиреоидит может протекать как на фоне увеличения щитовидной железы (зоб Хашимото), так и без увеличения ее размеров (атрофический тиреоидит). В обоих случаях гистологически в ткани железы определяется лимфоидная или плазмоцитарная инфильтрация, деструкция фолликулярного аппарата и фиброз. Под влиянием Т-хелперов В-лимфоциты превращаются в плазмотические клетки и продуцируют антитела к тиреоглобулину и тиреопероксидазе. Аутоантитела кооперируются с Т-киллерами и оказывают цитотоксическое действие на фолликулярный эпителий. Помимо этого аутоантитела к тиреопероксидазе фиксируют фракцию С1/3 комплемента и приводят к образованию патогенных иммунных комплексов, являющихся цитотоксичными для тиреоидного эпителия [15, 58, 60]. Развитие атрофической формы аутоиммунного тиреоидита связывают с образованием аутоантител, блокирующих рецепторы ТТГ на поверхности тиреоцитов. Интенсивная деструкция тиреоидного эпителия может приводить к повышению в крови трийодтиронина и тироксина и адекватному снижению ТТГ (деструктивный тиреотоксикоз) [6, 108]. С уменьшением объема функционирующей ткани железы развивается преходящий или стойкий гипотиреоз. В ряде исследований [61, 62] было показано, что беременность у эутиреоидных женщин с аутоиммунным тиреоидитом в 2-3,5 раза чаще заканчивается самопроизвольным прерыванием, чем у женщин без патологии 17 щитовидной железы. Патогенез невынашивания беременности при аутоиммунном тиреоидите без нарушения функции щитовидной железы, повидимому, связан с предшествующей овариальной недостаточностью и отложением в формирующейся плаценте патогенных иммунных комплексов, образующихся в результате фиксации аутоантител к тиреопероксидазе С1/3 фракцией комплемента [24, 237]. С другой стороны, в крови женщин с аутоиммунным тиреоидитом и невынашиванием беременности часто обнаруживаются антиовариальные и антифосфолипидные антитела, что само по себе может приводить к недостаточности яичников и невынашиванию беременности [251, 258]. Гипотиреоз – это синдром, обусловленный дефицитом тиреоидных гормонов в организме. Распространенность клинически выраженного гипотиреоза в популяции составляет 0,5-2%, субклинического гипотиреоза 510% [68, 106, 108]. Различают гипотиреоз первичный, развивающийся в результате поражения самой щитовидной железы, и вторичный, возникающий в результате дефицита синтеза ТТГ гипофизом или ТРГ гипоталамусом. Первичный гипотиреоз подразделяется на врожденный и приобретенный. Гипотиреоз является частой причиной ановуляции и дисфункциональных маточных кровотечений [108, 109, 119]. При первичном гипотиреозе нарушения менструального цикла выявлены у 33-80% больных [108]. A.R. Mansourian [215] отметил, что 20% женщин, больных гипотиреозом, имеют нерегулярный менструальный цикл. Ряд исследователей [20, 59, 71] указывает на первичный гипотиреоз как одну из частых причин полименореи. Наиболее выраженной формой нарушений менструального цикла при гипотиреозе является аменорея, частота которой при данном виде патологии щитовидной железы колеблется от 1,5% до 6% [5, 7, 59]. Первичный гипотиреоз является причиной нормогонадотропной недостаточности яичников (ановуляции и недостаточности лютеиновой фазы цикла) у 4% женщин [16, 49, 64]. Необходимо отметить, что у женщин с 18 гипотиреозом нарушения репродуктивной функции выявляются и при регулярном менструальном цикле. При этом недостаточность лютеиновой фазы цикла и ановуляторные менструальные циклы встречаются у больных гипотиреозом приблизительно с одинаковой частотой [17, 49, 158]. Нарушение гормональной и овуляторной функции яичников у женщин с гипотиреозом сопровождается нарушением менструального цикла по типу олигоменореи или аменореи. При этом обнаруживается зависимость между степенью повышения ТТГ в крови и выраженностью нарушения менструального цикла. Так как тиреотропин-релизинг гормон (ТРГ) стимулирует выработку гипофизом не только ТТГ, но и пролактина, можно было ожидать у больных гиперпролактинемической первичным недостаточности гипотиреозом яичников, развития проявляющейся синдромом аменорея-лакторея. В действительности гиперпролактинемия выявляется лишь у половины женщин с явным гипотиреозом и овариальной недостаточностью [23]. Моделирование предовуляторного подъема эстрогенов с помощью экзогенного эстрадиола (проба с эстрадиолом) выявило у женщин с гипотиреозом повреждение механизма положительной обратной связи между яичниками и гипофизом, обеспечивающего созревание доминантного фолликула и овуляцию в физиологических условиях, что связано, вероятно, с нарушением моноаминергического и опиоидного контроля секреции ГРГ гипоталамусом [24]. По мнению И.И. Дедова [26], нарушения менструального цикла находятся в прямой зависимости от тяжести гипотиреоза и могут проявляться различными расстройствами, включая развитие стойкой аменореи. В ходе исследования, проведенного С.В. Бескровным и соавт. [10], продемонстрировано, что при гипотиреозе не изменяется уровень ФСГ и ЛГ, у части больных имеется гиперпролактинемия, так как ТРГ стимулирует секрецию гипофизом не только ТТГ, но и пролактина. 19 Данные о влиянии субклинического гипотиреоза на гормональную и овуляторную функцию яичников противоречивы. К. Рорре и соавт. [229] отмечают, что частота выявления субклинического гипотиреоза среди женщин с гормональным бесплодием колеблется от 1% до 4%, то есть не превышает популяционного уровня. Вместе с тем, имеются сведения о восстановлении овуляторного менструального цикла у женщин с субклиническим гипотиреозом на фоне терапии тироксином [129]. Имеются данные [133, 274] о том, что эстрогены, увеличивая синтез ТСГ в печени, уменьшают уровень свободного тироксина в крови, что приводит к повышению компенсирующих доз тироксина у женщин с гипотиреозом на фоне приема КОК. У женщин с гипотиреозом на фоне терапии тироксином происходит восстановление овуляторного менструального цикла. Восстановление фертильности при компенсации гипотиреоза делает актуальной проблему гормональной контрацепции. 1.2. Метаболические изменения у женщин репродуктивного возраста при патологии щитовидной железы Патология щитовидной железы сопровождается изменениями в свертывающей системе крови, в липидном спектре крови и нарушением функции печени [111, 113, 114]. Данные изменения могут быть противопоказаниями или ограничениями для назначения гормональных препаратов с целью контрацепции. Гипотиреоз является частой причиной гиперлипидемии [27, 101, 105]. Дефицит гормонов щитовидной железы замедляет метаболические процессы, что приводит к снижению основного обмена. Биосинтез жирных кислот и липолиз при гипотиреозе замедлены. Среди женщин с дислипидемией в 4% случаев выявляется нераспознанный ранее гипотиреоз, в 14,1% – 20 субклиническая форма [132, 162, 211, 264]. Больные с клинически выраженным гипотиреозом имеют высокий уровень триглицеридов, и низкий уровень холестерина (ХС) и липопротеинов высокой плотности (ЛПВП) в крови. Результаты необходимость исследования исследования N. уровня Momotani ТТГ [217] у всех указывают на больных с гиперлипидемией. Повышение уровня триглицеридов и липопротеинов низкой плотности (ЛПНП) может создать предпосылки к развитию и прогрессированию атеросклероза. При тиреотоксикозе часто выявляется снижение уровня ХС и ЛПНП при нормальном или сниженном уровнем ЛПВП. Тиреоидные гормоны могут стимулировать активность ГАМК-КоАредуктазы – ключевого фермента биосинтеза ХС и таким образом индуцировать синтез ХС [132, 157, 162]. Уровень мРНК фермента ГАМККоА-редуктазы, который оценивался в мононуклеарных клетках пациентов c тиреотоксикозом, был повышен. Причиной снижения уровня ЛПВП при тиреотоксикозе, вероятно, является повышение активности печеночной липазы. По данным R. Malik и H. Hodgson [215], гипотиреоз может непосредственно влиять на структуру и функцию печени. При гипотиреозе отмечают холестатическую желтуху, обусловленную снижением экскреции билирубина и желчи. Уменьшение оттока желчи авторы объясняют увеличением соотношения ХС и фосфолипидов в мембранах гепатоцитов, что может оказывать негативное влияние на число канальцевых мембранных транспортеров и ферментов. Уменьшение экскреции билирубина, гипотония желчного пузыря и гиперхолестеринемия при гипотиреозе приводят к желчекаменной болезни. Эти изменения при гипотиреозе могут быть обратимы при проведении терапии тиреоидными гормонами [190, 202, 214]. При тиреотоксикозе выраженная стимуляция печёночного липогенеза может объясняться прямым стимулирующим влиянием избытка тиреоидных гормонов на секрецию инсулина, что, в ряде случаев, сопровождается 21 небольшим повышением уровня триглицеридов в крови [165, 174, 192]. Кроме того, при тиреотоксикозе происходит повышение уровня циркулирующих свободных жирных кислот и степени окисления липидов. Было показано [153], что при тиреотоксикозе в наибольшей степени липолизу подвергаются феморальные и абдоминальные жировые депо. По данным ряда авторов [218, 249], у 64% больных с ДТЗ отмечается повышение уровня щелочной фосфатазы, повышение уровней билирубина (5%) и глутамилтранспептидазы (17%) – эти признаки указывают на внутрипеченочный холестаз. При ДТЗ развивается жировая дистрофия печени, а при длительном тяжелом течении возможно развитие желтухи и цирроза печени. В связи с этим авторы рекомендуют исключать осложнения тиреотоксикоза или первичную патологию печени при симптомах холестатической патологии. Фибринолитическая активность крови при гипотиреозе, как правило, повышена, тем не менее, немало исследователей получили противоположные результаты. Наблюдения П.Я. Шаповалова [113], свидетельствуют, что наряду с понижением функции щитовидной железы и соответствующим ростом антиоксидантной активности выявляется тенденция к гипокоагуляции вследствие уменьшения способности тромбоцитов к адгезии и снижения концентрации в плазме крови фактора Виллебранда, VIII и IX факторов. Однако по данным M. Hostiuc и соавт. [140], при субклиническом гипотиреозе увеличен риск тромбообразования. По данным О.В. Гвоздевой [22], при ДTЗ у подавляющего большинства больных наблюдается спонтанная агрегация тромбоцитов и усиление способности тромбоцитов образовывать конгломераты при использовании коллагена, АДФ, ристомицина и адреналина. Одновременно формируется вторичная концентрации гипокоагуляция, антитромбина которая III, сопровождается повышением снижением растворимых фибрин- мономерных комплексов. По данным этого же автора, при ДTЗ также 22 наблюдается снижение антиоксидантной защиты и усиление процессов перекисного окисления липидов одновременно в тромбоцитах, эритроцитах и плазме крови. В своей работе Г.А. Сулкарнаева [101] показала, что у больных ДТЗ активированы процессы окисления липидов, снижены антиоксидантный потенциал тромбоцитов и общая свертываемость крови, повышена коагуляционная активность тромбоцитов и плазменное содержание маркеров взаимодействия тромбин-фибриноген, то есть ускорено непрерывное внутрисосудистое свертывание крови. Активация тромбоцитов, ускорение степени окисления липидов и снижение антиоксидантного потенциала значительнее при тяжелой форме тиреотоксикоза с более высоким содержанием трийодтиронина и тироксина в крови, и приближаются к физиологическим величинам при восстановлении эутиреоидного состояния [22, 136, 181, 246]. Перед назначением КОК и гестагенных контрацептивов женщинам с патологией щитовидной железы целесообразно проведение исследования системы свертывания крови, липидного спектра и функции печени с последующим динамическим наблюдением во время применения данных групп препаратов. 1.3. Патология органов репродуктивной системы у женщин с заболеваниями щитовидной железы У женщин репродуктивного возраста с заболеваниями щитовидной железы отмечается высокая частота гинекологической патологии (миома матки, гиперплазия и полипы эндометрия, аденомиоз, наружный генитальный эндометриоз, фиброзно-кистозная мастопатия), которая может служить дополнительным показанием для применения гормональной терапии [21, 81, 84, 86]. 23 Гиперпластические процессы органов репродуктивной системы изучались у женщин как со сниженной, так и с повышенной функцией щитовидной железы. Дефицит тиреоидных гормонов влияет на метаболизм эстрогенов, нарушая процесс перехода эстрадиола в эстрон [212]. Кроме того ТРГ стимулирует секрецию гипофизом не только ТТГ, но и пролактина, что приводит к гиперпролактинемической недостаточности функции яичников, возникает ановуляция, которая является основой для развития гиперпластических процессов [26], среди которых значительную частоту имеет миома матки. В структуре гинекологических заболеваний у женщин репродуктивного возраста частота миомы матки составляет от 20 до 30% [12, 89, 107, 110]. М.П. Ахмедова и соавт. [67], изучая функцию щитовидной железы у 68 больных с миомой матки, выявили, что применение гестагенных контрацептивов в сочетании с коррекцией гипотиреоза тироксином способствует уменьшению размеров миомы и снижению побочных эффектов гестагенных контрацептивов. Гиперпластические процессы эндометрия в структуре гинекологических заболеваний имеют частоту от 15% до 40% [12, 98]. Основной причиной возникновения гиперпластических процессов в эндометрии является нарушение нормального ритма образования и количественного содержания эстрогенов и прогестерона в крови [85]. При этом решающее значение придается длительности и непрерывности воздействия эстрогенов на эндометрий [237]. Антипролиферативное действие прогестерона на эндометрий проявляется в снижении уровня эстрогеновых рецепторов, торможении экспрессии ряда генов, необходимых для репликации ДНК, влиянии на синтез факторов роста и их рецепторов, снижении синтеза эстрадиола (угнетение ароматазы), активации 17-β гидроксистероиддегидрогеназы и сульфотрансферазы, инициации программы дифференцировки эндометрия [13]. По данным A.Д. Макарова и Ю.М. Кеда [95], как гипотиреоз, так и 24 тиреотоксикоз, являющиеся дисфункциональных частой маточных причиной кровотечений, ановуляции увеличивают и риск возникновения гиперпластических процессов в эндометрии. У женщин с гипертиреозом уровень эстрогенов в плазме крови в 2-3 раза превышает их уровень у здоровых женщин в течение менструального цикла. Однако гипертиреоз, кроме того, сопровождается и повышенным уровнем ГСПС [45, 46]. Установлено, что продукция ГСПС увеличивается под влиянием эстрогенов и гормонов щитовидной железы и уменьшается под воздействием андрогенов [26, 29, 44]. Гиперэстрогенемия при гиперпластических процессах в эндометрии у больных с гипертиреозом связана также с повышением продукции половых гормонов в яичниках [83]. Некоторые авторы [240, 246] указывают на то, что в печени под воздействием избытка андрогенов уменьшается синтез ГСПС, что приводит к повышению содержания свободных эстрогенов в крови. При гипотиреозе уровень ГСПС в крови снижается [26, 29, 95]. Эндометриоз является одним из распространенных заболеваний женщин репродуктивного возраста. Частота этого заболевания, по различным данным [2, 9, 120], варьирует в широких пределах – от 7% до 50%. Наружный генитальный эндометриоз нормогонадотропной у больных 50,4% недостаточностью яичников, сочетается с проявляющейся ановуляцией или недостаточностью лютеиновой фазы менструального цикла [120]. Овариальная недостаточность у данного контингента больных проявляется ановуляцией в 31% или недостаточностью лютеиновой фазы в 69% случаев [112]. У больных эндометриозом в ранней фолликулярной фазе, несмотря на такие же, как и у здоровых женщин значения ФСГ, базальный уровень эстрадиола активности оказывается специфического более высоким цитохрома Р-450 из-за повышенной (ароматазы) в эндометриоидных имплантах [1]. Тесная связь гипоталамо-гипофизарнояичниковой и гипоталамо-гипофизарно-тиреоидной систем осуществляется 25 благодаря наличию между ними общих центров регуляции. По мнению ряда авторов [109, 173], эстрогены повышают чувствительность тиреотрофов гипофиза к ТРГ. Следовательно, при повышенной продукции эстрогенов может возникать усиление активности тиреоцитов щитовидной железы. Многие исследователи [35, 88] считают, что у 72-90% больных ведущая роль в развитии фиброзно-кистозной мастопатии принадлежит нарушению функции яичников. По данным разных авторов [14, 33], у женщин с ановуляцией частота фиброзно-кистозной мастопатии колеблется от 27,6% до 53%, при недостаточности лютеиновой фазы достигает 20%. У двух третей больных репродуктивного возраста с пролиферативными формами фиброзно-кистозной мастопатии выявляется гормональная недостаточность яичников [34, 40]. Сведения о роли функционального состояния щитовидной железы в патогенезе мастопатии неоднозначны. Имеются сведения [241] о том, что при гипотиреозе снижается чувствительность яичников к гонадотропинам, меняется метаболизм эстрогенов, в частности нарушается трансформация эстрадиола в менее активный эстрон. Кроме того, гипотиреоз сочетается с нарушением синтеза дофамина в гипоталамусе и пролактина в передней доле гипофиза [120]. Все это может приводить к нарушению продукции ГРГ, повреждению положительной обратной связи между яичниками и гипофизом, недостаточности лютеиновой фазы цикла и ановуляции [120]. По данным И.А. Кузьмина [48], существует прямая зависимость между снижением функции щитовидной железы и степенью недостаточности второй фазы менструального цикла. Согласно имеющимся данным [40], в механизме развития фиброзно-кистозной мастопатии основную роль играет овариальная недостаточность и ,связанное с ней, недостаточное влияние прогестерона и избыточная эстрогенная стимуляция тканей органа. В работе Н.Н. Ткаченко [24] выявлено у женщин с гипотиреозом повреждение механизма положительной обратной связи между яичниками и гипофизом, которая 26 обеспечивает созревание физиологических доминантного условиях, что фолликула связано, вероятно, и овуляцию с в нарушением моноаминергического и опиоидного контроля секреции ГРГ гипоталамусом. И.А. Кузнецова [45, 46, 47] изучала состояние щитовидной железы у женщин с множественными гиперпластическими процессами органов репродуктивной системы. Обследованы 54 женщины с двумя и более гиперпластическими процессами органов репродуктивной системы (миомой матки, гиперплазией и полипами эндометрия, аденомиозом, наружным генитальным эндометриозом, фиброзно-кистозной мастопатией). Автор отмечает, что у женщин с множественными гиперпластическими процессами органов репродуктивной системы чаще, чем в популяции, встречались ДНЗ, диффузно-узловой нетоксический зоб и аутоиммунный тиреоидит, причем у большинства больных функция щитовидной железы не была нарушена. Объем щитовидной гиперпластическими железы у процессами больных органов с множественными репродуктивной системы достоверно превышал объем щитовидной железы у здоровых женщин. Это не было связано с ростовыми факторами и положительно коррелировало с уровнем эстрадиола в крови. Поэтому щитовидную железу можно рассматривать как орган-мишень для эстрогенов. Диффузное и узловое увеличение щитовидной железы и развитие гиперпластических процессов в органах репродуктивной системы могут быть связаны с общими механизмами – относительной или абсолютной гиперэстрогенемией. Таким образом, данные литературы свидетельствуют о частом сочетании гиперпластических процессах в органах репродуктивной системы женщин с патологией щитовидной железы. Для медикаментозной терапии гиперпластических применяются процессов в эстроген-гестагенные органах и репродуктивной гестагенные системы контрацептивные препараты. В связи с этим, актуальным представляется определение влияния этих препаратов на структуру и функцию щитовидной железы у больных, 27 имеющих доброкачественные заболевания этого органа в сочетании с гиперпластическими заболеваниями органов репродуктивной системы. 1.4. Влияние половых стероидных гормонов на щитовидную железу Влияние половых гормонов, преимущественно эстрадиола, на структуру и функцию щитовидной железы широко обсуждается в современной литературе. Есть основания считать, что увеличение щитовидной железы у женщин может быть связано с относительным или абсолютным повышением уровня эстрадиола в крови. Эстрогены способны регулировать экспрессию собственных рецепторов в ткани щитовидной железы. Выявлено повышение уровня α-рецепторов к эстрогенам в опухолевой и неизменённой ткани щитовидной железы после добавления эстрадиола in vitro, однако уровень β-рецепторов в тех же клетках оставался неизменным [188]. Также имеются исследования, в которых рецепторы к эстрогенам в неизменённой ткани щитовидной железы выявлены не были [212]. В цитоплазме эпителиальных клеток щитовидной железы обнаружен основной фермент биосинтеза эстрогенов – ароматаза Р450, а также 17-β гидроксистероид дегидрогеназа 1 и 2 типа, участвующие во взаимоконверсии эстрона и эстрадиола [212]. В исследовании S.K. Banu [134] на крысах линии Вистар в возрасте от 21 дня до 160 дней было установлено, что эстрогены стимулируют пролиферацию тиреоцитов, повышая уровень ТТГ в плазме крови и количество рецепторов к нему в клетках щитовидной железы. Имеются данные [182, 249, 267] о стимулирующем влиянии эстрогенов на интактные и опухолевые клетки щитовидной железы независимо от уровня ТТГ в крови. Установлено, что под действием эстрадиола и прогестерона усиливается биосинтез и реабсорбция коллоида 28 фолликулярными клетками щитовидной железы свиней. В работе А.Б. Логинова [52] выявлено, что при беременности, сопровождающейся высоким уровнем плацентарных эстрогенов в крови, происходит увеличение объема щитовидной железы в среднем на 24,1%. Высокие дозы эстрогенов могут вызывать повышение уровня общего тироксина в крови за счет способности эстрогенов стимулировать продукцию ТСГ печенью, тогда как содержание свободного тироксина в крови при этом не меняется [212, 274]. Сведения о действии экзогенных эстрогенов на функцию щитовидной железы имеют разноречивый характер. Некоторые авторы [164, 171] считают, что эстрогены оказывают стимулирующее действие на щитовидную железу. По данным эстрогенсодержащих Л.M. оральных Берштейна [11], контрацептивов у при применении женщин с раком щитовидной железы содержание тиреоглобулина в сыворотке крови увеличилось у 5 из 24 больных. В папиллярной карциноме α-рецепторов к эстрогенам было больше у женщин в пременопаузе по сравнению с этим показателем у женщин в постменопаузальном периоде. Были выделены βрецепторы к эстрогенам в фолликулярных и С-клетках щитовидной железы, однако изменений в содержании этих рецепторов в зависимости от возраста и тиреоидной патологии выявлено не было [212, 274]. Опухоли щитовидной железы встречаются у женщин в три раза чаще, чем у мужчин [36]. Имеются сведения о том, что прием эстроген-гестагенных препаратов ассоциирован с более высоким риском рака щитовидной железы [141, 169], однако в ходе других эпидемиологических исследований эти данные не подтвердились. Более высокий риск развития опухолей щитовидной железы также наблюдался у женщин, использующих эстрогенсодержащие препараты для лечения гинекологических заболеваний [53, 92, 98, 100]. F.A. Candanedo-Gonzalez и соавторы [141] полагают, что снижение содержания эстрогенов в крови в постменопаузальном возрасте повышает 29 риск возникновения папиллярного рака щитовидной железы. При этом в пременопаузальном возрасте эстрогеновых α-рецепторов в фолликулярных клетках щитовидной железы было больше, чем у женщин в постменопаузальном возрасте. M. Vaiman и соавторы [154] в 296 образцах ткани щитовидной железы с различными опухолевыми процессами иммуногистохимическим методом выявляли α- и β-рецепторы к эстрогенам. Было обнаружено, что их количество не зависит от наличия злокачественных опухолей. С другой стороны, имеются работы [158], показывающие, что применение эстрогенов в постменопаузальном периоде в течение одного года не оказывает влияния на объем щитовидной железы, а также на число и объем узловых образований щитовидной железы. Таким образом, вопрос о влиянии половых стероидных гормонов на структуру и функцию щитовидной железы остается открытым и требует проведения дополнительных исследований. 1.5. Гормональная контрацепция при заболеваниях щитовидной железы Число женщин, применяющих современные методы контрацепции, неуклонно возрастает. Комбинированные гормональные контрацептивы применяются не только с целью предохранения от нежелательной беременности, но и с лечебным эффектом [43, 53, 55, 76, 80, 90]. История практического использования гормональной контрацепции начинается с 1960 года. С этого времени происходят эволюционные изменения в сторону повышения безопасности и эффективности применения КОК. За период использования гормональных контрацептивов содержание гормональных компонентов в них удалось снизить более чем в 10 раз без уменьшения контрацептивной эффективности. Современные 30 низкодозированные и микродозированные контрацептивы характеризуются минимальным числом осложнений и побочных реакций [19, 28, 42, 88, 89]. В состав комбинированных гормональных контрацептивов входят два гормональных компонента: ЭЭ и прогестаген. В зависимости от содержания ЭЭ КОК подразделяются на низкодозированные (30 мкг или 35 мкг ЭЭ) или микродозированные (20 мкг или 15 мкг ЭЭ). Синтезированные в настоящее время КОК в зависимости от схемы комбинации эстрогена и гестагена подразделяются на монофазные – с постоянной на протяжении приема ежедневной дозой эстрогена и гестагена и фазные - имеющие динамический режим дозирования. В качестве эстрогенного компонента в большинстве КОК применяется ЭЭ. В его структуру включена этинильная группа, за счет которой биологическая усвояемость ЭЭ при пероральном применении на 90% выше, чем у эстрадиола. Кроме того, за счет этинильной группы ЭЭ медленнее метаболизируется, обеспечивая необходимую длительность действия, и не превращается в эстрадиол и эстрон. Однако, помимо положительных эффектов этот компонент имеет и недостатки: в частности, он обусловливает негативное влияние на липидный профиль – возрастает содержание триглицеридов в крови, стимулируется синтез факторов свертывания крови, могут возникать желудочно-кишечные и психоэмоциональные побочные эффекты [13, 42, 53]. С целью снижения выраженности побочных явлений высоких доз ЭЭ (в 60-х гг. XX века) доза эстрогенного компонента была снижена с 50 мкг до 15 мкг/сут. [53]. Однако дальнейшее снижение уровня ЭЭ (ниже 15 мкг/сут.) связано с большей вероятностью появления прорывного кровотечения или мажущих кровянистых выделений. В последние десятилетия разрабатывались КОК, содержащие эстроген, структурно идентичный натуральному эстрадиолу (Э2) вместо ЭЭ. [167, 170]. Идентичность Э2 эндогенному эстрогену снижает его влияние метаболические параметры и возможные риски побочных эффектов. на 31 В настоящее время гестагены, входящие в состав гормональных контрацептивов, достаточно разнообразны по своей химической структуре, фармакологическим особенностям, спектру взаимодействия с рецепторным аппаратом клеток. Их можно разделить на следующие группы: производные прогестерона; производные производные 17-гидроксипрогестерона 19-норпрогестерона нортестостерона (эстраны и (норпрегнаны); гонаны); (прегнаны); производные производные 19- спиронолактона (дросперинон). При этом выделяют три поколения производных 19нортестостерона: I – норэтинодрел; II – норэтистерон, левоноргестрел; III – дезогестрел, гестоден, норгестимат; IV – дросперинон. Производные 19нортестостерона в качестве гестагенного компонента используются в большинстве средств гормональной контрацепции. Гестагены обладают не только прогестагенным действием, но могут обладать другими эффектами. Это определяется их связыванием с рецепторами клеток, что приводит к появлению ряда дополнительных свойств, метаболических эффектов и возможных побочных явлений [179]. Так, некоторые гестагены могут обладать андрогенной активностью (производные 19-нортестостерона). Гестагены третьего поколения – дезогестрел, гестоден отличаются низкой тропностью к рецепторам андрогенов, что определяет их низкую андрогенную активность [185]. Некоторые гестагены взаимодействуют с глюкокортикоидными рецепторами (гестоден), рецепторами к альдостерону дроспиренон), (гестоден, препятствуя задержке жидкости в организме. Контрацептивы, содержащие только гестагены, в частности дезогестрел, относящиеся к последнему поколению производных 19-норстероидов, являются эффективными средствами контрацепции и могут быть использованы у женщин, которым противопоказано эстрогенного назначение компонента контрацептивов перед эстрогенов определяет ряд комбинированной [179, 185]. преимуществ контрацепцией, Исключение гестагенных а именно: 32 отсутствие эстрогензависимых побочных эффектов, лучшую переносимость, меньшее системное влияние на организм, возможность применения во время лактации - препарат не влияет на количество и качество молока [51, 55, 179, 182]. У женщин, принимающих дезогестрел, происходит подавление овуляции и пролиферации эндометрия, за счет чего при длительном применении препарата может наблюдаться аменорея, однако у ряда больных отмечаются межменструальные кровянистые выделения. В настоящее время становится очевидным, что КОК обладают терапевтическим эффектом при таких патологических состояниях, как миома матки, гиперпластические процессы эндометрия, дисфункциональные маточные кровотечения, синдром поликистозных яичников, функциональные кисты яичников, железодефицитная анемия, развивающаяся на фоне обильной менструальной обеспечивают кровопотери. регулярность, Гормональные уменьшают объем и контрацептивы длительность менструальных выделений, используются в комплексном лечении некоторых форм эндометриоидной болезни [2, 80, 120]. В механизме лечебного действия препаратов имеет значение подавление овуляции, ингибирование синтеза эстрогенных рецепторов, супрессия пролиферации эндометрия, снижение менструальной кровопотери и болевого синдрома [53]. В исследовании А. Prentice [232] показано, что КОК эффективны в устранении болевого синдрома при эндометриозе. Монофазные комбинированные гормональные контрацептивы стабилизируют эндокринные и биохимические изменения в течение менструального цикла и эффективны для терапии предменструального синдрома [32, 36, 50, 55]. Имеются сведения о том, что на фоне приема КОК наблюдается снижение кортизолового ответа на психологическое напряжение [31, 36, 54]. По данным F. Tremollieres [262], использование КОК в репродуктивном возрасте не приводит к значимым изменениям метаболизма костной ткани, 33 однако у женщин с гипоэстрогенемией эти препараты предотвращают деминерализацию костной ткани. Первые публикации на тему лечебного действия гормональной контрацепции при разнообразных нарушениях менструального цикла появились в США 1957 году [179]. В дальнейшем было показано, что терапевтический эффект гормональной контрацепции распространяется не только на патологию репродуктивной системы, но и на экстрагенитальные заболевания [90, 91, 180]. Протективное действие КОК на гиперпластические процессы в эндометрии связаны с антиэстрогенным влиянием прогестагенов: снижением синтеза эстрогенных рецепторов, увеличением содержания 17β- дегидрогеназы 1 типа, конвертирующей эстрадиол в менее активный эстрон. По данным E. Suvanto-Luukoonen и соавт. [210], гестагены вызывают увеличение синтеза белка, связывающего инсулиноподобный фактор роста 1 (секретируемый в печени и ряде других тканей), низкий уровень которого ассоциирован с риском рака эндометрия и стимуляцией инсулино-подобного фактора роста, относящегося к медиаторам пролиферативного и митотического действия эстрогенов на эндометрий. Необходимо также отметить, что профилактический эффект приема КОК в отношении риска онкопатологии сохраняется в течение многих лет после завершения приема контрацептива [253]. В когортном исследовании, проведенном в Канаде, было выявлено, что применение гормональной контрацепции снижает риск развития пролиферативной формы фиброзно-кистозной болезни молочных желез без атипии, однако не влияет на риск развития атипичных форм эпителия протоков молочных желез [239]. Считается, что позитивный эффект гормональных контрацептивов в отношении риска заболеваний молочных желез наблюдается через 2 года от начала использования КОК и увеличивается при длительном приеме препаратов [40, 48, 87, 223]. По 34 результатам исследования S.S. Jickl [223], отсутствует взаимосвязь между использованием КОК и риском развития рака молочной железы. Имеются также данные о положительном влиянии КОК на риск развития колоректального рака [227]. Тем не менее, кроме положительного неконтрацептивного действия гормональная контрацепция также обладает и отрицательным системным действием на организм человека, например, на отдельные параметры гемостаза [42, 94]. По данным C.M. Zahn [213], изучавшего влияние КОК на систему гемостаза, эстрогены способны повышать агрегацию тромбоцитов и свертываемость крови и вместе с тем уменьшать содержание ингибитора коагуляции – антитромбина III. С другой стороны, эстрогены приводят к активации фибринолитической системы, повышая уровень плазминогена в крови и уменьшая уровень ингибиторов фибринолиза. При этом увеличение активности свертывающей системы крови является дозозависимым и обнаруживается при применении КОК с содержанием более 35 мкг ЭЭ. Принято считать, что гормональная контрацепция является оптимальным методом для женщин с врожденными и наследственными коагулопатиями, такими как болезнь Виллебранда, дефицит фактора VII, носительство гемофилии А, тромбоцитопатия. Применение КОК позволяет уменьшить геморрагические проявления заболевания, в том числе гиперполименорею, частоту апоплексий яичника и снизить уровень нетрудоспособности больных [31, 42, 47]. По некоторым данным [179], применение гестагенных контрацептивов, в отличие от комбинированных, не вызывает существенных изменений в свертывающей системе крови, что ещё раз свидетельствует в пользу ведущей роли эстрогенного компонента в развитии тромботических осложнений. Имеются сведения [90, 99] о том, что при наличии врожденных аномалий системы гемостаза (дефицит ингибиторов коагуляции: антитромбина III, протеина С, протеина S, а также мутации гена, 35 ответственного за синтез фактора V), применение КОК повышает относительный риск тромботических осложнений в 15 раз. Согласно рекомендациям ВОЗ [216], группу женщин с патологией щитовидной железы (диффузный нетоксический зоб, субклинический гипотиреоз и субклинический тиреотоксикоз) следует отнести к первой категории приемлемости для гормональной и внутриматочной контрацепции. Это означает, что такие контрацептивные средства, как КОК, гестагенные контрацептивы, импланты, внутривлагалищные кольца, пластыри, медьсодержащие и гормонсодержащие внутриматочные средства, признаны сегодня безопасными и могут быть назначены данной группе женщин без ограничений, так же, как и здоровым женщинам. Имеются сведения [153] о том, что эстрогены не влияют на выраженность симптомов тиреотоксикоза при диффузном токсическом зобе. О.М. Моисеевой [57] установлено, что при 48-недельном приеме КОК у женщин без патологии щитовидной железы и при ДНЗ I-II степени отмечается уменьшение содержания ТТГ и достоверное увеличение содержания гормонов щитовидной железы в крови, не выходящее за пределы физиологических колебаний. Действие КОК клинически не отражалось на функциональном состоянии щитовидной железы женщин с ДНЗ I степени, однако при ДНЗ II степени увеличенная ткань щитовидной железы под влиянием КОК становилась более «рыхлой» при пальпации. Имеются данные о том [220, 240], что эстрогены повышают чувствительность тиреотрофов гипофиза к ТРГ, стимулируя секрецию ТТГ гипофизом. Наряду с этим авторы [209] указывают, что эстрогены тормозят секрецию ТТГ гипофизом и при этом повышают чувствительность тиреоцитов к ТТГ, что в свою очередь стимулирует процессы пролиферации в ткани щитовидной железы [134, 190]. Половые стероидные гормоны и их аналоги оказывают влияние на иммунную систему [35, 94]. Прогестерон подавляет активность Т-хелперов 1 типа (клеточный иммунитет) и усиливают активность Т-хелперов 2 типа 36 (гуморальный иммунитет). По данным А.Н. Акопян и соавторов [41], применение КОК и гестагена дезогестрела сопровождается уменьшением антитиреоидных аутоантител в крови больных аутоиммунным тиреоидитом. В экспериментальных исследованиях [225] было обнаружено, что под действием эстрогенов увеличивается уровень Т-хелперов 1 и 2 типа. Однако значительных изменений как Т-хелперов, так и Т-супрессоров при этом не происходит [203]. В исследовании I. Auerbach [127] показано, что низкодозированные КОК увеличивают уровень Т-лимфоцитов и NK-клеток в щитовидной железе. При изучении изменений гуморального иммунитета было показано, что эстрогены могут действовать на его активность не только путем активации Тхелперов 2 типа, но и опосредованным влиянием на В-клетки [240]. Есть данные [190], что эстрогены усиливают экспрессию гена bcl2, в результате чего блокируется апоптоз В-клеток, что в свою очередь приводит к активации гуморального иммунитета. Имеются также единичные исследования [240], указывающие на стимулирующее влияние эстрогенов на продукцию антител к тиреопероксидазе. Однако, другим автором [57] было отмечено отсутствие влияния как комбинированных гормональных контрацептивов, так и гестагенных контрацептивов на функциональное состояние щитовидной железы у здоровых женщин и больных аутоиммунным тиреоидитом. Показано, что назначение с целью гормональной контрацепции низкодозированных и микродозированных пероральных контрацептивов женщинам с аутоиммунным тиреоидитом является предпочтительным. Согласно многочисленным исследованиям, гормональная контрацепция является одним из наиболее распространенных и приемлемых методов планирования семьи, обладающей не только контрацептивным, но и лечебным эффектом, что является весьма важным, особенно при патологии щитовидной железы. Но, несмотря на большое количество работ и широкий 37 интерес к этой проблеме, в настоящее время многие аспекты остаются неизученными. На сегодняшний день данные о влиянии комбинированных и гестагенных гормональных контрацептивов на структуру и функцию щитовидной железы противоречивы, что требует дальнейшего изучения. 38 ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1. Характеристика групп обследованных женщин и дизайн исследования В период с 2011 по 2014 год проведено обследование 280 женщин репродуктивного возраста с заболеваниями щитовидной железы и без патологии щитовидной железы, обратившихся для подбора контрацепции в ФГБУ «НИИАГ им. Д.О. ОТТА» СЗО РАМН. Все женщины прошли обследование перед включением в исследование. Группу контроля составили 90 женщин без патологии щитовидной железы. Критериями включения в группу контроля являлись: ● возраст женщин от 18 до 40 лет; ● отсутствие патологии щитовидной железы; ● регулярный менструальный цикл; ● согласие на применение КОК или гестагена дезогестрела с целью контрацепции. В основные группы включены женщины, соответствующие следующим критериям: ● возраст женщин от 18 до 40 лет; ● наличие патологии щитовидной железы: аутоиммунный тиреоидит или диффузный нетоксический зоб; ● регулярный менструальный цикл; ● согласие на применение КОК или гестагена дезогестрела с целью контрацепции; Критериями исключения являлись: ● неустраненный тиреотоксикоз; ● некомпенсированный гипотиреоз; ● узловой зоб; 39 ● сахарный диабет и нарушение толерантности к глюкозе; ● послеродовый период; ● беременность; ● лактация; ● курение; ● артериальное давление более 140/90 мм рт.ст.; ● тромбоз и тромбоэмболии в анамнезе; ● тяжелая экстрагенитальная патология; ● кровотечения из половых путей неясной этиологии; ● эстрогензависимые опухоли; ● злокачественные новообразования в настоящее время или в анамнезе; ● психические заболевания. Для определения критериев включения или исключения проводили клинико-лабораторное обследование, которое включало: сбор анамнеза, антропометрию, определение показателей липидного спектра крови и свертывающей системы крови, биохимические показатели функции печени, ультразвуковое исследование органов малого таза, а также проводилось обследование щитовидной железы, включающее пальпаторное, эхографическое, иммунологическое и гормональное исследования. При пальпаторном исследовании размеры щитовидной железы оценивались по международной классификации ВОЗ 1994 [196]: Степень 0 – зоба нет; Степень I – зоб не виден, но пальпируется, при этом размеры его долей больше дистальной фаланги большого пальца руки обследуемого; Степень II – зоб пальпируется и виден на глаз. Диффузный зоб диагностировали только после ультразвукового подтверждения и сравнения полученных значений объема щитовидной 40 железы с нормативами ВОЗ, полученными в регионах с адекватным обеспечением йодом: у женщин зоб определялся, если объем железы превышал 18 мл [186]. Диагноз аутоиммунного тиреоидита устанавливали на основании сочетания иммунологических признаков содержания (повышение антитиреоидных аутоантител в сыворотке крови) с ультразвуковыми (гетероэхогенность щитовидной железы) и/или пальпаторными (повышенная плотность щитовидной железы) признаками. Данные опроса и объективного обследования заносили в специально разработанную анкету, включающую следующие показатели: жалобы больных, возраст появления заболевания щитовидной железы, длительность заболевания, методы предшествующей терапии заболевания и их эффективность, наследственность (наличие заболеваний щитовидной железы у кровных родственников). При сборе гинекологического анамнеза выясняли сведения о возрасте менархе, характере беременностях, менструального родах, цикла, гинекологических методах контрацепции, заболеваниях, а также о репродуктивных планах. Клиническое обследование включало: измерение роста и веса, вычисление индекса массы тела, осмотр кожных покровов и видимых слизистых, оценка характера оволосения, гинекологическое и эндокринологическое обследование. Всем больным проводилось измерение артериального давления, и частоты пульса после 5 минут покоя на доминирующей руке с помощью аппарата «OMRON». Для каждой женщины было запланировано 3 визита в поликлинику. На этапе скрининга проводили сбор анамнеза, антропометрию, клиническое и лабораторное обследование (липидный спектр крови, биохимический анализ крови, коагулограмма), эндокринологическое обследование (определение в крови уровня свободного тироксина, свободного трийодтиронина, 41 тиреотропного гормона, антител к тиреопероксидазе и антител к тиреоглобулину), осмотр и пальпация молочных желез, гинекологическое обследование, цитологическое исследование мазка с поверхности шейки матки и из цервикального канала, выполняли УЗИ органов малого таза и УЗИ щитовидной железы. Женщинам всех трех групп были рекомендованы гормональные препараты с целью контрацепции. Через 6 месяцев женщины приглашались на второй осмотр, во время которого выполняли антропометрическое, клиническое, лабораторное, эндокринологическое, гинекологическое и ультразвуковое обследование. Оценивали эффективность применения гормональных препаратов, переносимость их и отмечали побочные эффекты. Во время третьего посещения, после 12-месячного приема гормональных контрацептивов, оценивали результаты приема препаратов, выполняли антропометрическое, клиническое, лабораторное, эндокринологическое и гинекологическое, ультразвуковое обследование. Все включенные в исследование 280 женщин случайным образом были распределены на две основные группы. В первую группу вошли 90 женщин с ДНЗ, которые получали микро- и низкодозированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола в сочетании с различными гестагенными компонентами (дроспиренон 3000 мкг, гестоден 75 мкг, диеногест 2000 мкг) или гестагенный контрацептив с дезогестрелом в дозе 75 мкг. Во вторую основную группу были включены 100 женщин с аутоиммунным тиреоидитом, которые получали микро- и низкодозированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола, в сочетании с различными гестагенными компонентами (дроспиренон 3000 мкг, гестоден 75 мкг, диеногест 2000 мкг) или гестагенный контрацептив с дезогестрелом в дозе 75 мкг. 42 У 40 женщин больных аутоиммунным тиреоидитом гипотиреоз был компенсирован тироксином до начала применения гормональной контрацепции, они получали тироксин продолжительностью от 6 месяцев до 7 лет в суточной дозе от 25 мкг до 100 мкг. До начала исследования женщины с диффузным нетоксическим зобом йодид калия и тироксин не получали. После включения в исследование 40 женщин с ДНЗ и 40 женщин без патологии щитовидной железы получали йодид калия в суточной дозе 100мкг. Группу контроля составили 90 женщин без патологии щитовидной железы, которые получали микро- и низкодозированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола в сочетании с различными гестагенными компонентами (дроспиренон 3000 мкг, гестоден 75 мкг, диеногест 2000 мкг) или гестагенный контрацептив с дезогестрелом в дозе 75 мкг. Возраст обследованных женщин колебался от 18 до 40 лет и в среднем составлял год. 27,5±3,4 До начала приема гормональных контрацептивов обследованные женщины имели массу тела от 45 кг до 75 кг. Средний индекс массы тела у женщин всех обследованных групп до начала приема гормональных контрацептивов составлял 22,4±0,5 кг/м2, у женщин с аутоиммунным тиреоидитом – 20,6±0,6 кг/м2, у женщин, включенных в контрольную группу, ИМТ составлял 21,3±0,3 кг/м2. У женщин всех исследуемых групп наблюдался регулярный менструальный цикл длительностью от 26 до 30 дней. 2.2. Методы исследования Измерение роста осуществлялось стоя при помощи ростомера в сантиметрах, погрешность метода составляет 0,5 см. Масса тела определялась в килограммах с помощью электронных весов фирмы «АND 43 Company Ltd.», модель МС-101W, (Япония). Погрешность метода составляет 100 г. Индекс массы тела (ИМТ) рассчитывали делением показателя массы тела в килограммах на показатель роста человека, выраженный в метрах и возведенный в квадрат (кг/м2). 2.2.1. Лабораторные методы исследования Показатели липидного обмена Взятие крови для определения липидного спектра проводилось из локтевой вены утром натощак. Содержание в крови общего холестерина (ХС), триглицеридов (ТГ), липопротеидов высокой плотности (ЛПВП) определяли ферментативным методом с помощью биохимического анализатора «Konelab 60/60i», (Финляндия). Содержание холестерина липопротеинов низкой плотности (ЛПНП) и холестерина липопротеинов очень низкой плотности (ЛПОНП) определяли по формуле [181]. ХСЛПНП, ммоль⁄л = ХСобщий − ХСЛПВП − ХСЛПОНП = ТГ , , (ммоль/л) ТГ 2,2 Коэффициент атерогенности (КА) определяли по формуле: КА = ХСобщий − ХСЛПВП ХСЛПВП Биохимические показатели функции печени Взятие крови для определения биохимических показателей функции печени проводили из локтевой вены утром натощак. Содержание в крови 44 АЛТ, АСТ, билирубина определяли с помощью стандартного набора Synchron Systems Total Bilirubin, Alanine Aminotransferase, Aspartate Aminotransferase reagents c использованием анализатора «Beckman» (США). Показатели свертывающей системы крови Взятие крови для определения показателей свертывающей системы крови проводили из локтевой вены утром натощак. Коагулограмма выполнялась с использованием коагулометра ACL-200 (Instrumentation laboratory, Испания) и реактивов HemosIL (Италия). Прибор представляет собой полностью автоматизированный, управляемый микро-ЭВМ анализатор с микроцентрифугой. Анализатор ACL-200 способен производить автоматическую калибровку, в нем имеется программа системы контроля точности работы прибора, которая обеспечивает высокий уровень качества полученных результатов. С помощью данного прибора изучали следующие показатели коагуляционного звена гемостаза: активированное парциальное тромбопластиновое время (АПТВ), протромбиновое время, протромбиновый индекс, тромбиновое время, концентрацию фибриногена, международное нормализованное отношение (МНО). Гормональные исследования Исследование функции щитовидной железы включало определение иммуноферментным методом содержания тиреоидных гормонов в сыворотке крови: свободного трийодтиронина (св. Т3) и свободного тироксина (св. Т4) с использованием наборов фирмы тиреотропного гормона (ТТГ) “Orgentec” в (Германия). сыворотке крови Содержание определяли иммуноферментным методом при помощи реагентов фирмы “Orgentec” (Германия). Иммунологическое обследование включало определение 45 иммуноферментным методом антитиреоидных аутоантител в сыворотке крови: аутоантител к тиреопероксидазному антигену (реагенты фирмы “Orgentec”, Германия) и аутоантител к тиреоглобулину («Алкор-Био», Россия). 2.2.2. Ультразвуковые методы исследования Ультразвуковое исследование органов малого таза Ультразвуковое исследование органов малого таза осуществляли на 2023 день менструального цикла с использованием аппарата «Аloka SSD-1700» (Япония), применяя трансвагинальный датчик с частотой 5 мГц. Во время исследования определяли размеры матки, особенности структуры миометрия, толщину и структуру эндометрия, размеры и структуру яичников, состояние фолликулярного аппарата, наличие желтого тела. Длина тела матки измерялась от середины перпендикуляра, опущенного от вершины угла между телом и шейкой к противоположной стороне матки, до наиболее удаленной точки дна. Перпендикулярно этому измерению определяли передне-задний размер тела матки в наиболее широкой части. Ширину матки определяли в наиболее широкой части при поперечном сканировании. Толщину эндометрия измеряли как передне-задний размер срединного маточного эха (М-эхо). Двухфазный менструальный цикл определялся при наличии признаков произошедшей овуляции (наличие желтого тела и признаки секреторной трансформации эндометрия). Ультразвуковое исследование щитовидной железы Ультразвуковое исследование щитовидной железы проводилось на ультразвуковом аппарате «Аloka SSD-1700» (Япония) с использованием линейного датчика с частотой 7,5-10 мГц. Исследование проводилось в 46 положении пациентки, лежа спиной на кушетке с подложенным под плечевой пояс валиком толщиной 10-15 см. Измерение долей щитовидной железы проводили при продольном и поперечном сканировании. На обзорном этапе эхографичекого исследования оценивали следующие структуры щитовидной железы: ее расположение, размеры, объем, границы, контуры, форму, эхогенность, эхоструктуру, кровеносные сосуды паренхимы щитовидной железы, зоны регионарного лимфоотока. Обращалось внимание на наличие и месторасположение локальных изменений структуры, участков с нарушенной архитектоникой. Ультразвуковые признаки аутоиммунного тиреоидита подтверждались наличием гетероэхогенности щитовидной железы. При диффузном нетоксическом зобе объем щитовидной железы превышает 18 мл [186], при этом эхогенность и эхоструктура не изменялась. Объем щитовидной железы рассчитывали по формуле J.Brunn [268]: V п.д.=ап.д. х bп.д. х сп.д. х 0,479 V л.д.=ап.д. х bп.д. х сп.д. х 0,479 Vобщ.= Vп.д + Vл.д. Где V – объем (см³), а – ширина, b – длина, с – высота долей, п.д. – правая доля, л.д. – левая доля щитовидной железы. 2.2.3. Методы статистического анализа Статистическую обработку результатов проводили с использованием методов параметрической (дескриптивной) статистики статистики. включали Методы в себя описательной оценку среднего арифметического (М), средней ошибки среднего значения (m) – для признаков, имеющих встречаемости непрерывное признаков с распределение; дискретными а также значениями. Для частоты оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применяли t-критерий Стьюдента. Статистическая обработка 47 материала выполнялась на ЭВМ с использованием стандартного пакета программ прикладного статистического анализа (Statistica for Windows v.7.0). Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых различий или факторных влияний) принимали равным 0,05. 48 ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Характеристика обследованных женщин В исследование включены 280 женщин репродуктивного возраста, обратившихся в поликлинический отдел ФГБУ «НИИАГ им. Д.О. Отта» СЗО РАМН для выбора метода контрацепции. Возраст обследованных женщин колебался от 18 до 40 лет и в среднем составил 27,5±3,4 года. Все женщины были заинтересованы в контрацепции, после консультирования выбрали гормональный метод контрацепции. Противопоказаний для применения гормональной контрацепции согласно категориям приемлемости метода (по рекомендациям ВОЗ 2009) – не имели [216]. Среди обследованных выделены 2 группы женщин с заболеваниями щитовидной железы. В первую группу вошли 90 больных ДНЗ, во вторую – 100 женщин с АТ. Группу контроля составили 90 женщин без патологии щитовидной железы. В браке состояли 165 (58,9%) женщин, половую жизнь вне брака имели 115 (41,0%) женщин. Беременность в анамнезе имела 171 (61,0%) женщина, роды – 115 (41,0%) женщин, аборты – 10 (3,5%) женщин. Ранее женщины использовали различные методы контрацепции: гормональную контрацепцию 150 (53,5%) женщин, барьерную контрацепцию 40 (14,3%) женщин, внутриматочную контрацепцию 40 (14,3%) женщин. Не использовали методы контрацепции 50 (17,8%) женщин. Все женщины, вошедшие в исследование, подписали информированное согласие на участие в исследовании и применение гормональной контрацепции. До начала исследования женщины с ДНЗ йодид калия и тироксин не получали. Диагноз диффузного нетоксического зоба устанавливался на основании данных пальпаторного и ультразвукового исследования. У 100 женщин аутоиммунный тиреоидит был выявлен до начала исследования. Из 49 них 40 больных получали лечение тироксином в течение от 6 месяцев до 7 лет. Диагноз аутоиммунного тиреоидита устанавливался на основании сочетания иммунологических признаков содержание (повышенное антитиреоидных аутоантител в сыворотки крови) с ультразвуковыми (гетероэхогенность щитовидной железы) и/или пальпаторными (повышение плотности щитовидной железы) признаками. Женщины с узловыми формами зоба в исследование не включались. Соматические заболевания у обследованных женщин представлены в таблице 1. Таблица 1 – Частота соматической патологии у обследованных групп женщин (М±m) Заболевания Диффузный нетоксический зоб n=90 Аутоиммунный тиреоидит Группа контроля n=100 n=90 абс 15 8 абс 16 7 % 16,5±3,7* 8,8±2,8 % 16,7±3,5* 7,4±2,7 Хронический гастрит Вегето-сосудистая дистония Варикозная болезнь 2 2,2±1,5 3 3,2±1,8 Хронический 9 9,5±3,0 8 8,4±2,8 пиелонефрит Диффузный фиброаденоматоз 39 43,1±5,0 36 36,8±4,9 молочных желез *-р<0,05 по сравнению с показателем в контрольной группе абс 7 5 % 7,6±2,7 5,5±2,3 1 7 1,1±1,0 7,6±2,7 34 37,8±4,9 Из таблицы 1 видно, что наиболее часто встречающейся патологией во всех группах обследованных женщин является диффузный фиброаденоматоз молочных желез. Заболевания пищеварительной системы встречались в 2 раза чаще у женщин с ДНЗ (16,5±3,7%) и у больных АТ (16,7±3,5%), чем в контрольной группе (7,6±2,7%). 50 Возраст менархе у женщин основных групп составил 13,6±0,4 года, в контрольной группе – 12,1±0,4 года. У женщин всех исследуемых групп наблюдался регулярный менструальный цикл длительностью от 26 до 30 дней. Изучение гинекологического анамнеза показало, что во всех обследованных группах самым частым заболеванием был кольпит - у 180 (64,2%) женщин; 76 (27,1%) женщин получали в прошлом лечение по поводу одного или нескольких заболеваний, передающихся половым путем. Наиболее частыми возбудителями инфекционных заболеваний были Сhlamydia trachomatis – у 15 (5,3%) женщин и Тrihamonаs vaginalis – у 25 (8,9%) женщин. Лапароскопию по поводу апоплексии яичников перенесли 14 (5%) женщин. Особенности акушерского представлены в таблице 2. анамнеза у обследованных женщин 51 Таблица 2 – Исходы беременностей и родов в анамнезе обследованных женщин (М±m) Предшествующие беременности Диффузный нетоксический зоб n=90 абс % 49 54,4±3,6* Аутоиммуный тиреоидит абс 57 n=100 % 57,0±1,1* Группа контроля n=90 абс % 65 72,2±2,8 Беременности в анамнезе Роды 32 35,4±3,7* 35 35,0±2,8* 60 20 20,0±4,5* 32 Из них-1 роды 20 22,0±1,2* -2 и более 12 13,3±0,7* 15 15,0±1,4* 28 родов Искуственные 4 4,4±1,7 3 3,2±1,8 3 аборты Из них -1 аборт 1 3,3±1,4 2 2,1±0,3 2 1,1±0,7 1 -2 и более 3 1,1±1,1 1 аборта 2 Самопроизвольные 13 14,4±3,7 19 19,2±6,9 выкидыши 8,8±3,4 9 9,1±1,3 1 Из них- 1 выкидыш 8 10 10,1±0,6 1 - 2 и более 5 5,5±0,8 выкидыша *-р<0,001 по сравнению с показателем в контрольной группе 66,6±3,0 35,5±4,5 31,1±2,4 3,3±1,1 2,2±1,8 1,1±1,4 2,2±1,8** ∆ 1,1±1,4** 1,1±1,4** ∆ **-р<0,001 по сравнению с показателем в группе ДНЗ ∆-р<0,001 по сравнению с показателем в группе с АТ Беременности в анамнезе имели 54,4±3,6% женщин с ДНЗ, 57,0±1,1% больных аутоиммунным тиреоидитом, в контрольной группе – 72,2±2,8% женщин (р<0,001). Беременности, закончившиеся родами, в контрольной группе были достоверно (р<0,001) чаще, чем у женщин с ДНЗ и аутоиммунным тиреоидитом. Самопроизвольные выкидыши достоверно чаще встречались у женщин с ДНЗ (15,7±3,7%; р<0,001) и у больных АТ (19,2±6,9%; р<0,001), чем в контрольной группе (2,2±1,8%). До начала приема гормональных контрацептивов обследованные женщины имели массу тела от 45 до 75 кг. Средний ИМТ у женщин с ДНЗ до 52 начала приема КОК составлял 22,4±0,5 кг/м2, у женщин с аутоиммунным тиреоидитом – 20,6±0,6 кг/м2, у женщин, включенных в контрольную группу, ИМТ составлял 21,3±0,3 кг/м2. Показатели систолического и диастолического артериального давления до начала приема гормональной контрацепции были в пределах от 100/70 мм.рт.ст. до 120/80 мм. рт.ст. При проведении гинекологического обследования на данном этапе гинекологической патологии не выявлено. В качестве микродозированные гормональных и контрацептивов низкодозированные оральные использовались контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола в сочетании с различными гестагенными компонентами (дроспиренон 3 мг, гестоден 75 мкг, диеногест 2мг) или гестагенный контрацептив с дезогестрелом в дозе 75 мкг. Женщины всех групп до включения в исследование в течение 6 месяцев не получали гормональные контрацептивы. У 40 больных аутоиммунным тиреоидитом гипотиреоз был компенсирован тироксином до начала применения гормональной контрацепции, они получали тироксин продолжительностью от 6 мес. до 7 лет в суточной дозе от 25 мкг до 100 мкг. До начала исследования женщины с ДНЗ йодид калия и тироксин не получали. Сорок женщин с ДНЗ и 40 женщин без патологии щитовидной железы, включенные в исследование, получали йодид калия в суточной дозе 100 мкг. В зависимости от проводимого лечения и выбранного контрацептива в двух основных и контрольной группе выделены подгруппы. Группа с ДНЗ была разделена на 3 подгруппы. Первую подгруппу составили 40 женщин, которые получали КОК в сочетании с йодидом калия. В двух других подгруппах женщины получали только гормональные контрацептивы: во второй подгруппе, включавшей 30 женщин, – комбинированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (дроспиренон, гестоден, диеногест), в третьей – 20 53 женщин, которые получали гестагенный контрацептив с дезогестрелом. В группе женщин с АТ выделено 4 подгруппы. В двух подгруппах женщины получали гормональные контрацептивы в сочетании с тироксином: в первой подгруппе – 40 женщин, которые получали КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (дроспиренон, гестоден, диеногест) в сочетании с тироксином, в третьей подгруппе – 15 женщин, которые получали гестагенный контрацептив с дезогестрелом в сочетании с тироксином. В двух других подгруппах женщин с АТ получали только гормональные контрацептивы: во второй подгруппе – 30 женщин, которые получали комбинированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенными компонентами (дроспиренон, гестоден, диеногест), в четвертой – 15 женщин, которые получали гестагенный контрацептив с дезогестрелом. В контрольной группе выделено 3 подгруппы. Первую подгруппу составили 40 женщин, которые получали КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (дроспиренон, гестоден, диеногест) в сочетании с йодидом калия. В двух других подгруппах женщины получали только гормональные контрацептивы: во второй подгруппе, включавшей 30 женщин – комбинированные оральные контрацептивы, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (дроспиренон, гестоден, диеногест), в третьей – 20 женщин, которые получали гестагенный контрацептив с дезогестрелом. представлена в таблице 3. Подгруппы обследованных женщин 54 Таблица 3 – Подгруппы обследованных женщин Группы ДНЗ (I группа), n=90 I II III Подгруппы АТ (II группа), n=100 I II III IV Контрольная группа, n=90 I II III n=40 n=30 n=20 n=40 n=30 n=15 n=15 n=40 n=30 n=20 + + - + + - - + + - - - + - - + + - - + + - - - - - - + - - - - - + - + - - - - КОК, содержащие 20 и 30 мкг ЭЭ, и прогестагены: дроспиренон, гестоден и диеногест Гестагенный контрацептив с дезогестрелом Йодид калия 100мкг Тироксин 25-100 мкг Все обследованные женщины наблюдались в течение 12 месяцев. За этот период значимых изменений ИМТ, уровня систолического и диастолического артериального давления у женщин основных и контрольных групп не отмечалось. Переносимость и частота побочных эффектов в течение 12 месяцев применения комбинированных и гестагенных гормональных контрацептивов была оценена у женщин с заболеваниями щитовидной железы и в контрольной группе. Все женщины отметили хорошую переносимость гормональных препаратов. В таблицах 4 и 5 представлена частота побочных эффектов, связанных с приемом гормональных контрацептивов. комбинированных и гестагенных 55 Таблица 4 – Побочные эффекты при приеме КОК ДНЗ n=70 Побочные эффекты Тошнота -в течение 2 мес. -через 6 мес. Головная боль -в течение 2 мес. -через 6 мес. Эмоциональная лабильность -в течение 2 мес. -через 6 мес. Масталгия -в течение 2 мес. -через 6 мес. Межменструальные кровянистые выделения -в течение 2 мес. -через 6 мес. АТ n=70 Контрольная группа n=70 N % n % n % 6 - 8,5 - 6 - 8,5 - 5 - 7,1 - 7 - 10 - 8 - 11,4 - 6 - 8,5 - 12 4 17,4 5,7 16 5 22,8 7,1 10 3 14,2 4,2 10 4 14,2 5,7 10 3 14,2 4,2 8 2 11,4 2,8 12 - 17,1 - 11 - 15,7 - 11 - 15,7 - У больных ДНЗ в течение первых 2 месяцев приема КОК наблюдались следующие побочные эффекты: у 6 женщин (8,5%) – тошнота, у 7 женщин (10%) – головная боль, у 12 женщин (17,4%) – эмоциональная лабильность, у 10 женщин (14,2%) масталгия и у 12 женщин (17,1%) – межменструальные кровянистые выделения. Через 6 месяцев приема КОК частота побочных эффектов уменьшилась: у 4 женщин (5,7%) с ДНЗ сохранялась эмоциональная лабильность и у 4 женщин (5,7%) – масталгия. В течение первых 2 месяцев приема КОК больные аутоиммунным тиреоидитом отмечали следующие побочные эффекты. У 6 женщин (8,5%) была тошнота, у 8 женщин (11,4%) – головная боль, 16 женщин (22,8%) – эмоциональная лабильность, у 10 женщин (14,2%) – масталгия и у 11 (15,7%) – межменструальные кровянистые выделения. Через 6 месяцев приема КОК у 56 женщин с АТ сохранялись следующие побочные эффекты: у 5 женщин (7,1%) – эмоциональная лабильность и у 3 (4,2%) – масталгия. В контрольной группе в течение первых 2 месяцев приема КОК у 5 женщин (7,1%) отмечена тошнота, у 6 (8,5%) – головная боль, у 10 женщин (14,2%) – эмоциональная лабильность, у 8 (11,4%) – масталгия и у 11 (15,7%) – межменструальные кровянистые выделения. Через 6 месяцев приема КОК у 3 женщин (4,2%) в контрольной группе сохранялась эмоциональная лабильность, а у 2 женщин (2,8%) – масталгия. Побочные эффекты, которые наблюдались на фоне приема КОК, были невыраженными, не влияли на общее самочувствие женщин с заболеваниями щитовидной железы и женщин контрольной группы. Ни в одном случае не наблюдалось серьезных гормональных препаратов. побочных эффектов, требующих отмены 57 Таблица 5 – Побочные эффекты при приеме гестагена дезогестрела ДНЗ n=20 Побочные эффекты Тошнота -в течение 2 мес. -через 6 мес. Головная боль -в течение 2 мес. -через 6 мес. Эмоциональная лабильность -в течение 2 мес. -через 6 мес. Масталгия -в течение 2 мес. -через 6 мес. Межменструальные кровянистые выделения -в течение 2 мес. -через 6 мес. Отсутствие менструальноподобных выделений -в течение 2 мес. -через 6 мес. АТ n=30 Контрольная группа n=20 N % n % n % 1 - 5 - 2 - 6,6 3 - 10 - 1 - 5 - 1 - 3,3 - - - 2 - 10 1 - 3,3 - 1 - 5 - 1 - 5 - 1 - 3,3 - 1 - 5 - 12 8 60 40 11 10 36,6 33,3 11 6 55 30 10 5 50 25 11 4 36,6 13,3 8 4 40 20 У больных ДНЗ в течение первых 2 месяцев приема гестагена дезогестрела наблюдались следующие побочные эффекты. У 1 женщины (5%) – тошнота, у одной (5%) – головная боль, у двух (10%) – эмоциональная лабильность, у одной (5%) – масталгия, у 12 (60%) – межменструальные кровянистые выделения и у 10 (50%) – отсутствовали менструальноподобные выделения. Через 6 месяцев приема КОК частота побочных эффектов уменьшилась: у 8 женщин (40%) с ДНЗ сохранялись межменструальные кровянистые выделения, а у менструальноподобные выделения. 5 больных (25%) – отсутствовали 58 В течение первых 2 месяцев приема гестагена дезогестрела у больных аутоиммунным тиреоидитом отмечались следующие побочные эффекты. У двух женщин (6,6%) – тошнота, у одной (3,3%) – головная боль, у одной (3,3%) – эмоциональная лабильность, у одной (3,3%) – масталгия, у 11 женщин (36,6%) – межменструальные кровянистые выделения и у 11 женщин (36,6%) – отсутствовали менструальноподобные выделения. Через 6 месяцев приема гестагена дезогестрела у женщин с АТ сохранялись следующие побочные эффекты: у 10 женщин (33,3%) – межменструальные кровянистые выделения, а у 4 (13,3%) отсутствовали – менструальноподобные выделения. В контрольной группе в течение первых 2 месяцев приема КОК у 3 женщин (10%) отмечена тошнота, у одной (5%) – эмоциональная лабильность, у одной (5%) – масталгия, у 11 женщин (55%) – межменструальные кровянистые выделения и у 8 (40%) – отсутствовали менструальноподобные выделения. Через 6 месяцев приема гестагена дезогестрела у женщин контрольной группы сохранялись следующие побочные эффекты: у 6 женщин (30%) – межменструальные кровянистые выделения и у 4 (20%) – отсутствовали менструальноподобные выделения. Межменструальные кровянистые выделения и отсутствие менструальноподобных выделений у женщин с заболеваниями щитовидной железы и у женщин без патологии щитовидной железы на фоне приема гестагена дезогестрела не требовали отмены гормонального препарата. 59 3.2. Размеры и функциональное состояние щитовидной железы женщин, принимающих гормональные контрацептивы 3.2.1. Размеры и функциональное состояние щитовидной железы у здоровых женщин, принимающих комбинированные или гестагенные гормональные контрацептивы Размеры и функция щитовидной железы у женщин контрольной группы оценивались до начала и через 12 месяцев приема гормональных препаратов. Данные об объеме щитовидной железы до начала и через 12 месяцев приема КОК и гестагена дезогестрела у женщин контрольной группы представлены в таблицах 6 и 7. Таблица 6 – Размеры щитовидной железы на фоне применения КОК у женщин контрольной группы (М±m) Контрольная группа I подгруппа (КОК и йодида калия) n=40 II подгруппа (КОК) n=30 Объем железы (см³) До начала приема Через 12 месяцев КОК 11,9±0,4 10,9± 0,4 12,2±0,5 11,0± 0,4 У женщин первой и второй подгрупп контрольной группы, получавших в течение 12 месяцев КОК, объем щитовидной железы достоверно не изменился. 60 Таблица 7 – Объем щитовидной железы на фоне применения дезогестрела у женщин контрольной группы (М±m) III подгруппа (дезогестрел) n=20 Объем железы (см³) До начала приема Через 12 месяцев дезогестрела 12,1±0,5 12,0± 0,4 Объем щитовидной железы у женщин третьей подгруппы контрольной группы, получавших в течение 12 месяцев гестаген дезогестрел, не изменился. Содержание ТТГ в крови женщин контрольной группы до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены в таблицах 8 и 9. Таблица 8 – Содержание ТТГ в крови женщин контрольной группы на фоне применения КОК (М±m) Контрольная группа I подгруппа, n=40 II подгруппа, n=30 ТТГ (мМЕ/л) До начала прима КОК Через 12 месяцев 1,7±0,6 1,4 ± 0,2 1,8±0,4 1,7± 0,2 Как в подгруппе женщин, получавших КОК, так и в подгруппе женщин, получавших КОК с дополнительным приемом йодида калия, достоверных изменений уровня ТТГ в крови через 12 месяцев приема препаратов по сравнению с исходными значениями не наблюдалось. 61 Таблица 9 – Содержание ТТГ в крови женщин контрольной группы на фоне применения дезогестрела (М±m) III подгруппа, n=20 ТТГ (мМЕ/л) Да начала приема дезогестрела Через 12 месяцев 1,8±0,4 1,8 ± 0,2 Достоверных различий уровня ТТГ в крови женщин третьей подгруппы контрольной группы за 12 месяцев приема гестагена дезогестрела выявлено не было. Оценка содержания гормонов щитовидной железы в крови женщин контрольной группы, а именно уровня свободного тироксина и свободного трийодтиронина до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены в таблицах 10 и 11. Таблица 10 – Содержание свободного тироксина и трийодтиронина в крови женщин контрольной группы на фоне применения КОК (М±m) св. Т4 (пмоль/л) Контрольная св.Т3 (пмоль/л) До начала приема КОК Через 12 мес. приема До начала приема КОК Через 12 мес. приема I подгруппа, n=40 14,7±0,4 15,5±0,6 3,5±1,0 3,6±0,7 II подгруппа,n=30 14,1±0,4 15,2±0,6 3,5±1,0 3,6±0,7 группа Как в подгруппе женщин, получавших КОК, так и в подгруппе женщин, получавших КОК с дополнительным приемом йодида калия, достоверных изменений уровня свободного тироксина и свободного трийодтиронина в крови не наблюдалось. 62 Таблица 11 – Содержание свободного тироксина и трийодтиронина в крови женщин контрольной группы на фоне применения дезогестрела (М±m) св. Т4 (пмоль/л) III подгруппа, n=20 св.Т3 (пмоль/л) До начала приема дезогестрела Через 12 мес. До начала приема дезогестрела Через 12 мес. 14,5±0,3 15,0±0,3 3,2±0,4 3,3±0,4 Уровень свободного тироксина и свободного трийодтиронина в крови женщин третьей подгруппы контрольной группы в течение 12 месяцев приема гестагена дезогестрела достоверно не изменился. Представленные результаты указывают микродозированных на КОК то, и что гестагена прием низкодозированных дезогестрела не влияет и на функциональную активность щитовидной железы у женщин без тиреоидной патологии. 3.2.2. Результаты обследования женщин с диффузным нетоксическим зобом, получающих комбинированные или гестагенные гормональные контрацептивы У женщин с ДНЗ размеры и функция щитовидной железы оценивались до начала и через 12 месяцев приема гормональных препаратов. При ультразвуковом сканировании щитовидной железы у женщин с ДНЗ в течение 12 месяцев применения КОК и гестагена дезогестрела не было выявлено формировавшихся узлов в щитовидной железе. Данные об объеме щитовидной железы до начала и через 12 месяцев приема КОК и гестагена дезогестрела у женщин с ДНЗ представлены на рисунке 1 и в таблице 12. 63 * Объем щитовидной железы (см3) 25 до начала приема КОК 20 15 через 12 месяцев 10 5 0 I подгруппа (n=40) II подгруппа (n=30) ДНЗ I подгруппа (n=40) II подгруппа (n=30) Контрольная группа I - КОК и йодид калия II - КОК * – отличие от исходного уровня при p<0,05 Рисунок 1 – Размеры щитовидной железы у женщин с диффузным нетоксическим зобом на фоне применения КОК Во второй подгруппе женщин с ДНЗ, получавших в течение 12 месяцев КОК, выявлено достоверное (p<0,05) увеличение объема щитовидной железы (от 21,2±0,3 см³ до 22,4±0,3 см³). Однако сочетанное применение КОК и йодида калия в суточной дозе 100 мкг у женщин первой подгруппы с ДНЗ не сопровождалось увеличением объема щитовидной железы. 64 Таблица 12 – Объем щитовидной железы у женщин с диффузным нетоксическим зобом на фоне применения гестагена дезогестрела (М±m) Группы женщин I группа Контрольная группа III подгруппа (женщины с ДНЗ), n=20 III подгруппа, n=20 Объем железы (см³) До начала приема Через 12 мес. дезогестрела 21,1±0,3 21,8±0,6 12,1±0,5 12,0± 0,4 Объем щитовидной железы в третьей подгруппе женщин с ДНЗ и в контрольной группе, получавших в течение 12 месяцев гестаген дезогестрел, не изменился (таблица 12). В первой подгруппе женщин с ДНЗ, получавших в течение 12 месяцев КОК в сочетании с йодидом калия, существенного изменения уровня ТТГ не было выявлено (рис. 2). Так, до назначения контрацептивных препаратов в первой подгруппе больных ДНЗ уровень ТТГ в крови составил 1,9±0,2 мМЕ/л. Через 12 месяцев приема КОК в сочетании с йодидом калия уровень ТТГ достоверно не изменился и составил 1,6±0,4 мМе/л, и не отличался от показателей во второй подгруппе больных с ДНЗ, принимавших в течение 12 месяцев только КОК (с 2,0±0,1 мМЕ/л до 2,1±0,1 мМЕ/л). Содержание ТТГ в крови женщин с ДНЗ до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены на рисунке 2 и в таблице 13. 65 ТТГ (мМЕ/л) 2,5 до начала приема КОК 2 1,5 через 12 месяцев 1 0,5 0 I подгруппа (n=40) II подгруппа (n=30) I подгруппа (n=40) ДНЗ II подгруппа (n=30) I - КОК и йодид калия Контрольная группа II - КОК Рисунок 2 – Содержание ТТГ в крови женщин с диффузным нетоксическим зобом на фоне применения КОК Результаты определения уровня ТТГ в крови женщин с ДНЗ представлены в таблице 13. Таблица 13 – Содержание ТТГ в крови женщин с диффузным нетоксическим зобом на фоне применения дезогестрела (М±m) ТТГ (мМЕ/л) Группы женщин До начала приема Через 12 мес. дезогестрела I группа III подгруппа , n=20 2,0±0,4 2,0±0,6 Контрольная группа III подгруппа, n=20 1,8±0,4 1,8 ± 0,2 В третьей подгруппе женщин с ДНЗ через 12 месяцев приема гестагена дезогестрела достоверных различий уровня ТТГ в крови выявлено не было. Результаты определения уровня гормонов щитовидной железы, а именно свободного тироксина и свободного трийодтиронина, в крови женщин с ДНЗ до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены в таблицах 14 и 15. 66 Таблица 14 – Содержание свободного тироксина и трийодтиронина в крови женщин с диффузным нетоксическим зобом на фоне применения КОК (М±m) св. Т4 (пмоль/л) Группы женщин I группа, n=70 I подгруппа, n=40 II подгруппа, n=30 Контрольная I подгруппа, группа, n=40 n=70 II подгруппа, n=30 св.Т3 (пмоль/л) До начала приема КОК Через 12 мес. приема До начала приема КОК Через 12 мес. приема 14,9±0,4 15,0±0,3 3,5±0,8 3,3±0,5 13,9±0,4 14,0±0,3 3,3±0,8 3,4±0,5 14,7±0,4 15,3±0,6 3,5±1,0 3,6±0,7 14,1±0,2 15,2±0,6 3,3±0,2 4,0±0,6 Как в подгруппе женщин, получавших КОК, так и в подгруппе женщин, получавших КОК с дополнительным приемом йодида калия, у больных ДНЗ достоверных изменений уровня свободного тироксина и свободного трийодтиронина в крови не наблюдалось. Уровень свободного тироксина и свободного трийодтиронина в крови женщин с ДНЗ в течение 12 месяцев приема гестагена дезогестрела достоверно не изменился (таблица 15). 67 Таблица 15 – Содержание свободного тироксина и трийодтиронина в крови женщин с диффузным нетоксическим зобом на фоне применения дезогестрела (М±m) св. Т4 (пмоль/л) св. Т3 (пмоль/л) Группы женщин До начала приема дезогестрела Через 12 мес. приема До начала приема дезогестрела Через 12 мес. приема ДНЗ (III подгруппа), n=20 Контрольная группа (III подгруппа), n=20 15,3±0,5 14,8±0,3 3,2±0,4 3,4±0,5 14,5±0,3 15,0±0,3 3,2±0,4 3,3±0,4 Полученные данные показали отсутствие статистически значимых различий в показателях уровня свободного тироксина, свободного трийодтиронина, тиреотропного гомона в крови женщин с ДНЗ до начала приема и через 12 месяцев применения КОК и гестагена дезогестрела. Прием КОК больными ДНЗ в течение 12 месяцев вызывает достоверное увеличение объема щитовидной железы без изменения ее функции, однако сочетанное применение йодида калия в суточной дозе 100 мкг предупреждает увеличение объема щитовидной железы у больных ДНЗ. 3.2.3. Результаты обследования женщин с аутоиммунным тиреоидитом, получающих комбинированные гормональные или гестагенные гормональные контрацептивы Размеры и функцию щитовидной железы у женщин с аутоиммунным тиреоидитом оценивали до начала и через 12 месяцев приема гормональных препаратов. При ультразвуковом сканировании щитовидной железы у женщин с аутоиммунным тиреоидитом в течение 12 месяцев применения 68 КОК и гестагена дезогестрела не было выявлено формирования узлов в щитовидной железе. У 40 женщин больных аутоиммунным тиреоидитом гипотиреоз был компенсирован тироксином до начала использования гормональной контрацепции. Больным аутоиммунным тиреоидитом назначали тироксин в дозе от 50 мкг до 100 мкг в сутки, начиная с дозировки 25 мкг в сутки. В течение 12 месяцев приема КОК доза тироксина не изменялась. Данные об объеме щитовидной железы до начала и через 12 месяцев приема КОК и гестагена дезогестрела у группы женщин с аутоиммунным тиреоидитом представлены на рисунках 3 и 4. до начала приема КОК Объем щитовидной железы (см3) 18 * 16 14 через 12 месяцев 12 10 8 6 АТ I- КОК и тироксин II- КОК 4 2 0 I подгруппа (n=40) II подгруппа (n=30) Аутоиммунный тиреоидит II подгруппа (n=30) Контрольная группа Контрольная группа II - КОК * – отличие от исходного уровня при p<0,001 Рисунок 3 – Динамика размеров щитовидной железы на фоне применения КОК у женщин с аутоиммунным тиреоидитом Во второй подгруппе женщин с аутоиммунным тиреоидитом без терапии тироксином через 12 месяцев применения КОК объем щитовидной железы достоверно не изменился, однако на фоне применения тироксина у женщин первой подгруппы с аутоиммунным тиреоидитом объем 69 щитовидной железы через 12 месяцев достоверно уменьшился с 16,1±0,3 см³ до 14,2±0,4 см³ (p<0,05). Тироксин оказывал на щитовидную железу дозозависимое действие. При приеме 25 мкг тироксина не было отмечено изменений размеров щитовидной железы, на фоне приема 50 мкг и более – щитовидная железа достоверно уменьшилась, в большей степени – при Объем щитовидной железы (см3) приеме 75 мкг и 100 мкг тироксина в сутки. до начала приема дезогестрела 18 16 * 14 через 12 месяцев 12 10 8 6 4 2 0 III подгруппа (n=15) IV подгруппа (n=15) Аутоиммунный тиреоидит III подгруппа (n=30) Контрольная группа АТ III - дезогестрел и тироксин IV- дезогестрел Контрольная группа III - дезогестрел * – отличие от исходного уровня при p<0,05 Рисунок 4 – Объем щитовидной железы у женщин с аутоиммунным тиреоидитом на фоне применения гестагена дезогестрела В четвертой подгруппе женщин с аутоиммунным тиреоидитом без терапии тироксином через 12 месяцев применения дезогестрела объем щитовидной железы достоверно не изменился, однако на фоне применения тироксина у женщин третьей подгруппы с аутоиммунным тиреоидитом объем щитовидной железы через 12 месяцев достоверно (p<0,05) уменьшился с 16,1±0,3 см3 до 15,2±0,2 см3. При использовании в течение 12 месяцев КОК 70 в сочетании с тироксином у женщин третьей подгруппы с аутоиммунным тиреоидитом происходило достоверное (p<0,05) снижение уровня ТТГ в крови с 1,9±0,1 мМЕ/л до 1,4±0,2 мМЕ/л. Содержание ТТГ в крови больных аутоиммунным тиреоидитом до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены на рисунках 5 и 6. ТТГ (мМЕ/л) до начала приема КОК 2,5 через 12 месяцев 2 * 1,5 АТ I - КОК и тироксин II - КОК 1 0,5 0 I подгруппа (n=40) II подгруппа (n=30) Аутоиммунный тиреоидит II подгруппа (n=30) Контрольная группа II - КОК Контрольная группа * – отличие от исходного уровня при p<0,05 Рисунок 5 – Содержание ТТГ в крови женщин с аутоиммунным тиреоидитом на фоне применения КОК В первой подгруппе женщин с аутоиммунным тиреоидитом через 12 месяцев приема гестагена дезогестрела в сочетании с тироксин в суточной дозе 50-75 мкг произошло достоверное (p<0,05) снижение уровня ТТГ в крови с 2,0±0,1 мМЕ/л до 1,5±0,2 мМЕ/л. Достоверных различий уровня ТТГ в крови женщин второй подгруппы с аутоиммунным тиреоидитом за 12 месяцев применения гестагена дезогестрела выявлено не было. Уровень ТТГ у больных аутоиммунным тиреоидитом зависит от дозы тироксина, которая в 71 свою очередь меняется в зависимости от уровня ТТГ в крови. Этот эффект является не следствием применения гормональных контрацептивных препаратов, а результатом компенсации гипотиреоза тироксином. ТТГ (мМЕ/л) 2 до начала приема дезогестрела * 1,5 через 12 месяцев 1 АТ III - дезогестрел и тироксин IV - дезогестрел 0,5 0 III подгруппа (n=15) IV подгруппа (n=15) Аутоиммунный тиреоидит III подгруппа (n=20) Контрольная группа III - дезогестрел Контрольная группа * – отличие от исходного уровня при p<0,05 Рисунок 6 – Содержание ТТГ в крови женщин с аутоиммунным тиреоидитом на фоне применения дезогестрела Результаты определения уровня свободного тироксина и свободного трийодтиронина в крови женщин с аутоиммунным тиреоидитом до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены в таблицах 17 и 18. 72 Таблица 17 – Содержание свободного тироксина и свободного трийодтиронина в крови женщин с аутоиммунным тиреоидитом на фоне применения КОК св. Т4 (пмоль/л) Группы женщин II группа, n=70 Контрольная группа, n=70 I подгруппа, n=40 II подгруппа, n=30 I подгруппа, n=40 II подгруппа, n=30 св. Т3 (пмоль/л) До начала приема КОК Через 12 мес. приема До начала приема КОК Через 12 мес. приема 14,8±0,3 14,1±0,4 3,3±0,2 3,4±0,3 14,6±0,8 14,9±0,4 3,3±0,2 4,0±0,6 14,7±0,4 15,5±0,6 3,5±1,0 3,6±0,7 14,1±0,2 15,2±0,6 3,3±0,2 4,0±0,6 Как в подгруппе женщин, получавших КОК, так и в подгруппе женщин, получавших КОК с дополнительным приемом тироксина, у больных аутоиммунным тиреоидитом достоверных изменений уровня свободного тироксина и свободного трийодтиронина в крови не наблюдалось. 73 Таблица 18 – Содержание свободного тироксина и свободного трийодтиронина в крови женщин с аутоиммунным тиреоидитом на фоне применения дезогестрела св. Т4 (пмоль/л) св. Т3 (пмоль/л) Группы женщин До начала приема дезогестрела Через 12 мес. приема До начала приема дезогестрела Через 12 мес. приема III подгруппа, АТ n=15 IV подгруппа, n=15 Контрольная группа (III подгруппа), n=20 15,8±0,3 15,1±0,4 3,2±0,2 3,3±0,3 14,7±0,6 14,8±0,8 3,2±0,4 3,3±0,4 14,5±0,3 15,0±0,3 3,2±0,4 3,3±0,4 Уровень свободного тироксина и свободного трийодтиронина в крови женщин с аутоиммунным тиреоидитом в течение 12 месяцев приема КОК и гестагена дезогестрела достоверно не изменились. Результат определения уровня аутоантител к тиреопероксидазе и антител к тиреоглобулину в крови женщин с аутоиммунным тиреоидитом до начала и через 12 месяцев приема КОК и гестагена дезогестрела представлены на рисунках 7 и 8. 400 350 * 300 * 250 200 150 100 50 0 КОК с 20 мкг ЭЭ (n=40) КОК с 30 мкг ЭЭ (n=30) Антитела к тиреоглобулину (МЕ/мл) Антитела к тиреопероксидазе (МЕ/мл) 74 500 400 * * до приема КОК через 12 месяцев 300 200 100 0 КОК с 20 мг ЭЭ КОК с 30 мг ЭЭ * – отличие от исходного уровня при p<0,05 Рисунок 7 - Динамика количества антител к ТПО и антител к тиреоглобулину в крови женщин с аутоиммунным тиреоидитом на фоне применения микродозированных (МД) и низкодозированных (НД) КОК. Через 12 месяцев приема КОК как во второй подгруппе женщин с аутоиммунным тиреоидитом, так и в первой подгруппе женщин, получавших КОК с дополнительным приемом тироксина, отмечено достоверное (p<0,05) снижение уровня аутоантител к тиреопероксидазе и к тиреоглобулину в крови. Однако через 12 месяцев приема гестагена дезогестрела у женщин в третьей и четвертой подгруппе с аутоиммунным тиреоидитом происходило достоверное (p<0,05) снижение только уровня антител к тиреопероксидазе в крови (рис 8). 75 Антитела к тиреоглобулину (МЕ/мл) Антитела к тиреопероксидазе (МЕ/мл) до назначения дезогестрела 350 300 * 250 200 150 100 50 0 через 12 месяцев 350 300 250 200 150 100 50 0 * – отличие от исходного уровня при p<0,05 Рисунок 8 – Антитела к ТПО и антитела к тиреоглобулину в крови женщин с аутоиммунным тиреоидитом до и на фоне применения дезогестрела В исследовании не было выявлено дозозависимого влияния эстрогенов на объем щитовидной железы у женщин с аутоиммунным тиреоидитом, получающих микро- и низкодозированные КОК и гестаген дезогестрел в течение 12 месяцев. У больных аутоиммунным тиреоидитом прием микро- и низкодозированных комбинированных гормональных контрацептивов в течение 12 месяцев приводит к достоверному снижению в сыворотки крови уровня аутоантител к тиреопероксидазе и к тиреоглобулину, тогда как прием гестагена дезогестрела в течение 12 месяцев приводит к достоверному снижению в сыворотки тиреопероксидазе. крови только уровня аутоантител к 76 3.3. Показатели липидного обмена у женщин с заболеваниями щитовидной железы, принимающих комбинированные или гестагенные гормональные контрацептивы Результаты определения липидного спектра крови у женщин контрольной группы до начала приема КОК и через 12 месяцев приема представлены на рисунке 9. При оценке показателей липидного обмена у женщин контрольной группы на фоне приема КОК в течение 12 месяцев установлено достоверное изменение ряда показателей. Общий холестерин в крови до начала приема КОК составлял 5,30±0,06 ммоль/л, и через 12 месяцев приема КОК отмечено его достоверное снижение до 5,10±0,07 ммоль/л (р<0,05); уровень ЛПНП в крови до начала приема КОК составил 3,31±0,04 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 3,22±0,02 ммоль/л (р<0,05); коэффициент атерогенности до начала приема КОК равнялся 2,70±0,04 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 2,60±0,02 ммоль/л (р<0,05). Уровень триглицеридов и ЛПВП в крови не изменился. 77 ммоль/л 6 * до начала приема КОК 5 4 * через 12 месяцев 3 2 1 0 *- отличие от исходного уровня при р<0,05 Рисунок 9 – Изменения показателей липидного спектра крови женщин в контрольной группе на фоне применения КОК При использовании прогестаген гормонального контрацептива, содержащего дезогестрел, подобных изменений не наблюдалось, все показатели (общий холестерин, триглицериды, ЛПВП, ЛПНП, коэффициент атерогенности) через 12 месяцев приема препаратов в контрольной группе достоверно не отличались от исходных показателей (таблица 19). 78 Таблица 19 – Изменения показателей липидного спектра крови женщин в контрольной группе на фоне применения гестагена дезогестрела Параметры Холестерин (ммоль/л) Триглицериды (ммоль/л) ЛПВП (ммоль/л) ЛПНП (ммоль/л) КА Контрольная группа, n=20 До начала приема Через 12 мес. приема дезогестрела 5,30±0,06 5,16±0,07 1,39±0,02 1,40±0,05 1,32±0,01 1,33±0,02 3,21±0,04 3,16±0,06 2,62±0,04 2,60±0,02 Результаты определения липидного спектра крови у женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом до начала приема гормональных контрацептивов представлены в таблице 20. Таблица 20 – Показатели липидного спектра крови женщин с заболеваниями щитовидной железы Параметры Холестерин (ммоль/л) Триглицериды (ммоль/л) ЛПВП (ммоль/л) ЛПНП (ммоль/л) КА ДНЗ, n=90 5,35±0,06 АТ, n=100 5,40±0,06 Контрольная группа, n=90 5,30±0,06 1,42±0,05 1,41±0,01 1,41±0,02 1,36±0,05 1,32±0,01 1,30±0,01 3,27±0,05 3,30±0,03 3,31±0,04 2,65±0,04 2,74±0,05 2,70±0,04 У женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом все показатели липидного спектра крови (общий холестерин, триглицериды, ЛПВП, ЛПНП, коэффициент атерогенности) не имели 79 достоверных различий по сравнению с показателями липидного спектра крови женщин контрольной группы. В группах женщин с заболеваниями щитовидной железы и в контрольной группе не было выявлено изменений липидного спектра крови, которые повлияли бы на выбор гормональных препаратов. Сравнительный анализ показателей липидного спектра у женщин с заболеваниями щитовидной железы на фоне приема КОК и гестагена дезогестрела представлены на рис. 10, 11 и в таблицах 21, 22. ммоль/л 6 * до начала приема КОК 5 4 * через 12 месяцев 3 2 1 0 * – отличие от исходного уровня при р<0,05 Рисунок 10 – Изменения показателей липидного спектра крови у женщин с диффузным нетоксическим зобом на фоне применения КОК Показатели липидного обмена у женщин с диффузным нетоксическим зобом на фоне приема КОК в течение 12 месяцев имели достоверные изменения (рис.10). Так общий холестерин в крови до начала приема КОК составлял 5,50±0,06 ммоль/л, и через 12 месяцев приема КОК отмечено его достоверное снижение до 5,20±0,05 ммоль/л (р<0,05); уровень ЛПНП в крови 80 до начала приема КОК составил 3,30±0,03 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 3,20±0,04 ммоль/л (р<0,05); коэффициент атерогенности до начала приема КОК был 2,70±0,05 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 2,59±0,02 ммоль/л (р<0,05). При этом уровень триглицеридов и ЛПВП в крови не изменился. Таблица 21 – Изменения показателей липидного спектра крови женщин с диффузным нетоксическим зобом на фоне применения гестагена дезогестрела Параметры Холестерин (ммоль/л) Триглицериды (ммоль/л) ЛПВП (ммоль/л) ЛПНП (ммоль/л) КА ДНЗ, n=30 До начала приема Через 12 месяцев приема дезогестрела 5,50±0,06 5,50±0,05 1,50±0,01 1,51±0,06 1,31±0,01 1,35±0,02 3,28±0,04 3,20±0,02 2,65±0,04 2,60±0,02 На фоне приема гормонального контрацептива, содержащего гестаген дезогестрел, подобных изменений не наблюдалось, все показатели липидного спектра крови через 12 месяцев приема препаратов у женщин с диффузным нетоксическим зобом достоверно не отличались от исходных показателей (таблица 21). 81 ммоль/л 6 * до начала приема КОК 5 4 * через 12 месяцев 3 2 1 0 * – отличие от исходного уровня при р<0,05 Рисунок 11 - Изменения показателей липидного спектра крови женщин с аутоиммунным тиреоидитом на фоне применения КОК У женщин с аутоиммунным тиреоидитом на фоне приема КОК в течение 12 месяцев анализ липидного спектра крови показал достоверное изменение ряда показателей. Уровень общего холестерина в крови до начала приема КОК составлял 5,41±0,06 ммоль/л и через 12 месяцев приема КОК отмечено его достоверное снижение до 5,20±0,06 ммоль/л (р<0,05); уровень ЛПНП в крови до начала приема КОК равнялся 3,32±0,01 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 3,21±0,05 ммоль/л (р<0,05); коэффициент атерогенности до начала приема КОК был 2,70±0,02 ммоль/л и через 12 месяцев приема КОК достоверно снизился до 2,60±0,02 ммоль/л (р<0,05). Уровень триглицеридов и ЛПВП в крови достоверно не изменился (рис. 11). 82 Таблица 22 – Изменения показателей липидного спектра крови женщин с аутоиммунным тиреоидитом на фоне применения гестагена дезогестрела Параметры АТ, n=30 Холестерин (ммоль/л) Триглицериды (ммоль/л) ЛПВП (ммоль/л) ЛПНП (ммоль/л) КА До начала приема дезогестрела 5,40±0,06 Через 12 мес. 1,39±0,02 1,40±0,05 1,32±0,01 1,34±0,02 3,27±0,04 3,23±0,03 2,64±0,05 2,60 ±0,04 5,30±0,06 Через 12 месяцев приема гестагенного контрацептива с дезогестрелом у женщин с аутоиммунным тиреоидитом подобных изменений показателей липидного спектра крови до начала приема препарата и на фоне приема не наблюдалось (таблица 22). Анализ липидного спектра крови показал улучшение изучаемых показателей на фоне применения КОК в течение 12 месяцев. У женщин в контрольной группе, больных аутоиммунным тиреоидитом и женщин с ДНЗ на фоне приема холестерина, КОК ЛПНП и происходило коэффициента достоверное снижение атерогенности. При уровня анализе показателей липидного спектра крови до и через 12 месяцев применения гестагена дезогестрела у здоровых женщин, женщин с аутоиммунным тиреоидитом и женщин с ДНЗ значительных изменений не выявлено. 83 3.4. Показатели свертывающей системы крови у женщин с заболеваниями щитовидной железы, принимающих комбинированные или гестагенные гормональные контрацептивы Установлено, что частота тромбозов глубоких вен при использовании комбинированных оральных контрацептивов зависит от дозы эстрогенного компонента и типа гестагена. Эти данные подчеркивают важность определения показателей свертывающей системы крови перед назначением комбинированных оральных и гестагенных контрацептивов. Результаты определения показателей свертывающей системы крови у женщин контрольной группы до начала приема КОК и через 12 месяцев приема представлены в таблице 23. Таблица 23 – Изменения показателей свертывающей системы крови у женщин в контрольной группе на фоне применения КОК Параметры Контрольная группа, n=70 До начала приема КОК Через 12 месяцев 12,38±0,16 12,27±0,13 Протромбиновое время (с) Протромбиновый 90,6±0,10 индекс (%) Индекс АПТВ 0,96±0,01 Тромбиновое 14,65±0,21 время (с) Фибриноген (г/л) 2,93±0,02 МНО 1,00±0,01 * – отличие от исходного уровня при р<0,05 90,8±0,10 0,96±0,01 14,34±0,12 3,00±0,03* 0,98±0,01 Показатели свертывающей системы крови у женщин в контрольной группе до начала приема КОК соответствовали физиологической норме. Через 12 месяцев приема КОК из всех изученных показателей достоверно 84 увеличился только уровень фибриногена в крови с 2,93±0,02 г/л до 3,00±0,03 г/л (р<0,05). Однако уровень фибриногена в крови через 12 месяцев приема КОК не превышал физиологических показателей. При использовании гормонального контрацептива, содержащего гестаген дезогестрел, подобных изменений не наблюдалось, все показатели (протромбиновое время, протромбиновый индекс, индекс АПТВ, тромбиновое время, фибриноген, МНО) через 12 месяцев приема препарата в контрольной группе достоверно не отличались от исходных показателей (таблица 24). Таблица 24 – Изменения показателей свертывающей системы крови у женщин в контрольной группе на фоне применения гестагена дезогестрела Параметры Протромбиновое время (с) Протромбиновый индекс (%) Индекс АПТВ Тромбиновое время (с) Фибриноген (г/л) МНО Контрольная группа, n=20 До начала приема Через 12 месяцев гестагена дезогестрела 12,38±0,16 12,27±0,13 90,6±0,10 90,8±0,10 0,96±0,01 14,65±0,21 0,96±0,01 14,34±0,12 2,93±0,02 1,00±0,01 2,99±0,03 0,98±0,01 Средние значения параметров свертывающей системы крови у женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом до начала приема гормональных контрацептивов представлены в таблице 25. У женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом все показатели свертывающей системы крови (протромбиновое время, протромбиновый индекс, индекс АПТВ, тромбиновое время, фибриноген, МНО) не имели достоверных различий по сравнению с показателями в контрольной группе. В группах женщин с заболеваниями щитовидной 85 железы и в контрольной группе не было выявлено изменений коагулограммы, которые повлияли бы на выбор гормональных препаратов. Таблица 25 – Показатели свертывающей системы крови у женщин с заболеваниями щитовидной железы Параметры Протромбиновое время (с) Протромбиновый индекс (%) Индекс АПТВ Тромбиновое время (с) Фибриноген (г/л) МНО ДНЗ, n=90 12,38±0,16 АТ, n=100 13,12±0,13 Контрольная группа, n=90 12,38±0,16 90,8±0,10 90,6±0,10 90,6±0,10 0,98±0,01 14,85±0,21 0,96±0,01 14,56±0,21 0,96±0,01 14,65±0,21 2,90±0,06 1,11±0,01 2,98±0,02 1,12±0,02 2,93±0,02 1,00±0,01 Сравнительный анализ показателей свертывающей системы крови у женщин с заболевания щитовидной железы на фоне приема КОК и гестагена дезогестрела представлены в таблицах 26, 27, 28 и 29. Таблица 26 – Изменения показателей свертывающей системы крови у женщин с диффузным нетоксическим зобом на фоне применения КОК Параметры ДНЗ, n=70 До начала приема КОК Через 12 месяцев 12,38±0,16 12,67±0,13 Протромбиновое время (с) Протромбиновый 90,8±0,10 индекс(%) Индекс АПТВ 0,98±0,01 Тромбиновое 14,85±0,21 время (с) Фибриноген(г/л) 2,90±0,06 МНО 1,11±0,01 *- отличие от исходного уровня при р<0,05 91,0±0,10 0,97±0,01 14,34±0,12 3,09±0,06* 1,03±0,04 86 У женщин с ДНЗ исходные показатели коагулограммы также соответствовали физиологической норме. Однако на фоне приема КОК в течение 12 месяцев достоверно увеличился уровень фибриногена плазмы с 2,90±0,06 г/л до 3,09±0,06 г/л (р<0,05). Этот показатель оставался в пределах нормы, его незначительное увеличение не имело клинического значения (таблица 26). Таблица 27 – Изменения показателей свертывающей системы крови у женщин с диффузным нетоксическим зобом на фоне приема гестагена дезогестрела Параметры Протромбиновое время (с) Протромбиновый индекс (%) Индекс АПТВ Тромбиновое время (с) Фибриноген (г/л) МНО ДНЗ, n=20 До начала приема дезогестрела 12,38±0,16 Через 12 месяцев 90,8±0,10 91,0±0,10 0,98±0,01 14,85±0,21 0,97±0,01 14,34±0,12 2,90±0,06 1,11±0,01 2,95±0,05 1,03±0,04 12,67±0,13 На фоне приема гормонального контрацептива, содержащего гестаген дезогестрел, подобных изменений не наблюдалось, все показатели свертывающей системы крови через 12 месяцев приема препаратов у женщин с диффузным нетоксическим зобом достоверно не отличались от исходных (таблица 27). 87 Таблица 28 – Изменения показателей свертывающей системы крови у женщин с аутоиммунным тиреоидитом на фоне применения КОК Параметры АТ, n=70 До начала приема Через 12 месяцев приема дезогестрела 13,12±0,13 12,55±0,16 Протромбиновое время (с) Протромбиновый 90,6±0,10 индекс (%) Индекс АПТВ 0,96±0,01 Тромбиновое 14,56±0,21 время (с) Фибриноген (г/л) 2,98±0,02 МНО 1,12±0,02 *- отличие от исходного уровня при р<0,05 91,0±0,10 0,95±0,01 14,46±0,12 3,10±0,05* 1,09±0,01 Исходные показатели коагулограммы у женщин с аутоиммунным тиреоидитом соответствовали физиологической норме. Однако на фоне приема КОК в течение 12 месяцев достоверно увеличился уровень фибриногена плазмы с 2,98±0,02 г/л до 3,10±0,05 г/л (р<0,05), но не превышал физиологических показателей (таблица 28). Таблица 29 – Изменения показателей свертывающей системы крови у женщин с аутоиммунным тиреоидитом на фоне применения гестагена дезогестрела Параметры Протромбиновое время (с) Протромбиновый индекс (%) Индекс АПТВ Тромбиновое время (с) Фибриноген (г/л) МНО АТ, n=30 До начала приема Через 12 месяцев приема дезогестрела 13,12±0,13 12,55±0,16 90,6±0,10 91,0±0,10 0,96±0,01 14,56±0,21 0,95±0,01 14,46±0,12 2,98±0,02 1,12±0,02 3,00±0,04 1,09±0,01 88 Через 12 месяцев приема гестагенного контрацептива с дезогестрелом у женщин с аутоиммунным тиреоидитом подобных изменений показателей свертывающей системы крови до начала приема препарата и на фоне приема не наблюдалось (таблица 29). При анализе показателей свертывающей системы крови до и через 12 месяцев применения КОК и гестагена дезогестрела у женщин контрольной группы, больных аутоиммунным тиреоидитом и больных ДНЗ значительных изменений не выявлено. Однако было отмечено достоверное увеличение уровня фибриногена на фоне применения КОК в течение 12 месяцев во всех группах женщин, не выходящего за пределы физиологических колебаний. 3.5. Биохимические показатели функции печени у женщин с заболеваниями щитовидной железы, принимающих комбинированные или гестагенные гормональные контрацептивы Биохимические показатели функции печени у женщин контрольной группы до начала приема гормональных контрацептивов и через 12 месяцев приема представлены в таблице 30. Таблица 30 – Биохимические показатели функции печени у женщин в контрольной группе на фоне применения КОК и гестагена дезогестрела Параметры АЛТ (ед/л) АСТ (ед/л) Билирубин (мкмоль/л) Контрольная группа, n=90 До начала приема КОК и Через 12 месяцев гестагена дезогестрела 22,38±0,16 22,27±0,13 20,6±0,10 20,8±0,10 10,96±0,01 10,96±0,01 89 У женщин в контрольной группе до начала приема КОК и гестагена дезогестрела биохимические показатели функции печени (АЛТ, АСТ, билирубин) соответствовали физиологической норме. Через 12 месяцев приема гормональных препаратов достоверных изменений этих показателей выявлено не было. Результаты биохимических показателей функции печени у женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом до начала приема гормональных контрацептивов представлены в таблице 31. Таблица 31 – Биохимические показатели функции печени у женщин с заболеваниями щитовидной железы Параметры АЛТ (ед/л) АСТ (ед/л) Билирубин (мкмоль/л) ДНЗ, n=90 21,7±1,3 21,6±0,4 10,6±0,3 АТ, n=100 23,12±0,13 20,6±0,10 10,96±0,01 Контрольная группа, n=70 22,38±0,16 20,6±0,10 10,96±0,01 У женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом биохимические показатели функции печени не имели достоверных различий по сравнению с биохимическими показателями функции печени в крови женщин контрольной группы. В группах женщин с заболеваниями щитовидной железы и в контрольной группе не было выявлено изменений биохимических показателей функции печени, которые повлияли бы на выбор гормональных препаратов. Результаты биохимических показателей функции печени у женщин с аутоиммунным тиреоидитом и диффузным нетоксическим зобом на фоне приема гормональных контрацептивов представлены в таблицах 32 и 33. 90 Таблица 32 – Биохимические показатели функции печени у женщин с диффузным нетоксическим зобом на фоне применения КОК и гестагена дезогестрела Параметры АЛТ (ед/л) АСТ (ед/л) Билирубин (мкмоль/л) ДНЗ, n=90 До начала приема КОК и Через 12 месяцев гестагена дезогестрела 21,7±1,3 22,67±0,13 21,6±0,4 21,0±0,10 10,6±0,3 10,97±0,01 Таблица 33 – Биохимические показатели функции печени у женщин с аутоиммунным тиреоидитом на фоне применения КОК и гестагена дезогестрела Параметры АЛТ (ед/л) АСТ (ед/л) Билирубин (мкмоль/л) АТ, n=100 До начала приема КОК и Через 12 месяцев гестагена дезогестрела приема 23,12±0,13 22,55±0,16 20,6±0,10 21,0±0,10 10,96±0,01 10,95±0,01 В группах женщин с ДНЗ и аутоиммунным тиреоидитом до начала приема гормональных контрацептивов биохимические показатели функции печени соответствовали физиологической норме. В группах женщин с заболеваниями щитовидной железы не было выявлено изменений биохимических показателей функции печени через 12 месяцев приема КОК и гестагена дезогестрела. Таким образом, анализ биохимических показателей функции печени (АЛТ, АСТ, билирубин) в течение 12 месяцев приема гормональных препаратов у женщин в контрольной группе и женщин с заболеваниями щитовидной железы не показал достоверных различий. 91 ГЛАВА 4. OБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ Заболевания щитовидной железы являются частой экстрагенитальной патологией у женщин репродуктивного возраста. ДНЗ – наиболее распространенное заболевание щитовидной железы, закономерно чаще встречающееся в местностях с дефицитом йода в окружающей среде [25, 73,109, 118, 207, 208]. Большое медико-социальное значение йодного дефицита для России обусловлено тем, что более или менее выраженный дефицит йода наблюдается на всей ее территории. Другим частым заболеванием щитовидной железы является АТ – органное аутоиммунное заболевание. Антитиреоидные аутоантитела, как один из признаков заболевания, обнаруживают у 5-26% женщин репродуктивного возраста [15, 38, 44, 49, 209]. По данным Викгемского исследования [258], ежегодный риск развития гипотиреоза у женщин с повышенным уровнем аутоантител к тиреопероксидазе составляет 2,1%. Ежегодно во всех странах мира число женщин, применяющих современные методы контрацепции, увеличивается. Более 120 миллионов женщин используют контрацептивы не комбинированные только для и гестагенные предохранения от гормональные нежелательной беременности, но и с лечебной целью [43, 53, 55,76, 90, 103]. Гестагенные контрацептивы не оказывают отрицательного влияния на углеводный, липидный обмен и систему гемостаза. В связи с этим, они назначаются женщинам, имеющим противопоказания к использованию эстроген- гестагенных препаратов, в частности, артериальную гипертензию, сахарный диабет, а также наличие в анамнезе или в настоящее время тромбоза глубоких вен или тромбоэмболии мелких ветвей легочной артерии [42, 257]. Комбинированные оральные контрацептивы, содержащие эстрогенный компонент, могут негативно влиять на артериальное давление и свертывающую систему крови [42, 53, 104]. КОК с гестагенами, 92 обладающими андрогенным эффектом, могут оказывать анаболическое действие, способствовать увеличению жировой ткани, развитию инсулинорезистентности и нарушение толерантности к глюкозе [256]. Современные низко- и микродозированные контрацептивы, содержащие низкоандрогенные гестагены, не оказывают клинически значимого влияния на гемостаз, массу тела, липидный и углеводный обмен, на реологические показатели крови [256]. У значительной части женщин с патологией щитовидной железы репродуктивная функция сохранена, что требует подбора надежной гормональной контрацепции. Вопросы гормональной контрацепции у женщин с заболеваниями щитовидной железы не являются окончательно разработанными. Известно, что использование низкодозированных и микродозированных контрацептивов при патологии щитовидной железы допустимо. Согласно разработанным ВОЗ [216] медицинским критериям приемлемости методов контрацепции, женщины с патологией щитовидной железы (диффузным нетоксическим зобом, субклиническим гипотиреозом и субклиническим тиреотоксикозом) имеют первую категорию приемлемости для гормональной контрацепции. Это означает, что такие контрацептивные средства, как КОК, гестагенные контрацептивы, в том числе импланты, внутривлагалищные кольца, пластыри и гормонсодержащие внутриматочные средства могут быть назначены данной группе женщин без ограничений. Вместе с тем имеются данные [8] о стимулирующем влиянии эстрогенов на интактные и опухолевые клетки щитовидной железы независимо от уровня тиреотропного гормона в крови. В эксперименте [267] показано, что эстрогены стимулируют пролиферацию тиреоцитов, повышая уровень ТТГ в плазме крови и количество рецепторов к нему в клетках щитовидной железы. При беременности высокий уровень плацентарных эстрогенов в крови приводит к увеличению объема щитовидной железы в среднем на 24,1% [52]. 93 Эстрогены снижают секрецию тиреотропного гормона за счет прямого влияния на клетки аденогипофиза, секретирующие ТТГ [141]. Под влиянием эстрогенов повышается чувствительность тиреоцитов к ТТГ, что может приводить к увеличению функциональной активности щитовидной железы [154, 180]. В ряде исследований [57, 180, 241] показано, что комбинированные гормональные контрацептивы могут способствовать увеличению размеров щитовидной железы у женщин с диффузным нетоксическим зобом. По данным О.М. Моисеевой [57], этот эффект зависит от исходной степени увеличения щитовидной железы. Имеются сведения о стимулирующем влиянии эстрогенов на продукцию антитиреоидных аутоантител у женщин с аутоиммунным тиреоидитом [220, 240]. В отличие от комбинированных препаратов гестагенные контрацептивы не оказывают влияния на структуру и функцию щитовидной железы [57]. С целью оценки влияния гормональных контрацептивов на структуру и функцию щитовидной железы у женщин с диффузным нетоксическим зобом и аутоиммунным тиреоидитом было обследовано 280 женщин репродуктивного возраста без противопоказаний к применению эстрогенгестагенных и гестагенных контрацептивов. В первую основную группу включено 90 женщин, имеющих диффузный нетоксический зоб; во вторую основную группу – 100 женщин с аутоиммунным тиреоидитом. Контрольную группу составили 90 женщин без патологии щитовидной железы. Средний возраст всех обследованных женщин составил 27,5±3,4 года. Средний возраст менархе у обследованных женщин составил 12,6±0,4 года. Все женщины имели регулярный менструальный цикл. Группа больных ДНЗ была разделена на 3 подгруппы. Первую подгруппу составили 40 женщин, которые получали КОК в сочетании с йодидом калия. В двух других подгруппах женщины получали только 94 гормональные контрацептивы: КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (II подгруппа, n=30); гестагенный контрацептив с дезогестрелом (III подгруппа, n=20). В группе женщин с АТ выделено 4 подгруппы. В двух подгруппах женщины получали гормональные контрацептивы в сочетании с тироксином: КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты в сочетании с тироксином (I подгруппа, n=40); гестагенный контрацептив с дезогестрелом в сочетании с тироксином (III подгруппа, n=15). В двух других подгруппах женщины с АТ получали только гормональные контрацептивы: КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (II подгруппа, n=30); гестагенный контрацептив с дезогестрелом (IV подгруппа, n=15). В контрольной группе выделено 3 подгруппы. Первую подгруппу составили 40 женщин, которые получали КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты в сочетании с йодидом калия. В двух других подгруппах женщины получали только гормональные контрацептивы: КОК, содержащие 20 мкг и 30 мкг этинилэстрадиола и различные гестагенные компоненты (II подгруппа, n=30); гестагенный контрацептив с дезогестрелом (III подгруппа, n=20). На протяжении 12 месяцев приема КОК не наблюдалось ни одного серьезного побочного действия, требующего отмены препаратов. В группе больных ДНЗ через 6 месяцев приема КОК сохранялись следующие побочные эффекты: у 4 женщин (5,7%) – эмоциональная лабильность и у 4 женщин (5,7%) – масталгия. Через 6 месяцев приема КОК 5 женщин (7,1%) с аутоиммунным тиреоидитом отмечали повышенную эмоциональную лабильность и 3 женщины (4,2%) – масталгию. Частота побочных эффектов, которые наблюдались на фоне приема КОК у женщин с заболеваниями щитовидной железы, не отличалась от таковой в контрольной группе, были невыраженными и не влияли на общее самочувствие женщин. 95 Через 6 месяцев приема дезогестрела в суточной дозе 75 мкг наблюдались следующие побочные эффекты, не требующие отмены препарата: у 8 женщин (40%) первой группы, у 10 женщин (33,3%) второй группы и 6 (30%) женщин группы контроля отмечались межменструальные кровянистые выделения из половых путей; у 5 больных (25%) первой группы, у 4 больных (13,3%) второй группы и четырех женщин (13,3%) группы контроля не было менструальноподобных кровянистых выделений. Частота побочных эффектов соответствовала данным литературы [94, 176, 228]. Межменструальные кровянистые выделения и отсутствие менструальноподобных кровянистых выделений у женщин с заболеваниями щитовидной железы и у женщин без патологии щитовидной железы на фоне приема гестагена дезогестрела не требовали отмены препарата. Через 12 месяцев применения КОК и гестагенных контрацептивов во всех группах женщин не выявлено достоверного изменения ИМТ. Известно, что на липидный спектр крови оказывает влияние доза эстрогена. Эстрогены увеличивают уровень антиатерогенных и снижают количество атерогенных фракций липопротеидов, гестагенные контрацептивы данного эффекта не оказывают. Некоторые авторы [28, 96] отмечают влияние длительности приема препаратов на спектр липопротеидов. У больных трех обследованных групп до начала приема КОК и гестагена дезогестрела показатели липидного обмена не различались и соответствовали физиологической норме. Анализ липидного спектра крови показал улучшение изучаемых показателей на фоне применения КОК в течение 12 месяцев. У женщин без патологии щитовидной железы, женщин с аутоиммунным тиреоидитом и женщин с ДНЗ на фоне приема КОК происходило достоверное снижение уровня ХС, ТГ, ЛПНП и коэффициента атерогенности (p<0,05). В контрольной группе через 12 месяцев приема КОК уровень холестерина снизился на 3,7 %, ЛПНП – на 3,5% и коэффициента атерогенности – на 3,7%. У женщин I основной группы, наблюдалось снижение показателей общего холестерина на 5,4%, 96 ЛПНП на 3% и коэффициента атерогенности на 4%. Через 12 месяцев приема КОК у женщин II основной группы уровень холестерина снизился на 3,7%, ЛПНП на 2,7% и коэффициента атерогенности на 3,7%. Эти данные согласуются с результатами исследований [28, 55, 150], показавших, что эстрогены обладают защитным действием на артериальную стенку, предотвращая фиксацию ЛПНП. Гестагены в отличие от эстрогенов не оказывают влияния на липидный спектр крови [28, 97]. Действие КОК на метаболизм липидов обусловлено суммарным эффектом компонентов препаратов. Большинство исследователей [28, 55, 92, 166] описывают у женщин, принимающих КОК, повышение триглицеридов и отсутствие значительных изменений ХС и ЛПНП. При анализе показателей жирового обмена у женщин без патологии щитовидной железы, женщин с аутоиммунным тиреоидитом и женщин с ДНЗ не было выявлено изменений показателей липидного спектра крови на фоне применения дезогестрела в течение 12 месяцев. Особенности воздействия гестагенов третьего поколения на метаболизм липидов связаны с их низкой андрогенной активностью [170, 181]. Таким образом, прием низко- и микродозированных комбинированных и гестагенных гормональных контрацептивов не оказывает отрицательного влияния на липидный обмен женщин с патологией щитовидной железы. Известно также, что применение КОК является фактором, повышающим риск развития тромбозов [116, 140, 148, 224, 256]. Установлено, что частота тромбозов глубоких вен при использовании комбинированных оральных контрацептивов зависит от дозы эстрогенного компонента и типа гестагена [77, 146, 147, 224]. Исходя из этого, все больные до начала применения КОК и гестагенных контрацептивов были тщательно обследованы для исключения у них анамнестических и клинических факторов риска тромбоэмболии. У всех обследованных больных изучены показатели коагулограммы и биохимические показатели, характеризующие функцию печени. Через 12 месяцев приема КОК при оценке показателей свертывающей системы крови 97 во всех группах женщин было отмечено достоверное (р<0,05) увеличение уровня фибриногена. У женщин контрольной группы уровень фибриногена в крови достоверно увеличился от 2,93±0,02 г/л до 3,00±0,03 г/л (р<0,05), у женщин I основной группы – от 2,90±0,06 г/л до 3,09±0,06 г/л (р<0,05), у женщин II основной группы – от 2,98±0,02 г/л до 3,10±0,05 г/л (р<0,05). Однако уровень фибриногена в крови через 12 месяцев приема КОК во всех группах не превышал физиологических показателей. По данным литературы [180, 256], прием КОК может сопровождаться незначительным увеличением коагуляционной активности крови. Принципиально важно, что изменения показателей свертывающей системы крови возникают в основном в первый месяц приема КОК, а в дальнейшем не зависят от длительности применения и возвращаются к своему первоначальному уровню уже через 2 месяца после отмены препарата [165, 256]. Биохимические показатели функции печени (билирубин, АЛТ, АСТ) у больных всех групп до лечения соответствовали физиологической норме. После двенадцатимесячного приема КОК и гестагенных контрацептивов как у больных ДНЗ, больных АТ, так и у женщин без заболевания щитовидной железы, изученные биохимические показатели функции печени не ухудшились и достоверно не изменились. Всем трем группам женщин до начала приема КОК и гестагена дезогестрела и через год на фоне их применения было проведено гормональное обследование, включающее определение содержания свободного трийодтиронина, свободного тироксина, тиреотропного гормона, антител к тиреопероксидазе и антител к тиреоглобулину в сыворотке крови. Также дважды, до начала приема гормональных контрацептивов и через год женщинам проводили эхографию щитовидной железы. При ультразвуковом сканировании щитовидной железы у всех групп женщин не было выявлено формировавшихся узлов в щитовидной железе через 12 месяцев применения КОК и гестагена дезогестрела. У женщин без 98 патологии щитовидной железы объем щитовидной железы не изменился под влиянием приема КОК. В группе женщин с ДНЗ, получавших КОК в течение 12 месяцев, отмечено достоверное увеличение объема щитовидной железы, однако сочетанное применение КОК и йодида калия в суточной дозе 100 мкг у женщин с ДНЗ не сопровождалось увеличением объема щитовидной железы. В группе женщин с аутоиммунным тиреоидитом без терапии тироксином через 12 месяцев применения КОК объем щитовидной железы достоверно не изменился, однако на фоне применения тироксина объем щитовидной железы через 12 месяцев достоверно (p<0,05) уменьшился с 16,1±0,3 см³ до 14,2±0,4 см³. Тироксин оказывал на щитовидную железу дозозависимое действие. При приеме 25 мкг тироксина изменений размеров щитовидной железы не отмечено, на фоне приема 50 мкг и более – щитовидная железа достоверно уменьшилась, в большей степени (40%) – при приеме 75 мкг тироксина в сутки. Таким образом, прием комбинированных гормональных контрацептивов у женщин с диффузным нетоксическим зобом в течение 12 месяцев приводит к достоверному увеличению объема щитовидной железы без изменения ее функции. Однако сочетанный прием КОК и йодида калия в суточной дозе 100 мкг предупреждает увеличение объема щитовидной железы у больных диффузным нетоксическим зобом. На фоне приема КОК в сочетании с йодидом калия у женщин с ДНЗ существенного изменения уровня ТТГ в крови не было выявлено. Так, до назначения препаратов женщинам с ДНЗ уровень ТТГ в крови составил 1,9±0,2 мМЕ/л. На фоне приема КОК в сочетании с йодидом калия через 12 месяцев уровень ТТГ в крови достоверно не изменился и составил 1,6±0,4 мМе/л и не отличался от показателя в группе больных ДНЗ, принимавших только КОК (с 2,0±0,1 мМЕ/л до 2,1±0,1 мМЕ/л). При использовании тироксина у женщин с аутоиммунным тиреоидитом в дозе от 25 до 100 мкг в сутки происходило достоверное (p<0,05) снижение уровня ТТГ в крови с 1,9±0,1 мМЕ/л до 1,4±0,2 мМЕ/л. Достоверных различий за 12 месяцев 99 применения КОК уровня ТТГ в крови женщин группы контроля выявлено не было. Имеются данные [133] о повышении уровня ТТГ в сыворотке крови под влиянием эстрогенов в связи с повышением чувствительности тиреотрофов к ТРГ, что может усиливать активности тиреоцитов щитовидной железы. Уровень свободного тироксина и свободного трийодтиронина в крови после применения КОК в течение 12 месяцев у всех групп женщин достоверно не изменился. низкодозированных и Это указывает микродозированных на то, что прием КОК не влияет на функциональную активность щитовидной железы. Однако, по данным литературы [256, 274], эстрогены оказывают дозозависимый эффект, тем самым увеличивают синтез ТСГ в печени, повышают содержание общего тироксина и трийодтиронина в крови. Уровень аутоантител к тиреопероксидазе и к тиреоглобулину у женщин с аутоиммунным тиреоидитом достоверно (p<0,05) снижался через 12 месяцев приема КОК. Эти результаты противоречат данным T.G. Strieder и соавт. [237], указывающим на стимулирующее влияние эстрогенов на продукцию антител к тиреопероксидазе. При применении гестагенного контрацептива с дезогестрелом в течение 12 месяцев у женщин без патологии щитовидной железы и женщин с ДНЗ объем щитовидной железы не изменился. В группе женщин с аутоиммунным тиреоидитом при приеме гестагенного контрацептива с дезогестрелом без терапии тироксином изменения объема щитовидной железы не выявлено, однако на фоне применения тироксина объем щитовидной железы через 12 месяцев достоверно (p<0,05) уменьшился с 16,1±0,3 см3 до 15,2±0,2 см3. Уровень ТТГ в крови женщин группы контроля и женщин с ДНЗ за 12 месяцев применения дезогестрела достоверно не изменился. У женщин с аутоиммунным тиреоидитом, получавших тироксин в суточной дозе 50-75 мкг, произошло достоверное (p<0,05) снижение уровня ТТГ в крови с 2,0±0,1 100 мМЕ/л до 1,5±0,2 мМЕ/л. Уровень свободного тироксина и свободного трийодтиронина в крови на фоне применения дезогестрела в суточной дозе 75 мкг в течение 12 месяцев у всех обследованных групп женщин достоверно не изменился, что указывает на то, что прием гестагена дезогестрела не влияет на функциональную активность щитовидной железы. Эти результаты совпадают с исследованием P.I Bulow. и соавт. [209] показавшими отсутствие влияния гестагенных контрацептивов на функциональное состояние щитовидной железы у здоровых женщин и женщин с аутоиммунным тиреоидитом. Через 12 месяцев приема гестагена дезогестрела у женщин с аутоиммунным тиреоидитом происходило достоверное (p<0,05) снижение уровня аутоантител к тиреопероксидазе. Таким образом, прием микро- и низкодозированных комбинированных и гестагенных гормональных контрацептивов у женщин без тиреоидной патологии не оказывает влияние на объем и функцию щитовидной железы. Сочетанное использование микро- и низкодозированных комбинированных гормональных контрацептивов и йодида калия (100 мкг в сутки) предупреждает увеличение размера щитовидной железы у женщин с диффузным нетоксическим зобом. У женщин с аутоиммунным тиреоидитом прием как комбинированных гормональных контрацептивов, так и гестагена дезогестрела приводит к снижению в крови уровня антитиреоидных аутоантител. Полученные результаты обосновывают безопасность применения микро- и низкодозированных комбинированных гормональных контрацептивов и гестагена дезогестрела у женщин репродуктивного возраста с диффузным нетоксическим зобом и аутоиммунным тиреоидитом. 101 ВЫВОДЫ 1. У женщин без тиреоидной патологии прием микро- и низкодозированных комбинированных и гестагенных гормональных контрацептивов не оказывает влияния на объем и функцию щитовидной железы. 2. Прием комбинированных гормональных контрацептивов у женщин с диффузным нетоксическим зобом в течение 12 месяцев приводит к достоверному увеличению объема щитовидной железы без изменения ее функции. 3. У больных диффузным нетоксическим зобом и аутоиммунным тиреоидитом прием гестагена дезогестрела не оказывает влияния на объем и функцию щитовидной железы. 4. Применение йодида калия в суточной дозе 100 мкг предупреждает увеличение объема щитовидной железы у больных диффузным нетоксическим зобом под влиянием комбинированных гормональных контрацептивов. 5. У женщин с аутоиммунным тиреоидитом прием микро- и низкодозированных комбинированных гормональных контрацептивов в течение 12 месяцев приводит к достоверному снижению в сыворотке крови уровня аутоантител к тиреопероксидазе и к тиреоглобулину, прием гестагена дезогестрела в течение 12 месяцев приводит к достоверному снижению в сыворотке крови только уровня аутоантител к тиреопероксидазе. 6. Прием комбинированных гормональных контрацептивов и гестагена дезогестрела в течение 12 месяцев не вызывает изменений показателей, характеризующих свертывающую систему крови, функцию печени и липидный обмен, у женщин с диффузным нетоксическим зобом и аутоиммунным тиреоидитом. 102 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. У женщин с диффузным нетоксическим зобом с целью контрацепции могут применяться комбинированные низко- и микродозированные эстроген-гестагенные препараты и гестагенные гормональные контрацептивы. Для профилактики увеличения щитовидной железы у больных диффузным нетоксическим зобом на фоне приема микро- и низкодозированных комбинированных гормональных контрацептивов целесообразно использовать йодид калия в суточной дозе 100 мкг. 2. У женщин с аутоиммунным тиреоидитом с целью контрацепции могут применяться комбинированные низко- и микродозированные эстрогенгестагенные и гестагенные препараты. 3. У больных гипотиреозом или тиреотоксикозом целесообразно начинать прием гормональных контрацептивов после нормализации уровня тиреотропного гормона в крови. 103 СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 1. Абашова, Е.И. Наружный генитальный эндометриоз и гормональная недостаточность яичников: автореферат.дис. … канд. мед. наук / Е.И. Абашова. – СПб., 1999. – 23с. 2. Адамян, Л.В. Генитальный эндометриоз. Современный взгляд на проблему / Л.В. Адамян, С.А. Гаспарян. – Ставрополь: СГМА, 2004. 3. Айламазян, Э.К. Регуляция функции яичников у больных диффузным нетоксическим зобом и невынашиванием беременности раннего срока / Э.К. Айламазян, Е.К. Комаров, Е.А. Михнина // Вестник Российской ассоциации акушеров-гинекологов. – 1997. – № 1. – С. 17-19. 4. Алиева, Д.А. Гормональная контрацепция в программе предгравидарной подготовки женщин с нарушением репродуктивной функции, обусловленной заболеваниями щитовидной железы / Д.А. Алиева, М.Ш. Садыкова // Проблемы репродукции. – 2002. – № 5. – С. 65-68. 5. Бабичев, В.Н. Нейроэндокринология репродуктивной системы / В.Н. Бабичев // Проблемы эндокринологии. – 1998. – № 1. – С. 3-12. 6. Бабичев, В.Н. Современные представления о механизме взаимодействия гипоталамо-гипофизарно-тиреоидной и гипоталамо-гипофизарно- гонадной систем в организме / В.Н. Бабичев, В.М. Самсонова // Успехи современной биологии. – 1983. – Т. 95, № 2. – С. 281-292. 7. Бакшеев, Н.С. Влияние пролана, прогестерона и фолликулина на функцию щитовидной железы / Н.С. Бакшеев, Ю.И. Бецанич // Доклады и сообщения Ужгородского гос. университета. Серия мед. I. – Ужгород, 1957. – С. 6-8. 8. Баранова, характеристика О.В. Сравнительная узлового зоба, аденомы клинико-морфологическая щитовидной железы и аутоиммунного тиреоидита: автореф. дис. … кан. мед. наук / О.В. Баранова. – М., 1999. – 23с. 104 9. Баскаков, В.П. Клиника и лечение эндометриоза / В.П. Баскаков. – Л.: Медицина, 1990. – 238с. 10. Бескровный, С.В. Состояние гипоталамо-гипофизарно-овариальной системы у женщин с бесплодием, обусловленным гипофункцией щитовидной железы: автореф. дис. … канд. мед. наук / С.В. Бескровный. – СПб., 1981. – 29с. 11. Берштейн, Л.М. Рак щитовидной железы: эпидемиология, эндокринологи, факторы и механизмы канцерогенеза / Л.М. Берштейн / Практическая онкология. – 2007. –Т.8(1). – С. 1-8. 12. Болдырева, С. Н. Прогнозирование гиперпластических процессов эндометрия у женщин репродуктивного периода при патологии щитовидной железы: автореф. дис. … канд. мед. наук / С. Н. Болдырева. – Барнаул, 2001. – 35с. 13. Бохман, Я.В. Руководство по онкогинекологии / Я.В. Бохман. – СПб. Фолиант, 2002. – 542с. 14. Будрина, Л.М. Особенности состояния молочных желез и гормонального статуса у больных с доброкачественными гиперпластическими заболеваниями внутренних половых органов / Л.М. Будрина // Маммология. – 1991. – № 1. – С. 12-19. 15. Бурумкулова, Ф.Ф. Тактика ведения беременных с аутоиммунными заболеваниями щитовидной железы / Ф.Ф. Бурумкулова, В.А. Петрухин, В.М. Гурьева // Материалы II Российского форума «Мать и дитя». – М., 2000. – С. 27-28. 16. Варламова, Т.М. Репродуктивное здоровье женщины и недостаточность функции щитовидной железы / Т.М. Варламова, М.Ю. Соколова // Гинекология. – 2004. – Т.6, № 1. – С. 29-31. 17. Варламова, Т.М. Состояние гипоталамо-гипофизарно-гонадной системы у девочек пре- и пубертатноговозраста с диффузным токсическим зобом: автореф. дис. … кан. мед. наук / Т.М. Варламова. – М., 1986. – 24 с. 105 18. Витамин Е и малоновый диальдегид в сыворотке крови у больных тиреотоксикозом / Ю.К. Данис [и др.] // Проблемы эндокринологии. – 1990. – № 5. – С. 21-23. 19. Вихляева, E.М. Руководство по эндокринной гинекологии / Е.М. Вихляева. – М.: МИА, 2006. – 214с. 20. Власова, Т.А. Особенности течения беременности, родов и неонатального периода при заболеваниях щитовидной железы у жительниц Карелии : автореф. дис. ... кан. мед. наук / Т.А. Власова. – СПб., 1999. – 23с. 21. Волобуев, А. И. Результаты обследования женщин с сочетанными доброкачественными гиперпластическими процессами молочных желез и половых органов / А. И. Волобуев, В. А. Синицин, В. А. Малышева // Акушерство и гинекология. – 2003. – № 5. – С. 27-31. 22. Гвоздева, О.В. Иммунитет, гемостаз, перекисное окисление липидов и лейкоцитарно-эритроцитарно-тромбоцитарные взаимоотношения при диффузном токсическом зобе: автореф. дис. … д-ра. мед. наук / Т.А. Власова. – Чита, 2008. – 132с. 23. Гипотиреоз и гиперпролактинемия / В.В. Потин [и др.] // Акушерство и гинекология. – 1989. – № 10. – С.40-43. 24. Гипотиреоз и репродуктивная система женщины / Н.Н. Ткаченко [и др.] // Материалы II Российского форума "Мать и дитя". – М., 2000. – С. 308309. 25. Глиноер, Д. Функция щитовидной железы матери и новорожденного при легкой йодной недостаточности / Д. Глиноер // Тироид Россия: сборник лекций. – М., 1997. – С. 19-26. 26. Дедов, И.И. Персистирующая галакторея-аменорея: Этиология, патогенез, клиника, лечение / И.И. Дедов, Г.А. Мельниченко. – М., 1985. – 256с. 106 27. Джанашия, П.Х. Гипотиреоз и артериальная гипертензия: нерешенные вопросы патогенеза, диагностики и фармакотерапии / П.Х.Джанашия, Г.Б. Селиванова // Кардиоваскулярная терапия и диагностика. – 2004. – № 3. – С. 125-132. 28. Джангндзе, М.А. Влияние оральных контрацептивов 2 и 3 поколений на липидный обмен у практически здоровых женщин / М.А. Джангидзе // Мед. новости Грузии. – 2000. – № 2. – С.38-42. 29. Диагностика и лечение узлового зоба / И.И. Дедов [и др.]. – Петрозаводск.: Интел Тек, 2003. – 56с. 30. Диагностическое значение пробы с экзогенным эстрадиолом у больных нормогонадотропной недостаточностью яичников / В.В. Потин [и др.] // Клинико-лабораторный консилиум. – 2003. – № 1. – С. 21-26. 31. Дильман, В.М. Эндокринологическая онкология / В.М. Дильман. – Л.: Медицина, 1983. – 408с. 32. Доброхотова, Ю.Э. Современная оценка предменструального синдрома и предменструальных дисфорических расстройств / Ю.Э. Доброхотова, Г.М. Дюкова, К.Б. Логинова // Вестник Российского государственного медицинского университета. –2010. – № 6. – С. 40-44. 33. Дымарский, Л.Ю. Рак молочной железы / Л.Ю. Дымарский. – М.: Медицина, 1980. – 193с. 34. Ильин, А.Б. Молочная железа - орган репродуктивной системы женщины / А.Б. Ильин, С.В. Бескровный // Журнал акушерства и женских болезней. – 2000. – Т. XLIX, N 2. – С. 51-53. 35. Иммунологические аспекты аутоиммунного тиреоидита и дефицит магния у женщин репродуктивного возраста на фоне гормональной контрацепции / Г.Т. Сухих [и др.] // Вопросы гинекологии, акушерства и перинатологии. – 2007. – Т. 6, № 5. – С. 97-101. 107 36. Йен, С.К. Щитовидная железа и репродукция / С.К. Йен, Г.Б. Джаффе // Репродуктивная эндокринология: пер. c англ. – М.: Медицина, 1998. – С. 587-612. 37. Кахтурия, Ю.Б. Особенности заместительной гормональной терапии у женщин с эндокринными заболеваниями / Ю.Б. Кахтурия, Г.А. Мельниченко, Т.Е. Чазова // РМЖ. – 2000. – Т. 8, №1. – С. 764-767. 38. Кеттайл, В.М. Патофизиология эндокринной системы: пер. с англ. / В.М. Кеттайл, Р.А. Арки. – СПб.: Невский Диалект, 2001. – 84с. 39. Клячко, В.Р. Исследования по взаимодействию между щитовидной железой и яичниками / В.Р. Клячко // Бюлл. эксперим. биол. мед. – 1937. № 3. – С. 299-301. 40. Коган, И.Ю. Гестагенные контрацептивы и мастопатия / И.Ю. Коган, Е.В. Мусина // Журнал акушерства и женских болезней. – 2009. – Т. LVIII, №6. – С.70-75. 41. Контрацепция у женщин с аутоиммунной патологией / А.Н. Акопян [и др.] // Акушерство и гинекология. – 2009. – № 5. – С. 48-51. 42. Корж, Е.В. Влияние синтетических эстрогенов и прогестагенов и прогестагенов на изменения периферического капиллярного кровотока / Е.В. Корж // Научно-медицинский вестник Центрального Черноземья. – 2009. – № 38. – С. 72-73. 43. Корхов. В.В. Медицинские аспекты применения контрацептивных препаратов / В.В. Корхов. – СПб., 1996. –170с. 44. Крихели, И.О. Патогенез, диагностика и прогноз послеродового тиреоидита: автореф. дис. …канд. мед. наук / И.О. Крихели. СПб. –, 2001. 45. Кузнецова, И.А. множественными Состояние щитовидной гиперпластическими железы у процессами женщин с органов репродуктивной системы: автореф. дис. … канд. мед. наук / И.А. Кузнецова. – СПб, 2009. – 29с. 108 46. Кузнецова, И.А. Состояние множественными репродуктивной щитовидной железы гиперпластическими системы / И.А. у женщин процессами Кузнецова органов Вестник // с Санкт- Петербургского университета. Медицина. – 2009. – № 3. – С. 198-203. 47. Кузнецова, И.В. Комплексный подход к терапии женщин с гиперпластическими процессами эндометрия и ожирением / И.В. Кузнецова, М.В. Якутова // Акушерство и гинекология. – 2007. – № 6. – С.59-63. 48. Кузьмин, И.А. Состояние тиреоидной и репродуктивной функции у больных с доброкачественными заболеваниями и раком молочной железы: автореф. дис. … кан.мед.наук / И.А. Кузьмин. – Л., 1991. – 23с. 49. Курмачева, Н.А. репродуктивного предгравидарной Заболевания возраста щитовидной (принципы подготовки): железы у диагностики, информационное женщин лечения, письмо / Н.А. Курмачева, О.П. Аккузина. – Саратов, 2004. 50. Лекарева, Т.М. Предменструальное дисфорическое расстройство: роль серотонина в диагностике и лечебной тактике / Т.М. Лекарева, М.А. Тарасова // Акушерство и гинекология. – 2010. – N 3. – С.55-58. 51. Лобова, Т.А. Гипоталамо-гипофизарно-тиреоидная система у больных с дисфункциональными маточными кровотечениями и аменореей: автореф. дис. … канд. мед. наук / Т.А. Лобова. – М., 1990. 52. Логинов, А.Б. Влияние диффузного нетоксического зоба на течение и исход беременности.: автореф. дис. … канд.мед.наук / А.Б. Логинов. – М., 2003. 53. Мануйлова, И.А. Современные контрацептивные средства / И.А. Мануйлова. – М., 1993. – 195с. 54. Манухин, И.Б. Клинические лекции по гинекологической эндокринологии / И.Б. Манухин, Л.Г. Тумилович, М.А. Геворкян. – М: МИА, 2001. – 247с. 109 55. Межевитинова, Е.А. Прогестагены в контрацепции / Е.А. Межевитинова, // Гинекология. - 2001. - Т3, №2. - С. 36-40. 56. Мельниченко, Г.А. Заболевания щитовидной железы во время беременности. Диагностика, лечение, профилактика: пособие для врачей / Г.А. Мельниченко, В.В. Фадеев, И.И. Дедов. – М: Мед. эксперт. пресс, 2003. 57. Моисеева, О.М. Регулирование репродуктивной функции оральными контрацептивами у женщин с эутиреоидной гиперплазией щитовидной железы I-II степени: автореф. дис. … канд. мед. наук / О.М. Моисеева. – Ташкент, 1987. 58. Молчанова, Н.В. Изменения иммунной системы у женщин с нарушениями менструальной функции при патологии щитовидной железы: автореф. дис. … канд. мед. наук / Н.В. Молчанова. – Пермь, 1998. 59. Мохорт, Т.В. Функциональное состояние ряда гормональных систем при патологии щитовидной железы: автореф. дис. ... канд. мед. наук / Т.В. Мохорт. – Минск, 1983. – 25с. 60. Мурашко, Л.E. Гипофункция щитовидной железы и беременность / Л.E. Мурашко, Г.А. Мельниченко, Н.И. Клименченко // Проблемы беременности. – 2000. – №2. – С. 3-11. 61. Мусаева, Т.Т. Размеры и функциональное состояние щитовидной железы новорожденных от женщин с аутоиммунным тиреоидитом / Т.Т. Мусаева // Журнал акушерства и женских болезней. – 2008. – Т. LVII, № 3. – С. 41-44. 62. Мусаева,Т.Т. Влияние аутоиммунного тиреоидита на течение и исход беременности: автореф. дис. … канд.мед.наук / Т.Т. Мусаева. – М., 2009. 63. Немченко, О.И. Влияние плазмафереза на состояние иммунной и нейроэндокринной систем у больных хроническим сальпингоофоритом 110 с нарушениями репродуктивной функции: автореф. дис. ... канд. мед. наук / О.И. Немченко. – М., 1999. 64. Ниаури, Д.А. Репродуктивное здоровье женщины и недостаточность функции яичников / Д.А. Ниаури, Л.Х. Джемлиханова, А.М. Гзгзян // Журнал акушерства и женских болезней, 2010. – N 1. – С. 84-89. 65. Никонова,С.И. Особенности гинекологических заболеваний у женщин репродуктивного возраста с аутоиммунным тиреоидитом: автореф. дис. … канд. мед. наук / С.И. Никонова. – М., 2003. 66. Объем и функциональное состояние щитовидной железы новорожденных от матерей с диффузным токсическим зобом / Ю.С. Ловкова [и др.] // Журнал акушерства и женских болезней. – 2011. – Т. 60, № 3. – С. 102-105. 67. Опыт лечения больных с миомой матки при различных функциональных состояниях щитовидной железы / М.П. Ахмедова [и др.] // Российский вестник акушера-гинеколога. – 2003. – № 1. – С.43-44. 68. Особенности морфофункционального состояния миокарда у больных гипотиреозом / И.В. Гурьева [и др.] // Терапевтический архив. – 1990. – Т. 62, № 8. – С.105-108. 69. Пагаева, Ф.П. Артериальная гипертензия при гипотиреозе: характер степени тяжести и состояния ренин-альдостероновой системы / Ф.П. Пагаева, Г.Б. Селиванова, П.Х. Джанашия // Российский кардиологический журнал. – 2004. – № 3 . – С. 14-20. 70. Паршин, B.C. Ультразвуковая диагностика аутоиммунного тиреоидита / B.C. Паршин, А.Ф. Цыб, Г.В. Нестайко // Ультразвуковая диагностика. 1997. – № 2. – С. 58-67. 71. Патогенез гормональной недостаточности яичников у женщин с первичным гипотиреозом / Н.Н. Ткаченко [и др.] // Вестник российской ассоциации акушеров гинекологов. – 1997. – № 3. – С.37.-40. 111 72. Патогенетические механизмы развития недостаточности яичников у больных с первичным гипотиреозом / А.М. Гзгзян [ и др.] // Актуальные вопросы физиологии и патологии репродуктивной функции женщины: мат. XXV науч. сессии НИИАГ / ред. Э.К. Айламазян. – СПб.,1997. – С. 46-48. 73. Патология щитовидной железы и беременность / В.В. Фадеев [и др.] // Врач. – 2008. – N 5. – С. 11-16. 74. Петунина, Н.А. Сердечно-сосудистая система при заболеваниях щитовидной железы / Н.А. Петунина // Сердце. – 2002. – Т. 2, № 6. – С. 273-279. 75. Потемкина, Е.Е. Клиническая лабораторная диагностика / Е.Е. Потемкина, Л.M. Манукян, Т.Ю. Иванец. – М., 1996. – С.24-26. 76. Прилепская, В.Н. Контрацепция у женщин с патологией щитовидной железы / В.Н. Прилепская // Руководство по контрацепции. – М.: МЕД пресс-информ, 2006. – 307с. 77. Применение оральных контрацептивов и систем гемостаза при различных состояниях щитовидной железы / Ф.Т. Файзиева [и др.] // Медицинский журнал Узбекистана. – 1988. – № 1. – С. 51-53. 78. Профилактика йоддефицитных заболеваний во время беременности / Л.Е. Мурашко [и др.] // РМЖ. – 2003. – Т.11, № 1. – С. 7-10. 79. Раждабова, Ш.Ш. К вопросу влияния патологии щитовидной железы на гестацию женщин / Ш.Ш. Раждабова // Сборник научных трудов ДГМА. Юбилейный выпуск. Т.1. – Махачкала, 2002. – С. 52-54. 80. Различные аспекты применения нового низкодозированного контрацептива Жанин / В.Н. Прилепская [и др.] // Гинекология. – 2003. – № 5. – С. 24-27. 81. Рафибеков, А.Д. Влияние гипофункции щитовидной железы на возникновение доброкачественных опухолей и гиперпластических 112 процессов женской репродуктивной системы: автореф. дис. … канд. мед. наук / А.Д. Рафибеков. – Бишкек, 2003. – 21с. 82. Реброва, О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA/ О.Ю. Реброва. – М.: Медиа Сфера, 2002. – 312с. 83. Роль патологии щитовидной железы в развитии гиперпластических процессов в эндометрии / B.C. Горин [и др.] // Вестник Российской ассоциации акушеров-гинекологов. – 2000. – № 4. – С. 24-27. 84. Роткина, И.Е. Гиперпластические процессы и предрак эндометрия / И.Е. Роткина. – Новокузнецк, 1993. – 203с. 85. Руководство по клинической эндокринологии / ред. Н.Т. Старкова. – СПб., Питер, 1996. 86. Савицкий, Г.А. Локальная гормонемия матки и гиперпластические процессы эндометрии / Г.А.Савицкий, Ф.А. Свешникова // Акушерство и гинекология. – 1985. – № 11. – С. 37-44. 87. Семиглазов, В.Ф. Мастопатия – угроза малигнизации? / В.Ф. Семиглазов // Terra Medica Nova. – 2005. – № 2. – С. 52-56. 88. Серебренникова, К.Г Клиническая оценка низкодозированных контрацептивов у девушек-подростков / К.Г. Серебренникова // Материалы II Российского форума «Мать и дитя». – М., 2000. – 285с. 89. Серов, В.Н. Гинекологическая эндокринология / В.Н. Серов, В.Н. Прилепская, Т.В. Овсянникова. – М.: МЕДпресс-информ, 2004. 90. Серов, В.Н. Новые возможности лечебного действия комбинированных оральных контрацептивов: клиническая лекция / В. Н.Серов, С.В. Никитин // Русский медицинский журнал. – 2000. – Т. 2, N 6. – С. 180133. 91. Сидоренко, Л.Н. Мастопатия: психосоматические аспекты / Л.Н. Сидоренко. – 2-е изд. –Л.: Медицина,1991. – 264с. 113 92. Сметник, В.П. Неоперативная гинекология: рук. для врачей / В. П. Сметник, Л. Г. Тумилилович. – М.: МИА, 2003. – 558с. 93. Соколов, Е.И. Клиническая иммунология / Е.И. Соколов. – М.: Медицина, 1998. 94. Соловьев, В.Г. Влияние эстрогенов и прогестагенов на биохимический компонент гемостаза, тромбоциты, непрерывное внутрисосудистое свертывание крови и толерантность к тромбину: коррекция их эффектов антиоксидантами / В.Г. Соловьев, А.Ш. Бышевский, И.А. Карпова // Биомедицинская химия. – 2012. – № 4. – С.429-437. 95. Состояние гипоталамо-гипофизарной системы у больных с многоузловым коллоидным эутиреоидным зобом / А.Д.Макаров, Ю.М. Кеда, И.В.Крюкова [и др.] // Проблемы эндокринологии. – 1994. – № 3. – С. 22-25. 96. Состояние углеводного и липидного обмена у женщин при применении комбинированных оральных контрацептивов / В.А. Зигизмунд [и др.] // Вопросы охраны материнства и детства. – 1981. – №1. – С. 56-58. 97. Состояние щитовидной железы у больных с доброкачественными опухолями и гиперпластическими процессами женских половых органов / С.В. Руднев [и др.] // Акушерство и гинекология. – 2000. – № 2 – С. 4143. 98. Состояние щитовидной железы у пациенток с патологией эндометрия / И.Ю. Ганжий [и др.] // Актуальні питання медичної науки та практики. – 2012. – Т. 2, № 79. – С. 139-145. 99. Сперофф, Л. Клиническое руководство по контрацепции: пер. с англ. / Л. Сперофф, Дарни Ф.Д.; ред. перевода В.Н. Прилепская. – М.: БИНОМ, 2009. – 432с. 100. Стрижова, Н. В. Функциональное состояние щитовидной железы у больных с патологией эндометрия в пременопаузе / Н.В. Стрижова, Г.А. Мельниченко // Акушерство и гинекология. –2002. – № 5. – С. 24-28. 114 101. Сулкарнаева, Г.А. Внутрисосудистое свертывание крови, толерантность к тромбину, активность тромбоцитов и интенсивность липидпероксидации при гипер - и гипотиреозе: автореф. дис. … д-ра мед. наук / Г.А. Сулкарнаева. – Тюмень, 2007. – 44 с. 102. Тарасова, М.А. Консультирование по вопросам репродуктивного здоровья и выбору метода контрацепции / М.А. Тарасова, К.А. Шаповалова, Т.М. Лекарева; ред. Э.К. Айламазян. – СПб.: Изд-во Н-Л, 2008. – 115с. 103. Татарчук, Т.Ф. Репродуктивная система женщин и нарушения функции щитовидной железы / Т.Ф. Татарчук, В.А. Олейник, Т.О. Мамонова // Вестник ассоциации акушеров-гинекологов Украины. – 2000. – № 4. – С. 16-23. 104. Телкова, И.Л. Роль тиреоидных гормонов в регуляции сердечной деятельности / И.Л. Телкова, Р.С. Карпов // Клиническая медицина. – 2004. – № 1. – С. 12-17. 105. Теппермен, Д. Физиология обмена веществ и эндокринной системы / Д. Теппермен, X. Теппермен. – М.: Мир, 1989. 106. Тотоян, Э.С. Репродуктивная функция женщин при патологии щитовидной железы / Э.С. Тотоян // Акушерство и гинекология. – 1994. – № 1. – С. 8-10. 107. Трубникова, Л.И. Эндокринные механизмы патогенеза миомы матки и дифференциальные методы терапии и диспансеризации больных: автореф. дис. … д-ра мед. наук / Л.И. Трубникова. - Душанбе, 1987. – 35с. 108. Фадеев, В.В. Аутоиммунные заболевания щитовидной железы и беременность / В.В. Фадеев, С.В. Лесникова // Проблемы эндокринологии. – 2003. – Т. 49, № 2. – С. 23-31. 109. Фадеев, В.В. Йоддефицитные и аутоиммунные заболевания щитовидной железы в регионе легкого йодного дефицита.: автореф. дис. … д-ра мед. наук / В.В.Фадеев. – М., 2004. – 20с. 115 110. Хайт, Б.М. Некоторые обменно-гормональные нарушения у больных с гиперпластическими процессами эндометрия / Б.М. Хайт // Акушерство и гинекология. – 1988. – № 5. – С. 30-33. 111. Хомасуридзе, А.Г. Функция эндокринных желез, печени, почек при гормональной контрацепции / А.Г.Хомасуридзе // Актуальные вопросы охраны здоровья женщины, матери и новорожденного. – М. 1980. – С. 33-38. 112. Чистякова, Д.С. Роль овариальной недостаточности в патогенезе невынашивания беременности: автореф. дис. … канд. мед. наук / Д.С. Чистякова. – СПб., 2009. – 24с. 113. Шаповалов, П.Я. Гемостаз, взаимодействие тромбин-фибриноген и липопероксидация при гипотиреозе / П.Я. Шаповалов, Г.А. Сулкарнева // Фундаментальные исследования. – 2005. – № 2. – С. 38-39. 114. Шустов, С.Б. Особенности гемодинамики при нарушениях функции щитовидной железы / С.Б. Шустов, В.А. Яковлев, В.В. Яковлев // Клиническая медицина. – 2000. – № 8. – С. 64 -65. 115. Щеплягина, Л.A. Медико-социальные последствия роста зобной эндемии для детей и подростков / Л.A. Щеплягина // Тиреоид России: сборник лекций. – М., 1997. – С. 34-37. 116. Щитовидная железа и беременность / Л.Е. Мурашко [и др.] // Проблемы беременности. – 2000. – № 1. – С. 7 - 10. 117. Щитовидная железа и репродуктивная система женщины: пособие для врачей / В.В. Потин [и др.]. – СПб., Изд-во Н-Л, 2008. – 44с. 118. Эндокринная гинекология. Клинические очерки. – Киев, 2003. –303с. 119. Эседова, А.Э. Гормональный профиль у женщин с гипотиреозом в пременопаузе в республике Дагестан / А.Э. Эседова, Т.Х. Хашаева // Южно-Российский медицинский журнал. – 1998. – № 1. – С. 24-29. 120. Ярмолинская, М.И. Генитальный эндометриоз: влияние гормональных, иммунологических и генетических факторов на развитие, особенности 116 течения и выбор терапии: авт. дис. … д-ра мед.наук / М.И .Ярмолинская. – СПб., 2009. – 40с. 121. A randomized cross-over comparison of two low-dose oral contraceptives upon hormonal and metabolic parameters: I. Effects on sexual hormone levels / Kuhl H. [el al.] // Contraception. – 1985. – Vol. 31, N 6. – P. 583-593. 122. A trial of contraceptive methods in women with systemic lupus erythemasosus / J. Sanches-Guerrero [et al.] // N. Engl. J. Med. – 2005. - Vol. 353, N 24. – P. 2539-2549. 123. Accuracy of free thyroxine measurements across natural ranges of thyroxine binding to serum proteins / R. Wang [et al.] // Thyroid. – 2000. – Vol. 10, N 1. – P. 31-39. 124. Aeppli, H. Relations between thyroid and ovarian function / H. Aeppli // Gynaecoloqia. – 1954. – Vol. 137, N 4. – Р. 238-241. 125. Akande, E.O. Plasma oestrogen and luteinizing hormone concentrations in thyrotoxic menstrual disturbance / E.O. Akande, T.D. Hockaday // Proc. R Soc. Med. – 1972. – Vol. 65, N 9. – Р. 789-790. 126. Amsterdam, L.L. Anastrazole and oral contraceptives: a novel treatment for endometriosis / L.L. Amsterdam // Fertil. Steril. – 2005. – Vol. 84, N2. – P. 300-304. 127. Andersen, J. Factors in fibroid growth / J. Andersen // Baillieres Clin. Obstet. Gynaecol. – 1998. – Vol. 12, N 2. – P. 225-243. 128. Andersen, J. Growth factors and cytokines in uterine leiomiomas / T. Andersen // Repr. Endocrinology. – 1996. – Vol. 14, N 3. – P. 270-280. 129. Arafah, B.M. Increased need for thyroxine in women with hypothyroidism during estrogen therapy / B.M. Arafah // N. Engl. J. Med. – 2001. – Vol. 344, N 23. – P. 1743-1749. 130. Askanase, A.D. Estrogen therapy in systemic lupus erythemasosus / A.D. Askanase // Treat Endocrin. – 2004. – Vol. 3, N 1. – P. 19-26. 117 131. Assessment of pituitary gonadotropin reserve using luteinizing hormonereleasing hormone (LRH) in states of altered thyroid function / L.A. Distiller [et al.] //J. Clin. Endocrinol. Metab. – 1975. – Vol. 40, N 3. – Р. 512-515. 132. Aviram, M. Lipid and lipoprotein pattern in thyroid dysfunction and the effect of therapy / M. Aviram, R. Luboshitzky, J. Brook // Clin. Biochem. – 1982. – Vol. 15, N 1. – P. 62-66. 133. Banu, K. S. Testosterone and estradiol have specific differential modulatory effect on the proliferation of human thyroid papillary and follicular carcinoma cell lines independent of TSH action / K.S. Banu, P. Govindarajulu, M.M. Aruldhas // Endocr. Pathol. – 2001. – Vol. 12, N 3. – P. 315-327. 134. Banu, K. S. Testosterone and estradiol up-regulate androgen and estrogen receptors in immature and adult rat thyroid glands in vivo / K.S. Banu, P. Govindarajulu, M.M. Aruldhas // Steroids. – 2002. – Vol. 67, N 13-14. – P. 1007-1014. 135. Beagley, K.W. Regulation of innate and adaptive immunity by the female sex hormones oestradiol and progesterone / K.W. Beagley, C.M. Gockel // FEMS Immunol. Med. Microbiol. – 2003. – Vol. 38, N 1. – P. 13-22. 136. Blood coagulation and fibrinolysis in patients with hyperthyroidism / C. Erem [et al.] // J. Endocrinol. Invest. – 2002. – Vol. 25, N 4. – P. 345-350. 137. Boas, M. Environmental chemicals and thyroid function: an update / M. Boas, K.M. Main, U. Feldt-Rasmussen //Curr. Opin. Endocrinol. Diabetes Obes. 2009. – Vol. 16, N 5. – P. 385-391. 138. Bohnet, H.G. Subclinical hypothyroidism in infertility / H.G. Bohnet, K. Fiedler, К.A. Liedenbeerger // Lancet. – 1981. – Vol 5. – P. 1278. 139. Brown, C.L. Pathology of the cold nodule / C.L. Brown // Clin. Endocrinal. Metabol. – 1981. – Vol. 10, N 3. – P. 235-245. 140. Can subclinical hypothyroidism explain some sudden deaths due to pulmonary embolism without evident risk factors? / M. Hostiuc [et al.] // Med. Hypotheses. – 2011. – Vol. 76, N 6. – P. 855-857. 118 141. Candanedo-Gonzalez, F.A. Postmenopause is associated with recurrence of differentiated papillary thyroid carcinoma / F.A. Candanedo-Gonzalez, A. Gamboa-Dominguez // Med. Hypotheses. – 2007. – Vol. 69, N 1. – Р. 209213. 142. Characterization оf thyroid fibrosis in a murine model of granulomatous experimental autoimmune thyroiditis / K. Chen [et al.] //J. Leukoc. Biol. – 2000. – Vol. 68, N 6. – P. 828-835. 143. Clinical and biochemical features of muscic dysfunction in subclinical hypothyroidism / F. Monzani [et al.]//J. Clin. Endocrinol. Metab. – 1997. – Vol. 82, N10. – P. 3315-3318. 144. Clinical chemistry alterations in pregnancy and oral contraceptive use / R.H. Knopp [et al.] // Obstet. Gynecol. – 1985. – Vol. 66. – P. 682-690. 145. Coleman, M.E. Porcine somatotropin (pST) increases IGF-I mRNA abundance in liver and subcutaneous adipose tissue but not in skeletal muscle of growing pigs / M. Coleman, L. Russel, T. Etherton // J. Anim. Sci. – 1994. – Vol. 72, N 4. – P. 918-924. 146. Comp, P. C. Should coagulation tests be used to determine which oral contraceptive users have an increased risk of thrombophlebitis? / P.C. Comp // Contraception. – 2006. – Vol. 73, N 1 – P. 4-5. 147. Components of the fibrinolytic system are differently altered in moderate and severe hypothyroidism / R. Chadarevian, E. Bruckert, L. Leenhardt [et al.] // J. Clin .Endocrinol. Metab. – 2001. – Vol. 86, N 2. – P. 732-737. 148. Constitutive and inducible expression and regulation of vascular endothelial growth factor / K. Xei [et al.] // Cytokine and Growth Factor Reviews. – 2004. – Vol. 15, N 5. – P. 297-324. 149. Davis, L.B. The effect of infertility medication on thyroid function in hypothyroid women who conceive / L.B. Davis, R.B. Lathi, M.H. Dahan // Thyroid. – 2007. – Vol. 17, N 8. – P. 773-777. 119 150. Day 3 serum inhibin В and FSH and age as predictors of assisted reproduction treatment outcome / M. Creus [et al.] // Hum. Reprod. 2000. – Vol. 15, N 11. – P. 2341-2346. 151. Decidualization of the human endometrium: mechanisms, functions, and clinical perspectives / B. Gellersen [et al.] // Semin. Reprod. Med. – 2007. – Vol. 25, N 6. – Р. 445-453. 152. Denef, J.F. Experimental goiter formation / J.F. Denef // Bull. Mem. Acad. R. Med. Belg. – 1989. – Vol. 144,N 5-7. – Р. 313-318. 153. Derangement of Kurffer cell functioning and hepatotoxicity in hyperthyroid rats subjected to acute iron overload / X. Boisier [et al.] // Redox Rep. – 1999. – Vol. 4, N 5. – P. 243-250. 154. Diagnostic value of estrogen receptors in thyroid lesions / M.Vaiman [et al.] // Medical Science Monitor. – 2010. – Vol. 16, N 7. – P. 203-207. 155. Doufas, A.G. The hypothalamic-pituitary-thyroid axis and the female reproductive system / A.G. Doufas, G. Mastorakos // Ann. N.Y. Acad. Sci. 2000. – Vol. 900. – Р. 65-76. 156. Druckmann, R. IGF-1 in gynaecology and obstetrics: update 2002 / R. Druckmann, U.D. Rohr // Maturity. – 2002. – Vol. 41, N 1. – P.65-83. 157. Duntas, L.H. Thyroid disease and lipids / L.H. Duntas // Thyroid. – 2002. – Vol. 12, N 4. – P. 287-293. 158. Effect of estrogen therapy for 1 year on thyroid volume and thyroid nodules in postmenopausal women / G. Ceresini [et al.] // Menopause. – 2008. – Vol. 15, N 2. – Р. 326-331. 159. Effect of glucocorticoids and oestrogen on interleukin- 6 production by human thyrocytes from patients with Graves disease and toxic multinodular goiter and from HTori3 cells / T.H. Jones [et al.] // Eur. J. Endocrinol. – 1997. – Vol. 137, N 4. – P. 429-432. 120 160. Effect of small doses of iodine on thyroid function in patients with Hashimoto's thyroiditis residing in an area of mild iodine deficiency / W. Reinhardt [et al.] // Eur. J. Endocrinol. – 1998. – Vol. 139, N 1. – P. 23-28. 161. Effect of testosterone propionate on the thyroid of young male rats / B. Mukerji, S.N. Roy, S.K. Roy // Indian J. Med. Res. – 1956. – Vol. 44, N 3. – P. 427-432. 162. Effect of thyroid state on lipid peroxidation, antioxidant defences, and susceptibility to oxidative stress in rat tissyes / P. Venditti [et al.] // J. Endocrinol. – 1996. – Vol. 155, N 1. – P. 151-157. 163. Efficacy and safety of a novel oral contraceptive based on oestradiol (oestradiol valerate/dienogest): A Phase III trial / S. Palacios [et al.] // Eur. J. Obstet. Gynecol. – 2010. – Vol. 149, N 1. – P. 57-62. 164. Efficacy and tolerability of a monophasic combined oral contraceptive containing nomegestrol acetate and 17β-oestradiol in a 24/4 regimen, in comparison to an oral contraceptive containing ethinylestradiol and drospirenone in a 21/7 regimen / D. Mansour [et al.] // Eur. J. Contracept. Reprod. Health Care. – 2011. – Vol. 16, N 6. – P. 430-443. 165. Elevated regional lipolysis in hyperthyroidism / A.L. Riis [et al.] // J. Clin. Endocrinol. Metab. –2002. – Vol. 87, N 10. – P. 4747-4753. 166. Erem, C. Blood coagulation, fibrinolytic activity and lipid profile in subclinical thyroid disease: subclinical hyperthyroidism increases plasma factor X activity / C. Erem // Clin. Endocrinol. – 2006. – Vol. 64, N 3. – P. 323-329. 167. Estrogen activity as a preventive and therapeutic target in thyroid cancer / S. Rajoria [et al.] // Biomed. Pharmacother. – 2012. – Vol. 66, N 2. – P. 152158. 168. Estrogen and insulin/IGF-1 cooperatively stimulate cell cycle progression in MCF-7 breast cancer cells through differential regulation of c-Myc and cyclin 121 Dl / A. Mawson [et al.] // Mol. Cell. Endocrinol. – 2005. – Vol. 14, N 1-2. – P. 161- 173. 169. Estrogen promotes growth of human Thyroid tumor cells by different molecular mechanisms / D. Manole [et al.] // J.Clin. Endocrinol. Metab. – 2001. – Vol. 86, N 3. – P. 1072-1077. 170. Estrogen receptors (alpha and beta) and 17 beta-hydroxysteroid dehydrogenase type 1 and 2 in thyroid disorders: possible in situ estrogen synthesis and actions / W. Kawabata [et al.] // Mod. Pathol. – 2003. – Vol. 16, N 5. – P. 437-444. 171. Estrogen-mediated angiogenesis in thyroid tumor microenvironment is mediated through VEGF signaling pathways / A. Kamat [et al.] // Archives Otolaryngology Head Neck Surgery. – 2011. – Vol. 137, N 11. – P.11461153. 172. Evans, J.A. A circulating factor(s) mediates cell depolarization in hemorrhagic shock / J.A. Evans, M.J. Lewis, A. Shah // Cardiovasc. Res.1993. – Vol. 27. – P. 1486-1490. 173. Expression of estrogen and progesterone receptors and Ki-67 antigen in Graves' disease and nodular goiter / P. Domoslawski [et al.] // Folia Histochem. Cytobiol. – 2013. – Vol. 51, N 2. – Р. 135-140. 174. Expression of nitric oxide synthase isoforms in the thyroid gland: evidence for a role of nitric oxide in vascular control during goiter formation / I.M. Colin [et al.] // Endocrinology. – 1995. –Vol. 136, N 12. – Р. 5283-5290. 175. Expression of the vascular permeability factor/vascular endothelial growth factor gene in central nervous system neoplasms / R. A. Berkman [et. Al.] // J. Clin. Invest. –1993. – Vol. 91, N 1. – P. 153-159. 176. Expression of vascular endothelial growth factor and its receptors fit and KDR in ovarian carcinoma / A. Christine [et al.] // J. Nat. Cancer Institute. – 1995. – Vol. 87, N 7. – P. 506-516. 122 177. Follicular cystic ovaries and cystic endometrial hyperplasia in a bitch /FayrerR.A. Hosken [et al.] // J. Am. Vet. Med. Assoc. – 1992. – Vol. 201, № 1. – P. 107-108. 178. Franchini, M. Acquired hemophilia A / M. Franchini // Hematology. – 2006. – Vol. 11, N 2. – P. 119-125. 179. Frank, Z.S. Pharmacookinetics and potency of progestins used for hormone replacement therapy and contraception / Z.S. Frank // Reviews in Endocrine Metabolic Disorders. – 2002. – Vol. 3, N 3. – P. 211-224. 180. Fraser, I. S. The efficiency of non-contraceptive uses for hormonal contraceptives / I.S. Fraser, G.T. Kovacs // Med. J. Aust. – 2003. – Vol. 178, N 12. – P. 621-623. 181. Friedewald, W.T. Estimacion of the concentration of low density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge / W.T. Friedewald, R.I. Levy, D.S. Fredrickson // Clin. Chem. – 1972. – Vol. 18. – P. 490-502. 182. Fruzzetti, F. Review of clinical experience with estradiol in combined oral contraceptives / F. Fruzzetti, J. Bitzer // Contraception. – 2010. – Vol. 81, N 1. – P. 8-15. 183. Furlanetto, T.W. Estradiol increase proliferation and down-regulates the sodium/iodide symporter gene in FRTL-5 cells / T.W. Furlanetto L.Q., Nguyen, J.L. Jameson // Endocrinology. – 1999. – Vol. 140, N 12. – P. 57055711. 184. Further studies on thyroid growth-stimulating immunoglobulins in euthyroid nonendemic goiter / R.D. Van der Gaag [et al.] // J. Clin. Endocrinol. Metab. – 1985. – Р. 60, № 5. – Р. 972-979. 185. Gellersen, B. Non-genomic progesterone actions in female reproduction / B. Gellersen, I.A. Brosens, J.J. Brosens // Hum. Reprod. Update. – 2009. – Vol. 15. – Р. 119-138. 123 186. Glinoer, D. The regulacion of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology / D. Glinoer // Endocrine Reviews. – 1997. – Vol. 18, N 3. – P. 404-433. 187. Glinoer, D. The thyroid and enviromental / D. Glinoer // Merk Europen Thyroid Symposium. – Budapest, 2000. – P. 121-133. 188. Grimaldi, C.M. Estrogen alters thresholds for В cell apoptosis and activation / C.M. Grimaldi // J. Clin. Invest. – 2002. – Vol. 109, N 12. – P. 1625-1633. 189. Growth and differentiation in cultured human thyroid cells: effects of epidermal growth factor and thyrotropin / J.E. Errick [et al.] // In Vitro Cell Dev Biol. – 1986. – Vol. 22, N 1. – Р. 28-36. 190. Growth factor expression in cold and hot thyroid nodules / M. Eszlinqer [et al.] // Thyroid. – 2001. – Vol. 11, N 2. – P. 125-135. 191. Hepatic lipogenesis and cholesterol synthesis in hyperthyroid patients / A. Cachefo [et al.] // J. Clin. Endocrinol. Metab. – 2001. – Vol. 86, N 11. – P. 5353 -5357. 192. Holly, J. M. Insulin-like growth factors: autocrine, paracrine or endocrine? New perspectives of the somatomedin hypothesis in the light of recent developments / J. M. Holly, J. A. Wass // Endocrinol. – 1989. – Vol. 122, N 3. – P. 611-618. 193. Hypertension in hypotheroidism: arterial pressure and hormone relationships / A.M. Richards [et al.] // Clin. Exp. Hypertens. – 1985. – Vol. 7, № 11. – P. 1499-1514. 194. Hаna, V. Interdependence of epidermal growth factor and insulin-like growth factor-1 expression in the mouse uterus / V. Hana, L.J. Murphy // Endocrinology. – 1994. – Vol. 135, N 1. – P. 107-112. 195. In vivo effects of Sex Steroids on lymphocyte responsiveness and immunoglobulin levels in humans / E.J. Giltay [et al.] // J. Clin. Endocrinol. Metab. – 2000. – Vol. 85, N 4. – P. 1648-1657. 124 196. Indecators for Assessing lodine deficiency disorders and their control through salt iodisazion. N.6. – Geneva: WHO, 1994. 197. Influence of low-dose oral contraception on peripheral blood lymphocyte subsets at particular phases of the hormonal cycle / L. Auerbach [et al.] // Fertil. Steril. – 2002. – Vol. 78, № 1. – P. 83-89. 198. Influence of timing and dose of thyroid hormone replacement on development in infants with congenital hypothyroidism / J.J. Bongers-Schokking [et al.] // J. Pediatr. – 2000. – Vol. 136, N 3. – P. 292-297. 199. Inkinen, J. Association between common bile duct stones and treated hypothyroidism /J. Inkinen, J. Sand, I. Nordback // Hepatogastroenterology. 2000. – Vol. 47, N 34. – P. 919-921. 200. Inverse relation between iodine intake and thyroid blood flow: color doppler flow imaging in euthyroid humans / A.B. Arntzenius [et al.] // J. Clin. Endocrinol. Metab. – 1991. – Vol. 73, N 5. – Р. 1051-1055. 201. Involuntary movement disorders as first manifestation of systemic lupus erythematous: case report / A.M. Kakehasi [et al.] // Arq. Neuropsiquiatr. – 2001. – Vol. 59, N 3. – P. 609-612. 202. Kamran, S.M. Diagnostic and therapeutic options / S.M. Kamran // Women's health in Primary Care. – 2005. – Vol. 8, N 5. – P. 249- 252. 203. Kanda, N. Estrogen enhancement of anti-stranded DNA antibody and immunoglobulin G production in peripheral blood mononuclear cells from patients with systemic lupus erythemasosus / N. Kanda, T. Tsuchida, K. Tamaki // Arthritis Rheum. – 1999. – Vol. 42, N 2. – P. 328-337. 204. Kaplаn, M. Monitoring thyroxin treatment during pregnancy / M. Kaplаn // Thyroid. – 1992. – Vol. 2, N. – P. 147-152. 205. Klaiber, H. Pathogenesis and elucidation of ovulation disorders / H. Klaiber, J. Keller // Ther. Umschk. – 1985. – Vol. 42, N 7. – P. 409-413. 206. Knudsen, N. Risk factors for benign thyroid disease / N. Knudsen // Dan. Med. Bull. – 2005. – Vol. 52, N 4. – P. 160-185. 125 207. Krassas, G.E. Thyroid disease and female reproduction / G.Е. Krassas // Fert. Steril. – 2000. – Vol. 74, N 6. – P. 1063-1070. 208. Krassas, G.E. Thyroid function and human reproduction heaith / G.E. Krassas, K. Poppe, D. Glinoer // Endocr. Rev. – 2010. – Vol. 31, N 5. – P. 702-755. 209. Lack of association between thyroid autoantibodies and parity in a population study argues against microchimerism as a trigger of thyroid autoimmunity / P.I. Bulow [et al.] // Eur. J. Endocrinol. – 2006. – Vol. 154, N 1. – P. 39-45. 210. Lipid effects of an intrauterine levonorgestrel device or oral vs. vaginal natural progesterone in post-menopausal women treated with percutaneous estradiol / E. Suvanto-Luukkonen [et al.] // Arch. Gynecol. Obstet. – 1998. – Vol. 261, N 4. – Р. 201-208. 211. Lotz, H. Lipoprotein (a) increase associated with thyroid autoimmunity / H. Lotz, G.B. Salabe // Eur. J. Endocrmol. – 1997. – Vol. 136, N 1. – P. 87-91. 212. Low TSII requirement and goiter in transgenic mice overexpressing IGF-I and TGL-Ir receptor in the thyroid gland / S. Clement [et al.] // Endocrinology. – 2001. – Vol. 142, N 12. – P. 5131-5139. 213. Low-dose oral contraceptive effects on tromboelastogramm criteria and relationship / C.M. Zahn [et al.] // Am. J. Obstet. Gynecol. – 2003. – Vol. 189. – P. 43-47. 214. Malik, R. The relationship between the thyroid gland and the liver / R. Malik, H. Hodgson // Quart. J. Med. – 2002. – Vol. 95, N 9. – P. 559-569. 215. Mansourian, A.R. Female reproduction physiology adversely manipulated by thyroid disorders: a review of literature / A.R. Mansourian // Pak. J. Biol.Sci. – 2013. – Vol. 16, N 3. – P. 112-120. 216. Medical Eligibility Criteria for Contraceptive Use. – 4 th ed. – Geneva: WHO, 2009. 126 217. Momotani, N. Current problems in the treatment of Graves' disease in pregnancy and in lactation / N. Momotani // Nihon Rinsho. – 2006. – Vol. 64, N 12. – P. 2297-2302. 218. Moses, Н.А.The effect of Enovid on the binding of theroxine to plasma protein in vitro/ Н.А. Moses, C. Battle, D. Watson // J. Nat. Med.Ass. – 1970. – Vol. 62, N 3. – P. 331-333. 219. Nuclear localization of epidermal growth factor and epidermal growth factor receptors in human thyroid tissues / U. Marti [et al.] // Thyroid. – 2001. – Vol. 11, N 2. – P. 137-145. 220. Olsen, N.J. Gonadal steroids and immunity / N.J. Olsen, W.J. Kovacs // Endocrinol. Rev. – 1996. – Vol. 17. – P. 369-384. 221. Olsson, S.E. Aspects of thyroid function during use Norplant implants / S.E. Olsson, L. Wide, V. Odlind // Contraception. – 1986. – Vol. 34, N 6. – P. 583-587. 222. Oral contraceptive use, reproductive findings from factors, and colorectal cancer risk: Wisconsin / H.B. Nichols [et al.] // Cancer Epidemiol. Biomarkers Prev. – 2005. – Vol. 14, N 5. – Р. 1212-1218. 223. Oral contraceptives and breast cancer / S.S. Jickl [et al.] // Br. J. Cancer. – 1989. – Vol. 59, N 4. – P. 618-621. 224. Oral contraceptives and venous thromboembolism: findings in a large prospective study / M. Vessey [et al.] // Br. Med. J. 1986. – Vol. 292. – P. 526. 225. Pattern of thyroid function during early pregnancy in women diagnosed with subclinical hypothyroidism and treated with l-thyroxine is similar to that in euthyroid controls / C. De Geyter [et al.] // Thyroid. – 2009. – Vol. 19, N 1. – P. 53-59. 226. Pharmacokinetics of an oral contraceptive containing oestra- diol valerate and dienogest / S. Zeun [et al.] // Eur. J. Contracept. Reprod. Health Care. – 2009. – Vol. 14, N 3. – P. 221–232. 127 227. Piek, E. Specificity, diversity, and regulation in TGF-bcla superfamily signaling / E. Piek, С.H. Heldin, D.P. Ten // Faceb. J. – 1999. – Vol. 13, N 15. – P. 2105-2124. 228. Poppe, K. Female infertility and the thyroid / K. Poppe, B.Vеlkeniers // Best Pract. Res. Clin. Endocrinol. Metab. – 2004. – Vol. 18, N 2. – P. 153-165. 229. Poppe, K. Thyroid autoimmunity and female infertility / K. Poppe [et al.] // Verh. K. Acad. Geneeskd. Belg. – 2006. – Vol. 68, N 5-6. – P. 357-377. 230. Poppe, K. Thyroid disease female reproduction / K. Poppe, D. Velkinicrs, D. Glinoer // Clinical Endocrinology. – 2007. – Vol. 66, N 3. – P. 309-321. 231. Pregnancy in patients with mild thyroid abnormalities: maternal and neonatal repercussions / D. Glinoer [et al.] // J. Clin. Endocrinol.Metab. – 1991. – Vol. 7, N 2. – P. 421-427. 232. Prentice, A. Regular review:Endometriosis / A. Prentice // Br. Med. J. – 2001. – Vol. 323. – P. 93-95. 233. Prevalence and correction of hypothyroidism in a large cohort of patients reffered for dyslipidemia / T. Diekman [et al.] // Arch. Intern. Med. – 1995. – Vol. 155. – P. 1490-1495. 234. Progesterone antagonists increase androgen receptor expression in the rhesus macaque and human endometrium / O.D. Slayden [et al.] // J. Clin. Endocrinol. Metab. – 2001. – Vol. 86, N 6. – Р. 2668-2679. 235. Raloxifene effects on thyroid gland morphology in ovariectomized rats / L.F. Araujo [et al.] // Fertil. Steril. – 2008. – Vol. 90, N 4. – P. 1211-1214. 236. Regulation of vascular endothelial growth factor expression by estrogens ad progestins / S. M. Hyder [et al.] // Environ health perspect. – 2000. – Vol. 108, N 5. – P. 785-790. 237. Risk factors for and prevalence of thyroid disorders in a cross-sectional study among healthy female relatives of patients with autoimmune thyroid disease / T.G. Strieder [et al.] // Clin. Endocrin. – 2003. – Vol. 59. – P. 396-401. 128 238. Risk factors for developmental disorders in infants born to women with Graves disease / N. Mitsuda [ et al.] // Obstet. Gynecol. – 1992. – Vol. 80, N 1. – P. 359-364. 239. Rohan, T.E. A cohort study of oral contraceptive use and risk of benign breast disease / T.E. Rohan, A.B. Miller // Int. J Cancer. – 1999. – Vol. 82, N 2. –P. 191-196. 240. Rumsey, T.S. Roasted soybeans and estrogenic growth promoter affect the thyroid status of beef steers / T.S. Rumsey, Т.Н. Elsasser, S.J. Kahl // J. Nutrition. – 1997. – Vol. 127, N 2. – P. 352-358. 241. Santin, A.P. Role of estrogen in thyroid function and growth regulation / A.P. Santin, T.W. Furlanetto // J. Thyroid Research. – 2011. – 875125. doi: 10.4061/2011/875125. 242. Schindler, A.E. Thyroid function and postmenopause / A.E.Schindler / Gynecol. Endocrinol. – 2003. – Vol. 17, N 1. – Р. 79-85. 243. Segaloff, A. The failure of certain steroid hormones to prevent enlargement of the theroid in rats fed thiourea / A. Segaloff //Endocrinology. – 1944. – Vol. 35. – P. 134. 244. Seli, E.Sex steroids and the immune system / E. Seli, A. Arici // Immunol. Allergy Clin. North Am. – 2002. – Vol. 22. – P. 407-433. 245. Serum insulin-like growth factor type 1, insulin-like growth factor-binding protein-1, and insulin-like growth factor-binding protein-3 concentrations in patients with thyroid dysfunction / P. Iglesias [et al.] // Thyroid. – 2001. – Vol. 11, N11. – P. 1043-1048. 246. Sola, J. Liver changes in patients with hyperthyroidism / J. Sola // Liver. – 1991. – Vol. 11, N 4. – P. 193-197. 247. Stanczyk, F.Z. Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception / F.Z. Stanczyk // Reviews in Endocrine Metabolic Disorders. – 2002. – Vol. 3, N 3. – Р. 211-224. 129 248. Studer, H. Intrathyroidal iodine heterogeneity of iodocompounds and kinetic compartmentalization / H. Studer, H. Gerber // Trends Endocrinol. Metab. – 1991. – Vol. 2, N 1. – Р. 29-35. 249. Susarla, R. Regulation of human thyroid follicular cell function by inhibition of vascular endothelial growth factor receptor signaling / R.Susarla, J.C. Watkinson, M.C. Eggo // Mol. Cell. Endocrinol. – 2012. – Vol. 4, N 2. – P. 199-207. 250. Testosterone and estradiol differentially regulate thyroid growth in Wistar rats from immature to adult age / S. К. Banu [et al.] // Endocr. Res. – 2001. – Vol. 27, N 4. – P. 447-463. 251. Th2 immune deviation induced by pregnancy: the two faces of autoimmune rheumatic disease / A.Doria [et al.] // Reprod. Toxic. – 2006. – Vol. 22, N 2. – P. 234-241. 252. The conversion of androgens to estrogens in hyperthyroidism / A.L. Southren [et al.] // J. Clin. Endocrinol. Metab. – 1974. – Vol. 38, N 2. – Р. 207-214. 253. The influnce of steroids on gynecologic cancers / J.J. Schesselman, J.A. Colins // Estrogen and progestogens and clinical practice / ed. I.S. Fraser, R.P.S. Janssen, R.A. Lobo, M.J. Whitehead. – London: Churchill Livingstone, 1998. – P. 831-864. 254. The nature of human chorionic gonadotropin glycoforms in gestational thyrotoxicosis / J.A. Talbot [et. al.] // Clin. Endocrinol. – 2001. – Vol. 55. – P. 33-39. 255. The role of estrogen receptors and androgen receptors in sex steroid regulation of В lymphopoiesis / G. Smithson [et al.] // J. Immunol. – 1998. – Vol. 161, N l. – P. 27-34. 256. The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and progestogen type: results of the MEGA case-control study/ V.A. Van Hylckama [et al.] // Br. Med. J. – 2009. – Vol. 13. – Р 339-342. 130 257. Thromboembolic disease developing during oral contraceptive therapy in young females with antiphospholipid antibodies / A. Girolami [et al.] // Blood Coaqul. Fibrinolysis. – 1996. – Vol. 7, N 4. – P. 497-501. 258. Thyroid autoimmunity and abortion: a prospective study in women undergoing in vitro fertilization / A.F. Muller [et al.] // Fertil. Steril. – 1999. – Vol. 71, 1. – P. 30-34. 259. Thyroid hormone causes mitogen-activated protein kinase-dependent phosphorylation of the nuclear estrogen receptor / H.Y. Tang [et al.] // J. Endocrinology. – 2004. – Vol. 145, N 7. – P. 3265-3272. 260. Thyroxine treatment modified in infertile women according to thyroxinereleasing hormone testing: 5-year follow-up of 283 women referred after exclusion of absolute causes of infertility / W. Raber [et al.]// Human Reproduction. – 2003. – Vol. 18, N 4. – P. 707-714. 261. Tremollieres, F. Impact of oral contraceptive on bone metabolism/ F. Tremollieres // Best Pact. Res. Clin. Endocrinol. Metab. – 2013. – Vol. 27, N 1. – P. 47-53. 262. Triphasic norgestimate-ethinyl estradiol for treating dysfunctional bleeding / A. Davis [et al.] // Obstet. Gynecol. – 2000. – Vol. 96, N 6. – P. 913-920. 263. Turrens ,J.F. Ubisemiquinone is the electron donor for superoxide formation by complex III of heat mitochondria / J.F. Turrens, A. Alexandre, A.L. Lehninger //Arch. Biochem. Biophys. – 1985. – Vol. 237, N 2. – P. 415-424. 264. Type III hyperlipidemia with primari hypothyroidism / J. Kobayashi [et al.] // Clin. Endocrinol. – 1997. – Vol. 46, N 5. – P. 627-630. 265. Upregulation of the angiogenic factors PlGF, VEGF and their receptors (Flt-1, Flk-1/KDR) by TSH in cultured thyrocytes and in the thyroid gland of thiouracil-fed rats suggest a TSH-dependent paracrine mechanism for goiter hypervascularization / G. Viglietto[et al.] // Oncogene. – 1997. – Vol. 27, N 15. – Р. 2687-2698. 131 266. Utiger, R.D. Estrogen, thyroxin binding in serum, and thyroxine therapy / R.D. Utiger // N. Engl. J. Med. – 2001. – Vol. 344, N 23. – P. 1784-1785. 267. Vasudevan, N. Estrogen and thyroid hormone receptor interactions: physiological flexibility by molecular specificity/ N. Vasudevan, S. Oqawa, D. Pfaff // Physiol. Rev. – 2002. – Vol. 82, N 4. – P. 923-944. 268. Volumetric analysis of thyroid lobes by real-time ultrasound (author's transl) / J. Brunn [et al.] // Dtsch. Med. Wochenschr. –1981. – Vol. 106, N 41. – P. 1338-1340. 269. Wang, J. Gender-specific pattern of insulin-like growth factor-binding protein- 3 protease activity in mouse thyroid / J. Wanq, J. Grunler, M. S. Lewitt // Endocrinology. – 2004. – Vol. 145, N 3. – P. 1137-1143. 270. Whitehead, M.I.Controversies concerming the safety of estrogen replacement therapy / M.I. Whitehead, D. Fraser // Amer. J. Obstet. Gynecol. – 1987. – Vol. 156, N 5. – P. 1313-1322. 271. Wilder, R.L. Adrenal and gonadal steroid hormone deficiency in the pathogenesis of rheumatoid arthritis / R.L. Wilder // J. Rheumatol. – 1996. – Vol. 44. – P. 10-12. 272. Wooclburn, J. R. The epidermal growth factor receptor and its inhibition in cancer therapy / J.R. Woodbum // Pharmacol. Ther. – 1999. – Vol. 82. – P. 241-250. 273. Zagrodzki, P. The interaction between selenium status, sex hormones, and thyroid metabolism in adolescent girls in the luteal phase of their menstrual cycle / P. Zagrodzki, R. Ratajczak, R.Wietecha-Posłuszny // Biol. Trace Elem. Res. – 2007. – Vol. 120, N 1-3. – P. 51-60. 274. Zigman, J.M. Impact of thyroxine-binding globulin on thyroid hormone economy during pregnancy / J.M. Zigman, S.E. Cohen, J.R. Garber // Thyroid. – 2003. – Vol. 13, N 12. – P. 1169-1174.