исследование воздействия мембраноактивных веществ и
реклама

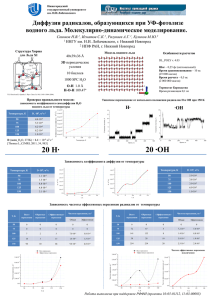
Раздел 2 479 УДК 577.35 ИССЛЕДОВАНИЕ ВОЗДЕЙСТВИЯ МЕМБРАНОАКТИВНЫХ ВЕЩЕСТВ И ЭЛЕКТРИЧЕСКОЙ СТИМУЛЯЦИИ НА ВОДНЫЙ ТРАНСПОРТ В СЕДАЛИЩНОМ НЕРВЕ МЕТОДОМ ЯМР С ИГМП Мишагина Е.А., Сибгатуллин Т.А., Никольский Е.Е., Анисимов А.В. Казанский институт биохимии и биофизики, КазНЦ РАН Одна из основных проблем нейробиологии заключается в определении взаимосвязи деталей структуры нерва с выполняемыми функциями. В частности, неизвестно, может ли изменение режимов электрической активности нерва модулировать кинетику аксонального транспорта веществ. По одной из выдвинутых гипотез прохождение электрического импульса по нерву сопровождается механической волной в аксоплазме. Представляет интерес одновременно с электрическим воздействием на аксоны исследовать изменения интенсивности трансляционного переноса в них. На примере седалищного нерва озерной лягушки изучены возможности проведения диффузионных ЯМР экспериментов на нервном волокне в норме и непосредственно в процессе электростимуляции и химического воздействия. Исследования проводились с использованием последовательности стимулированного эхо с импульсным градиентом магнитного поля. Периферические нервы состоят из миелиновых и безмиелиновых волокон, сгруппированных в пучки, и соединительнотканных оболочек. Эндоневрий – рыхлая соединительная ткань [1] между отдельными нервными волокнами. Периневрий окружает каждый пучок нервных волокон. Эпиневрий – волокнистая соединительная ткань, объединяющая все пучки в составе нерва. Для подачи электрических импульсов на нерв одновременно с диффузионными измерениями был сконструирован автономный электростимулятор, скомбинированный с ампулой-ложементом, позволяющей четко фиксировать положение нервных волокон относительно градиента магнитного поля и поддерживать его во влажной атмосфере во время экспериментов. Электрический импульс с амплитудой 8 Вольт подавался двумя способами: на все время действия последовательности стимулированного эхо и перед диффузионной программой (с длительностью 500 мкс). 480 Структура и динамика молекулярных систем, 2007 г., Выпуск №1 норма и м п . д о п р о гр и м п . в о в р е м я п р о гр A(g)/A(0) 10 1 0 9 1x10 9 2x10 2 (g γδ ) t, с / м 9 3x10 9 4x10 2 Рис. 1. Диффузионные затухания электростимуляции, td = 15 мс для нерва в норме и во время Таблица. 1. КСД для нерва в норме и под действием электрического импульса D, 10-9 м2/c [td =15 мс] D, 10-9 м2/c [td=150 мс] (населенность, %) (населенность, %) Без электростимула 0,40 ± 0,02 (32 ±2%) 1,77 ± 0,1 (68 ± 2%) Электр. импульс до 0,50 ± 0,01 (33 ±3%) 1,97 ± 0,05 (67 ±3%) «стимулированного эхо» Электр. импульс во время 0,52 ± 0,03 (32 ±3%) 2,1 ± 0,2 (68 ± 3%) «стимулированного эхо» Для продольной ориентации нервных волокон относительно внешнего градиента магнитного поля происходит увеличение наклона диффузионного спада при прохождении через них электрического импульса (рис.1), что соответствует увеличению коэффициентов самодиффузии (КСД) воды. Данный эффект проявляется при обоих вариантах включения электрического импульса (таб.1). Если рост трансляционной подвижности при постоянном прохождении тока через нервное волокно (первый вариант) можно связать с явлением электроосмоса, то во втором случае рост подвижности молекул воды работает на гипотезу электромеханической волны. Для оценки чувствительности измеряемых параметров к изменению трансляционных характеристик дополнительно проводились измерения на образцах подвергнутых химическому воздействию. В качестве химического воздействия на нервные волокна выбраны мембраноактивные вещества: метронидазол и хлоргексидин. Диффузия воды исследовалась в радиальном направлении нервных волокон. Концентрация метронидазола составляла 167 мг/мл, время выдержки образца в растворе 30 мин. Концентрация хлоргексидина составляла 0,5 мг/мл, время выдержки образца – 20 мин. Раздел 2 Норма Хлоргексидин A(g)/A(0) 10 1 0,1 481 1 A(g)/A(0) норма метронидазол 0,1 0,01 1E-3 0,0 9 0,0 9 4,0x10 2,0x10 2 (gγδ) t, с/м 9 9 2,0x10 4,0x10 2 2 9 6,0x10 (gγδ) t, с/м Рис.2. Диффузионные затухания для нерва в норме и под действием хлоргексидина, td = 15 мс 9 8,0x10 2 Рис.3. Диффузионные затухания для нерва в норме и под действием метронидазола, td = 15 мс 1E-8 2 Ds, м /с 10 -1 D(td) , м2/с Норма Хлоргексидин ~ td Dap model D model 1E-9 1E-10 t -1 1E-11 0,01 1 10 100 td, мс 1000 0,1 1 10 100 td , с Рис. 4. Зависимость КСД от времени диффузии при воздействии на нерв хлоргексидином Интервал времен диффузии в эксперименте с хлоргексидином составлял от 15 мс до 700 мс. На рис.2 представлены диффузионные затухания (ДЗ) для времени диффузии td = 15 мс. Минимальный КСД под действием хлоргексидина характеризуется более слабой зависимостью от времени диффузии, чем в норме, что соответствует менее ограниченной диффузии (рис.4). Полученный с помощью теоретических приближений размер ограничений равен 18 ± 2 мкм [2]. Это не может быть размером аксона в нашем объекте, имеющего на порядок меньший диаметр. Следовательно, это размер периневрия, объединяющего целые пучки аксонов. Таким образом, обнаружено уменьшение влияния ограничений периневрия под действием хлоргексидина. Существуют данные, что метронидазол снижает диффузионную подвижность приповерхностной воды, в частности, поверхности 482 Структура и динамика молекулярных систем, 2007 г., Выпуск №1 мембраны [3]. Логично предположить, что минимальный КСД отражает поведение примембранной воды, т.е. воды, близкой к ограничениям (и поэтому характеризующейся меньшим КСД, чем КСД «свободной воды», не чувствующей препятствий). Этот слой может обмениваться протонами с гидратной оболочкой, тогда сигнал от гидратной оболочки будет вносить вклад в величину и долю минимального КСД. На рис.3 представлены ДЗ в норме и после воздействия на нервы метронидазолом для времени диффузии td = 15 мс. Воздействие на нервы метронидазолом (таб.2) приводит к снижению подвижности водных молекул в околомембранном слое. Это происходит, по-видимому, за счет увеличения уровня гидратации мембран. Таблица. 2 КСД воды в норме и под действием метронидазола td, мс 15 150 Ds в норме, 10-9 м2/c (населенность, %) 0,4±0,2 (33±2%) 0,4±0,3 (34±1%) 1,6±0,05 (67±2%) 1,56±0,1 (66±1%) Ds под действием метронидазола, 10-9 м2/c (населенность, %) 0,31 ±0,11 (25±3%) 0,32±0,05 (26±2%) 1,6±0,5 (75±3%) 1,34±0,9 (74±2%) Данная интерпретация результатов не противоречит той, в которой мы отнесли минимальный КСД воде внутри периневрия. Именно внутри области периневрия содержится большое количество аксональных мембран, и вода в пристеночной области может давать ощутимый вклад в минимальный КСД. Таким образом, в данной работе показана возможность использования метода ЯМР-диффузометрии для исследования трансляционных переносов молекул воды в нервных волокнах в норме и при различных внешних воздействиях. Литература 1. Гистология // Под ред. проф. Э. Г. Улумбекова, проф. Ю. А. Челышева. – М.: ГЭОТАР-МЕД. –2001. – 672с. 2. Valiullin R. R., Skirda V.D. // Time dependent self-diffusion coefficient of molecules in porous media. J. Chem. Phys. 114. – 2001. – р. 452 – 458. 3. Попыхова Э.Б., Мавлюдова А.Ш., Кузнецов П.Е. // Влияние 1(2’гидроксиэтил)-2-метил-5-нитроимидазола на скорость фолдинга ферментов. Биология – наука XXI века.- Пущино. – 2005. – С.124.