Дисперсные системы
реклама

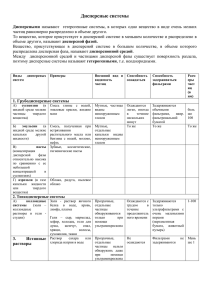
Дисперсные системы Классификацию химических систем с гонки зрения их однородности и состава можно представить в виде схемы: Чистые вещества встречаются редко. Строго говоря, абсолютно чистых веществ в природе не существует. Как бы мы ни старались очистить, например, воду, она будет содержать примеси других веществ, в частности растворенных в ней газов. Сверхчистый кремний, который применяют в электронной технике, содержит 99,999 999 999% кремния. Однако 1,0- 10|0% вес же приходится на примеси. В химии очень важное значение имеет степень чистоты реактивов. Для ее характеристики даже введена специальная маркировка (табл. 3.1). Даже незначительное количество примесей может существенно повлиять на свойства веществ: электро- и теплопроводность, температуру кипения и температуру плавления и даже на реакционную способность. Интересно отметить, что очень чистое железо практически не подвергается коррозии на воздухе! Значительно чаще приходится иметь дело со смесями двух или более веществ. Смеси могут иметь произвольный состав, который, как правило, не выражается единой химической формулой. Таблица 3.1 Классификация химических реактивов по степени чистоты Маркировка Степень чистоты Содержание Область применения примесей, % «ч.» «ч. д. а.» Чистый (1,0-2,0)- 10-5 Чистый для анализа (0,4-1,0)- 10-5 «x. ч.» Химически чистый (0,05-5,0)- 10-6 Промышленность Анализ технических продуктов Научно-исследовательские и лабора- «ос. ч» Особо чистый 10 -14 –10 -10 торные работы Электроника, полупроводниковая и ядерная техника Если смесь веществ однородна, т.е. между различными ее компонентами нет границы (поверхности) раздела, ее называют гомогенной. Примером гомогенных смесей могут служить растворы. Смеси могут состоять из веществ, которые практически не растворимы или ограниченно растворимы друг в друге. В этом случае их называют гетерогенными (неоднородными). Примером гетерогенной системы может служить молоко — мелкие капельки жира в водной среде. Огромное значение в природе, технике, промышленности, в быту имеют гомогенные системы — растворы. Растворы Образование раствора — это физико-химический процесс, т.е. помимо распределения частиц одного вещества среди частиц другого могут происходить химические явления: диссоциация электролита, образование гидратов. Раствор представляет собой гомогенную систему, состоящую из растворителя, частиц растворенного вещества и продуктов их взаимодействия. Растворы всегда однородны; по агрегатному состоянию могут представлять собой газ, жидкость или твердое вещество. Любые газы смешиваются друг с другом в любых соотношениях, такие растворы чаще называют газовыми смесями. В жидкостях могут растворяться газы, другие жидкости и твердые вещества (агрегатное состояние такого раствора жидкое). Аналогично существуют растворы газов, жидкостей и твердых веществ в твердых веществах. Например, при кристаллизации расплава серебра и золота можно получить твердые растворы различного состава. В любом растворе одно вещество «раздроблено» в среде другого до мельчайших частиц: молекул или ионов. Такие частицы невозможно увидеть даже «вооруженным» глазом, поскольку их размеры не превышают 1—5 нм (1 нм = 10-9 м). Раствор, в котором данное вещество при заданной температуре больше не растворяется, называют насыщенным. Обычно растворимость веществ выражают максимальной массой растворенного вещества в 100 г раствори геля с указанием температуры. Например, при температуре 20 °С растворимость в воде сульфата бария составляет 2,4-10–4 г/100 г, сульфата кальция 0,203 г/100 г, сульфата магния — 44,5 г/100 г. Первое вещество условно считают нерастворимым в воде (растворимость менее 0,1 г в 100 г Н20), второе — малорастворимым (от 0,1 до 1,0 г в 100 г), третье — хорошо растворимым (более 1 г в 100 г воды). Как вы уже знаете, состав растворов характеризуют массовой долей растворенного вещества. Дисперсные системы, их классификация Далеко не все вещества растворимы друг в друге, т.е. образуют истинные растворы. Конечно, можно искусственно измельчить одно вещество и распределить его в объеме другого, но в любом случае такая система будет гетерогенной. Например, можно разбить жидкость на мельчайшие капельки и распылить их в газовую среду (допустим, с помощью аэрозольного баллончика). Раствором полученную систему назвать нельзя, даже мельчайшая капелька жидкости будет отделена от газа поверхностью раздела двух фаз: жидкой и газообразной. Аналогичную систему представляет собой зубная паста: мелкие частицы твердого вещества распределены в жидкости. Подобное состояние веществ получило название дисперсного. Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого. *Первое вещество, которое распределено в объеме второго, называют дисперсной фазой. Второе вещество, представляющее собой непрерывную фазу, носит название дисперсионной среды. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды различают восемь типов дисперсных систем (табл. 3.2). Т а б л и ц а 3.2 Типы дисперсных систем Дисперсион- Дисперсная Название ная среда фаза системы Газ Жидкость Аэрозоль Газ Аэрозоль Жидкость Твердое вещество Газ Жидкость Жидкость Эмульсия Пена Пример Туман, облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля Дым, смог, пыль в воздухе Газированные напитки, взбитые сливки Молоко, майонез, жидкие Жидкость Твердое вещество Твердое вещество Газ Твердое вещество Жидкость Твердое вещество Твердое вещество среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) Золь, Речной и морской ил, суспензия строительные растворы, пасты Твердая пена Керамика, пенопласты, полиуретан, поролон, пористый шоколад Гель Желе, желатин, косметические и медицинские средства (мази, тушь, номада) Твердый Горные породы, цветные золь стекла, некоторые сплавы Грубодисперсныс системы Грубодисперсными аэрозольными системами являются дым, смог (частицы твердых веществ в газовой среде), облака (мельчайшие капельки воды в газовой среде). Более известны и применимы дисперсные системы, в которых средой выступает вода. Примером такой системы является строительная побелка. Растворимость карбоната кальция (мела) очень мала (6,2 х х 10 4 г/100 г Н20). Попробуем приготовить из этого вещества и воды дисперсную систему. Как можно более тщательно разотрем мел в ступке, перенесем в стакан с водой и перемешаем. Получим мутную жидкость — дисперсную систему, называемую суспензией. Однако пройдет немного времени, и мел осядет на дно стакана, жидкость станет прозрачной. Под действием силы тяжести частицы твердого вещества оседают — седиментируют. Это доказательство того, что наша система получилась грубодисперсной. Получить дисперсную систему карбонат кальция —вода можно химическим способом: пропуская углекислый газ через известковую воду (раствор гидроксида кальция). При этом раствор мутнеет. Полученная система также грубодисперсная, через непродолжительное время в результате осаждения карбоната кальция она расслоится. Грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой называют суспензиями. Суспензиями являются многие краски, строительные растворы (побелка, цементный растбор, бетон). Особую группу составляют грубодисперсные системы, в которых концентрация дисперсной фазы относительно велика. Примерами таких систем могут служить пасты (в том числе зубная), кремы, мази. Суспензии, в которых седиментация (оседание) идет очень медленно изза малой разности плотностей дисперсионной среды и дисперсной фазы, называют взвесями. Вода из грязной лужи, сколько ее не отстаивай, всегда остается мутноватой; в ней во взвешенном состоянии находятся мельчайшие частицы ныли. Грубодисперсную систему можно получить из двух несмешивающихся друг с другом жидкостей. Если несколько капель растительного масла энергично взболтать в пробирке с несколькими миллилитрами воды, образуется мутная дисперсная система — эмульсия. Со временем она расслоится, поскольку представляет собой грубодисперсную систему. Примерами эмульсий могут служить некоторые смазочно-охлаждающие жидкости, пестицидные препараты, лекарственные и косметические средства. Например, в медицинской практике применяют жировые эмульсии для энергетического обеспечения голодающего или ослабленного организма путем внутривенного вливания. Типичные биологические эмульсии — это капельки жира в лимфе, кровь. Коллоидные системы Коллоиды занимают промежуточное положение между грубодисперсными системами и истинными растворами. На основании данных табл. 3.2 вы можете убедиться, что дисперсные системы чрезвычайно многообразны. Можно сказать, что они составляют основу всего живого мира. Распространенность их в быту, технике, промышленности также очень велика. Большое значение имеют коллоидные системы для биологии и медицины. В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложнейших взаимоотношениях друг с другом и окружающей средой. Цитоплазма клеток обладает свойствами, характерными как для жидких, так и для студнеобразных веществ. С химической точки зрения организм в целом — это сложная совокупность многих коллоидных систем, включающих в себя и жидкие коллоиды, и студни — гели. Если частицы дисперсной фазы малы, коллоидная система напоминает истинный раствор, отсюда и происходит название — коллоидный раствор. Такая система образуется, например, при растворении небольшого количества яичного белка в воде. Коллоидные растворы, как правило, опалесцируют, т.е. рассеивают падающий свет за счет частиц дисперсной фазы, размеры которых сравнимы с длиной волны излучения. При этом коллоидный раствор при освещении как бы светится сам. Характерным проявлением опалесценции является эффект Тиндаля. Он заключается в появлении в коллоидном растворе светящейся дорожки при пропускании через него луча света (цв. вклейка, рис. 10). Такой эффект можно наблюдать, выпустив на луч лазерной указки немного аэрозоля. Существует несколько основных способов получения коллоид-пых растворов. Один из них — дисперсионный, а проще говоря — дробление вещества на мелкие частицы в дисперсионной среде или вне ее. Такое дробление можно осуществлять механически с помощью специальных машин — коллоидных мельниц. Так получают, например, тушь, жидкие акварельные, водоэмульсионные и вододисперсионные краски. Дробление можно проводить при помощи электрического тока (коллоидные растворы серебра, золота, платины) или ультразвука (коллоидные растворы гипса, графита, смол). Важнейшими типами коллоидных систем являются золи и гели. * Золи — это коллоидные системы, в которых дисперсионной средой является жидкость, а дисперсной фазой — твердое вещество. Отдельные частицы золя изолированы друг от друга дисперсионной средой. С течением времени они могут укрупняться, сталкиваясь друг с другом. Такое явление получило название коагуляция. В результате действия силы тяжести такие частицы выпадают в осадок, происходит их седиментация. Кроме коагуляции при длительном хранении гидрофильные золи могут превращаться в гели — особое студнеобразное коллоидное состояние. При этом отдельные частицы золя связываются друг с другом, образуя сплошную пространственную сетку. Гели широко распространены в нашей повседневной жизни. Любому известны пищевые гели (зефир, мармелад, холодец, заливное), косметические (гель для душа, кремы), медицинские (мази, пасты). Однако немногие знают, что хрящи, сухожилия, волосы представляют собой биологические гели, а опал, жемчуг, сердолик, халцедон — минеральные. Для некоторых гелей характерно явление синерезиса (или расслоения) — самопроизвольного выделения жидкости. Чаще всего с явлением синерезиса приходится бороться, поскольку имение оно определяет сроки годности пищевых, косметических, медицинских гелей. Например, при длительном хранении мармелад или торт «Птичье молоко» выделяют жидкость, становятся непригодными к употреблению. Однако в некоторых случаях синерезис — великое благо. Благодаря биологическому синерезису мы наблюдаем такое явление, как свертывание крови, суть которого состоит в превращении растворимого белка фибриногена в нерастворимый — фибрин. Вопросы 1. На какие группы делят чистые вещества? Существуют ли абсолютно чистые вещества? Будет ли дистиллированная вода чистым веществом? 2. Как классифицируют химические реактивы по степени чистоты? 3. Дайте определение истинных растворов. Как выражают состав истинных растворов? 4. В 150 мл воды растворили 33,6 л аммиака (п.у.). Найдите массовую долю аммиака в полученном растворе. 5. Чем отличаются дисперсные системы от истинных растворов? На какие группы их делят? Приведите примеры и покажите значение этих систем в природе и жизни человека. 6. Что такое суспензии? Эмульсии? Что между ними общего и чем они отличаются? Приведите примеры суспензий и эмульсий, с которыми мы сталкиваетесь на производственной практике. 7. Чем отличаются коллоидные растворы от истинных? Как их различить опытным путем? 8. Охарактеризуйте понятие «золи». На какие группы делят золи? Приведите примеры и расскажите об их значении. 9. Охарактеризуйте понятие «гели». На какие группы делят гели? Приведите примеры каждой из групп гелей и расскажите об их значении. 10. Охарактеризуйте явления коагуляции и синерезиса. 11. Какое практическое значение имеет синерезис в промышленном производстве? 12. В чем суть биологического синерезиса — свертывания крови? Расскажите о его значении и условиях, необходимых для его протекания. Как называется болезнь, при которой этот биологический синерезис затруднен?