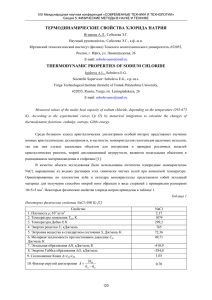
Полиморфные переходы СaF 2 , измеренные при исследовании
реклама

6 СЕКЦИЯ: ЭКСТРЕМАЛЬНЫЕ СОСТОЯНИЯ УДК 536.424; 536.63; 536.722 ПОЛИМОРФНЫЕ ПЕРЕХОДЫ CaF2, ИЗМЕРЕННЫЕ ПРИ ИССЛЕДОВАНИИ ТЕПЛОЕМКОСТИ И ЭНТАЛЬПИИ В ИНТЕРВАЛЕ ТЕМПЕРАТУР 300…1900К Арсеев И.В., Люстерник В.Е., Пелецкий В.Э., Тарасов В.Д., Чеховской В.Я. Институт теплофизики экстремальных состояний ОИВТ РАН, г. Москва E-mail: valtar@nccinet.ru Противоречивые сведения в литературе о полиморфных превращениях в дифториде кальция определили цель представляемой работы – по измерениям теплоемкости и энтальпии в интервале температур 300…1900 К уточнить наличие и определить характер переходов в CaF2. Теплоемкость для этих целей является весьма чувствительным и подходящим инструментом. Для измерения теплоемкости в интервале температур 300…1100 К использован метод непрерывного адиабатического нагрева исследуемого образца в вакууме. Кристаллический образец имел вид цилиндра и содержал 99.95 мас. % CaF2. Скорость его нагрева варьировалась в пределах 0.5…10 град/мин. Разность температур между образцом и адиабатической оболочкой не превышала ±0.005 град. Температуру образца измеряли Pt/Pt-10%Rh термопарой. Проведено 10 серий измерений и получено около 1500 опытных точек теплоемкости CaF2. Работа установки проверялась по измерениям теплоемкости корунда, меди и алюминия. Погрешность измерений оценивается в 1…2%. Энтальпия измерялась методом смешения в интервале температур 1150…1900 К с погрешностью 1…1.5%. Для определения количества тепла падающего образца, использовался массивный медный калориметр с изотермической оболочкой. Температура образца измерялась эталонным оптическим монохроматическим пирометром типа ЭОП-66 по модели абсолютно черного тела, расположенной в исследуемом образце. Энтальпия и теплоемкость исследовались на одном и том же образце. Дифторид кальция для исследования твердой фазы помещался в молибденовые ампулы, а расплава - в ампулы из ниобия. Эксперименты проводились в аргоне при давлении, несколько выше атмосферного. В результате измерения теплоемкости обнаружено, что CaF2 выше 650К может существовать в упорядоченном и неупорядоченном состояниях. При этом в интервале температур 650…923К теплоемкость упорядоченного CaF2 превышает теплоемкость разупорядоченной структуры и при 923К имеет минимум. Надо полагать, что полиморфный переход при 923К соответствует переходу при 863К, обнаруженному другими авторами. Теплоемкость разупорядоченного CaF2 имеет максимум около 863К. Температурные зависимости теплоемкостей обеих структур описываются экспоненциальными уравнениями. При измерении энтальпии обнаружены полиморфные переходы при 1310 и 1410К и плавление при 1691К. Полученные значения согласуются с измерениями других авторов. При температуре 1310К происходит небольшой скачок энтальпии ∆H = 1.26 кДж/моль, который можно рассматривать как фазовый переход первого рода. В области температур 1310…1410К наблюдается существенный рост энтальпии, который описывается экспоненциальным уравнением. Теплота плавления CaF2 ∆Hпл = 30.78 кДж/моль, а теплоемкость расплава в интервале 1691…1900К Cp = 92.4 Дж/(моль·К). Полиморфные превращения в CaF2 можно объяснить процессом непрерывного разупорядоточения анионной подрешетки вплоть до температуры плавления. С ростом температуры происходит образование антифренкелевских пар анионных дефектов: отрицательная анионная вакансия и отрицательный анион в междоузлии. При определенных температурах процесс разупорядочения сопровождается полиморфными переходами. Данные по теплоемкости и энтальпии использованы для определения энергии образования антифренкелевских пар анионных дефектов: при температурах 923, 1113 и 1410К они равны 1.8; 1.3 и 5.8 эВ/пара. Отмеченные переходы можно отнести к фазовым переходам второго рода. 220 ____________________________ http://www.kstu.ru ____________________ E-mail: office@kstu.ru ________________ ТЕЗИСЫ ДОКЛАДОВ X РОССИЙСКОЙ КОНФЕРЕНЦИИ ПО ТЕПЛОФИЗИЧЕСКИМ СВОЙСТВАМ ВЕЩЕСТВ Для неупорядоченной структуры CaF2 методом наименьших квадратов рассчитаны коэффициенты следующих уравнений теплоемкости: для интервала 298.15…1113 К Cp = 69.027 + 1.955·10-2 T – 783312 T-2 + 8.0871·109 T-2exp(-7508/T), Дж/(моль·К); для 1113…1310 К Cp = 57.5434 + 3.2602·10-2 T, Дж/(моль·К); для 1310…1410 К Cp = 57.5434 + 3.2602·10-2 T + 6.4274·1018 T-2 exp(-33725/T), Дж/(моль·К); для 1410…1691 К Cp = 66.902 + 2.9862·10-2 T, Дж/(моль·К). Казанский государственный технологический университет. Ул. К. Маркса, 68. г. Казань 420015. ____________________ 221