Лабораторная работа № 2. Неэмпирический квантовохимический расчет молекулы.
реклама
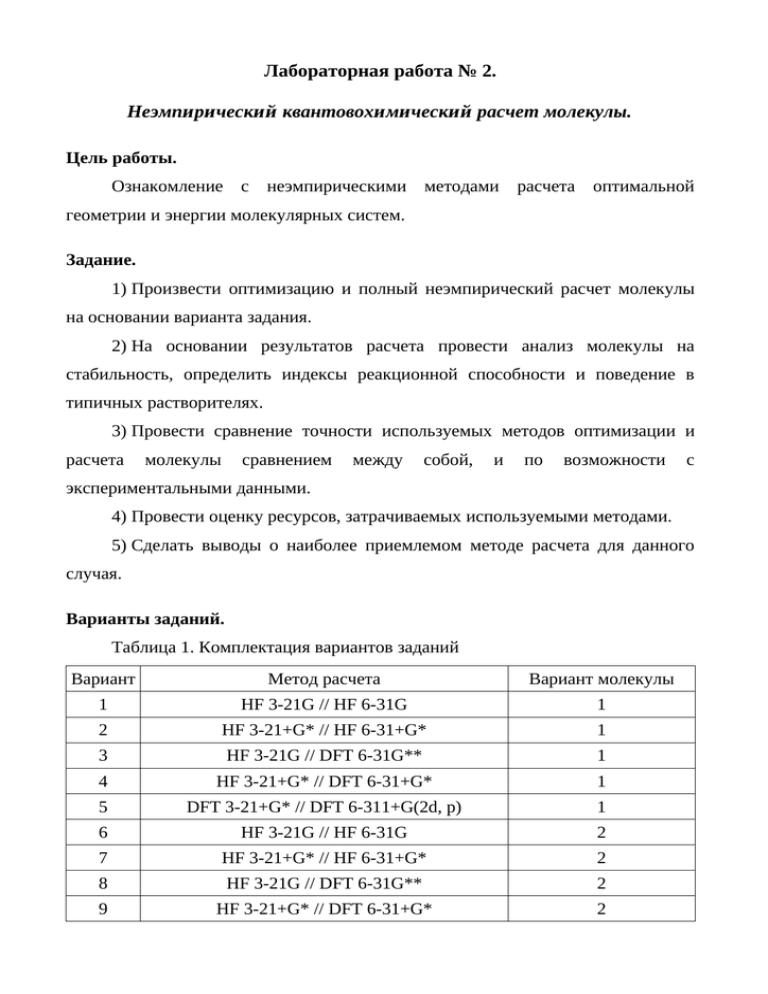
Лабораторная работа № 2. Неэмпирический квантовохимический расчет молекулы. Цель работы. Ознакомление с неэмпирическими методами расчета оптимальной геометрии и энергии молекулярных систем. Задание. 1) Произвести оптимизацию и полный неэмпирический расчет молекулы на основании варианта задания. 2) На основании результатов расчета провести анализ молекулы на стабильность, определить индексы реакционной способности и поведение в типичных растворителях. 3) Провести сравнение точности используемых методов оптимизации и расчета молекулы сравнением между собой, и по возможности с экспериментальными данными. 4) Провести оценку ресурсов, затрачиваемых используемыми методами. 5) Сделать выводы о наиболее приемлемом методе расчета для данного случая. Варианты заданий. Таблица 1. Комплектация вариантов заданий Вариант Метод расчета Вариант молекулы 1 HF 3-21G // HF 6-31G 1 2 HF 3-21+G* // HF 6-31+G* 1 3 HF 3-21G // DFT 6-31G** 1 4 HF 3-21+G* // DFT 6-31+G* 1 5 DFT 3-21+G* // DFT 6-311+G(2d, p) 1 6 HF 3-21G // HF 6-31G 2 7 HF 3-21+G* // HF 6-31+G* 2 8 HF 3-21G // DFT 6-31G** 2 9 HF 3-21+G* // DFT 6-31+G* 2 10 DFT 3-21+G* // DFT 6-311+G(2d, p) 2 11 HF 3-21G // HF 6-31G 3 12 HF 3-21+G* // HF 6-31+G* 3 13 HF 3-21G // DFT 6-31G** 3 14 HF 3-21+G* // DFT 6-31+G* 3 15 DFT 3-21+G* // DFT 6-311+G(2d, p) 3 Таблица 2. Варианты молекул Вариант Название по ИЮПАК 1. толуол 2. анилин 3. фенилгидразин 4. трихлор-1,3,5-триазин 5. 3-нитротолуол Методика выполнения. 1) В пакете Gabedit строится модель молекулы выбранного вещества и создается inp-файл для оптимизации геометрии системы. 2) Оптимизируется геометрия системы. 3) По данным out-файла определяется оптимизированная геометрия системы, и на основе оптимизированной геометрии создается inp-файл для расчета энергетических характеристик системы. 4) Рассчитываются энергетические характеристики системы. 5) Пункты 1 – 4 повторяются для всех молекул. Производится анализ результатов расчета: 6) Оценка стабильности молекулы, расчет энтальпии образования, сравнение ее, если возможно с экспериментальными значениями. 7) Оценка геометрии системы и характеристик связей, сравнение с литературными данными. 8) Оценка реакционной способности молекулы, нуклеофильных/электрофильных свойств и центров возможных атак. расчет 9) Оценка растворимости молекулы в полярных и неполярных растворителях. Теоретические основы и методические указания по анализу результатов. Оценка стабильности молекулы. Оценка стабильности молекулы проводится на основе ее энтальпии образования. При этом оценку энтальпии образования при неэмпирическом расчете можно провести 2 способами: 1) Как разность энергии молекулы и составляющих ее простых веществ. Например, для молекулы анилина (брутто-формула C6H7N), при допущении что простые вещества имеют формулы C2, H2, и N2, формула для вычисления энтропии образования имеет вид: ΔH = E(C6H7N) – 6/2·E(C2) – 7/2·E(H2) – 1/2·E(N2) 2) Из вибрационного анализа молекулы (флаг runtyp=hessian входного файла пакета PCGAMESS). У каждого из этих методов есть свои достоинства и недостатки. Для первого метода допущение о двухатомных молекулах простых веществ верно далеко не всегда, плюс к тому же, энтальпия образования посчитанная таким образом, это энтальпия одиночной молекулы в вакууме при T = 0 K без учета энергии нулевых колебаний и влияния температуры.. Для второго метода накладывается ограничение, что матрица гессиана (вторых производных энергии по атомным координатам) не должна содержать отрицательные значения, что соответствует точке минимума энергии системы и отсутствию мнимых частот в спектре колебаний, иначе вибрационный анализ молекулы некорректен. Этого можно добиться правильной оптимизацией геометрии, т. е. нахождения истинного минимума, не важно локального или глобального, который, однако, зависит от используемого базиса и метода расчета. Проверку на отсутствие мнимых частот можно осуществлять автоматически, используя флаг hssend=.t., при использовании которого производится контроль гессиана при успешной оптимизации, однако, при использовании более широкого базиса при вибрационном анализе этого зачастую недостаточно. Вывод о стабильности молекулы делается на основании величины и знака ее энтальпии образования. Оценка геометрии системы, характеристик связей и распределения зарядов. Сравнение производится по межъядерным расстояниям, валентным и торсионным углам. При отсутствии экспериментальных данных сравнение производится с характерными длинами связей и углами для данного типа соединений, например длина связи C-H в алкенах близка к 1.083 Å. Оцениваются валентности атомов по Коулсону. Оцениваются порядки связей в соединении и заряды на атомах по Лоудину. Первые две характеристики могут дать информацию о типах связей в соединении. Заряды на атомах по теории Лоудина (или Малликена) по сути не отражают реальное распределение электрического заряда между атомами, т. к. в них не существует само понятие атома и они чувствительны к выбору базиса, но для качественной оценки распределения зарядов и поиска возможных центров нуклеофильной либо электрофильной атаки они вполне сгодятся. По значениям валентных углов определяется тип гибридизации на каждом из атомов и сравнивается со стандартными, исходя из типа атомов, его валентности и кратности связей. Оценка реакционной способности. Реакционная способность молекул оценивается исходя из анализа заселенности и энергетических характеристик молекулярных орбиталей. Отнесение молекул к нуклеофильным либо электрофильным реагентам осуществляется по знаку энергии нижней вакантной молекулярной орбитали (НВМО) молекулы: знак «+» - нуклеофил; знак «–» - электрофил. Зарядовый или орбитальный контроль реакций определяется отнесением реагента к жесткому либо мягкому типу. Реагент считается мягким, если его граничная молекулярная орбиталь (верхняя занятая, ВЗМО нуклеофила или НВМО электрофила) отделена от других орбиталей энергетической щелью более 1 эВ, иначе жесткий. Для количественного описания абсолютной жесткости Пирсоном предложено соотношение: η= ( E НВМО – E ВЗМО ) 2 (1) Мягкость молекулы связана с жесткостью соотношением: S= 1 1 = 2⋅η ( E НВМО – E ВЗМО ) (2) Возможные центры нуклеофильных и электрофильных атак будем определять по индексам реакционной способности: зарядах на атомах, для жестких реагентов и граничной плотностью электронов на атомах, для мягких реагентов. Заряды на атомах по Лоудину приведены в предыдущем пункту, на основании их величины и знака делается вывод о возможных местах нуклеофильной либо электрофильной атаки. Граничная плотность электронов рассчитывается для всех атомов А по формуле: f A =2⋅∑ c 2iμ μ∈ A (3) где ciμ - коэффициенты разложения граничной молекулярной орбитали (ВЗМО нуклеофила или НВМО электрофила) по атомным орбиталям, центрированным на атоме А. На основании величины fА делается вывод о возможных местах нуклеофильной либо электрофильной атаки. Оценка растворимости. Растворимость вещества в полярных либо неполярных растворителях зависит от близости дипольных моментов растворителя и растворяемого вещества, таким образом, для оценки растворимости необходимо сравнить расчетный дипольный момент молекулы и табличные данные по дипольным моментам известных растворителей. Список литературы. 1. Краткий справочник физико-химических величин / под ред. А.А. Равделя и А.М. Пономаревой. – Л.: Химия, 1983. – 232 с. 2. GAMESS: User Manual and Reference Guide [Электронный ресурс]. – 1999. – 209 pp. 3. Алексеев, А.И. Термодинамический анализ реакций в химической технологии: Учебное пособие / А.И. Алексеев, О.В. Кулинич, Л.П. Рамзаева, С. Юзвяк. – СПб.: СЗТУ, 2003. – 135 с. 4. Путилов, К.А. Термодинамика / К.А. Путилов. – М.: Наука, 1971. – 376 с. 5. Самуилов, Я.Д. Реакционная способность органических соединений: учебное пособие / Я.Д. Самуилов, Е.Н. Черезова. – Казань: Казан. гос. технол. Ун-т., 2003. – 419 с. 6. Реутов, О.А. Органическая химия. Ч. 1 / О.А. Реутов, А.Л. Курц, К.П. Бутин. – М.: Изд-во МГУ, 1999 – 560 с. 7. Апостолова, Е.С. Квантово-химическое описание реакций / Е.С. Апостолова, А.И. Михайлюк, В.Г. Цирельсон. – М.: РХТУ, 1999 – 61 с. 8. http://classic.chem.msu.su/gran/gamess/index.html 9. http://gabedit.sourceforge.net/

