Лекция 17 Тема:
реклама
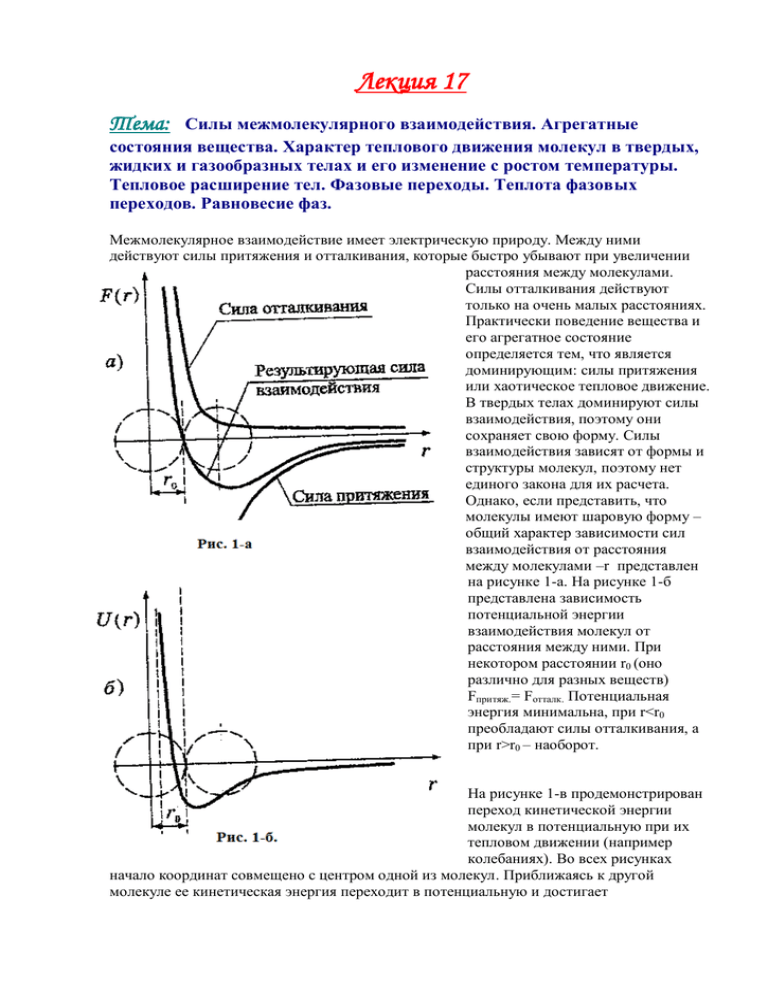
Лекция 17 Тема: Силы межмолекулярного взаимодействия. Агрегатные состояния вещества. Характер теплового движения молекул в твердых, жидких и газообразных телах и его изменение с ростом температуры. Тепловое расширение тел. Фазовые переходы. Теплота фазовых переходов. Равновесие фаз. Межмолекулярное взаимодействие имеет электрическую природу. Между ними действуют силы притяжения и отталкивания, которые быстро убывают при увеличении расстояния между молекулами. Силы отталкивания действуют только на очень малых расстояниях. Практически поведение вещества и его агрегатное состояние определяется тем, что является доминирующим: силы притяжения или хаотическое тепловое движение. В твердых телах доминируют силы взаимодействия, поэтому они сохраняет свою форму. Силы взаимодействия зависят от формы и структуры молекул, поэтому нет единого закона для их расчета. Однако, если представить, что молекулы имеют шаровую форму – общий характер зависимости сил взаимодействия от расстояния между молекулами –r представлен на рисунке 1-а. На рисунке 1-б представлена зависимость потенциальной энергии взаимодействия молекул от расстояния между ними. При некотором расстоянии r0 (оно различно для разных веществ) Fпритяж.= Fотталк. Потенциальная энергия минимальна, при r<r0 преобладают силы отталкивания, а при r>r0 – наоборот. На рисунке 1-в продемонстрирован переход кинетической энергии молекул в потенциальную при их тепловом движении (например колебаниях). Во всех рисунках начало координат совмещено с центром одной из молекул. Приближаясь к другой молекуле ее кинетическая энергия переходит в потенциальную и достигает максимального значения при расстояниях r=d. d называется эффективным диаметром молекул (минимальное расстояние, на которое сближаются центры двух молекул. Понятно, что эффективный диаметр зависит, в том числе, от температуры, так как при большей температуре молекулы могут сблизится сильнее. При низких температурах, когда кинетическая энергия молекул мала, они притягиваются вплотную и установятся в определенном порядке – твердое агрегатное состояние. Тепловое движение в твердых телах является в основном колебательным. При высоких температурах интенсивное тепловое движение мешает сближению молекул – газообразное состояние, движение молекул поступательное и вращательное. . В газах менее 1% объема приходится на объем самих молекул. При промежуточных значениях температур молекулы будут непрерывно перемещаться в пространстве, обмениваясь местами, однако расстояние между ними не намного превышает d – жидкость. Характер движения молекул в жидкости носит колебательный и поступательный характер ( в тот момент, когда они перескакивают в новое положение равновесия). Тепловое движение молекул объясняет явление теплового расширения тел. При нагревании амплитуда колебательного движения молекул увеличивается, что приводит к увеличению размеров тел. Линейное расширение твердого тела описывается формулой: l l 0 (1 t ) , где - коэффициент линейного расширения 10-5 К-1. Объемное расширение тел описывается аналогичной формулой: V V0 (1 t ) , - коэффициент объемного расширения, причем =3. Вещество может находится в твердом, жидком, газообразном состояниях. Эти состояния называют агрегатными состояниями вещества. Вещество может переходить из одного состояния в другое. Характерной особенностью превращения вещества является возможность существования стабильных неоднородных систем, когда вещество может находится сразу в нескольких агрегатных состояниях. При описании таких систем пользуются более широким понятием фазы вещества. Например, углерод в твердом агрегатном состоянии может находится в двух различных фазах – алмаз и графит. Фазой называется совокупность всех частей системы, которая в отсутствии внешнего воздействия является физически однородной. Если несколько фаз вещества при данной температуре и давлении существуют, соприкасаясь друг с другом, и при этом масса одной фазы не увеличивается за счет уменьшения другой, то говорят о фазовом равновесии. Переход вещества из одной фазы в другую называют фазовым переходом. При фазовом переходе происходит скачкообразное (происходящее в узком интервале температур) качественное изменение свойств вещества. Эти переходы сопровождаются скачкообразным изменением энергии, плотности и других параметров. Бывают фазовые переходы первого и второго рода. К фазовым переходам первого рода относят плавление, отвердевание (кристаллизацию), испарение, конденсацию и сублимацию (испарения с поверхности твердого тела). Фазовые переходы этого рода всегда связаны с выделением или поглощением теплоты, называемой скрытой теплотой фазового перехода. При фазовых переходах второго рода отсутствует скачкообразное изменение энергии и плотности. Теплота фазового перехода тоже равна 0. Превращения при таких переходах происходят сразу во всем объеме в результате изменения кристаллической решетки при определенной температуре, которая называется точкой Кюри. Рассмотрим переход первого рода. При нагревании тела, как отмечалось, происходит тепловое расширение тела и как следствие уменьшения потенциальной энергии взаимодействия частиц. Возникает ситуация, когда при некоторой температуре соотношения между потенциальной и кинетической энергиями не могут обеспечить равновесии старого фазового состояния и вещество переходит в новую фазу. Плавление – переход из кристаллического состояния в жидкое. Q=m, удельная теплота плавления, показывает какое количество теплоты необходимо, чтобы перевести 1 кг твердого вещества в жидкое при температуре плавления, измеряется в Дж/кг. При кристаллизации выделяющееся количество теплоты рассчитывают по этой же формуле. Плавлении и кристаллизация происходят при определенной для данного вещества температуре, называемой температурой плавления. Испарение. Молекулы в жидкости связаны силами притяжения, однако некоторые, самые быстрые молекулы могут покидать объем жидкости. При этом средняя кинетическая энергия оставшихся молекул уменьшается и жидкость охлаждается. Для поддержания испарения необходимо подводить тепло: Q=rm, r – удельная теплота парообразования, которая показывает какое количество теплоты необходимо затратить, чтобы перевести в газообразное состояния 1 кг жидкости при постоянной температуре. Единица: Дж/кг. При конденсации теплота выделяется. Теплота сгорания топлива рассчитывается по формуле: Q=qm. В условиях механического и теплового равновесия состояния неоднородных систем определяются заданием давления и температуры, так как эти параметры одинаковы для каждой из частей системы. Опыт показывает, что при равновесии двух фаз давление и температура связаны между собой зависимостью, представляющей собой кривую фазового равновесия. Точки, лежащие на кривой, описывают неоднородную систему, в которой существуют две фазы. Точки, лежащие внутри областей, описывают однородные состояния вещества. Если кривые всех фазовых равновесий одного вещества построить на плоскости, то они разобьют ее на отдельные области, а сами сойдутся в одной точке, которая называется тройная точка. Эта точка описывает состояние вещества, в котором могут сосуществовать все три фазы. На рисунке 2 построены диаграммы состояния воды. Тройная точка, соответствующая 00С равновесие льда, воды и пара.

