Металлы и неметаллы
реклама
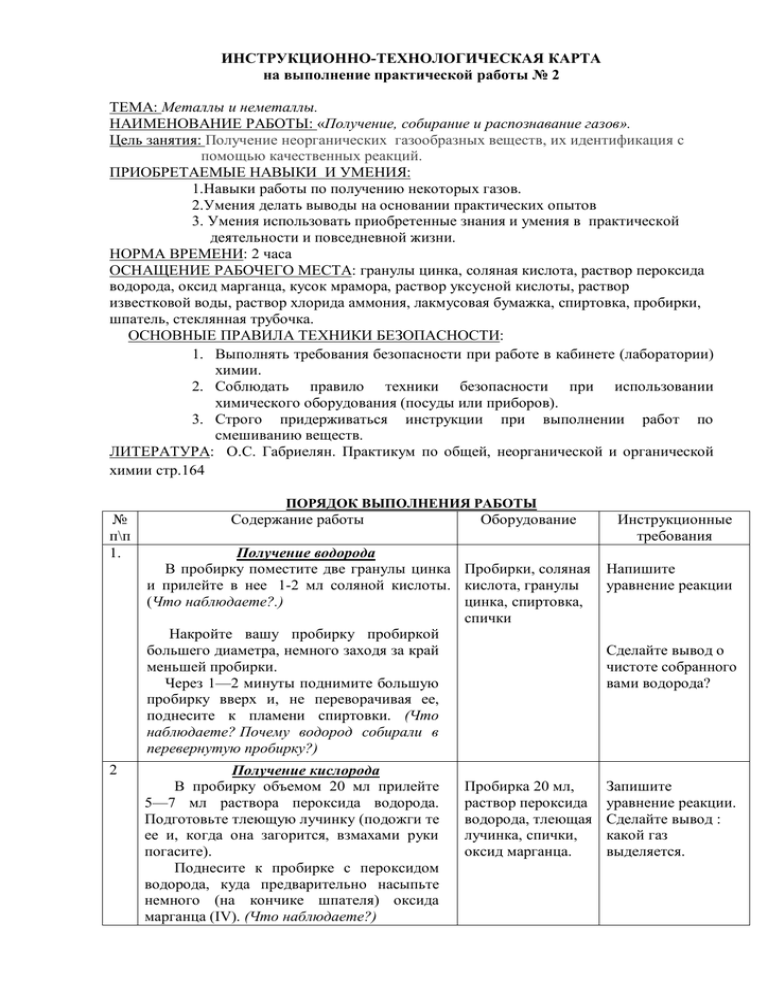
ИНСТРУКЦИОННО-ТЕХНОЛОГИЧЕСКАЯ КАРТА на выполнение практической работы № 2 ТЕМА: Металлы и неметаллы. НАИМЕНОВАНИЕ РАБОТЫ: «Получение, собирание и распознавание газов». Цель занятия: Получение неорганических газообразных веществ, их идентификация с помощью качественных реакций. ПРИОБРЕТАЕМЫЕ НАВЫКИ И УМЕНИЯ: 1.Навыки работы по получению некоторых газов. 2.Умения делать выводы на основании практических опытов 3. Умения использовать приобретенные знания и умения в практической деятельности и повседневной жизни. НОРМА ВРЕМЕНИ: 2 часа ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА: гранулы цинка, соляная кислота, раствор пероксида водорода, оксид марганца, кусок мрамора, раствор уксусной кислоты, раствор известковой воды, раствор хлорида аммония, лакмусовая бумажка, спиртовка, пробирки, шпатель, стеклянная трубочка. ОСНОВНЫЕ ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ: 1. Выполнять требования безопасности при работе в кабинете (лаборатории) химии. 2. Соблюдать правило техники безопасности при использовании химического оборудования (посуды или приборов). 3. Строго придерживаться инструкции при выполнении работ по смешиванию веществ. ЛИТЕРАТУРА: О.С. Габриелян. Практикум по общей, неорганической и органической химии стр.164 ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ № п\п 1. 2 Содержание работы Оборудование Получение водорода В пробирку поместите две гранулы цинка Пробирки, соляная и прилейте в нее 1-2 мл соляной кислоты. кислота, гранулы (Что наблюдаете?.) цинка, спиртовка, спички Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1—2 минуты поднимите большую пробирку вверх и, не переворачивая ее, поднесите к пламени спиртовки. (Что наблюдаете? Почему водород собирали в перевернутую пробирку?) Получение кислорода В пробирку объемом 20 мл прилейте 5—7 мл раствора пероксида водорода. Подготовьте тлеющую лучинку (подожги те ее и, когда она загорится, взмахами руки погасите). Поднесите к пробирке с пероксидом водорода, куда предварительно насыпьте немного (на кончике шпателя) оксида марганца (IV). (Что наблюдаете?) Пробирка 20 мл, раствор пероксида водорода, тлеющая лучинка, спички, оксид марганца. Инструкционные требования Напишите уравнение реакции Сделайте вывод о чистоте собранного вами водорода? Запишите уравнение реакции. Сделайте вывод : какой газ выделяется. 3. 4. Получение углекислого газа В пробирку объемом 20 мл поместите кусочек мрамора и прилейте раствор уксусной кислоты. (Что наблюдаете?) Через 1—2 минуты внесите в верхнюю часть пробирки горящую лучинку. (Что наблюдаете?) В пробирку налейте 1—2 мл прозрачного раствора известковой воды. Используя чистую стеклянную трубочку, осторожно продувайте через раствор выдыхаемый вами воздух. (Что наблюдаете?) Получение аммиака В пробирку прилейте 1—2 мл раствора хлорида аммония, а затем такой же объем раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. (Что наблюдаете?) Запишите уравнение реакции в молекулярной и ионной формах. Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. (Что наблюдаете?) Осторожно понюхайте выделяющийся газ. (Что ощущаете?) Пробирка объемом 20 мл, кусочек мрамора, раствор уксусной кислоты, лучинка, спички, известковая вода, стеклянная трубочка. Запишите уравнение реакции в молекулярной и ионной формах. Пробирки, хлорид аммония (NH4CI), гидроксид натрия, держатель, спиртовка, спички, лакмусовая бумага. Запишите уравнение реакции в молекулярной и ионной формах. Запишите уравнение реакции в молекулярной и ионной формах ОФОРМИТЬ ОТЧЕТ ПО СЛЕДУЮЩЕЙ СХЕМЕ № п\п Ход работы Наблюдения Вывод КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Напишите уравнения реакций, иллюстрирующие следующие превращения: Сl2 → НСl→СuСl2 →ZnСl2 → АgСl 2. Определите коэффициенты в уравнении следующей химической реакции, используя метод электронного баланса: СuО + NН3→ Сu + N2 + Н2 Преподаватель: ___________ Дорошенко М.Г











