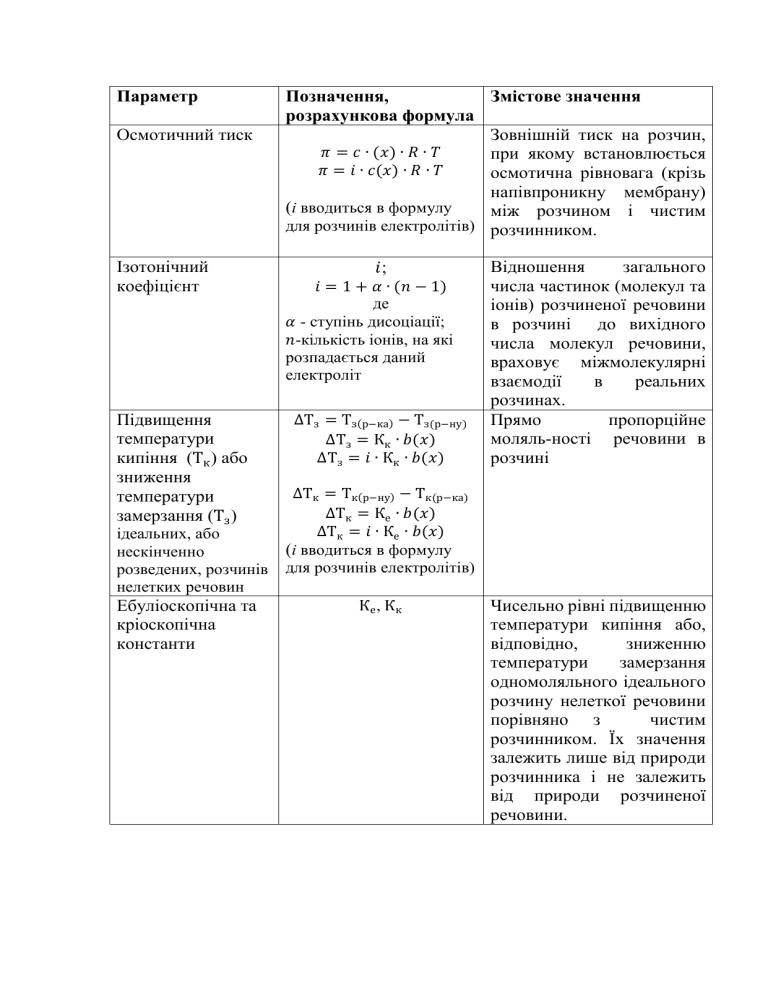
Параметр Осмотичний тиск Ізотонічний коефіцієнт Підвищення температури кипіння (Тк ) або зниження температури замерзання (Тз ) ідеальних, або нескінченно розведених, розчинів нелетких речовин Ебуліоскопічна та кріоскопічна константи Позначення, Змістове значення розрахункова формула Зовнішній тиск на розчин, 𝜋 = 𝑐 ∙ (𝑥) ∙ 𝑅 ∙ 𝑇 при якому встановлюється 𝜋 = 𝑖 ∙ 𝑐(𝑥) ∙ 𝑅 ∙ 𝑇 осмотична рівновага (крізь напівпроникну мембрану) (i вводиться в формулу між розчином і чистим для розчинів електролітів) розчинником. 𝑖; 𝑖 = 1 + 𝛼 ∙ (𝑛 − 1) де 𝛼 - ступінь дисоціації; 𝑛-кількість іонів, на які розпадається даний електроліт ∆Тз = Тз(р−ка) − Тз(р−ну) ∆Тз = Кк ∙ 𝑏(𝑥) ∆Тз = 𝑖 ∙ Кк ∙ 𝑏(𝑥) Відношення загального числа частинок (молекул та іонів) розчиненої речовини в розчині до вихідного числа молекул речовини, враховує міжмолекулярні взаємодії в реальних розчинах. Прямо пропорційне моляль-ності речовини в розчині ∆Тк = Тк(р−ну) − Тк(р−ка) ∆Тк = Ке ∙ 𝑏(𝑥) ∆Тк = 𝑖 ∙ Ке ∙ 𝑏(𝑥) (i вводиться в формулу для розчинів електролітів) Ке , Кк Чисельно рівні підвищенню температури кипіння або, відповідно, зниженню температури замерзання одномоляльного ідеального розчину нелеткої речовини порівняно з чистим розчинником. Їх значення залежить лише від природи розчинника і не залежить від природи розчиненої речовини.







