03 Регуляция активности ферментов.
advertisement

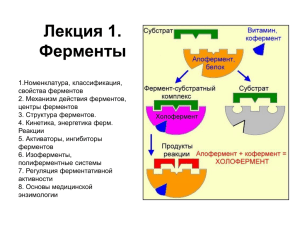
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ, ФЕРМЕНТОДИАГНОСТИКА. ФЕРМЕНТОПАТИИ. ЭНЗИМОТЕРАПИЯ. Michaelis і Menten – первые иследовали кинетику реакций (1913) Во время реакции молекула фермента, E и молекула субстрата S, формируют промежуточный ферментсубстратный (ES) комплекс E + S k1 k-1 ES k2 k-2 E + P k1, k-1, k2 – константы скорости – указывают на скорость или эффективность реакций Скорость катализа - При фиксировании концентрации фермента начальная скорость реакции линиейно пропорционная концентрации субстрата -Скорость реакции возрастает линейно при увеличении концентрации субстрата и потом прекращается при насыщении фермента Аналоги субстратов –структурно похожи на субстрат фермента -ковалентно модифицируют активный центр Кинетика ферментативных реакций Действие концентрации субстрата на скорость реакции Суицидные ингибиторы •Ингибитор связывается как субстрат и сначала инициирует нормальный каталитический механизм •Потом образуются химически реактивные соединения, которые инактивируют фермент ковалентную модификацию •”Суицидный” потому что фермент сам принимает участие в своем инактивировании Регуляция активности ферментов Методы регуляции активности ферментов • • • • Аллостерическая регуляция Обратимая ковалентная модификация Изоферменты Протеолитическая активация Аллостерические ферменты Аллостерические ферменты имеют специальный регуляторный участок (аллостерический центр), который пространственно отдален от активного центра Аллостерические модуляторы -связываются нековалентно с аллостерическим центром - регулируют активность фермента изменяя его конформацию Регуляция активности ферментов путем ковалентной модификации Ковалентное присоединение молекулы к аминокислотному остатку фермента может модифицировать активность последнего Типы ковалентной модификации: -фосфорилирование; -ацетилирование; -карбоксилирование и др. Фосфорилирование Реакция дефосфорилирования Как правило, фосфорилированные ферменты более активные Ферменты, ответственные за фосфорилирование - протеинкиназы Ферменты, ответственные за дефосфорилирование – фосфатазы Коферментом моноаминооксидазы является ФАД Изоферменты множесственные формы фермента, которые отличаются аминокислотной последовательностью, но катализируют ту же реакцию Изоферменты могут отличаться: кинет икой, регулят орными свойст вами, коэнзимом, распрост ранением в клет ках и т канях Изоферменты кодируются разными генами Пример: лакт ат дегидрогеназа (ЛДГ) Лактат + НАД+ пируват + НАДН + H+ – tetramer (4 субединицы) – состоит из двух типов полипептидных цепей, М и Н Есть 5 изоферментов ЛДГ: H4 – в сердце HM3 H2M2 H3M M4 – в печени, мышцах Изоферменты – важны для диагностики различных заболеваний Протеолитическая активация • Много ферментов синтезируются как неактивные предшественники (зимогены) и активируются протеолитическим расщеплением Примеры специфического протеолиза •Ферменты перетравливания –синтезируются как зимогены в желудке и поджелудочной железе •Ферменты свертывания крови –каскад протеолитической активации •Некоторые белковые гормоны –проинсулин в инсулин путем удаления пептида Полиферментные комплексы и полифункциональные ферменты • Полиферментные комплексы - разные ферменты, которые катализируют последовательные реакции одного процесса и пространственно размещаются в одном месте -продукт одной реакции переносится прямо на активный центр следующего фермента -значительно увеличивается скорость реакции • Полифункциональные ферменты – в зависимости от условий один фермент может иметь различные активности Безконкурентное торможение • Інгибитор присоединяется к ES но не к свободному E • Присутствует только в мультисубстратных реакциях Неконкурентное торможение • Ингибитор присоединяется не к активному центру, а к другому участку фермента • Ингибитор и субстрат могут связыватся с ферментом в одно и то же время •Ингибитор может связыватся как с ферментом (EI) , так и с фермент-субстратным комплексом (ESI) •Ингибитор не может быть вытеснен путём увеличения концентрации субстрата Конкурентное торможение Бензамидин конкурирует с аргинином при связывании с трипсином Ингибирование ферментов Разные химические агенты (метаболиты, аналоги субстратов, токсины, лекарственные препараты, металы и др.) могут ингибировать активность ферментов Ингибирование – И связывается с ферментом и предуприждает формирование комплекса ЕS либо его расщепление на E + P Обратимые и необратимые ингибиторы Обратимые ингибиторы – после связывания с ферментом (образование EI комплекса) быстро дисоциирует EI комплекс удерживается вместе с помощью слабых нековалентных связей Три типа обратимого ингибирования: Конкурентное, Неконкурентное, Безконкурентное Обратимое ингибирование Конкурентное торможение •Ингибитор за структурой похожий на субстрат, и связывается с тем же активным центром •Фермент не может розличать ингибитор и субстрат •Присоединение ингибитора к активному центру предупреждает связывание субстрата •Конкурентный ингибитор снижает скорость катализа снижается количество молекул фермента, связанных с субстратом •Ингибитор может быть вытеснен из активного центра путём увеличения концентрации субстрата Необратимое ингибирование Очень медленная дисоциация EI комплекса Ингибитор связывается ковалентными связями с ферментом Необратимые ингибиторы •ингибит оры специфические к группам аминокислот ных ост ат ков •аналоги субст рат ов •суицидные ингибит оры 2 типа аллостерических модуляторов • От рецат ельные модулят оры (ингибит оры) –связываются с аллостерическим центром и ингибируют активность фермента; – являются конечными продуктами биохимических путей – обратимая отрицательная связь • Положит ельные модулят оры (акт иват оры) –связываются с аллостерическим центром и стимулируют активность фермента; –обычно являются субстратом реакции – обратимая отрицательная связь Влияние концентраци фермента на скорость реакции При достаточной концентрации субстрата чем выше концентрация фермента, тем выше скорость реакции Уровнение Michaelis-Menten Vmax[S] vo = Km + [S] Km – константа Michaelis; Vo – начальная скорость, [S]; Vmax – максимальная скорость Пример аллостерического фермента – фосфофруктокиназа-1 (ФФК-1) • Катализует реакцию гликолиза в начале процесса • Фосфоэнолпируват, промежуточное соединение с конца гликолиза, е аллостерическим ингибитором ФФК-1 PEP Спасибо за внимание!