03Адсорбция твердым телом
advertisement

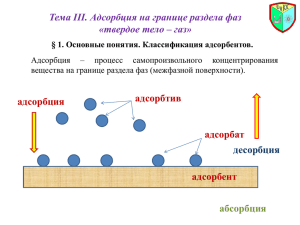
Адсорбция на поверхности твердого тела План 1. Адсорбция на границе твердое тело – газ. Физическая и химическая адсорбция. 2. Теория мономолекулярной адсорбции Ленгмюра и полимолекулярной адсорбции БЭТ. Уравнение Фрейндлиха. 3. Адсорбция на границе твердое тело – раствор. Адсорбция електролитов. 4. Значение адсорбции. Подготовила к.х.н., доц. Иванец Л.Н. Основные различия между физической и химической адсорбцией Физическая адсорбция 1) Теплота адсорбции ~ 10 ÷ 30 кДж/моль 2) Скорость адсорбции W ~ a – число ударов о стенку 3) Температурная зависимость скорости W ~ a ~ T 4) Адсорбция неспецифична и ряд по адсорбируемости сохраняется на любом адсорбенте. Химическая адсорбция 1) ~ 100 ÷ 300 кДж/моль 2) W ae E RT , где Е > 80 ÷ 120 кДж/моль 3) Скорость процесса резко увеличивается с температурой 4) Адсорбция специфична. Данный газ может с одним адсорбентом реагировать, с другим – нет. Изотермы адсорбции на мелкопористом (1), среднепористом (2) и крупнопористом (3) адсорбентах Влияние темпертуры на процесс адсорбции Зависимость объема адсорбированного никелем водорода от температуры Основные тезисы теории адсорбции Ленгмюра: Адсорбция локализована на адсорбционных центрах Каждый адсорбционный центр взаимодействует с одной молекулой Адсорбированные молекулы не взаимодействуют между собой Адсорбция – процес обратимый Уравнение Ленгмюра : KС Г Г 1 KС При С <<1: При С >>1: Г Г Г Г KC 1 Ê , если Г = Г∞/2 C Линейная форма уравнения: 1 1 1 1 à Ã∞ Ã Ê C Изотерма адсорбции Лэнгмюра ½Г∞ Уравнение Фрейндлиха: x 1/ n à kC m k = Г, когда С = 1 Линейная форма уравнения: ln Г = ln k + 1/n lnC Изотерма адсорбции Фрейндлиха Г Г С С Графическое нахождение констант в уравнении Фрейндлиха lg Г lg K 1 / n lg C Характеристика уравнения Фрейндлиха: Уравнение получено эмпирически (экспериментально); Применимо только для твердых поверхностей; Справедливо только для средних концентраций. Схема строения адсорбционного слоя по теории БЭТ Полимолекулярная адсорбция Г С А + В↔ АВ АВ + В ↔ АВ2 АВ2 + В ↔ АВ3 Ориентация молекул ПАВ на поверхности адсорбента Гидрофобизация гидрофильной поверхности Адсорбция твердыми телами Величина адсорбции зависит от: 1. Размера поверхности адсорбента чем > Sповерхности, тем > адсорбция. 2. Температуры (↑t ↓Г ). 3. Типа сорбента, его сродства к растворителю. - гидрофильные сорбенты (силикагель SiO2, глина, пористое стекло) для адсорбции полярных веществ из неполярных (неводных) растворителей. - гидрофобные сорбенты (активированный уголь, графит, тальк) для адсорбции неполярных веществ из полярных растворителей. 4. Заряда адсорбента и адсорбтива. 5. Концентрации адсорбтива. Правило Панета-Фаянса Из раствора адсорбируются те ионы, которые входят в состав кристаллической решетки сорбента или образуют с ним малорастворимое соединение. Определить знак заряда поверхности AgI(крист.) полученного по реакции: АgNО3(р) + КI(р) = АgI(крист.) + KNO3(р) а) nАgNО3 = nКI : поверхность осадка не заряжена; б) nАgNO3 > nКI : в) nАgNО3 < nКI : избыток АgNO3 Аg+ + NО3избыток КI К+ + IАgI + + + АgI - Ионообменная адсорбция Ионообменная адсорбция – процесс, в котором адсорбент и раствор обмениваются между собой в эквивалентных количествах одноименно заряженными ионами. RM1 + М2+ → RM2 + M1+ обмен катионов катионит RА1 + А2- → RА2 + А1- обмен анионов анионит Схема структуры ионита (катионита) + + 1 + + + + + + + 2 3 + + 1 – матрица ионита (каркас); 2 – функциональные группы ( ковалентно связаны с матрицей); 3 – противоионы ( электростатически связаны с ионогенными группами) По знаку обменивающихся ионов иониты делятся: 1. Катиониты: R – SO3– H+ ; R – COO–H+; R – S–H+ 2. Аниониты: R+ – OH– 3. Амфолиты: N+(CH3)OH– R SO3–H+ R – матрица ионита Обменная емкость это количество ммоль эквивалентов ионов, которые может обменять 1г сухого или 1мл набухшего ионита на ионы, находящиеся в растворе СИ: [ммоль/г], [ммоль/мл] Схема ионообменного обессоливания воды II анионит I катионит Исходная вода Диминерализованная вода Катионит: 2R – An–H+ + CaCl2 ↔ (R – An–)2Ca2+ + 2HCl Анионит: R – Kt+OH– + HCl ↔ R – Kt+Cl– + H2O Ионная адсорбция зависит: От величины заряда адсорбируемых ионов: K+ ‹ Ca2+ ‹ Al3+ ‹ Th4+ От радиуса иона в сольватированном состоянии: Li+ ‹ Na+ ‹ K+ ‹ Rb+ ‹ Cs+ увеличение гидратации увеличение адсорбции Хроматография Хроматография - динамический метод анализа, основанный на многократно повторяющихся процессах сорбции и десорбции. А+В А В Сущность хроматографии: это процесс, основанный на различии в скоростях движения исследуемых компонентов; динамический многократное характер процесса; повторение процессов сорбции и десорбции Aдсорбционная хроматография Сорбенты: Полярные: Неполярные: - оксид алюминия (Al2O3 ∙nH2O) - силикагель (SiO2 ∙ nH2O) - крахмал - целлюлоза - активированный уголь - графитированная сажа Растворители: вода, спирты, бензол, гексан и другие углеводороды СОРБЦИОННЫЕ ПРОЦЕССЫ В ОРГАНИЗМЕ ОПРЕДЕЛЯЮТСЯ ТЕМ, ЧТО: --поверхность кожи взрослого человека около 1,5 м²; -- площадь поверхности эритроцитов крови человека около 3500 м²; -- суммарная площадь поверхности 1 г белка 6000 м²; -- суммарная величина поверхностей раздела в организме несколько десятков миллионов м². Медико-биологическое значение темы: 1. Усвоение питательных и лекарственных веществ 2. Перенос О2 и СО2 из лёгких к тканям 3. Действие ферментов 4. Детоксикация организма: а) Гемосорбция - очистка крови б) Лимфосорбция - очистка лимфы. 5. Поглощение ядовитых веществ в желудочнокишечном тракте. 6. Хроматография: - разделение смесей аминокислот; - очистка лекарственных препаратов; - количественное определение витаминов, гормонов; - диагностика заболеваний Сорбенты медицинского назначения Гемосорбция Биоспецифичний антипротеиназний гемосорбент ОВОСОРБ С кровяного русла удаляется избыток патогенных сериновых протеиназ. Показания: сепсис, общий гнойный перитонит, острый панкреатит, ожоги, лучевая болезнь, отторжения после трансплантации органов и тканей