1334939_presentation
advertisement

Химический факультет
Кафедра аналитической химии
МАГНЕТОХИМИЯ
2008
Магнетохимия - раздел физической химии, в
котором изучается связь между магнитными и
химическими свойствами веществ
Термин «магнетохимия» используется как
краткий аналог выражения «исследование
химических
соединений
магнитными
методами»
Ланжевен, Кюри, Вейсс, Паскаль, Бете, Льюис,
Полинг, Ван Флек, Селвуд, Фиггис, Мюлей, Хэтфилд,
Зеленцов, Дорфман, Калинников, Ракитин
ЗАДАЧИ, КОТОРЫЕ РЕШАЕТ
МАГНЕТОХИМИЯ:
Определение степени окисления ионов
переходного металла, изучение дефектов,
областей гомогенности
Структурные задачи
Аналитические задачи
Изучение кинетики химических процессов
Метод магнитной
восприимчивости - основной
метод магнетохимии
Магнитная восприимчивость (χ )количественная мера отклика
вещества
на внешнее магнитное поле
М = χ*H ,
М – намагниченность, или магнитный
момент единицы объема, H – приложенное
поле.
единицы измерения
[M] гаусс
=
[H] эрстед
χизм
[χ ] =безразмерная величина
[см3/г],
emu/g = CGSM/g, emu/mol = CGSM/mol
ед. CGSM/ед.SI = 4π*10-3.
Аппаратурные методы
Силовые методы
Метод Гуи
Основан на измерении силы,
действующей на длинный цилиндрический
однородный образец в магнитном поле
mg 1 / 2( 0 )S ( H
2
max
H
2
min
χ0 — мв среды, S— площадь поперечного сечения
образца, Hmax и Hmin максимальная и минимальная
напряженность внешнего магнитного поля
)
Метод Фарадея
Измеряется сила, действующая на
малый образец, помещенный в
неоднородное магнитное поле
H
F mH 0
Z
Неоднородное магнитное поле, создаваемое
специальными полюсными наконечниками
электромагнита
Сочетание прецизионных весов с мощным
электромагнитом и наконечниками удачной формы
позволяет достичь в методе Фарадея
чувствительности не хуже 10 ед. СГСМ при точности
лучше 2 %
Пример реальной установки, предназначенной для
измерения магнитной восприимчивости методом
Фарадея в температурном интервале 77-300 K в
полях 2-10 кЭ
1 – кварцевая подвеска, 2 – корундовые иглы, 3 –
агатовые подпятники, 4 – ампула с исследуемым
веществом, 5 – наконечники электромагнита, 6 –
постоянные магнитики, 7 – соленоиды, 8 –
осветитель, 9 – зеркальце, 10 – шкала, 11 –
вилочный поводок, 12 – печь, 13 – термопара.
Метод Квинке
Измеряется изменение высоты
жидкости в капилляре под действием
магнитного поля
H 02 ( 0 )
h
2g
Метод вискозиметра
Измеряется время протекания заданного
объема жидкости через вискозиметр после
наложения внешнего магнитного поля
t0 t H
k
tH
Индукционные методы
В индукционных методах регистрируется
поле, создаваемое намагниченным образцом
.
Вибрационный магнетометр
Фонера
1 - динамик,
2 -катушки
сравнения,
3 - магнит,
4 - намагниченный
стержень,
5 – детектирующие
катушки,
6 – образец
Современный вибрационный
магнетометр фирмы
Современный
SQUID- магнетометр фирмы
SQUID-магнетометры
SQUID - superconducting quantum interference
device
СКВИД - сверхпроводящий квантовый
интерференционный датчик
В основе- эффект Джозефсона - квантование
магнитного потока при движении электронных пар
через тонкий изолятор (~ 50 А), помещенный между
двумя сверхпроводниками
Создание конструкции связано с именем американского
ученого Джона Кларка. Такие приборы обладают очень
высокой чувствительностью
Чувствительность SQUID:
1 fT=10-15 T=10-11Oe
Магнитное поле сердца:
50000 fT
Магнитное поле мозга:
5-7 fT
Анализ экспериментальных
данных
вещество втягивается в магнитное поле
+χ
вещество выталкивается из магнитного поля
-χ
М. Фарадей разделил объекты
dia -
paraМ.Фарадей
22.IX 1791 - 25.VIII 1867
1. на каких оболочках находятся электроны и как
они связаны с ядрами
электроны, находящиеся на внутренних
заполненных оболочках,
неспаренные электроны внешних оболочек,
делокализованные электроны.
2. наличие или отсутствие взаимодействия
между электронами соседних атомов
.
атомы (ионы) могут быть рассмотрены как
независимые центры,
связь ограничена определенной группой атомов
(ионов),
связь распространяется на всю решетку
Основные классы магнитных
веществ
Виды температурной зависимости магнитной
восприимчивости для различных магнетиков
ДИАМАГНИТНАЯ СОСТАВЛЯЮЩАЯ МАГНИТНОЙ
ВОСПРИИМЧИВОСТИ
χ~ - 10-7 - 10-5 см3/г;
MдиаH.
Этот род магнетизма обусловлен заполненными
оболочками атома (иона) и поэтому характерен для
всех веществ.
Он вызван прецессией электронов, индуцирующей
магнитный момент, направленный противоположно
внешнему полю.
Формула Ланжевена:
2
NZe
2
d
ri
2
6mc
ri - средний радиус орбитали i-го
электрона;
N - число электронов в атоме
П.Ланжевен
23.01 1872 -19.12 1946
Магнитная восприимчивость атомов и ионов
в зависимости от положения в периодической
таблице
Атом
χ ·106
Ион
χ ·106
F
-6.3
F-
- 9.4
Атом
χ ·106
Cl
-20.1
Cl -
-24.2
C
-6.00
Br
-30.6
Br-
- -34.5
N
-5.57
-50.6
-4.61
-44.6
I-
O
I
Аддитивная схема Паскаля
Молекулярные магнитные восприимчивости χm
аддитивно складываются из атомных
инкрементов χa,.
Детали строения учитываются с помощью
конститутивных поправок
N
d ni i i
i 1
χi - диамагнитная восприимчивость i-го
атома;
ni - число атомов данного вида;
λ - конститутивные поправки;
N - общее число атомов в молекуле
Пример:
χ(C6H6)=6 χ (C) + 6 χ(H)=-6(6+2.9)*10-6= -53.4*10-6 см3/моль.
Измеренная величина: -54.8*10-6 см3/моль.
Конститутивная поправка для бензольного кольца
λ = -1.4*10-6 см3/г-а.
Критерий
ароматичности
χd1 = -56.1·10-6 см3/моль,
χd2 = -53.9·10-6 см3/моль,
χd3 = -169.0·10-6 см3/моль
d3
d2
d1
Поляризационный парамагнетизм
Ван-Флека
Ne2
m
6mc2
n
2
r
i N
i 1
Деформация несферичной
электронной оболочки
приложенным магнитным
полем (H) приводит к
индуцированию магнитного
момента в направлении поля.
N 2 N 0
S Z 0
Д.Х.Ван-Флек
13. 03.1899 – 27.10 1980
Нобелевская премия по физике, 1977 г
2
E S E0
N0 – число Авогадро, S Z 0 - матричный
элемент z - компоненты орбитального
магнитного момента для основного (0) и
возбужденного (s) состояний, (ES - E0) –
разность энергий этих состояний.
Вычисление ван-флековской
составляющей.
χ= χd + χp
Сложность и неточность квантово-механической оценки
Формула Кирквуда
Позволяет, используя экспериментально
определенную электрическую поляризуемость (α),
рассчитать χd , и найти значение ван-флековского
парамагнетизма
Ne2
6
d
na
3
.
11
10
n
0
2
4mc
n
4
( ri 2 )
9a0 n i 1
2
a0 –наименьший радиус боровской
орбиты, равный 0.525 10-8 см,
n - число электронов иона
Диамагнетизм солевых систем
Теоретическая
зависимость χ , χр и χd от
состава в твердых
растворах ионных солей
Диамагнитная восприимчивость твердых
растворов в системе NaCl-KBr, о – твердый
раствор, +– механическая смесь
Идеальный диамагнетизм
Внешнее магнитное поле индуцирует в
сверхпроводнике токи, магнитное поле
которых противоположно внешнему.
Контур индуцированного тока охватывает
поверхность всего тела
B=0
сверх 1 / 4
Эффект Мейснера
ПАРАМАГНИТНАЯ СОСТАВЛЯЮЩАЯ МАГНИТНОЙ
ВОСПРИИМЧИВОСТИ
χ~ 10-6 – 10-3 см3/г
Mпара H
Источник парамагнетизма - орбитальное и спиновое
движение электронов.
Парамагнетизм - следствие двух противоположно
действующих
факторов:
приложенного
поля,
ориентирующего
все
магнитные
моменты
в
направлении поля, и теплового движения, которое
ведет к беспорядочному расположению моментов
H
H= 0; Σμ=0
H≠ 0; Σμ≠0
Ориентация магнитных моментов в поле
За парамагнетизм отвечают:
Атомы, молекулы, ионы и дефекты решетки, у
которых число электронов нечетное.
Примеры:
ионы переходных и редкоземельных металлов,
органические свободные радикалы,
F-центры в кристаллах галогенидов щелочных
металлов,
свободные атомы и ионы с незаполненной
внутренней электронной оболочкой.
Некоторые соединения с четным числом электронов:
молекулы кислорода
органические бирадикалы
Именно этот вид магнетизма содержит наибольшую
информацию, которая может интересовать химиков
ОЖИДАЕМАЯ ИНФОРМАЦИЯ
Степень окисления
Характер обменных взаимодействий с
другими парамагнитными центрами
Тип занимаемых позиций
Структурное упорядочение
Ближний порядок
Фазовые переходы
Химические превращения
Спиновое состояние
Характеристики химической связи
Закон Кюри
В 1905 г. Ланжевен рассмотрел модель
парамагнитного вещества в виде совокупности
невзаимодействующих между собой магнитных
стрелок с магнитным моментом μ, помещенных в
магнитное поле H и получил формулу, названную
его именем.
M=N μ L(x)
L(x) = cthx - 1/x функция Ланжевена
где x=μ H/kBT
В области умеренных полей и температур:
x«1 → cthx=1/x+x/3+…→ L(x)≈x/3 →
→ M≈Nμ2H/3kBT
χ= M/H= C/T
закон Кюри
Пьер Кюри
(1859–1906)
Нобелевская премия, 1903
Эффект Зеемана
При H=0 магнитные моменты электронов ориентированы
случайным образом, и их энергия практически не
отличается друг от друга (Е0). В поле магнитные моменты
ориентируются в зависимости от величины спинового
магнитного момента, и их энергетический уровень
расщепляется.
M=NAgJμBB(x), где x= gJμB H/kBT
B(x)=(2J+1)/2Jcth((2I+1)x/2J)-1/2Jcth(x/2J)
функция Бриллюэна
Условия применимости:
μH/kBT «1
Магнитный момент электрона: μ = 0.927 10-20 эрг/Гс
T~300 K; H~104Гс → μH/kBT ~0.002
Эффекты насыщения при низких
температурах и больших полях
Закон Кюри-Вейсса
χ= A0+С/(T-Θ) ;
Θ – константа Вейсса
(эмпирическая константа, отражающая
неидеальность системы)
Θ
2S(S 1)
zm J m
3k
m 1
N'
Молекулярное поле Вейсса
S– суммарный спин, k– константа Больцмана zm – число
m-тых по порядку соседей данного атома, Jm– обменное
взаимодействие между m– ми по порядку соседями, а N
- число наборов соседей, для которых J≠0.
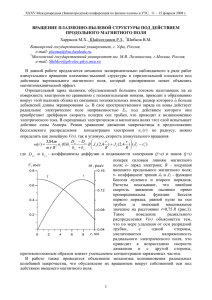
Определение параметров уравнения
Кюри-Вейсса
6
2
3
b
, mol/ñì
a
4
mol*10
-2
1.5
2
mol*10 , ñì 3/mol
2.5
1
2
-20 K
C=0.5 ñì 3K/ì î ëü
0.5
0
0
0
100
200
300
0
100
T, K
200
300
T, K
T→Θ при 1/χ→0;
χ→A0 при 1/T →0
8
mol/ñì
2
)-1*10-2,
c
1.5
6
d
4
mol
1
0.5
-15 K
C=0.4 ñì 3K/ì î ëü
2
corr
mol*102, ñì 3/mol
3
2.5
3
A0=0.0005 ñì /ì î ëü
0
0
0
0.1
0.2
1/T, K
0.3
-1
0.4
0.5
0
100
T, K
200
300
Связь макроскопических
и микроскопических
параметров
Макроскопические:
C=NAμ2μB2/3 kB
μB - единица, в которых принято считать магнитные
моменты - магнетон Бора, равный 9.27 10 -21 эрг/Э
μ2 =8C
μэфф=(8χm*T)1/2 – эффективный магнитный момент,
приходящийся на парамагнитный центр, например
на ион переходного или редкоземельного металла
Микроскопические:
μ2= 4S(S+1)=n(n+2 )
(для переходных элементов)
S- полный спин , n- число неспаренных электронов
для
для
для
для
для
3d1
3d2
3d3
3d4
3d5
μ
μ
μ
μ
μ
=√3=1.73
=√8=2.83
=√15=3.87
=√24=4.90
=√35=5.92
μB;
μB;
μB
μB
μB
для 3d9
для 3d8
для 3d7
для 3d6
μ =√3=1.73 μB
μ =√8=2.83 μB
μ =√15=3.87 μB
μ =√24=4.90 μB
МАГНЕТИЗМ ИОНОВ ПЕРЕХОДНЫХ
МЕТАЛЛОВ
Факторы, усложняющие энергетический спектр
электронов:
Электрон-электронные взаимодействия
Спин-орбитальное взаимодействие
Расщепление кристаллическим полем
Электронные состояния свободных ионов:
Способы размещения электрона с ms= +1/2 на пяти d-орбиталях
конфигурация
микросостояния
Терм 2D
Терм группирует вместе все вырожденные
размещения в свободном ионе
Порядок заполнения орбиталей
в первую очередь заполняются орбитали,
имеющие большие величины ml
электроны размещаются согласно правилам
Хунда
в соответствии с принципом Паули, два электрона
не могут иметь одинаковый набор квантовых чисел
Индивидуальные орбитальные угловые
моменты электронов, взаимодействуют
с образованием суммарного углового
момента, L (L=Σml)
Взаимодействие спиновых моментов
дает S (S=Σms)
Для обозначения величин L
используются буквы
S, P, D, F, G, Н, I
L= 0, 1, 2, 3, 4, 5 , 6
Спиновая мультиплетность состояния
(2S +1) указывается с помощью
индекса вверху слева от символа
терма
Пример: d3
терм основного состояния 4 F (L=2,
S=3/2)
Расщепление энергетических
уровней межэлектронными
взаимодействиями
(на примере d2-конфигурации)
Существует 45 способов размещения двух
электронов с ms=±1/2 на пяти d-орбиталях
Терм основного состояния - 3F
Термы возбужденных состояний: 1D, 3P, 1G, 1S
Каждый из этих термов представляет собой
вырожденный набор состояний, и каждый терм
отличается по энергии от любого другого
Электронные
взаимодействия
отсутствуют
5 вырожденных
d- орбиталей (45)
Электронные
взаимодействия
Свободные термы для различных
dn-ионов
Расщепление энергетических уровней
спин-орбитальным взаимодействием
При рассмотрении этого эффекта широко
используются две схемы: схема j-j-взаимодействия и
схема Рассела—Саундерса ( L-S –взаимодействия).
j-j-схема - спиновый угловой момент отдельного
электрона взаимодействует с орбитальным моментом с
образованием суммарного вектора j. Отдельные j
суммируются и дают J полного углового момента атома.
В
схеме
Рассела-Саундерса
индивидуальные
орбитальные
угловые
моменты
электронов
ml
взаимодействуют с образованием суммарного углового
момента (L). Взаимодействие спиновых моментов дает
S. Результирующий угловой момент, включающий спинорбитальное взаимодействие, обозначается J. Квантовое
число J изменяется от L - S до L + S. Если подоболочки
заполнены менее чем наполовину, то состоянию с
низшей
энергией
(терму
основного
состояния)
соответствует минимальное значение J.
В том случае, когда подоболочка заполнена более чем
наполовину состоянию низшей энергии сопоставляется
максимальное значение J. Если оболочка заполнена
наполовину, существует только одно значение J,
поскольку L = 0.
Схема
элементов
Рассела-Саундерса
используется
для
d-
Пример:
основное и возбужденное состояние иона V3+
Терм: 3F2 (L = 3, S = 1, J = 2)
Терм 1G4 (L = 4, S = 0, J = 4)
Энергия спин-орбитального
взаимодействия
ξ - одноэлектронная константа спин-орбитального
взаимодействия
<r-3> — средняя величина r-3, m— масса электрона,
с—скорость света, Zeff—эффективный заряд ядра
λ- константа спин-орбитального взаимодействия терма
Спин-орбитальное взаимодействие вызывает
расщепление термов на мультиплеты
Вклад спин-орбитального взаимодействия в энергию
любого уровня 1/2 λ[J(J + 1) - L(L + 1) - S(S + 1)]
Разность энергий двух соседних состояний терма,
возникших из-за спин-орбитального взаимодействия
ΔEJ,J+1=λ(J+1)
Значения констант спин- орбитального
взаимодействия ξ и λ для основных
состояний некоторых ионов
переходных элементов
Расщепление d2-конфигурации под действием
спин-орбитального взаимодействия
Расщепление d2-конфигурации под
действием спин-орбитального
взаимодействия
расщепление
состояния 3F2
магнитным полем
Расщепление энергетических уровней
кристаллическим полем
Представления теории кристаллического поля
Расщепление d- орбиталей
в полях различной симметрии
Октаэдрически координированный комплексный ион и
угловое распределение одноэлектронных функций
Представления теории молекулярных орбиталей
Схема образования σ - и π – связей в октаэдрическом
комплексе
«СЛАБОЕ ПОЛЕ»
кристаллическое поле сильнее спинорбитального взаимодействия, но слабее
межэлектронного отталкивания
«СИЛЬНОЕ ПОЛЕ»
кристаллическое поле сильнее и спинорбитального взаимодействия, и
межэлектронного отталкивания
кристаллическое поле слабее
межэлектронного отталкивания
и спин-орбитального взаимодействия
d-элементы
f-элементы
Теоретико-групповые представления
А , В - невырожденные состояния
Е
- двукратно вырожденные состояния
Т
- трехкратно вырожденные состояния
Схема расщеплений основных термов d-ионов в
октаэдрическом и тетраэдрическом полях
Корреляционная диаграмма для конфигурации d2
в октаэдре:
a – свободный ион, б – термы слабого поля, в - термы
сильного поля, г – конфигурация сильного поля
Примеры влияния расщепления в нулевом поле
на магнитный момент
Система с S = 3/2 и L = 0
Изменение спинового состояния комплексов
Ni2+ при понижении симметрии в случае
сильного поля
Электронное строение внешне – и внутриорбитальных
комплексов железа
Слабое поле: реализуется sp3d2-гибридизация
Характерно для аквакомплексов железа(II)
Восприимчивость подчиняется закону Кюри (μ~5.5 μB)
Сильное поле: реализуется d2sp3 - гибридизация
Характерно для гексацианоферрата(II)
Восприимчивость не зависит от температуры (μ=0)
Спектрохимический ряд
Уравнение Ван-Флека
основное уравнение магнетохимии
a N
[( E
) / kT 2 E ]e
(1) 2
i
i
( 2)
i
e
Ei 0 / kT
Ei 0 / kT
i
Ei= Ei0+H Ei(1)+ H2Ei(2)+…..
коэффициенты зеемановского разложения по
степеням поля (для каждого энергетического уровня)
Ei(0) = λLS - энергия уровня в отсутствии поля
Ei(1) = gβHS - энергия взаимодействия магнитного
момента неспаренного электрона с полем
Ei(2) – энергетический вклад, связанный с
примешиванием возбужденного состояния
Основным при использовании уравнения
Ван-Флека является адекватный учет
расщеплений энергетических уровней
под действием
магнитного поля (зеемановское расщепление),
спин-орбитального взаимодействия,
кристаллического поля,
межэлектронного отталкивания
Межэлектронное отталкивание, e2/rij
5*103-5*104 см-1;
Кристаллическое поле:
103-5*104 см-1;
Понижение симметрии кристаллического поля:
102-103 см-1;
Спин-орбитальное взаимодействие:
102-5*103 см-1;
Зеемановское взаимодействие:
~1 см -1
Частные случаи использования
уравнения Ван-Флека
Изолированный орбитальный синглет со спином S
Ei(2)=0 ; Ei(1)= gμBms, где ms= S, S-1,….., -S; Ei(0)=0
χa =N g2μB2S(S+1)/3kT
чисто спиновая магнитная восприимчивость
Основное состояние с S=0; энергия возбужденных
состояний Еi(0)»kТ
μ=0; E(1) = 0
χa=N(-2E(2))=Nα>0
ван-флековский парамагнетизм
Основное состояние с S ≠ 0; энергия возбужденных
состояний Еi(0)»kТ
χa =N g2μB2S(S+1)/3kT+ Nα
Учет спин-орбитального взаимодействия при
использовании уравнения Ван-Флека
Суммирование в уравнении Ван-Флека проводится с
учетом всех возможных значений полного момента J
L S
a N
{[ g
J LS
2
( J ) B2 J ( J 1) / 3kT ] ( J )}(2 J 1) exp[ E ( J ) / kT ]
L S
(2 J 1) exp[ E ( J ) / kT ]
J LS
Расщепления между мультиплетами малы по
сравнению с kТ
μэфф=[(3kT/NμB2)χа)]1/2=[4S(S+1)+L(L+1)]1/2μB
справедливо для свободного иона при достаточно
высоких температурах
Расщепления между мультиплетами велики по
сравнению с kТ
μэфф=g[J(J+1)]1/2μB
справедливо для соединений редкоземельных
элементов
Магнитные моменты редкоземельных
элементов
Ион
Терм
g
g[J(J+1)]1/2,μB
μэфф, μB
(эксперимент)
4f0 (La3+,Ce4+)
1S
-
0
0
4f1(Ce3+,Pr4+)
2F
3/2
6/7
2.54
2.5
4f2(Pr 3+)
3H
4
4/5
3.58
3.6
4f3 (Nd3+)
4I
9/2
8/11
3.62
3.6
4f 4(Pm3+)
5I
4
3/5
2.68
2.8
4f 5(Sm3+)
6H
5/2
2/7
0.84
1.5
4f 6(Eu3+, Sm2+)
7F
0
0
0
3.4
2
7.9
7.9
4f 7(Gd3+, Eu2+)
0
8S
7/2
4f 8(Tb3+)
7F
6
3/2
9.7
9.7
4f 9(Dy3+)
6H
15/2
4/3
10.6
10.5
4f 10(Ho3+)
5I
8
5/4
10.6
10.5
4f 11(Er3+)
4I
15/2
6/5
9.6
9.5
4f 12(Tm3+)
3H
6
7/6
7.6
7.3
4f 13(Yb3+)
2F
7/2
8/7
4.5
4.5
4f 14(Lu3+, Yb2+)
1S
0
0
0
0
Различие μэкс и μтеор для соединений Sm3+(4f5) и
Eu3+(4f6) объясняются малой величиной расщепления
между
нижним
и
первым
возбужденным
мультиплетами. Это приводит к термической
заселенности возбужденного уровня и к появлению
большого
температурно-независимого
парамагнетизма.
Магнитные моменты высокоспиновых соединений
переходных металлов группы железа
Для 3d-элементов орбитальная составляющая во
многих случаях в значительной степени подавлена
полем лигандов, и поэтому магнитный момент близок к
чисто спиновой величине : μэфф= 2[S(S+1)]1/2μB.
Вклад орбитальной составляющей в μэфф задается
константой спин-орбитального взаимодействия
Примеры теоретического анализа
магнитных свойств комплексов переходных
металлов
Терм 2T2 в кубическом поле
d1 (Ti3+, V4+,…) в октаэдрическом
d9 (Cu2+, Ni+… ) в тетраэдрическом окружении
Диаграмма расщеплений терма 2T2 под действием
спин-орбитального взаимодействия и магнитного
поля (в скобках показана степень вырождения
уровней)
Решение уравнения Ван-Флека:
N 2 8 (3 y 8) exp( 3 y / 2)
A
3kT
y[2 exp( 3 y / 2)]
8 (3 y 8) exp( 3 y / 2)
2
'ЭФФ
y[2 exp( 3 y / 2)]
Λ>0
μэфф (а) и 1/χ (б) для терма 2T2
λ<0
y= λ/kT
Изменение эффективных магнитных для
моментов для термов 2T2, 3T1, 4T1, 5T2
а- терм 2T2: 1-λ<0, 2-λ>0;
б- терм 3T1: 1, 1’-λ<0, 2, 2’-λ>0
в- терм 4T1: 1-λ<0, 2-λ>0;
г- терм 5T2: 1-λ<0, 2-λ>0
Терм 2E в кубическом поле
d9 (Cu2+, Ni+… ) в тетраэдрическом
d1 (Ti3+, V4+,…) в октаэдрическом окружении
Решение уравнения Ван-Флека:
4
A N
[ g
2
/ 4kT ]e
2
i 1
4
e
0
0
Ng 2 2
4kT
i 1
2E
– терм в кубических полях обладает
только спиновым магнетизмом
Все результаты, полученные для терма 2E,
могут быть перенесены на терм 5E
При понижении симметрии до тетрагональной:
основное состояние E расщепляется на
синглеты A1 (dZ2) и B1(dx2-y2)
возбужденный терм T2 расщепляется на дублет
E {dxz, dzy} и синглет B2 (dxy)
Решения уравнения Ван-Флека:
N
kT
2
N
kT
2
2
4k Z 8 N 2 k Z 2
1
2
2
2
2
kX
2 N 2 k X
1
3
3
Δ2 – расстояние между термами 2B1g и 2B2g,
kz –компонента фактора орбитального сокращения,
учитывающего влияние ковалентности на магнитные
свойства комплексов, 0.8 ≤ k < 1
Δ3 – расстояние между термами 2B1g и 2Eg
Эффективный g- фактор
В кубических полях термы A и E не расщепляются
спин – орбитальным взаимодействием
Отклонение от чисто-спинового значения магнитного
момента возникает в результате примешивания
терма T к основному состоянию
эфф
S 1
10 Dq
g 21
10 Dq
α=2 для E; α=4 для A2
Эффективный g-фактор для терма 2E в
тетрагональном поле
g║=2(1-4kZλ/Δ2);
g┴=2(1-kxλ/Δ3)
Низкоспиновые комплексы
Спиновое равновесие
f1и f2 - степени вырождения состояний с
восприимчивостью χ1 и χ2 и энергиями Е1 и Е2;
∆Е =Е2-Е1
МАГНЕТИЗМ ОБМЕННЫХ
КЛАСТЕРОВ
Обменное взаимодействие — квантовый эффект,
вызывающий скоррелированное поведение спинов
не слишком удаленных парамагнитных ионов
обменные кластеры - полиядерные комплексы
с обменно-связанными парамагнитными ионами
Обменные кластеры «a-b»
с параллельной и
антипараллельной
ориентацией спинов
Задачи
определение взаимосвязи магнитного поведения
со значениями обменных параметров,
характеризующих энергию и знак спин-спиновых
взаимодействий
определение зависимости значений обменных
параметров от особенностей геометрического и
электронного строения
Обменный эффект и модель
Гейзенберга-Дирака-Ван-Флека
(ГДВФ)
Ĥ= - 2JŜAŜB
Изотропный гамильтониан
ГДВФ
J- энергетическая характеристика системы,
называемая обменным параметром
Вернер Карл
Гейзенберг, 1901–76
Нобелевская премия,
1932
E(S)= - J [S(S+1)-S1(S1+1) –S2(S2+1)]
S= S1 + S2 , S1 + S2-1,…., │ S1 - S2│
Поль-АдриенМорис ДИРАК.
1902 - 1984
Нобелевская
премия,
1933
Диаграмма спиновых уровней для димера
с S1 = S2=5/2
Обобщение гамильтониана ГДВФ на
случай многоядерных комплексов
H 2 J i , j S i S J
i, j
индексы i, j нумеруют парамагнитные ионы
Для трехядерного кластера гамильтониан в
общем случае имеет вид:
H 2 J1, 2 S1S2 2 J 2,3S2 S3 2 J1,3S1S3
S2
J1,2
S1
J2,3
J1,3
S3
H 2 J (S1S2 S2 S3 S1S3 )
Ограничения модели ГДВФ
Модель изначально предназначена для
орбитально-невырожденных систем
Необходимы поправки на негейзенберговские
формы обмена:
Поправка на биквадратичный обмен
E ( S ) J [ S ( S 1) S a ( S a 1) Sb ( Sb 1)]
j[ S ( S 1) S a ( S a 1) Sb ( Sb 1)]2
Поправка на ассимметричный обмен
H as D[S a S b ]
D
g 2
g
Поправка на анизотропный обмен
,
H d J ( S a , S b, S a , S b, )
,
J
,
g 2 2
(
) J
g
J
Механизмы обмена
Для того чтобы в полиядерных кластерах
осуществился обмен необходимо, чтобы
неспаренные электроны двух соседних ионов
взаимодействовали
Обмен может быть прямым (а) и косвенным (б, в)
Взаимодействие, возникающее за счет
делокализации неспаренных электронов по
протяженным
молекулярным
орбиталям,
включающим орбитали мостиковых лигандов,
получило
название
сверхобмена,
или
косвенного обмена
Косвенный обмен в в димерных
карбоксилатах переходных металлов
Два основных механизма обмена:
2 J 2 a b e 2 / r1, 2 b a 2b 2 / U
Механизм
реализуется,
если
орбитали
неспаренных электронов перекрываются. В
этом случае неспаренный электрон одного
центра может делокализоваться к другому
центру и притягиваться к его положительно
заряженному остову. Ему соответствует
антиферромагнитное взаимодействие (J<0).
Другой вклад связан с отталкиванием
неспаренных
электронов
двух
центров
(e2/r1,2)., Ему соответствует ферромагнитное
взаимодействие (J>0). Этот вклад примерно
на порядок меньше первого. Однако он может
стать
преобладающим,
если
взаимодействующие орбитали ортогональны,
и вклад, обусловленный делокализацией,
близок к нулю.
Схемы прямого и косвенного взаимодействия
двух электронов, благоприятствующие
антиферромагнетизму (a, c) и ферромагнетизму (b, d)
При сильном антиферромагнитном прямом
обмене (│J│>>kT ) механизм взаимодействия
аналогичен образованию ковалентной металл-металл
связи.
В этом случае связи настолько прочны, что
вещества ведут себя как диамагнетики, несмотря на
наличие неспаренных электронов.
Условием образования таких связей является
наличие в структуре соединения коротких металлметалл расстояний.
Уравнение Гуденафа:
3d
Rкрит
[3.05 0.05m 0.03( z zTi ) 0.04Si (Si 1)]
m – степень окисления; Si - спиновое квантовое
число; z - атомный номер переходного металла.
Пример: для ионов Ti3+ критическое межатомное
расстояние, составляет 2.87 Å.
Типы обмена
Рассматривают обмен на 180° и обмен на 90°
Принятые обозначения:
║
орбитали перекрываются
┴
орбитали не перекрываются
J<0. Типичная ситуация для 1800 обмена:
(dz2║pz║dz2), (dz2║s║dz2).
J>0. Типичная ситуация для 900 обмена:
(dxy ║ ру ┴ рz ║ dxz)
Взаимное расположение орбиталей ионов металла
и лигандов в случае обмена на 1800 и общей оси Z
Взаимное расположение орбиталей ионов металла
и лигандов при обмене на 1800 в случае общей
плоскости
Взаимное расположение орбиталей ионов металла
и лигандов при обмене на 900
Параметры, влияющие на сверхобмен:
Радиальная зависимость
-2J~R-n n = 10÷12
Угловая зависимость
J=J90sin2φ+ J180cos2φ+ J1cosφ + J0
Связь обмена и донорной способности лигандов
Пример:
в ряду соединений с мостиковьими лигандами F1-, О2-,
S2-, Se2-, для которого характерно повышение
степени ковалентности σ- и π-связей, величина
обменного параметра 2|J| возрастает
Модель обменных каналов
Hˆ 2 J Sˆ Sˆb 2 J Sˆa Sˆb 2 J Sˆa Sˆb 2 J Sˆa Sˆb
Каждая из величин Jij обусловлена
взаимодействием определенной пары электронов,
представляющим канал обмена. В общем случае
число каналов обмена 4SaSb.
J
J i , j 4S a Sb J
i
J
Типы обменных кластеров
В зависимости от от числа центров в кластере
они называются тримерами, тетрамерами,
пентамерами и.т. д.
Тетрамеры
и
другие
многоцентровые
кластеры могут быть как плоскими, так и
объемными.
Отдельно можно выделить линейные цепи,
которые могут иметь конечную длину, а могут
быть бесконечными
Пример: тетрамеры
Пример: пяти-, шести- и девятиядерные
кластеры
Димеры
Решение уравнения Ван-Флека для димера:
m Ng 2 2
E ( J , S ) / kT
S
(
S
1
)(
2
S
1
)]
e
S
3kT (2S 1)e E ( S , J ) i / kT
S
S= Sa+Sb, Sa+Sb-1….| Sa-Sb|
Уравнение Блини-Бауэрса для Sa=Sb=1/2
Ng 2 2
2 J 1
m
[1 1 / 3 exp(
)] N
2 3kT
kT
Пример: ацетат ванадила
Анализ магнитных свойств димера в разных
температурных областях
Высокие температуры: ׀J«׀kT
Ng 2 2
'm (T )
[ S a ( S a 1) S b ( S b 1)]
2 3kT
Ng 2 2
Ng 2 2
1/ 2 [
S a ( S a 1)
Sb ( Sb 1)]
3kT
3kT
эфф (T ) (a 2 эфф b 2 эфф ) / 2
Тепловое движение «разрушает» связь между спинами
в кластере и парамагнитные ионы ведут себя как
независимые частицы. Восприимчивость димера при
высоких температурах стремится к среднему значению
восприимчивостей составляющих его парамагнитных
частиц.
В частном случае Sa=Sb=S:
Ng 2 2
'm (T )
S ( S 1)
3kT
чисто спиновая восприимчивость ансамбля
невзаимодействующих одинаковых
парамагнитных частиц
Низкие температуры: ׀J »׀kT
Населен только нижний энергетический уровень
При J > 0 нижним является уровень Ŝ = Sa+Sb
при J < 0 Ŝ=|Sa-Sb|
Ng 2 2 ~ ~
'm (T 0)
S ( S 1) / 2
3kT
~ ~
эфф (T 0) g S (S 1) / 2
В частном случае Sa=Sb=S и J < 0
'm (T 0)
эфф (T 0) 0
В экспериментальной практике чаще всего
приходится сталкиваться именно с такими
кластерами
Промежуточные температуры: J > 0
Магнитная восприимчивость (сплошная линия) и
эффективные магнитные моменты (пунктир)
димеров с Sa = Sb при J >0
Промежуточные температуры: J < 0
Магнитная восприимчивость (сплошная линия) и
эффективные магнитные моменты (пунктир)
димеров с Sa = Sb при J <0
Положение широкого максимума определяется
величиной обменного параметра (J) и спинами
ионов.
Пример: для Sa=Sb=S=1/2 J=-1.247kTc
для S=5/2 J=-5.761kTc.
Мономерная примесь
Причины:
Структурные особенности объекта
Дефекты
Неполное протекание реакции кластерообразования
в комплексных соединениях
Димер
Мономер
(1 i ) m i i
i
i
α — доля примеси мономерных частиц i-го сорта
Конкретный пример применения модели ГДВФ для
описания магнитных свойств соединений,
содержащих обменно- связанные кластеры
*Магнитная восприимчивость Sr4ZnMn2O9 и
Sr4MgMn2O9
Базуев Г.В., Зайцева Н.А., Красильников В.Н., Келлерман Д.Г.
// ЖНХ 2003. Т. 48. С. 219
продолжение
oНаличие максимума свидетельствуют о том , что в
системе присутствуют димеры или другие кластеры
o структурные исследования подтвердили
существование пар Mn4+-Mn4+
o Возрастание восприимчивости при понижении
температуры указывает на мономерную примесь,
поведение которой подчиняется закону КюриВейсса
oТакого рода мономерная примесь связана с
дефектами
Mn
4
Mn 4
C /T
2J
kT
6J
kT
12 J
kT
2 N A (1 x) g 2 B2
e 5e 14e
2J
6J
12 J
k BT
1 3e kT 5e kT 7e kT
x- доля ионов марганца, не
5 xN A 2 B
связанных в димеры
k BT
На рис. приведен результат разложения
магнитной восприимчивости на димерную и
мономерную составляющие
Sr4ZnMn2O9
Sr4MgMn2O9
J, см-1
203
215
X, %
2
6
Представления о суперпарамагнетизме
Частица ферромагнитного материала с размерами ниже
определенной критической величины (150 Å) ведет себя в
магнитном поле как изолированный магнитный домен.
Поведение ансамбля таких доменов может быть описано
уравнением, аналогичным уравнению Ланжевена для
атомного парамагнетизма
C.P.Bean
ввел
в
употребление
новый
термин
"суперпарамагнетизм“.
Особенность
суперпарамагнетика
состоит в том, что парамагнитными центрами в нем являются
не
отдельные
атомы
(ионы),
а
ферромагнитные
однодоменные частицы, которые могут содержать до 105
атомов, связанных между собой обменными взаимодействиями
Используется
для
определения
магнитных наночастиц и описания
порядка в твердых растворах
размеров
ближнего
LiNi0.4Fe0.6O2
Суперпозиция кривых намагничивания как доказательство
существования
суперпарамагнетизма
в
кубических
твердых растворах LiFe1-xNixO2
120
80
- 77.4
- 96.6
- 109.6
- 123.5
- 155.1
40
0
0
20
40
60
H/T, Ý K-1
80
100
ОПРЕДЕЛЕНИЕ РАЗМЕРОВ ДОМЕНОВ
K AV k BTB
1/ 3
9k B CM
r
4M S I o
Температура блокировки
0.0025
V, r –размеры частицы
fc 50000Ý
0.002
, ñì 3/ã
M, Ãc ñì 3 ì î ë ü-3
160
C, Ms, I0 -
0.0015
магнитные параметры
0.001
Ρ –плотность
fc 100 Ý
M- молекулярный вес
0.0005
zfc
0
0
100
200
T, K
300
Ферромагнетизм
В некоторых металлах, сплавах и соединениях
намагниченность
(она
называется
спонтанной)
существует и без внешнего магнитного поля. Такое
явление известно, например, для железа, откуда и
название— ферромагнетизм. Ферромагнетизм, одно
из
магнитных
состояний
кристаллических
веществ,
характеризуемое
параллельной
ориентацией магнитных моментов атомных
носителей магнетизма в отсутствии магнитного
поля.
Схема ферромагнитного
перехода
Ферромагнетик в магнитном поле: а-г –стадии изменения
доменной структуры, д - петля гистерезиса
Антиферромагнетизм
Схема антиферромагнитного
перехода
Ферримагнетизм
Ферримагнитный порядок
Спиновые стекла
b
Фрустрации, приводящие к спинстекольному состоянию
a
c
ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ
МАГНЕТОХИМИЧЕСКОГО ПОДХОДА
К РЕШЕНИЮ ХИМИЧЕСКИХ ЗАДАЧ
Аналитическая химия
Катализ
Биохимия
Химия высокомолекулярных
соединений
Химия твердого тела
Структурная химия
Получение информации о дефектном
состоянии, стехиометрии соединения и
степени окисления элементов
Пример
Определение концентрации дефектов в LiCoO2:
В стехиометрическом кобальтите :
μ =0; χ не зависит от
температуры
Частичное восстановление:
LiCo3+O2 = LiCo(3-2δ)+O2-δ + δ/2O2↑
C=NA μB2[15*2δ +0* (1-2δ)]/3kB
25.0
eg
Co3+
μ =0
t2g
*106, ñì 3/ã
20.0
15.0
eg
Co2+
10.0
t2g
5.0
δ ≈ 0.0002
LiCoO2-
LiCoO2
0.0
0
50
100
150
T, K
200
250
μ =√15=3.87 μB
300
Изучение химических реакций
Пример 1
Изучение процесса полимеризации:
χm и χp — молярные восприимчивости мономера и
полимера, содержащего n молекул.
В соответствии с аддитивной схемой Паскаля:
χр = n χm + (n-1)λ ,
где λ — конститутивная поправка на n-1 новых
связей, возникших при образовании полимера из n
мономерных единиц.
Удельная восприимчивость полимера
χр=[n χm+(n-1) λ]/n M
где M- молекулярный вес мономера.
λ и χm известны или определяются независимо,
величина χр — измеряется.
Зная χр, легко рассчитать n.
Измеряя зависимость χр от времени, определяют
временную зависимость степени полимеризации и
исследуют кинетику процесса.
Пример 2
Изучение процесса окисления LiMnO2:
Магнитная
восприимчивость
продукта
окисления
и
приведенная степень превращения в зависимости от
времени окисления
LiMn+3O2 + /2 O2 LiMn+31–2Mn+42O2+
При окислении (или восстановлении) меняется
зарядовое состояние ионов. Это приводит к изменению
магнитных моментов. Поэтому, в ряде случаев исследуя
изменение магнитной восприимчивости в зависимости
от времени процесса in situ, можно получить важную
информацию о кинетике процесса.
700
Схема эксперимента.
Точки указывают на
измерение
восприимчивости
T, K
600
500
400
300
200
0
50
, час
100
150
Пример 3
Изучение процесса восстановления LiCoO2 :
0.04
*104см3/моль
1.8
в LiCoO2-
0.03
0.02
1.6
1.4
1.2
600
800
1000
T, K
0.01
0.00
600
700
800
900
1000
1100
T, K
Co3+
LS
(t2g)3
(t2g)3
μ=0
eg
(eg)
t2g
Co2+ HS (t2g)3 (t2g)2 (eg)2
μ =3.87 μB
eg
g 2 02 B2 N A (n0 nT )
d vv
3kT
n
Nd
N
A
0
где
e
S d
k
1 e
e
S d
k
A0 – тнп;
A2 – eS/k,
2
0
H d
kT
e
0.125 g ( A1 A2 e
T
2
t2g
A3
T
H d
kT
(1 A2 e
A1 – (n0);
A3 – H/k.
A3
T
))
Пример 4
Изучение реакций с участием свободных
радикалов:
В свободных органических радикалах вследствие
сильной делокализации неспаренного электрона
орбитальный момент практически равен нулю. Поэтому
эффективный магнитный момент близок к чисто
спиновой величине (μ2=3).
Мольная восприимчивость: χm = μ2/8T=0.375/T
Зависимость
восприимчивости от
времени при обратимом
восстановлении дурохинона
Радикалы исчезают
Радикалы возникают
Пример 5
Изучение сложных химических реакций:
Этот пример демонстрирует прикладные возможности
магнетохимического метода исследования.
Установлен механизм формирования и защитного
действия компаунда, представляющего собой суспензию
алюминиевого порошка в растворе Н3Р04 с добавками
СгО3 и MgO.
Было установлено, что покрытие после термообработки
становится парамагнитным в отличие от исходного
практически диамагнитного компаунда. Появление
парамагнетизма объяснено как результат окислительновосстановительной реакции между бихромат-ионами
Сг2О2+ и металлическим алюминием:
2Аl0 + Сг26+О72-+ 8Н+1= Сг23+О3 + 2Аl3++ 4Н20
По значениям эффективного магнитного момента для
Cr3+ удалось рассчитать его количественное содержание
в защитном покрытии.
Оксид хрома (III) являлся основным компонентом,
обусловливающим повышение твердости и стойкости
покрытия.
На основании результатов исследования были
предложены практически важные пути направленного
модифицирования состава и свойств защитных
компаундных покрытий.
Получение информации о структуре
координационных
соединений
и
электронной конфигурации центрального
иона
Пример 1
Доказательство наличия в растворах комплексных
соединений двухвалентного никеля структурного
равновесия квадрат—тетраэдр:
Комплексы двухвалентного никеля, в которых
координационный узел центрального иона имеет
планарное строение (структура I), являются
диамагнитными, а комплексы с тетраэдрическим
строением координационного узла
(структура II)
являются парамагнитными. На основании измеренной
магнитной восприимчивости оценивают концентрации
обеих форм.
Пример 2
Определение координационного числа d-элемента
Если магнитный момент соединения Cu(II)
зависит от температуры, то ион находится в
тетраэдрическом окружении (триплетное
состояние, T)
Основные термы атомов в октаэдрическом и тетраэдрическом
окружении в зависимости от электронной конфигурации
Обнаружение малых количеств примесей
Одно из важнейших применений магнитных
методов в химии твердого тела, как и при
изучении катализаторов, состоит в анализе
следов ферромагнитных и ферримагнитных
примесей,
неуловимых
методами
рентгенофазового и химического анализа.
*103, ñì
3
ã-1
В ходе термолиза Сг2О3 была выделена фаза
Сг2О4.87. Казалось бы, она должна содержать
ионы Сг только в двух наиболее устойчивых
степенях окисления +3 и +6. Однако на кривой
температурной
зависимости
магнитной
восприимчивости при Т ~ 390 К была обнаружена
отчетливая
аномалия,
указывающая
на
присутствие ферромагнитного компонента Таким
компонентом мог быть только оксид СrO2
(Тс = 390 К). Полученные данные позволили
уточнить механизм разложения.
I
390 K
T, K
Анализ катионного упорядочения.
Известно, что величина магнитного момента иона
зависит от кристаллического окружения. Так,
например,
значения
эффективных
магнитных
моментов для ионов Co2+, находящихся в кислородных
тетраэдрах и октаэдрах, составляют
μ1 = 3.88 μB и μ2 = 5.20 μB соответственно.
В ряде кристаллов со структурой перовскита, шпинели,
граната и т.д. ионы металла часто могут одновременно
находиться на кристаллографически неэквивалентных
позициях. Характер распределения может меняться в
зависимости, как от состава твердого раствора, так и
от температуры, давления или облучения.
Для соединения, одновременно содержащего ионы
тетраэдрического и октаэдрического Co2+, можно
записать:
μ2эфф=α μ21 (1- α) μ22,
где α – доля ионов Co2+ в тетраэдрических позициях, а
μэфф –эффективный магнитный момент, определенный
из
экспериментального
значения
магнитной
восприимчивости.
α= (μ22 - μ2эфф)/ (μ22 - μ21).
По тому, как изменяется μэфф, мы можем судить о
катионном упорядочении.
Построение фазовых диаграмм систем,
содержащих ферро, антиферро- или
ферримагнитные компоненты
Фазовая диаграмма системы Fe-Ge,
построенная по температурам Кюри
Применение в биохимии
Применение магнитной
восприимчивости в биохимии
прежде всего связано с исследованием компонент крови
Установлено, что кровь ведет себя как
диамагнитная жидкость, когда она обогащена
кислородом (в артериях) и как парамагнитный
материал, когда она обескислорожена (в венах)
1. Селвуд П. Магнетохимия. - М.: ИЛ, 1958. 458 с.
2. Современная химия координационных
соединений. - М.: ИЛ, 1953. С. 370-419.
3. Калинников В.Т., Ракитин Ю.В. Введение в
магнетохимию. - М.: Наука, 1980. 302 с.
4. Карлин П. Магнетохимия. - М.: Мир, 1989. 399 с.
5. Дорфман Я.Г. Диамагнетизм и химическая связь. М.: Физматгиз, 1961. 231 с. 1.
6. Р. Драго. Физические методы в химии. Т.2. М.:
Мир. 1981. 422 с.
7 Физические методы исследования неорга-нических
веществ. Под. ред. А.Б.Никольского, глава 7,
М.:Академия.2006. с.212
8. И.Б.Берсукер. Электронное строение и свойства
координационных соединений. Л.: Химия.1976.349 с.
9. В.В.Луков. Магнетохимический метод. Новые
аспекты применения. Соросовский образовательный
журнал, 1999, №8, с.50.
10. А.Н.Глебов, А.Р.Буданов . Магнетохимия:
Магнитные свойства и строение веществ
Соросовский образовательный журнал, 1997, №7,
с.44.
11. С.П.Губин, Ю.А.Кокшаров, Г.Б.Хомутов,
Г.Ю.Юрков. Магнитные наночастицы: методы
получения, строение и свойства. Успехи химии. Т.74,
№ 6, с.533.