Задания первого (заочного) тура предметной олимпиады по
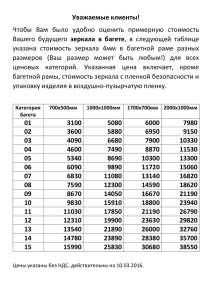
реклама

Задания первого (заочного) тура предметной олимпиады по химии на звание «Стипендиат АГУ» 10 класс Задача 1. Хлорофилл является важным пигментом, обусловливающим зеленый цвет листьев растений. При сжигании 89,2 мг хлорофилла в избытке кислорода получаются только следующие четыре вещества: 242 мг газа, которым обычно газируют напитки; 64,8 мг жидкости, составляющей основу этих напитков; 5,6 мг газа, которого больше всего в земной атмосфере и 4,00 мг белого порошка, который является оксидом легкого широко используемого металла, составляющего приблизительно 2,3 % земной коры. 1) О каких веществах идет речь? 2) Рассчитайте формулу хлорофилла, учитывая, что его молекула содержит только один атом металла. 3) Напишите уравнение реакции горения хлорофилла. 4) Содержит ли хлорофилл хлор? Откуда взялось название «хлорофилл»? 5) Приведите пример природного вещества, содержащего фрагмент структуры сходного строения. Задача 2. Рассмотрите цепочку превращений: 1. А = Б + В 2. Б + C2H5Cl = Г 3. Г + C2H5Cl = Д + А 4. Б + TiCl4 = А + Е 5. Б + C4H8Cl2 = А + Ж 6. Б + N2O4 = И + NO Расшифруйте вещества А – И, если известно, что вещество А придает горький вкус морской воде, Б, В и Е являются простыми веществами, реакции 1 и 4 проходят при высокой температуре, реакция 1 идет под действием электрического тока, реакцию 2 проводят в диэтиловом эфире. 1) Напишите уравнения реакций 1 – 6. 2) Что может представлять собой вещество Ж и назовите его. Задача 3. Кристаллическое вещество А, выделенное из природных объектов, имеет формулу С5Н11О4. Его водный слой дает реакцию «серебряного зеркала». Нагревание А с водным раствором йодоводорода и красным фосфором ведёт к образованию н-пентана. При действии уксусного ангидрида вещество А образует соединение С11Н16О7, нерастворимое в воде и не дающее реакции «серебряного зеркала», но при нагревании с водой легко превращающееся в соединение С9Н14О6, способное давать реакцию «серебряного зеркала». Нагревание А с метанолом в присутствии следов хлороводорода дает соединение С6Н12О4, не способное к реакции «серебряного зеркала». Установите структурные формулы вещества А и продуктов его превращений и напишите уравнения приведенных реакций. Задача 4. При гидролизе эфира одноосновной карбоновой кислоты, молекулярная масса которого 145 г/моль, образуется кислота А и спирт Б. Кислота А растворяется в щелочах и кислотах, обладает амфотерными свойствами и образует натриевую соль, содержащую 20,72% натрия. Спирт Б не окисляется дихроматом натрия в присутствии серной кислоты и легко реагирует с хлористым водородом с образованием алкилхлорида. Определить строение эфира. Задача 5. Смесь изомерных дихлорэтанов нагрели со спиртовым раствором щелочи. Выделившийся газ пропустили в аммиачный раствор оксида серебра, при этом выпало 9.60 г осадка. При обработке такого же количества исходной смеси водным раствором щелочи получена смесь, при действии на которую аммиачного раствора оксида серебра выпало 6.48 г осадка. Определите массу исходной смеси и мольную долю каждого изомера в ней. Задача 6. Два газообразных простых вещества, состоящие из двухатомных молекул, смешали в объемном соотношении 1 : 9 в закрытом реакционном сосуде при температуре 20°С и высоком давлении. Сосуд нагрели до 215°С; при этом с количественным выходом образовалось газообразное сложное вещество, а давление по окончании реакции оказалось равно первоначальному. Определите формулу продукта реакции и напишите уравнения его реакций с водой и щелочью. Задача 7. Неизвестный альдегид массой 3.92 г нагрели со смесью, полученной при действии избытка щелочи на 33.84 г нитрата меди(II). Образовавшийся осадок отфильтровали и выдержали при 150°С до постоянной массы, которая составила 13.28 г. Определите возможную структурную формулу альдегида и предложите формулы трех его изомеров. Атомную массу меди примите равной Ar(Cu) = 64. Задача 8. Смесь фенола и неизвестного амина массой 15.95 г может прореагировать с 1568 мл (н.у.) хлороводорода или же с 24 г 15%-ного раствора гидроксида натрия. Предложите структурные формулы трех изомеров этого амина. Задача 9. После пропускания 8.96 л (н.у.) смеси этана и ацетилена в избыток аммиачного раствора оксида серебра было получено 72 г осадка. Рассчитайте массовые доли газов в исходной смеси. Задача 10. Смесь изомерных спиртов массой 43.2 г нагрели с избытком уксусной кислоты в присутствии следов серной кислоты. В результате реакции получено 52.02 г смеси сложных эфиров. Установите строение спиртов, если известно, что выход одного из эфиров составил 75%, второго – 50%, а масса первого спирта больше массы другого в пять раз.